甲酸乙酯是一种常用的化工原料,常用作溶解醋酸或硝酸纤维的溶剂、香料添加剂、以及杀菌剂和杀幼虫剂[1-3]。甲酸乙酯广泛存在化工行业的废水中,直接排放含有甲酸乙酯的废水会对生物和环境造成很大的危害。当甲酸乙酯的浓度高于1 000 mg/m3时,会略微刺激人体的眼睛、鼻子和肺部。在急性吸入研究中,Opdyke等[4]发现当甲酸乙酯浓度为24 000 mg/m3时,会对6只大鼠中的5只引起致死。毒性迹象包括对中枢神经系统的抑制以及对呼吸循环的影响[5-6]。荷兰卫生委员会关于甲酸乙酯的职业接触限值和每日允许食品和化妆品毒理学设定的甲酸乙酯摄入限值,建议人类每天不应暴露于1 000 mg/m3以上的甲酸乙酯环境中[7]。另一方面,排入环境的甲酸乙酯挥发进入大气后,在一定环境条件下能够发生光化学反应,形成光化学烟雾[8-10]。因此,治理废水中的甲酸乙酯对人类健康和环境保护都具有重要的意义。
常用的甲酸乙酯净化方法包括吸附法[11]、Fenton氧化法等[12],而利用生物法对甲酸乙酯的降解性能研究较少。由于生物法具备净化效率高、成本低、对环境无二次污染等优点[13]。利用生物法处理废水中的甲酸乙酯,对于认识甲酸乙酯在微生物中的降解机理,开发具备低成本、高降解性能的甲酸乙酯降解技术具有重要意义。
本研究中,使用甲酸乙酯为唯一碳源,通过筛选和驯化,从活性污泥中分离出一株能高效降解高浓度甲酸乙酯的细菌。研究了pH和温度对菌株生长的影响,并研究了降解菌的生长动力学,以及不同浓度的甲酸乙酯对细菌生长及降解的影响。通过代谢产物的分析,探讨细菌对甲酸乙酯的代谢途径。
1 材料与方法 1.1 材料 1.1.1 样品(活性污泥)来源本实验活性污泥来源于北京某污水处理厂二沉池。活性污泥样品取样后,置于-20℃冰箱中待后续实验使用。
1.1.2 主要试剂和仪器主要试剂为ZnSO4·7 H2O,FeSO4·7 H2O,MnSO4·7 H2O,Co(NO3)2·6 H2O,CuSO4·5 H2O,KH2PO4,Na2HPO4,MgSO4·7 H2O,NaCl,LB肉汤,蛋白胨,甲酸乙酯(北京颐丰天成科技有限公司)。主要仪器为分析天平(北京赛多利科学仪器有限公司)、生化培养箱(上海申贤恒温设备厂)、气相色谱质谱联用仪(7890B Agilent)、可见光分光光度计(UNICO 2000)、高压蒸汽灭菌器(Panasonic公司)、超净操作台(哈尔滨市东联电子技术开发有限公司)、低温冷冻离心机(Sigma公司)、PCR仪(TECHNE公司)、智能冰箱(SAMSUNG公司)。
1.1.3 培养基牛肉膏蛋白胨培养基(LB培养基):牛肉膏10.0 g,蛋白胨10.0 g,氯化钠5.0 g,蒸馏水1 000 mL,调整pH值至7.0±0.2,于120℃灭菌15 min。
基础培养基:蛋白胨10 g/L,NaCl 5 g/L,KH2PO4 0.45 g/L,Na2HPO4 0.47 g/L,痕量金属溶液1 mL/L,pH 7.00±0.2,121℃高压灭菌40 min。其中,痕量金属溶液有FeSO4·7 H2O 0.55 g/L,ZnSO4·7 H2O 0.23 g/L,MnSO4·7 H2O 0.34 g/L,Co(NO3)2·6 H2O 0.075 g/L,CuSO4·5 H2O 0.047 g/L,(NH4)6MO7O24·4H2O 0.025 g/L[14]。
筛选培养基:在灭过菌的基本培养基中加入甲酸乙酯。
1.2 方法 1.2.1 甲酸乙酯降解菌的分离与纯化将活性污泥用高纯水稀释10倍,并过筛形成细菌悬浮液作为接种物。取5 mL稀释并过筛后的活性污泥接种到45 mL已灭菌的基础培养基中,加入500 mg/L的甲酸乙酯。置于170 r/min,30℃的摇床中培养48 h。之后,将5 mL的混合物接种到新的45 mL基础培养基中培养,并加入800 mg/L的甲酸乙酯,放于170 r/min,30℃的摇床中培养48 h。再取5 mL的混合物放入新的基础培养基中,加入1 000 mg/L的甲酸乙酯,放于170 r/min、30℃的摇床中培养48 h。富集结束后,使用稀释涂布法和平板划线法筛选出能以甲酸乙酯为碳源的单菌落,并分离纯化。
1.2.2 复筛降解菌株为了选择具有最高甲酸乙酯降解效率的菌株,进一步筛选获得的菌株。将1.2.1节中分离出的纯菌落与含有1 000 mg/L的甲酸乙酯和20 000 mg/L琼脂的混合基础培养基于30℃的恒温培养箱中培养24 h。然后将纯化好的菌株与5 mL无菌水混合并形成细菌悬浮液。取样1 mL细菌悬浮液并以10 000 r/min的速度离心5 min。收集离心后的沉淀并用蒸馏水洗涤2次后并重新接种到5 mL富集培养基中,其中加入1%的甲酸乙酯。于30℃,170 r/min的摇床里培养24 h。取样1 mL细菌悬浮液并以14 000 r/min离心5 min,用0.22 µm的滤膜过滤液体。之后通过气相色谱仪(7890B Agilent)测量甲酸乙酯的降解率。气相色谱仪的测试方法为:色谱柱为DB-624毛细血管柱,进样口温度为220℃,氢火焰离子化检测器(Flame ionization detector,FID)温度为250℃,空气流量为400 mL/min,尾吹气流量为25 mL/min。柱温:恒温70℃,保持8 min[15]。选择最佳降解率的菌株用于进一步研究。
1.2.3 菌株的生理生化测定生理生化实验:根据《常见细菌系统鉴定手册》[16]进行革兰氏染色试验、吲哚试验、葡萄糖氧化发酵试验、V-P试验、MR试验等测定。
1.2.4 DNA提取和PCR扩增鉴定菌株在30℃ LB培养基中生长至对数期,1.5 mL菌液在转速为12 000 r/min下离心收集菌体,并对该菌株16S rDNA基因序列分析。利用DNA提取试剂盒提取总DNA作为PCR模板,选用16S菌保守序列进行PCR扩增。16S rDNA扩增的引物为27F AGAGTTTGATCCTGGCTCAG和1 492R GGTTACCTTGTTACGACTT[17]。PCR所用酶为ExTaq,PCR程序为:95℃预变性5 min,95℃变性30 s,55℃退火30 s,72℃延伸40 s,循环35次;72℃延伸10 min,12℃保存。得到750 bp的片段,测序得到菌株ETH-3的16S rDNA全序列,并将序列上传到NCBI基因库中。利用BLAST将测序结果与GenBank中的基因序列进行同源性比对。最后在MEGA 6.0软件中绘制发育树。
1.2.5 菌株生长曲线及其动力学的研究取22支盛有5 mL LB肉汤的试管,灭菌后备用。其中11支接种0.25 mL已培养12 h的甲酸乙酯降解菌过夜培养液(使初始OD600达到0.01)。另11支作为对照。将22支试管置于恒温摇床中振荡培养,温度设置为30℃,转速170 r/min。每隔2 h取样检测其在600 nm处的吸光度值。检测筛选出的微生物生长曲线。
根据菌株在不同时间的生长数据,选择修正Gompertz模型[18]拟合降解菌的生长曲线。通过修正Gompertz模型[公式(1)]拟合得到的模型参数,计算出最大比生长速率U[公式(2)]和微生物生长的延滞期LPD[公式(3)]。最终采用R2对建立模型进行评价。
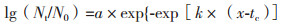 (1)
(1)
由此可以得到U和LPD的计算公式:
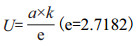 (2)
(2)
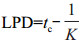 (3)
(3)
式中,t为时间,Nt和N0分别表示在时间t时和初始时间时的微生物数量;a为最大菌数Nmax与初始菌数N0的差值;tc为达到最大生长速率的时间,K为在时间点tc的最大生长速率[19]。
1.2.6 菌株的最佳生长环境条件(温度和pH)选取不同培养温度20、25、30、35和40℃,此时培养基的初始pH为6.60。将6份灭过菌并冷却的LB肉汤培养基,接种已培养至对数期的菌液,使初始OD600达到0.01。分别放入20、25、30、35和40℃的恒温摇床里,每隔4 h取样,共取6次,每组做4个平行样,并且用没有接种菌的无机盐培养基做对照。通过可见光分光光度计(UNICO 2000)测量微生物的吸光度。
选取5个pH梯度,通过1 mol/L的HCl和20%的NaCO3将初始pH分别调为5.0、6.0、7.0、8.0和9.0,测对菌株生长的影响。在已灭菌冷却的LB肉汤培养基中加入培养至对数期的菌液(使加入菌液后的无机盐培养基初始OD600为0.01),以不加菌液的体系作空白对照,置30℃、170 r/min的摇床中培养。每隔4 h取样,每组做4个平行样。通过可见光分光光度计(UNICO 2000)测量微生物的吸光度,用OD600作为细菌密度的指标。
1.2.7 菌株对不同浓度的甲酸乙酯降解研究研究菌株在6个不同甲酸乙酯浓度下的降解,6个甲酸乙酯浓度梯度分别是4 000 mg/L、7 500 mg/L、10 500 mg/L、15 500 mg/L、20 500 mg/L和60 000 mg/L。每个浓度梯度做4个平行样。以不接菌的无机盐培养基作为对照。对照组培养基跟实验组的培养基在基本培养基的基础上加入相同的培养6 h的微生物量,但是对照组中不添加甲酸乙酯。培养基中加入的微生物量为1%(体积分数)。对照组培养基和不同浓度甲酸乙酯的培养基同时置于30℃,170 r/min的摇床中培养。24 h前每隔4 h取样,36 h时再取一次样。检测微生物的生长情况、pH变化及降解率的变化。所有取样在无菌操作台里操作。
底物中甲酸乙酯的测定方法同1.2.2节测定的方法。
1.2.8 中间代谢产物分析选用降解后的样品,14 000 r/min离心5 min。用0.22 µm的滤膜过滤液体。取上清液置于60℃的水浴锅中,采用SPE(Solid phase extraction)固相微萃取技术结合GC-MS分析代谢产物成分[20]。GC-MS的分析条件为:采用程序升温40℃(维持10 min),再以50℃·min-1的速率升到180℃(维持5 min);进样口温度150℃;载气为高纯氮气;分流比为5:1。进样量为1 µL。
2 结果 2.1 菌种的鉴定 2.1.1 菌株的形态特征观察初步筛选分离后,从活性污泥中获得3株降解菌。进一步研究3株菌株对甲酸乙酯的降解率以筛选出具有最高降解效率的最佳菌株。在初始有机物浓度为8 000 mg/L时,36 h内,在30℃下,发现ETH-3菌株对甲酸乙酯的去除率最高,高达100%。因此,选择ETH-3进行进一步研究。菌株ETH-3肉眼可以看到清晰的单菌落,菌落较小且扁平,呈现不规则圆形,直径0.5-3 mm左右,湿润。其在平板上的形态如图 1所示。
|
| 图 1 菌株在平板上的形态 |
菌株ETH-3的5个生理生化试验结果(表 1)显示,为革兰氏阴性菌,吲哚试验阴性,葡萄糖氧化发酵试验阳性,且产酸也产气,V-P试验阴性,MR试验阳性。对菌株的DNA进行PCR扩增及16S rDNA基因鉴定后,根据BLAST结果,表明该菌株与Aeromonas salmonicida subsp.salmonicida亲源关系最近,同源性达99%以上。在NCBI上下载与菌株ETH-3所测序列较高相似性的序列,在MEGA 6.0软件中绘制系统发育树图(图 3)。结合菌株的形态观察结果及生理生化试验结果,确定该菌株鉴定为杀蛙气单胞菌杀鲑亚种(Aeromonas salmonicida subsp.salmonicida)。

|
| 图 2 菌株的系统发育树图 |
|
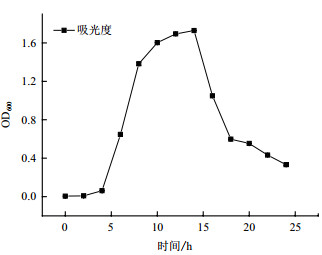
| 图 3 菌株ETH-3的生长曲线 |
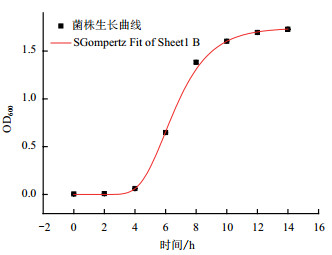
菌株ETH-3的生长曲线如图 3所示。运用Origin软件,选用SGompertz模型拟合菌株迟缓期、对数期及稳定期的生长曲线,如图 4所示。得到该模型的拟合参数并计算出最大比生长速率U和微生物的延滞期LPD(表 2)。模型的R2为0.999,说明SGompertz模型可以很好地描述菌株的生长。由表 2可知,菌株在第5.9 h达到最大生长率速度,菌株的OD600值最高达1.723±0.015,每小时OD600值增长0.69,菌株的最大比增长速率约为0.4,延迟期大约有4.497 h。
|
| 图 4 SGompertz模型拟合菌株的生长期 |
初始pH对菌株ETH-3生长的影响如图 5所示。如图所示,尽管菌株在pH为5-9时都可以生长,但是当初始pH为5和9时,生长明显受到抑制。当pH等于8左右时,最有利于菌株的生长。

|
| 图 5 初始pH对菌株ETH-3生长的影响 |
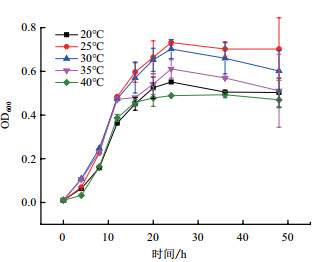
初始温度对菌株ETH-3生长的影响如图 6所示。如图所示,在22 h前,微生物的量都会随着时间的变化而逐渐增多,当达到22 h后,开始出现衰亡期。由图可知,虽然温度为20-40℃时,菌株都能生长,但当温度为25-30℃时,对菌株ETH-3生长最有利。
|
| 图 6 温度对菌株ETH-3生长的影响 |
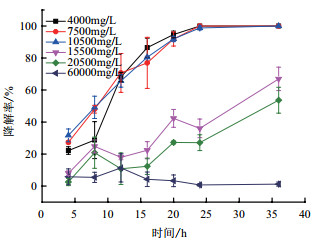
菌株ETH-3对不同浓度的甲酸乙酯降解率如图 7所示,菌株对浓度为4 000、7 500和10 000 mg/L的甲酸乙酯,在24 h内的降解率已经能达到100%。当甲酸乙酯的浓度高于10 000 mg/L时,降解率随着甲酸乙酯浓度的升高开始逐渐下降,菌株对15 500 mg/L的甲酸乙酯,36 h内最高降解率达到67%。而对20 500 mg/L浓度的甲酸乙酯,36 h内降解率最高只有53%。直至甲酸乙酯浓度为60 000 mg/L时,此时微生物对甲酸乙酯已没有降解率。
|
| 图 7 菌株对不同浓度甲酸乙酯的降解率 |
图 8为微生物在不同浓度甲酸乙酯中的生长情况。由图 8可以看出,当甲酸乙酯浓度为4 000 mg/L时,微生物在12 h时开始衰亡,24 h时达到稳定。当甲酸乙酯浓度为7 500 mg/L、10 000 mg/L、15 500 mg/L、20 500 mg/L时,微生物在24 h时达到微生物量的最大值,随后缓慢减少或不变。随着甲酸乙酯浓度的增大,微生物生长量开始减小,当甲酸乙酯浓度大于达到10 500 mg/L时,微生物的活性受到抑制。当浓度达到60 000 mg/L时,微生物彻底不再生长。
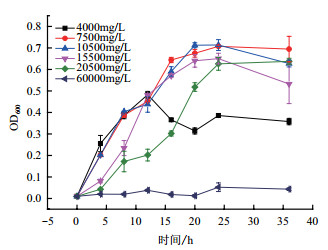
|
| 图 8 菌株ETH-3在不同浓度甲酸乙酯中的生长情况 |
图 9为pH随着时间的变化曲线。从图可知,当甲酸乙酯浓度为4 000 mg/L、7 500 mg/L、10 500 mg/L、15 500 mg/L,20 500 mg/L时,即微生物能够降解甲酸乙酯的几组浓度实验中,pH随着时间先降低再升高。16 h之前,pH随时间降低,都是从7降低至6左右。16 h后,pH随时间升高,最高升高至8。而微生物活性受到彻底抑制的一组浓度实验,即当甲酸乙酯浓度为60 000 mg/L时,pH随着时间是呈现一直降低的趋势。从整个图来看,培养基中甲酸乙酯浓度越大,pH越低。
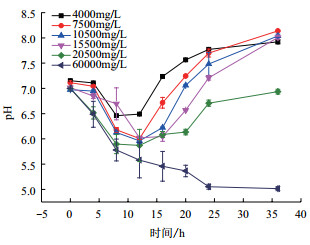
|
| 图 9 菌株ETH-3降解不同浓度甲酸乙酯时pH随时间的变化 |
表 3为6组不同浓度的甲酸乙酯在不同时间的降解速率。通过表 3可知,微生物对6种浓度的甲酸乙酯降解最快的区间都为4 h-8 h。与图 8菌株在4 h-8 h达到最大生长率速度的结果相呼应。
通过GC-MS对甲酸乙酯降解中间产物的分析,得到甲酸乙酯被微生物降解的主要产物为乙醇。以10 500 mg/L甲酸乙酯在4 h时代谢产物的分析图为例(图 10)。图 11为甲酸乙酯在4 h时降解的质谱图。

|
| 图 10 10 500 mg/L甲酸乙酯在4 h时的代谢产物分析 |
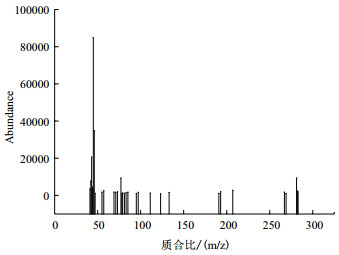
|
| 图 11 甲酸乙酯降解4 h时的质谱图 |
生物法处理有机物目前仍有很多方面等待解决,如微生物的驯化及高效降解菌的培养、工艺过程的完善、微生物降解机理的研究、占地面积较大等[21]。微生物的驯化及高效降解菌的培养是解决占地面积较大、缩短反应器启动时间、提高降解效率的关键因素。本研究从活性污泥中筛选得到一株高效降解甲酸乙酯的菌株ETH-3。经形态观察、生理生化和16S rDNA鉴定,确定筛选出的菌株ETH-3为杀鲑气单胞菌杀鲑亚种(Aeromonas salmonicida subsp.salmonicida)。36 h内该菌株对初始浓度0-10 000 mg/L的甲酸乙酯能实现完全降解。
微生物的生长曲线在废水治理中具有很重要的实践指导意义。通过对微生物生长曲线的形态分析,可以为实际处理工艺的改进提供参考[22]。本研究通过对筛选出的菌株进行生长曲线及生长动力学研究,确定菌株的最佳活性时期为5.9 h,这为实际应用中生物塔接种的菌液培养时间提供了理论依据。
微生物的活性是决定有机物处理效率的关键因素。影响微生物活性的因素很多,主要有有机物底物浓度、温度、pH值和溶解氧等。营养物质主要包括微生物生长所需要的能量、碳源、氮源、无机盐成分等[23]。其中温度和pH是影响菌株生长的最主要因素。pH在细菌代谢中起重要作用。pH值的增加可以改变生物大分子的电荷,如蛋白质和核酸,从而影响它们的生物活性。此外,它还能改变细胞膜的电荷,从而阻碍细胞膜对营养物质的吸收[24-26]。本研究中,菌株ETH-3生长的最佳pH为8。温度可以通过影响蛋白质、核酸等生物大分子的结构和功能以及细胞结构(如细胞膜的流动性及完整性)来影响微生物的生长、繁殖和新陈代谢。过高的环境温度会导致蛋白质或核酸的变性失活,而过低的温度会使酶活力受到抑制,细胞的新陈代谢活动减弱[27-28]。本研究中ETH-3生长的最佳温度为25℃。这与田会芹等[29]发现对于杀鲑气单胞菌的生长最佳pH为7.5,最佳生长温度为28℃结果相符合。
目前尚无杀鲑气单胞菌对废水中甲酸乙酯的降解研究,已有的杀鲑气单胞菌运用到污水治理的为利用杀鲑气单胞菌治理蓝藻分泌的微囊藻毒素[30]。研究甲酸乙酯的浓度对微生物降解有机物及其自身生长的影响,有利于为后续菌株的实际应用提供理论依据。当甲酸乙酯浓度为4 000 mg/L时,微生物在12 h时就开始衰亡,24 h时达到稳定。可能是因为此时微生物的死亡速率大于微生物的生长速率,培养基中的微生物继续对剩余的甲酸乙酯进行降解,直至甲酸乙酯24 h时降解完全,此时培养基中的微生物数量不再有明显的变化。当甲酸乙酯浓度为4 000 mg/L、7 500 mg/L和10 000 mg/L时,微生物在24 h时停止生长,因为此时培养基中的甲酸乙酯被完全降解,碳源被完全消耗。培养基中已无法提供足够的营养给菌株生长。当甲酸乙酯浓度高达20 500 mg/L时,此时有机物的浓度已经会对微生物的生长受到抑制,当浓度达到60 000 mg/L时,微生物的活性被彻底抑制,是因为此时高浓度的甲酸乙酯对微生物产生了毒性抑制作用[31]。甲酸乙酯在4-8 h降解速率最快的主要原因是此时微生物处于对数期,菌株在4-8 h的生理活性最高,细胞分裂繁殖最为旺盛[32]。随着菌株慢慢达到稳定期和衰亡期,菌株对甲酸乙酯的降解速率也随着减慢。
本研究发现在对每组不同浓度的降解实验检测pH时,不加菌的对照组和微生物活性受到抑制的浓度实验,pH是随着时间一直降低的,主要是因为甲酸乙酯会水解成甲酸等酸溶液,造成pH的降低[33]。甲酸乙酯浓度越高,其自身水解和被微生物降解的甲酸量越多,从而解释了甲酸乙酯浓度越大,pH越低。而加了菌的,且甲酸乙酯浓度未达到抑制微生物生长的几个浓度实验中,推测有碱性产物的产生,才导致pH升高。并且菌株ETH-3在pH为8时,生长的最好。碱性产物的产生,且此时pH未超过8,能促进微生物的生长。
由甲酸乙酯代谢产物的分析,结合甲酸乙酯降解过程中pH的变化图,推测甲酸乙酯先被微生物降解为甲酸和乙醇,在12 h时,甲酸被微生物进一步降解为CO2和H2O,导致酸性下降,pH上升。乙醇被微生物降解的主要途径是由乙醇脱氢酶(Alcohol dehydrogenase,ADH)和CYP2E1水解成乙醛和甲酮,乙醛继而由乙醛脱氢酶(Aldehyde dehydrogenase,ALDH)水解成乙酸,乙酸再变为乙酰辅酶A,进入三羧酸循环,最终代谢为CO2和H2O[34-36]。
4 结论本研究从活性污泥中筛选得到一株高效降解甲酸乙酯的菌株ETH-3。经形态观察和16S rDNA鉴定,确定筛选出的菌株ETH-3为杀鲑气单胞菌杀鲑亚种(Aeromonas salmonicida subsp.salmonicida)。选出的杀鲑气单胞菌杀鲑亚种(Aeromonas salmonicida subsp.salmonicida)的最佳生长温度为25℃,最佳生长pH为8。通过对6个不同浓度的甲酸乙酯的降解实验发现,在30℃下,转速为170 r/min时,36 h内菌株对初始浓度0-10 000 mg/L的甲酸乙酯能完全降解。通过对甲酸乙酯代谢产物的分析,及菌株代谢甲酸乙酯过程中pH的变化推测菌株代谢甲酸乙酯的途径为:甲酸乙酯先被微生物降解成甲酸和乙醇,甲酸被微生物进一步降解为CO2和水。该菌株具有较好的温度适应性以及对甲酸乙酯的高效降解性,具有一定的商业应用价值。
| [1] |
Dojchinov G. Ethyl formate for farm stored grains[J]. Pesticide Outlook, 2004, 14(6): 241-242. |
| [2] |
Lindinger C, Pollien P, Vos R CHD, et al. Identification of ethyl Formate as a quality marker of the fermented off-note in coffee by a nontargeted chemometric approach[J]. Journal of Agricultural and Food Chemistry, 2009, 57(21): 9972-9978. DOI:10.1021/jf901673d |
| [3] |
Charles-Bernard M, Kraehenbuehl K, Rytz A, et al. Rytz A, et al.Interactions between volatile and nonvolatile coffee components.1.Screening of nonvolatile components[J]. Journal of Agricultural and Food Chemistry, 2005, 53(11): 4417-4425. DOI:10.1021/jf048021q |
| [4] |
Opdyke DLJ. Ethyl formate[J]. Food & Cosmetics Toxicology, 1978, 16(Suppl 1): 737-739. |
| [5] |
Gibson HW. Chemistry of formic acid and its simple derivatives[J]. Chemical Reviews, 1969, 69(5): 673-692. DOI:10.1021/cr60261a005 |
| [6] |
Amoore JE, Hautala E. Odor as an aid to chemical safety:odor thresholds compared with threshold limit values and volatilities for 214 industrial chemicals in air and water dilution[J]. Journal of Applied Toxicology, 2010, 3(6): 272-290. |
| [7] |
Netherlands HCot.Health-based reassessment of administrative occupational exposure limits.Committee on updating of occupational exposure limits.Ethyl formate[EB].The Hague: Health Council of the Netherlands, 2002.
|
| [8] |
Qian Q, Gong C, Zhang Z, et al. Removal of VOCs by activated carbon microspheres derived from polymer:a comparative study[J]. Adsorption, 2015, 21(4): 333-341. DOI:10.1007/s10450-015-9673-9 |
| [9] |
Iranpour R, Cox HHJ, Deshusses MA, et al. Literature review of air pollution control biofilters and biotrickling filters for odor and volatile organic compound removal[J]. Environmental Progress & Sustainable Energy, 2010, 24(3): 254-267. |
| [10] |
王红丽, 景盛翱, 王倩, 等. 溶剂使用源有组织排放VOCs监测方法及组成特征[J]. 环境科学研究, 2016, 29(10): 1433-1439. |
| [11] |
Ramalingam SG, Pré P, Giraudet S, et al. Different families of volatile organic compounds pollution control by microporous carbons in temperature swing adsorption processes[J]. Journal of Hazardous Materials, 2012, 221-222(4): 242-247. |
| [12] |
杨峰. 甲酸乙酯废水工艺研究[J]. 江苏科技信息, 2014, 12: 25-27. |
| [13] |
宋红改, 张亚雄. 微生物处理技术在有机污染物降解中的应用[J]. 环境工程, 2008(s1): 205-208. |
| [14] |
Park IH, Ka JO. Isolation and characterization of 4-(2, 4-Dichlorophenoxy) butyric acid-degrading bacteria from agricultural soils[J]. Journal of Microbiology & Biotechnology, 2003, 13(2): 243-250. |
| [15] |
徐畅, 李琳. 气相色谱法测定环境空气中甲酸甲酯和甲酸乙酯[J]. 污染防治技术, 2016(3): 85-87. |
| [16] |
东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001.
|
| [17] |
Meena SS, Sharma RS, Gupta P, et al. Isolation and identification of Bacillus megaterium YB3 from an effluent contaminated site efficiently degrades pyrene[J]. Journal of Basic Microbiology, 2016, 56(4): 369-378. DOI:10.1002/jobm.v56.4 |
| [18] |
宇盛好, 曹慧, 徐斐, 等. 烤鸭中金黄色葡萄球菌生长模型的建立[J]. 食品科学, 2015, 36(13): 154-159. DOI:10.7506/spkx1002-6630-201513029 |
| [19] |
李想, 张雪英, 周俊, 等. 1株铜绿假单胞菌对芘的降解特性及代谢途径[J]. 环境科学, 2018, 39(4): 1794-1803. |
| [20] |
Chen YP, Chiang TK, Chung HY. Optimization of a headspace solid-phase microextraction method to quantify volatile compounds in plain sufu, and application of the method in sample discrimination[J]. Food Chemistry, 2019, 275: 32-40. DOI:10.1016/j.foodchem.2018.09.018 |
| [21] |
Barbusinski K, Kalemba K, Kasperczyk D, et al. Biological methods for odor treatment-A review[J]. Journal of Cleaner Production, 2017, 152: 223-241. DOI:10.1016/j.jclepro.2017.03.093 |
| [22] |
丁庆伟, 霍丽娟, 杨改强, 等. 废水治理中微生物的生长规律研究[J]. 太原科技大学学报, 2011, 32(2): 163-165. DOI:10.3969/j.issn.1673-2057.2011.02.019 |
| [23] |
何旭辉. 生物化学[M]. 第2版. 北京: 人民卫生出版社, 2010: 45-49.
|
| [24] |
郎咸勇, 张锦华, 刘宝生. 培养基高压蒸气灭菌后pH值的变化及其对细菌生长的影响[J]. 黑龙江畜牧兽医, 2016(4): 30-33. |
| [25] |
叶建生, 刘道成, 熊良伟, 等. pH值对光合细菌生长的影响[J]. 渔业致富指南, 2008(23): 61-62. |
| [26] |
Zhou X, Jin W, Sun C, et al. Microbial degradation of N, N-dimethylformamide by Paracoccus, sp.strain DMF-3 from activated sludge[J]. Chemical Engineering Journal, 2018, 343: 324-330. DOI:10.1016/j.cej.2018.03.023 |
| [27] |
诸葛健. 工业微生物实验与研究技术[M]. 北京: 科学出版社, 2007: 109-111.
|
| [28] |
曾恋之, 谭锋, 侯茂书. 温度对细菌在生菜基质中生长的影响[J]. 安徽农业科学, 2012(13): 7916-7918. DOI:10.3969/j.issn.0517-6611.2012.13.110 |
| [29] |
田会芹, 李贤, 傅松哲, 等. 温度及pH对杀鲑气单胞菌生长的影响研究[J]. 海洋科学, 2015, 39(7): 7-12. |
| [30] |
董小娜, 杨洁, 陈泽慧, 等. 太湖激浪鱼内脏中藻毒素降解菌的筛选及其特性研究[J]. 湖北农业科学, 2017(16): 3042-3047. |
| [31] |
石成春. 有机污染物微生物共代谢降解及其动力学研究[J]. 化学工程与装备, 2010(7): 164-167. |
| [32] |
王家玲, 李顺鹏, 黄正. 环境微生物学[M]. 第2版. 北京: 高等教育出版社, 2004: 89-91.
|
| [33] |
Tarakanova EG, Yukhnevich GV. Structure of proton disolvates formed in the acid hydrolysis of ethyl formate and methyl acetate[J]. Journal of Structural Chemistry, 2013, 54(3): 492-498. DOI:10.1134/S0022476613030037 |
| [34] |
伦世仪. 生化工程[M]. 北京: 中国轻工业出版社, 1993: 101-104.
|
| [35] |
Barbusinski K, Kalemba K, Kasperczyk D, et al. Biological methods for odor treatment-A review[J]. Journal of Cleaner Production, 2017, 152: 223-241. DOI:10.1016/j.jclepro.2017.03.093 |
| [36] |
薛开先. 乙醇代谢酶遗传多态与癌易感性关系的研究[J]. 国际遗传学杂志, 2000(1): 24-27. |







