水体氮元素污染本质上是水体中含氮量超过环境承受的限值而造成的一系列现象和结果。未处理的废水中,氮元素主要存在形式为有机氮和氨氮,二级生化处理后,氮元素的主要存在形式是氨氮和硝态氮。水体中氮元素污染的主要危害有:引发水体黑臭[1-3];引起水体富营养化[4-6]以及对水生生物造成伤害[7]。
水体脱氮常见的方法有物理法、化学法、生物法[8]。物理法有氨的空气吹脱法、电渗析法、反渗透法等,化学法有折点加氯法、选择性离子交换法、磷酸铵镁沉淀法等,生物脱氮法有传统硝化-反硝化、短程硝化反硝化、厌氧氨氧化等。物理化学脱氮方法成本高、易产生二次方法,生物法投资运行费用低、环境友好,是理想的脱氮方式。
本实验室从活性污泥中分离出一株具有良好反硝化脱氮活性的菌株M1,经16S rDNA鉴定为解淀粉芽孢杆菌。解淀粉芽孢杆菌产生的芽孢具有极强的抗逆性,可耐高温、辐射等恶劣条件,提高解淀粉芽孢杆菌的芽孢产量,有利于提升微生物菌剂的稳定性和寿命。为了进一步提高M1菌株液体发酵产芽孢量的水平,本研究运用单因子实验和正交试验,优化芽孢杆菌M1的培养基成分和培养条件,并考察了该菌株对实际废水的生物脱氮效果,为该菌株的产业化应用提供基础技术支持。
1 材料与方法 1.1 材料 1.1.1 菌株来源本实验室从活性污泥中分离并保存的解淀粉芽孢杆菌M1,其具有良好的反硝化脱氮活性。
1.1.2 主要仪器和试剂蔗糖、硫酸铵、尿素、丁二酸钠、氯化钠等,分析纯AR,国药集团化学试剂有限公司;胰蛋白胨、琼脂粉等,生化试剂BR,国药集团化学试剂有限公司;酵母浸粉等,生物试剂,北京奥博星生物技术有限责任公司。
ZQZY-AF8组合式全温振荡培养箱,上海知楚仪器有限公司;HQ40d pH计,瑞士梅特勒公司;YXQ-LS-75G立式压力蒸汽灭菌器,上海博迅实业有限公司医疗设备厂;KH-300DE型数控超声清洗器,昆山禾创超声仪器有限公司;SPX-150B-Z型生化培养箱,上海博迅实业有限公司医疗设备厂;SW-CJ-2FD洁净工作台,苏净安泰空气技术有限公司;WGLL-230BE电热鼓风干燥箱,天津市泰斯特仪器有限公司;HH-4数显恒温水浴锅,常州国华电器有限公司。
1.1.3 培养基M1菌株斜面培养基、种子培养基和基础发酵培养基均为LB培养基。
LB培养基组成为:10 g/L胰蛋白胨、5 g/L酵母粉、5 g/L NaCl,调节pH为7.2,120℃高压蒸汽灭菌20 min。固体LB培养基,琼脂含量为20 g/L。
1.2 方法 1.2.1 菌株M1培养方法菌种活化方法:将保存的菌种转接至斜面培养基,30℃活化24 h。
种子液培养方法:用接种环挑取1环菌泥,接入装有10 mL LB培养基的50 mL摇瓶中,30℃活化22 h。
菌株培养方法:采用装有100 mL LB培养液的250 mL摇瓶培养,接种量1%,于30℃、200 r/min培养48 h,取样测定活菌数和芽孢数。
1.2.2 芽孢计数法采用平板计数法[9],计数前将菌液在80水浴中热处理15 min。
1.2.3 发酵培养基成分的单因子筛选在LB培养基和30℃、200 r/min培养条件下,考察不同营养成分及浓度对M1液体发酵产芽孢量的影响。每个处理重复3次。
1.2.3.1 碳源种类在基础培养基中原有成分不变的前提下,分别添加10 g/L甘露醇、蔗糖、麦芽糊精、海藻糖、乙酸钠、木薯淀粉、玉米淀粉、马铃薯淀粉、可溶性淀粉、葡萄糖、丁二酸钠,选择最优碳源。
1.2.3.2 碳源浓度的选择上述筛选得到的最佳碳源,考察其浓度(5、10、15、20、25和30 g/L)对菌株M1液体发酵产芽孢量的影响。
1.2.3.3 氮源种类以可溶性淀粉为碳源,分别添加10 g/L的硝酸钾、硫酸铵、尿素作为单一氮源及1:1、1:2、1:3的胰蛋白胨和酵母粉作为混合氮源加到基础培养基中,筛选最优氮源。
1.2.3.4 氮源浓度的选择上述筛选得到的最佳氮源,考察其浓度(5、10、15、20、25和30 g/L)对菌株M1液体发酵产芽孢量的影响。
1.2.3.5 NaCl浓度的选择改变基础培养基筛选中的NaCl浓度(1、3、5、7、10、15和20),筛选出最优的NaCl浓度。
1.2.4 最佳培养条件的筛选在LB基础培养基、培养时间为48 h的条件下,研究接种量(0.5%、0.75%、1%、2%、5%、7%和10%)、装液量(25、50、75、100和125 mL)、pH(6.5、7、7.5、8、8.5和9)、培养温度(24、28、32、36和40℃)和转速(120、140、160、180和200 r/min)对菌株M1液体发酵的影响。每个处理重复3次。
1.2.5 正交试验根据单因子试验结果,选择对菌株M1产芽孢量影响显著的温度、装液量、接种量、氮源浓度为考察因素,按正交试验表L9(34)设计4因素、3水平的正交试验(表 1),比较各种发酵条件组合对菌株M1产芽孢量的影响。其他试验条件:可溶性淀粉5 g/L,NaCl 1 g/L,初始pH值6.5,摇床转速180 r/min,酵母粉:胰蛋白胨=2:1。
1.2.6 反硝化脱氮实验装置实验采用自制SBR反应器,反应器有效容积为2 L,高200 mm,内径140 mm。反应装置在30℃恒温水浴下运行,搅拌方式为磁力搅拌。
1.2.7 污泥特性及污水水质实验接种污泥取自南京市某污水处理厂缺氧池,该污泥的MLSS浓度为7 800 mg/L,MLVSS/MLSS为0.90,呈红褐色。将此活性污泥用纱布过滤除去塑料袋、石子等杂物,用蒸馏水清洗3次,按接种浓度3000-4000 mg/L接种。
实验废水取自同一污水处理厂匀质池出水,水质特征为pH=7.45,COD=11000 mg/L,TOC=2634 mg/L,TN=1284 mg/L,NO3--N=1281 mg/L,TP=1.0 mg/L。将此污水稀释10倍,作为实验用水。
活性污泥经20 d驯化,运行稳定后,开始反硝化脱氮评价实验。
1.2.8 评价方法采用前述优化工艺,摇瓶发酵制备M1菌液,在3 000 r/min条件下离心10 min,收集菌泥,生理盐水洗涤2次。分别考察不同的投加量(0.5%、0.7%、1%、3%和5%)及不同的HRT(2、4、6、8和10 h)对反硝化脱氮效果的影响。
1.2.9 分析方法NO3--N、MLSS、MLVSS等按标准方法[10]测定。
1.2.10 数据处理利用Excel 2007绘图,用SPSS22分析软件对数据进行单因素方差分析。
2 结果 2.1 发酵时间的确定发酵时间分别为24、36、48、60和72 h时,对应的活菌数分别为:8.3×107、2.58×108、3.2×108、3.3×108和2.88×108 CFU/mL,对应的芽孢数分别为:7.8×107、1.58×108、2.08×108、1.72×108和1.55×108 CFU/mL,芽孢数在48 h时达到最大值,故选择48 h作为发酵时间。
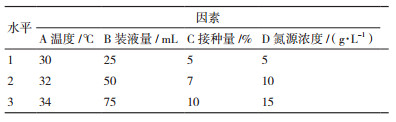
2.2 单因素试验 2.2.1 碳源种类的筛选由图 1可知,不同种类的碳源对芽孢杆菌M1活菌数及产芽孢量的影响很大(P < 0.05),其中可溶性淀粉、玉米淀粉、麦芽糊精能明显促进菌株M1生长,木薯淀粉、丁二酸钠、海藻糖对菌株M1生长影响不明显(P>0.05),甘露醇、蔗糖、葡萄糖不利于菌株M1生长(P < 0.05)。木薯淀粉、玉米淀粉、可溶性淀粉利于芽孢形成,马铃薯淀粉、丁二酸钠对芽孢的形成无明显影响,麦芽糊精对芽孢的形成有轻微的抑制作用(P>0.05),葡萄糖、甘露醇、蔗糖、海藻糖不利于芽孢的产生(P < 0.05)。
|
| 1:CK;2:甘露醇;3:蔗糖;4:麦芽糊精;5:海藻糖;6:乙酸钠;7:木薯淀粉;8:玉米淀粉;9:马铃薯淀粉;10:可溶性淀粉;11:葡萄糖;12:丁二酸钠 图 1 不同碳源对M1菌株发酵的影响 |
综合考虑M1菌株活菌数及芽孢数,可以确定可溶性淀粉为菌株M1最佳碳源。
2.2.2 可溶性淀粉浓度的优化可溶性淀粉浓度分别为5、10、15、20、25及30 g/L时,菌株M1活菌数从3.2×108 CFU/mL、依次降至2.4×108、2.2×108、2.5×108、2.2×108和2.1×108 CFU/mL,芽孢数从2.2×108 CFU/mL、依次降至1.4×108、1.3×108、1.2×108、1.2×108和1.1×108 CFU/mL。5 g/L为可溶性淀粉最优添加浓度,此时活菌数和芽孢数达到最大值。
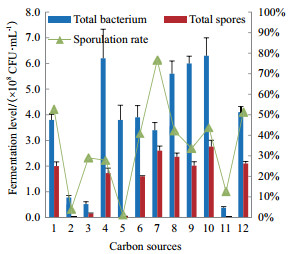
2.2.3 氮源的筛选由图 2可知,不同氮源对M1菌株活菌数及产芽孢数具有显著的影响(P < 0.05)。当酵母粉:胰蛋白胨=2:1时,M1菌株活菌数和芽孢数均达到最大值,其次是酵母粉:胰蛋白胨=1:1,当酵母粉:胰蛋白胨=3:1时,与空白对照相比,活菌数略微降低,芽孢数升高(P > 0.05),硝酸钾、硫酸铵、尿素不利于M1菌株生长和芽孢产生(P < 0.05)。综合考虑M1菌株活菌数和芽孢产量,以酵母粉:胰蛋白胨=2:1作为优选氮源。
|
| 1:CK;2:硝酸钾;3:硫酸铵;4:尿素;5:酵母粉:胰蛋白胨=3:1;6:酵母粉:胰蛋白胨=2:1;7:酵母粉:胰蛋白胨=1:1 图 2 不同氮源对M1菌株发酵的影响 |
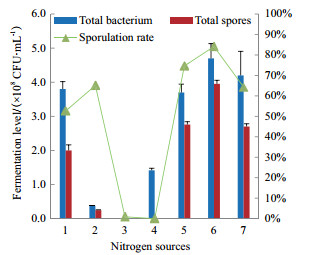
按照2.2.3中研究结果,以酵母粉:胰蛋白胨=2:1作为氮源,考察不同的氮源浓度对菌株M1发酵培养的影响(图 3)。随着氮源浓度的增加,菌株M1的活菌数和芽孢数呈现先增大后减少的趋势,在氮源浓度为10 g/L时,活菌数和芽孢数达到最大值。当氮源浓度≥15 g/L时,活菌数和芽孢数迅速下降。以芽孢数为参考指标,优选的氮源浓度为10 g/L。
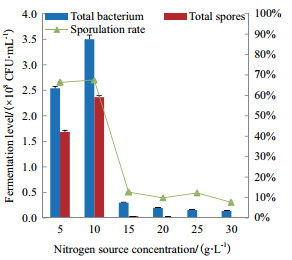
|
| 图 3 氮源浓度对M1菌株发酵的影响 |
NaCl浓度对M1菌株活菌数和芽孢数都有显著影响。当NaCl浓度分别为1%、3%、5%、7%、10%、15%和20%时,M1菌株的活菌数分别为:4.8×108、6.8×108、4.8×108、4.4×108、4.0×108、5.9×108和6.2×108 CFU/mL,芽孢数分别为:2.6×108、2.5×108、2.1×108、1.8×108、1.7×108、1.7×108和1.7×108 CFU/mL。M1菌株的芽孢数随着NaCl浓度的增加,逐渐减少。以芽孢产量为标准,最优的NaCl浓度为1 g/L。
2.2.6 初始pH的筛选当初始pH值分别为6.5、7.0、7.5、8.0、8.5、9时,菌株的活菌数分别为:5.6×108、7.1×108、6.4×108、7.2×108、5.2×108和6.4×108 CFU/mL,芽孢数分别为:2.3×108、1.8×108、1.7×108、1.6×108、1.6×108、1.5×108 CFU/mL。以芽孢产量为标准,最佳的初始pH值为6.5。
2.2.7 最佳装液量的筛选装液量对M1菌株活菌数和芽孢量的影响见图 4。M1菌株活菌数随着装液量的增加呈现先减少后增大的趋势,在装液量为50 mL时达到最大值。M1菌株的芽孢量随着装液量的增加呈现先增大后减少的趋势,在装液量为50 mL时,芽孢数和芽孢产率最高,分别为3.1×108 CFU/mL和62%,在250 mL三角瓶中,最佳装液量为50 mL。
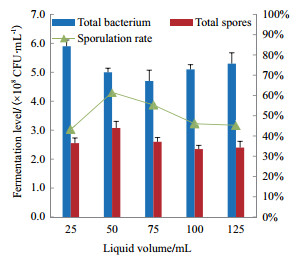
|
| 图 4 装液量对M1菌株发酵的影响 |
温度对菌株M1活菌数和芽孢数具有显著的影响(图 5)。随着温度的升高,菌株M1的活菌数和芽孢数呈现先增大后减少的趋势,在温度为32℃时,活菌数和芽孢数最大,因此,优选的培养温度为32℃。

|
| 图 5 温度对M1菌株发酵的影响 |
摇床转速分别为120、140、160、180和200 r/min时,菌株M1活菌数分别为2.07×108、2.1×108、2.38×108、3.08×108和2.17×108 CFU/mL,芽孢数分别为1.05×108、1.17×108、1.43×108、2.40×108和1.95×108 CFU/mL。优选的转速为180 r/min,此时活菌数和芽孢数达到最大。
2.2.10 接种量的筛选不同接种量对M1菌株发酵影响见图 6。在接种量为7%时,活菌数及芽孢数达到最大,为2.53×108 CFU/mL,高于或低于接种量7%,均不利于芽孢的产生。故选择7%为最优接种量。
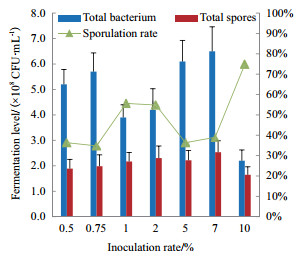
|
| 图 6 接种量对M1菌株发酵的影响 |
上述2.2中考虑了各因素对M1菌种发酵水平的影响,挑选其中对产芽孢量影响较为显著的影响因子初始温度(A)、装液量(B)、接种量(C)和氮源浓度(D),按正交试验表L9(34)设计4因素、3水平的正交试验,进一步确定影响M1菌株发酵产芽孢的实验条件。正交试验影响因素水平见表 1,实验结果见表 2。
从表 2中的实验结果可知,各因素对M1菌株发酵产芽孢数的影响次序为:C>B>A>D,最优方案为A3B3C2D1,即发酵温度34℃,装液量75 mL,接种量7%,氮源浓度10%,此时菌粉芽孢数为6.8×108 CFU/mL。采用优化后的工艺参数,发酵制备芽孢杆菌M1,芽孢数量高于优化前的2.08×108 CFU/mL。
2.4 反硝化脱氮评价实验结果不同投加量对反硝化脱氮影响较大,随着投加浓度的增加,反硝化脱氮效果不断提升。当投加量超过1%时,反硝化脱氮效果提升幅度不明显(图 7)。当HRT≥10 h,所有实验组中硝态氮完全去除。当投加量为1%时,HRT分别为2 h、4 h和6 h时,与空白组相比,加入菌种M1后,系统反硝化脱氮活性分别提升15%、27%和34%。实验说明,系统加入菌种M1后,对反硝化脱氮生物增效作用明显,M1具备良好的工业应用前景。

|
| 图 7 投加量对反硝化脱氮效果的影响 |
解淀粉芽孢杆菌可应用于环保、生物农药、养殖和畜产品加工等领域。不同研究者对解淀粉芽孢杆菌发酵条件优化研究的结果不尽相同[11-14],其原因可能是具体菌株不同、研究目的不同。培养基组分和操作条件对解淀粉芽孢杆菌的发酵具有重要影响,张子豪[15]等发现最佳碳源为淀粉,氮源为质量比为1:1:2的酵母浸出物、胰蛋白胨和尿素。汪晶晶等[16]发现优选的碳源为葡萄糖,氮源为酵母膏、pH为7.0,发酵温度28℃。李鑫等[17]发现最佳的发酵温度为37℃、初始pH为7.0。曹雪梅等[18]发现优选的碳源为糊精、氮源为牛肉膏、温度28℃,pH为7.0。He等[19]发现优选的pH为6.2,温度为37℃。王卉等[20]发现发酵温度为32℃时,活菌数最大。前述解淀粉芽孢杆菌优选的初始pH值一般在中性及偏酸性条件下,与本工作结果相同。本研究结果表明,当培养基组分为5 g/L碳源(可溶性淀粉)、10 g/L氮源(酵母粉:胰蛋白胨=2:1)、1 g/L NaCl,培养条件为初始pH 6.5、发酵温度34℃、摇床转速180 r/min、培养瓶装液量30%、接种量7%时,M1活菌数和芽孢数较优化前分别提升了1.2、2.3倍。本工作仅对菌株M1的摇瓶发酵条件做了较为基础的研究,后续还需要进行发酵罐小试和中试实验,对发酵过程进行控制优化[21],同时需要考察消泡剂、无机盐[22]等因素对发酵的影响。
生物脱氮具有环保、经济的特点,在治理水体富营养等领域具有较为广泛的应用[23-26]。本工作采用优选的发酵条件,发酵制备M1菌液,离心洗涤、浓缩后,投加量为1%,HRT分别为2 h、4 h和6 h时,与空白组相比,系统反硝化脱氮活性分别提升15%、27%和34%。实验说明反硝化脱氮菌M1具有良好的工业应用前景。后续需要做更为系统的实验,详细考察菌株M1的反硝化脱氮特性。
| [1] |
Chen X, Jiang X, Huang W. Evaluation and mechanism of ammonia nitrogen removal using sediments from a malodorous river[J]. Royal Society Open Science, 2018, 5(3): 1-11. |
| [2] |
李文超, 王文浩, 何岩, 等. 黑臭河道沉积物中硫铁行为与氮磷循环的耦合机制[J]. 华东师范大学学报:自然科学版, 2015(2): 1-8,29. |
| [3] |
吕佳佳, 杨娇艳, 廖卫芳, 等. 黑臭水形成的水质和环境条件研究[J]. 华中师范大学学报:自然科学版, 2014, 48(5): 711-716. |
| [4] |
Stutter MI, Graeber D, Evans CD, et al. Balancing macronutrient stoichiometry to alleviate eutrophication[J]. Science of the Total Environment, 2018, 634: 439-447. DOI:10.1016/j.scitotenv.2018.03.298 |
| [5] |
闫兴成, 王明玥, 许晓光, 等. 富营养化湖泊沉积物有机质矿化过程中碳、氮、磷的迁移特征[J]. 湖泊科学, 2018, 30(2): 306-313. |
| [6] |
桓清柳, 庞仁松, 周秋伶, 冷科明. 深圳近岸海域氮、磷营养盐变化趋势及其与赤潮发生的关系[J]. 海洋环境科学, 2016, 35(6): 908-914. |
| [7] |
Ménesguen A, Desmit X, Dulière V, et al. How to avoid eutrophica-tion in coastal seas?A new approach to derive river-specific combi-ned nitrate and phosphate maximum concentrations[J]. Science of the Total Environment, 2018, 628-629: 400-414. DOI:10.1016/j.scitotenv.2018.02.025 |
| [8] |
孙锦宜. 含氮废水处理技术与应用[M]. 北京: 化学工业出版社, 2003.
|
| [9] |
沈萍, 陈向东. 微生物学实验[M]. 北京: 高等教育出版社, 2007: 26-30.
|
| [10] |
国家环境保护总局. 水和废水监测分析方法[M]. 第4版. 北京: 中国环境科学出版社, 2002: 53-57.
|
| [11] |
李娟, 夏凯丽, 王远宏, 等. 解淀粉芽孢杆菌LJ1摇瓶发酵条件优化[J]. 生物技术通报, 2015, 31(12): 214-220. |
| [12] |
Fang CJ, Lu ZX, Sun LJ, et al. Optimization of fermentation technology for lipopeptides producing bacteri a Bacillus amyloliquefaciens ES-2-4[J]. Scientia Agricultura Sinica, 2008, 41(2): 533-539. |
| [13] |
梁昌聪, 郭立佳, 刘磊, 等. 响应面法优化解淀粉芽孢杆菌C101发酵培养基[J]. 生物技术通报, 2014(8): 169-174. |
| [14] |
刘京兰, 薛雅蓉, 刘常宏. 内生解淀粉芽孢杆菌CC09产Iturin A摇瓶发酵条件优化[J]. 微生物学通报, 2014, 41(1): 75-82. |
| [15] |
张子豪, 康建依, 谢远红, 等. 高效抑制大肠埃希氏菌的芽孢杆菌的发酵培养基及发酵条件优化[J]. 食品工业科技, 2018, 39(19): 114-118. |
| [16] |
汪晶晶, 曹雪梅, 李欢, 等. 抗菌海洋解淀粉芽孢杆菌GM-1-2菌株摇瓶发酵培养基和发酵条件优化[J]. 江苏农业科学, 2018, 46(8): 291-295. |
| [17] |
李鑫, 郝林, 马玲. 解淀粉芽孢杆菌HRH317抑菌物质发酵条件的优化[J]. 中国酿造, 2017, 36(2): 25-29. |
| [18] |
曹雪梅, 汪晶晶, 贾杰, 等. 海洋细菌GM-1-1菌株摇瓶发酵培养基和发酵条件优化[J]. 食品科技, 2017, 42(6): 23-29. |
| [19] |
He X, Zhang W, Ren F, et al. Screening fermentation parameters of the milk-clotting enzyme produced by newly isolated Bacillus amyloliquefaciens D4 from the Tibetan Plateau in China[J]. Annals of Microbiology, 2012, 62(1): 357-365. DOI:10.1007/s13213-011-0270-1 |
| [20] |
王卉, 尚庆茂, 张志刚, 等. 解淀粉芽孢杆菌L-H15产促生物质分析及发酵工艺优化[J]. 食品科学, 2017, 38(10): 74-81. DOI:10.7506/spkx1002-6630-201710013 |
| [21] |
王涛, 刘健, 左建英, 等. 解淀粉芽孢杆菌高密度发酵条件的优化[J]. 中国测试, 2017, 43(5): 49-52. |
| [22] |
Ren H, Su YT, Guo XH. Rapid optimization of spore production from Bacillus amyloliquefaciens in submerged cultures based on dipicolinic acid fluorimetry assay[J]. AMB Express, 2018, 8(1): 21. DOI:10.1186/s13568-018-0555-x |
| [23] |
Bricker SB, Ferreira JG, Zhu C, et al. Role of shellfish aquaculture in the reduction of eutrophication in an urban estuary[J]. Environmental Science & Technology, 2018, 52(1): 173. |
| [24] |
Prosser JI. Autotrophic nitrification in bacteria[J]. Advances in Microbial Physiology, 1990, 30: 125-181. DOI:10.1016/S0065-2911(08)60112-5 |
| [25] |
郭丽芸, 时飞, 杨柳燕, 等. 好氧反硝化菌处理低浓度含氮污水[J]. 江苏农业科学, 2016, 44(8): 523-526,575. |