低氧诱导因子(Hypoxia inducible factor,HIF)是动物低氧生理反应的重要转录因子,由α和β亚基组成的异二聚体,其中α亚基受氧调节,是调节HIF活性的功能亚单位。目前已知的α亚基有HIF-1α、HIF-2α和HIF-3α三种。在哺乳动物处于低氧环境下,HIF-1α和HIF-2α因子的蛋白质稳定性和体内转录潜力均显著提高[1],进而调控HIF下游基因,特别是关于糖酵解相关基因(如GLUT1、LDHA和VEGF)表达,通过增加糖酵解效率、促进血管生成和增加葡萄糖转运等途径来维持其在缺氧环境中的生存和对抗缺氧损伤[2]。低氧分压通过HIF-1α影响卵母细胞的成熟、黄体的形成与早期胚胎的发育[3],但是,慢性低氧也会引起动物繁殖能力下降[4]。HIF-2α又称内皮PAS蛋白1(EPAS-1),刺激胚胎分泌儿茶酚胺,调节胚胎发育[5]。小鼠子宫缺失HIF-2α会造成小鼠不孕不育,而小鼠子宫缺失HIF-1α会造成小鼠繁殖能力下降[6]。虽然世居高原的动物对高原低氧有一定的适应能力,但雌性高原鼠兔(Ochotona curzoniae)的窝产仔数也随着低氧程度的提高而下降[7]。目前,动物繁殖机能对低氧环境适应其分子调控机制的有待深入研究。
牦牛(Bos grunniens)是生活在青藏高原高海拔低氧地区的物种,是高原人民的主要生活资料和生产资料[8]。牦牛为季节性发情动物,生殖系统发育缓慢,性成熟晚,繁殖性能低[9]。黄牛则主要分布在海拔2 000 m以下的地区,为常年发情动物[10]。因此,本研究以母牦牛和母黄牛为研究对象,运用RT-qPCR技术对HIF-1αmRNA与HIF-2α mRNA在两物种生殖轴的表达差异进行分析,探讨牦牛生殖机能对高原低氧环境的适应调控机制。
1 材料与方法 1.1 材料 1.1.1 实验动物在2017年10月,实验选取5头4-5岁红原(海拔3 000 m)放牧饲养、处于卵泡期的健康母牦牛和5头4-5岁巴中(海拔1 500 m)放牧饲养、处于卵泡期的健康母黄牛,于四川省成都市青白江唐家寺屠宰场现场屠宰。使用无菌剪刀剪取下丘脑、脑垂体、卵巢、输卵管和子宫组织。组织样用生理盐水冲洗干净,投入液氮罐,快速运回实验室,保存备用。
1.1.2 主要试剂、仪器Trizol Reagent为美国Invitrogen公司产品;DNA Marker DL2000,2×Taq PCR Master mix为上海天根公司产品;反转录试剂盒(RevertAid First Strand cDNA Synthesis Kit)为Thermo Scientific公司产品;DH5α感受态细胞为康迪生物技术有限公司产品;克隆载体pMD-19Vector、IPTG、X-Gal和氨苄青霉素均为大连宝TaKaRa生物工程有限公司产品;Green Supermix为DBI®BIOSCIENCE公司产品;DNA胶回收试剂盒(AxyPrepTM DNA Gel Extraction Kit)为北京Axygen公司产品;RT-qPCR仪(CFX6)为美国Bio Rad公司产品;琼脂糖凝胶成像系统(GEL DOC2000)为美国Bio Rad公司产品;PCR仪(ETC811)为苏州东盛兴业科学仪器有限公司产品。
1.2 方法 1.2.1 引物设计与合成根据NCBI公布的牦牛HIF-1α(登录号:AY621118.1)、HIF-2α(登录号:KJ617390.1)和内参基因GAPDH(登录号:EU195062.1)设计荧光定量引物(表 1),引物由成都擎科梓熙生物技术有限公司合成。
将分别采集的牦牛和黄牛下丘脑、脑垂体、卵巢、输卵管和子宫组织各取0.5 g左右放入预先用液氮冷却的研钵内,用研磨棒将各组织研磨成白色粉末状,采用Trizol法分别提取牦牛和黄牛的生殖轴的总RNA。用1%琼脂糖凝胶电泳检测总RNA完整性并用紫外分光光度计检测RNA浓度。反转录前检测RNA的浓度为100 ng/μL。cDNA合成采用Thermo Scientific试剂盒进行反转录,转录程序按照说明书进行。反转录后,将得到的cDNA分别作为常规PCR和RT-qPCR模板,置于-20℃冰箱备用。
1.2.3 常规PCR检测引物特异性以牦牛和黄牛下丘脑cDNA为模板,利用常规PCR检测HIF-1α、HIF-2α和GAPDH引物特异性。常规PCR反应体系为25 μL:Taq酶(5 U/μL)12.5 μL,ddH2O 9.5 μL,上游引物(100 µmol/μL)各1 μL,cDNA1 μL。反应程序:94℃预变性3 min;94℃变性30 s;退火30 s(温度见表 1);72℃延伸30 s,循环39次;72℃终延伸5 min。反应结束后,将0.5 μL pMD-19Vector、4.5 μL纯化回收产物和5 μL Solution于16℃金属浴中反应过夜,保证连接彻底。连接后的产物再转化100 μL宿主菌E. coli DH5α感受态细胞,经过冰浴、热激活等步骤后均匀涂布于含有0.1%的氨苄青霉素(Amp)的LB固体培养基上,涂布至干后封口倒置于37℃恒温培养箱中培养12 h。在超净工作台中,用灭菌枪头挑取白色单克隆菌落于含有Amp(浓度为0.1%)的LB液体培养基中,37℃ 180 r/min。震荡培养8 h至菌液浑浊。取1 μL菌液作为模板进行PCR扩增反应及电泳检测鉴定后,最后挑选含目的基因片段的阳性单克隆菌液送至成都擎科梓熙生物技术有限公司进行测序。
1.2.4 制备标准品将PCR产物做胶回收作为制备标准品的模板,回收步骤按说明书进行,进行倍比稀释制作标准品,方法参照[11]。
1.2.5 绘制标准曲线依次从稀释5个梯度的标准品中各取2 μL作为cDNA模板进行qRT-PCR反应,反应体系25 μL:cDNA 2 μL,上、下游引物各1.5 μL,SYBR Green Supermix 12.5 μL,ddH2O 7.5 μL。反应程序如下:95℃预变性3 min,95℃变性10 s,退火30 s(温度见表 1),72℃延伸30 s,循环40次。
1.2.6 目的基因组织表达分析设置qRT-PCR温度梯度,以便确定最佳退火温度和优化实验方案,检测HIF-1α和HIF-2α mRNA分别在牦牛和黄牛的繁殖相关组织表达差异,反应体系25 μL:酶12.5 μL,ddH2O 7.5 μL,上、下游引物各1.5 μL,cDNA 2 μL,反应程序和1.2.5一致。每个样品作3个重复。荧光定量结果分析方法参照[12]。
1.2.7 数据分析数据用SPSS 22.0软件进行显著性分析,结果用“平均值±标准误(Mean±SE)表示,采用One-way ANOVA和-t-检验进行差异显著性分析。
2 结果 2.1 牦牛和黄牛不同组织总RNA提取提取的RNA经过1%琼脂糖凝胶电泳检测其完整性,在凝胶成像系统下观察,28S RNA和18S RNA条带清晰可见。说明提取的总RNA完整性强,无降解;分光光度计测得样品OD260/ OD280比值均在1.8-2.0之间,说明提取总RNA纯度高。这两者结果表明RNA均符合要求,可以用于后续实验。
2.2 常规PCR检测引物特异性取PCR产物10 μL加入上样孔,110 V电泳30 min,1%琼脂糖凝胶电泳结束后,在琼脂糖凝胶成像系统清晰观察到在胶上173 bp和140 bp处均为单一条带,说明引物的特异性好且与预期的片段长度相符。将测序结果与NCBI公布的序列进行比对,结果(图 1)表明,这6段序列与NCBI公布序列完全一致。可以用于实验后续工作。

|
| 图 1 HIF-1α、HIF-2α和GAPDH基因在黄牛和牦牛扩增产物 M:DNA Marker DL2000;1:黄牛HIF-1α;2:牦牛HIF-1α;3:黄牛HIF-2α;4:牦牛HIF-2α;5:黄牛GAPDH;6:牦牛GAPDH;7:阴性对照 |
以制备好的标准品作为模板,RT-qPCR自动生成HIF-1α、HIF-2α和GAPDH基因的标准曲线和熔解曲线。由标准曲线可知R2值(相关系数)均大于或等于0.998,计算扩增效率[12]分别为2.02、1.98和1.98,满足实验要求;优化RT-qPCR后,各基因溶解曲线形成单峰(图 2),表明符合RT-qPCR要求。可以用于实验后续工作。
|
| 图 2 HIF-1α、HIF-2α和GAPDH溶解曲线 图A:HIF-1α溶解曲线;图B:HIF-2α溶解曲线;图C:GAPDH溶解曲线 |
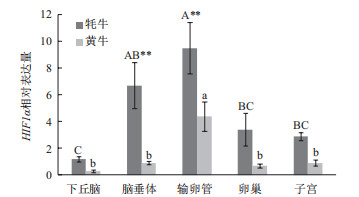
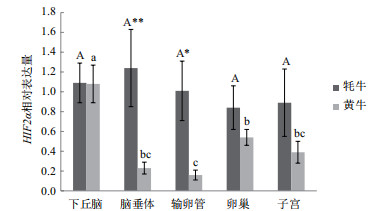
RT-qPCR检测结果表明HIF-1α mRNA、HIF-2α mRNA在牦牛生殖轴均有表达,但在各个组织中存在较大差异。HIF-1α mRNA在牦牛输卵管表达量最高,在下丘脑、脑垂体、卵巢和子宫相对表达量较低。HIF-1α mRNA在牦牛脑垂体、输卵管表达量均极显著高于黄牛(P < 0.01),而两物种在下丘脑、子宫和卵巢的表达差异均不显著(图 3)。HIF-2α mRNA在牦牛脑垂体表达量最高。HIF-2α mRNA在牦牛脑垂体表达量极显著高于黄牛(P < 0.01),在输卵管表达量显著高于黄牛(P < 0.05),而两物种在下丘脑、卵巢和子宫的表达差异均不显著(图 4)。
|
| 图 3 HIF-1α mRNA在黄牛和牦牛不同组织的表达量 A-C不同字母表示牦牛不同组织表达量差异显著(P<0.05);a、b表示黄牛不同组织表达量差异显著(P<0.05);**表示同一组织两物种间表达量差异极显著(P<0.01) |
|
| 图 4 HIF-2α mRNA在黄牛和牦牛组织表达谱 大写字母相同表示牦牛不同组织表达量差异不显著(P>0.05);a、b、c表示黄牛不同组织表达量差异显著(P<0.05);*表示同一组织两物种间表达量差异显著(P<0.05);**表示同一组织两物种间表达量差异极显著(P<0.01) |
HIF是诱导低氧基因和修复细胞氧内环境的核心调节因子,通过增强转录水平参与缺氧反应基因的调控,从而使机体对低氧刺激产生复杂反应。HIF-1α主要作为应激性低氧调控因子来调节细胞活动,HIF-2α主要负责细胞的长期性低氧适应[13]。HIF能够提高滋养细胞的耐氧能力,而滋养细胞利于侵袭子宫蜕膜[14]。HIF-1α与胎盘转录因子相关,胚胎在子宫内膜处于生理性缺氧状态时,HIF对于胚胎发育期间的造血前体细胞增殖和存活,低氧条件下对滋养细胞增殖及其在子宫着床有重要的调控作用[15]。然而,有研究表明在极度缺氧的状况下,HIF-1α等分子的作用不足以缓冲低氧的损害,使滋养细胞出现严重缺氧、微管骨架结构改变和侵袭能力明显下降,使侵袭子宫蜕膜层过浅,对滋养层细胞有明显的抑制作用[16]。在高海拔低氧条件下,高原绵羊黄体中HIF-1α和VEGF基因的表达量显著升高,增加黄体血管分布,提高黄体功能,从而提高对低氧条件的适应能力[17]。对牛的初始黄体和黄体颗粒细胞的研究证明,HIF通过PKA信号途径调节黄体细胞的增殖和固醇类激素的生成[18],以提高对高原低氧的适应能力。但有研究表明长时间生活在高海拔低氧的动的繁殖能力都降低[7, 17, 19]。雌性动物生殖活动受到下丘脑-垂体-卵巢轴(Hyp-othalamus-pituitary-ovaries,HPO)调控,输卵管是受精和早期卵裂的场所,而子宫是胚胎和胎儿发育的场所,因此,本研究采用RT-qPCR法检测了HIF-1α mRNA和HIF-2α mRNA在高海拔低氧环境条件下生存的牦牛与低海拔条件下生存的黄牛的HPO、输卵管和子宫组织的表达量差异,对揭示母牦牛生殖机能对高原低氧环境适应的分子调控机制具有重要意义。
本实验表明,HIF-1α mRNA在牦牛和黄牛下丘脑、脑垂体、输卵管、卵巢和子宫中都有表达说明该基因无组织表达特异性[20],同时HIF-2α mRNA在牦牛卵巢表达,但这与Xiong等[21]研究认为该基因在卵巢中无表达研究结果不一致,推测可能是实验方法不同引起结果不同,也说明两基因对调节动物繁殖机能有不可忽略的作用。HIF-1α mRNA在牦牛输卵管表达量最高,输卵管是哺乳动物受精和早期胚胎发育的场所,推测牦牛输卵管对低氧应激敏感性极高。下丘脑和脑垂体影响动物FSH(卵泡刺激素)和LH(促黄体素)的分泌,对动物生殖活动有重要的调节作用,有研究证明该基因在动物处于低氧状态下会诱导产生FSH,促进卵泡在低氧环境中成熟[22],本实验结果表明,HIF-1α mRNA在牦牛脑垂体表达量极显著高于黄牛(P < 0.01)且在牦牛下丘脑表达量最低,推测在牦牛处于低氧环境中,该基因可能引起牦牛较低的繁殖力。HIF-2α mRNA在牦牛脑垂体表达量极显著高于黄牛(P < 0.01),表明低氧环境可能通过刺激牦牛脑垂体分泌相关激素调节促红细胞生成素的合成和分泌,同时也会影响繁殖机能[23-25]。HIF-1α、HIF-2α mRNA在牦牛的表达量均高于黄牛,而HIF对促性腺激素释放激素、雌激素和促黄体素等生殖激素有促进作用[26],推测低氧诱导因子在牦牛处于低氧环境中对维持牦牛繁殖性能和调控牦牛繁殖相关激素有重要作用[26]。HIF-2α会参与促红细胞生成素的合成[23-25],而该生成素会影响输卵管中包括雌激素等多种激素的分泌[27],本实验中HIF-2α mRNA在输卵管表达量显著高于黄牛(P < 0.05),推测该基因会通过促红细胞生成素调控牦牛生殖激素的分泌,影响牦牛生殖活动,然而,动物长期的HIF高水平对其生殖能力有不良影响[4]。另外,HIF-1α、HIF-2α mRNA表达量均高于牦牛,说明HIF在缺氧的状态下会比非缺氧状态下更加活跃[28],而这种活跃程度是否会造成两物种的繁殖差异可做进一步研究。另外,本研究发现HIF-1α、HIF-2α mRNA在季节性发情的母牦牛与全年发情的黄牛在下丘脑、卵巢和子宫的表达差异均不显著,然而,本实验的牦牛样品均采自发情季节,因此,两基因在牦牛季节性乏情期与发情季节的表达量差异可做进一步研究。
4 结论长期处于低氧环境下的牦牛的脑垂体和输卵管中HIF-1α、HIF-2α mRNA表达量高于黄牛,这可能是牦牛生殖机能对高原低氧环境适应的重要调控机制。
| [1] |
Lando D, Peet DJ, Gorman JJ, et al. FIH-1 is an asparaginyl hydroxylase enzyme that regulates the transcriptional activity of hypoxia-inducible factor[J]. Genes Dev, 2002, 16(12): 1466-1471. DOI:10.1101/gad.991402 |
| [2] |
杨梦思, 周娜, 王志钢, 等. 转录因子HIF-1α及其信号通路在疾病发生中的作用研究进展[J]. 生物技术通报, 2016, 32(8): 8-13. |
| [3] |
刘晓淋, 杜凤娇, 雷钏, 等. 低氧分压通过低氧诱导因子(HIF)影响卵母细胞的体外成熟和早期胚胎的发育[J]. 中国畜牧兽医, 2015, 42(6): 1559-1565. |
| [4] |
陈香梅, 熊艳蕾, 龚辉, 等. 低氧下HIF-1α对小鼠性激素及睾丸生精细胞凋亡的影响[J]. 中国应用生理学杂志, 2013, 29(4): 371-375. |
| [5] |
Favier J, Kempf H, Corvol P, et al. Cloning and expression pattern of EPAS1 in the chicken embryo:Colocalization with Tyrosine Hydroxylase[J]. Febs Letters, 2018, 462(1-2): 19-24. |
| [6] |
Matsumoto L, Hirota Y, Saito-Fujita T, et al. HIF2α in the uterine stroma permits embryo invasion and luminal epithelium detachment[J]. Journal of Clinical Investigation, 2018, 128(7): 3186-3197. DOI:10.1172/JCI98931 |
| [7] |
魏莲, 王辰龙, 刘力华, 等. 低氧对不同海拔雄性高原鼠兔生殖机能若干指标的影响[J]. 青海大学学报:自然科学版, 2014, 32(3): 1-5. |
| [8] |
Lan D, Xiong X, Huang C, et al. Toward understanding the genetic basis of yak ovary reproduction:a characterization and comparative analyses of estrus ovary transcriptome in yak and cattle[J]. PLoS One, 2016, 11(4): e0152675. DOI:10.1371/journal.pone.0152675 |
| [9] |
Gerald W, Han JL, Long RJ. The yak[J]. RAP Publication:Thailand, 2003. |
| [10] |
Zhou GL, Jin HG, Zhu Q, et al. Genetic diversity analysis of five cattle breeds native to China using microsatellites[J]. Journal of Genetics, 2005, 84(1): 77-80. DOI:10.1007/BF02715894 |
| [11] |
王德朋, 李红阁, 郭松长, 等. 青海家牦牛HIF-1α基因组织特异性表达[J]. 安徽农业科学, 2007, 35(29): 9173-9175. |
| [12] |
Bionaz M, Loor JJ. Gene networks driving bovine milk fat synthesis during the lactation cycle[J]. BMC Genomics, 2008, 9(1): 366-10. 1186/1471-2164-9-366.. |
| [13] |
姜华鹏, 张驰, 王丛丛, 等. 软刺裸鲤和齐口裂鳆鱼HIF1B和HIF2A的克隆及低氧适应性的表达分析[J]. 淡水渔业, 2015, 45(5): 11-18. DOI:10.3969/j.issn.1000-6907.2015.05.002 |
| [14] |
周丽娟.缺氧对人滋养细胞中MAP4及微管的影响[C].中华高血压杂志社.中国转化医学和整合医学研讨会论文综合刊, 2015.
|
| [15] |
Matsubara K. Hypoxia in the pathogenesis of preeclampsia[J]. Hypertension Research in Pregnancy, 2017, 5(2): 46-51. DOI:10.14390/jsshp.HRP2017-014 |
| [16] |
Murray AJ. Oxygen delivery and fetal-placental growth:beyond a question of supply and demand[J]. Placenta, 2012, 33(2): 16-22. |
| [17] |
Bangham CR, Sacherer JM. Fertility of Nepalese Sherpas at moderate altitudes:comparison with high-altitude data[J]. Annals of Human Biology, 1980, 7(4): 323-330. DOI:10.1080/03014468000004391 |
| [18] |
Jiang YF, Tsui KH, Wang PH, et al. Hypoxia regulates cell proliferation and steroidogenesis through protein kinase A signaling in bovine corpus luteum[J]. Animal Reproduction Science, 2011, 129(3-4): 152-161. DOI:10.1016/j.anireprosci.2011.12.004 |
| [19] |
Parraguez VH, Atlagich MA, Behn C, et al. Fertility in ewes at high altitude:comparison between animals with long-and short-time residence at high altitude and the effect of antioxidant vitamins[J]. Reproduction in Domestic Animals, 2006, 41(4): 372-372. |
| [20] |
Zhao TB, Ning H X, Zhu SS, et al. Cloning of hypoxia-inducible factor 1α cDNA from a high hypoxia tolerant mammal-plateau pika(Ochotona curzoniae)[J]. Biochemical and Biophysical Research Communications, 2004, 316(2): 565-572. DOI:10.1016/j.bbrc.2004.02.087 |
| [21] |
Xiong X, Fu M, Lan D, et al. Yak response to high-altitude hypoxic stress by altering mRNA expression and DNA methylation of hypoxia-inducible factors[J]. Animal Biotechnology, 2015, 26(3): 222-229. DOI:10.1080/10495398.2014.1002563 |
| [22] |
Hunzicker-Dunn M, Maizels ET. FSH signaling pathways in immature granulosa cells that regulate target gene expression:branching out from protein kinase A[J]. Cellular Signalling, 2006, 18(9): 1351-1359. DOI:10.1016/j.cellsig.2006.02.011 |
| [23] |
Lee HG, Lee HC, Chung HJ, et al. Study on the reproductive function in transgenic pig Harboring Human Erythropoietin(HEPO)gene[J]. Reproductive & Developmental Biology, 2008, 32(2): 117-121. |
| [24] |
Ma Y, Freitag P, Zhou J, et al. Thyroid hormone induces erythropoietin gene expression through augmented accumulation of hypoxia-inducible factor-1[J]. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 2004, 287(3): R600-R607. DOI:10.1152/ajpregu.00115.2004 |
| [25] |
Agarwal A, Gupta S, Sekhon L, et al. Redox considerations in female reproductive function and assisted reproduction:from molecular mechanisms to health implications[J]. Antioxidants & Redox Signaling, 2008, 10(8): 1375-1404. |
| [26] |
Mirzaei Bavil F, Alipour MR, Keyhanmanesh R, et al. Ghrelin decreases angiogenesis, HIF-1α and VEGF protein levels in chronic hypoxia in lung tissue of male rats[J]. Advanced Pharmaceutical Bulletin, 2015, 5(3): 315-320. DOI:10.15171/apb.2015.044 |
| [27] |
Hüppi PS. The role of oxygen in health and disease-a series of reviews[J]. Pediatric Research, 2009, 65(3): 261-268. DOI:10.1203/PDR.0b013e31818fc83f |
| [28] |
Li Y, Padmanabha D, Gentile LB, et al. HIF-and non-HIF-regulated hypoxic responses require the estrogen-related receptor in Drosophila melanogaster[J]. PLoS Genetics, 2013, 9. |





