2. 水产增养殖安徽省重点实验室,合肥 230031
2. Key Laboratory of Aquaculture & Stock Enhancement for Anhui Province, Hefei 230031
中华鳖生长性状受肌肉发育等诸多遗传和环境因素的影响。生长性状的遗传力低,传统杂交改良周期长,寻找控制中华鳖生长性状的主效基因及其遗传标记,使用标记辅助选择加快选育进程,这对提高中华鳖生长性状具有重要意义。研究发现,MSTN基因对中华鳖肌肉生长具有调控作用[1],随着高通量测序技术的发展,新的生长性状候选基因不断被挖掘,如GRBP2基因和THSP基因[2]。同时,仍然有较多报道从基因功能来推测基因可能影响生长性状,通过扩增多态位点进行关联分析来证明SNP与生长性状的关系,如IGF2基因[3]和GHRL基因[4]。这些研究使得生长性状可利用的标记不断增加。
MyoD1(Myogenic differentiation 1)是生肌调节因子家族(MRFs)的重要成员,在肌形成早期阶段参与决定肌形成的发生[5-6]。该基因与肌肉基因启动子的特异性区域(E-BOX)相结合后激活肌肉特异性转录,促进肌前体细胞的增殖和分化,可使成纤维细胞及脂肪细胞等转化为成肌细胞,并最终分化为成熟肌纤维[7]。目前,在金头鲷(Sparus aurata)[8]、鳕(Gadus macrocephalus)[9]、文昌鱼(Branchiostoma belcheri)[10]、黄颡鱼(Pelteobagrus fulvidraco)[11]、鳜鱼(Siniperca chuatsi)[12]和长丝裂腹鱼(Schizothorax dolichonema)[13]等水产动物已完成MyoD基因的克隆、序列分析和表达等研究。鉴于MyoD1基因是影响动物生长性状的重要候选基因,且中华鳖MyoD1基因多态性与生长性状的相关研究尚未见报道,本研究通过直接测序法检测MyoD1基因多态位点,以期获得与中华鳖生长相关的SNP,为中华鳖分子标记辅助选育奠定工作基础。
1 材料与方法 1.1 材料本实验中华鳖取自安徽省农业科学院水产研究所稻田养鳖基地,随机选择同批繁殖、同块稻田养殖的2冬龄健康中华鳖共178只(其中雄性135只,雌性43只)。测量样本体质量、背甲长、背甲宽、腹甲长、腹甲宽、裙边后侧宽和体高7项生长指标。同时剪取200 mg左右的裙边组织,按照天根生化科技(北京)有限公司试剂盒说明书提取中华鳖组织DNA,使用琼脂糖和紫外分光光度计测定DNA质量和浓度,-20℃保存。2×Taq PCR master mix和DNA分子量标准购自宝生物(大连)工程有限公司;引物委托生工生物工程(上海)股份有限公司合成;琼脂糖为Sigma公司(美国)产品。
1.2 方法 1.2.1 MyoD1基因的扩增及突变位点基因分型根据NCBI数据库中登录的中华鳖MyoD1基因序列(GenBank登录号:NW_005858157.1)设计4对引物(表 1),以中华鳖基因组DNA为模板,采用PCR技术分别扩增MyoD1基因的各个片段。PCR扩增反应总体积为20.0 μL,PCR反应体系包括10.0 μL 2×Taq PCR master mix、上下游引物(20 μmol/L)各0.5 μL、模板DNA 0.5 μL,加dd H2O至20.0 μL。PCR反应程序:94℃预变性10 min;94℃变性30 s,55℃退火30 s,72℃延伸30 s,共进行35个循环;72℃延伸10 min,4℃保存。将PCR产物进行1.2%琼脂糖凝胶电泳检测。PCR产物纯化后送至生工生物工程有限公司测序。测序结果用BioEdit软件进行序列比对分析,获得SNP位点。
利用Haploview软件进行SNP位点间连锁分析。
1.2.3 数据统计分析利用Picalc程序包计算各位点的多态信息含量(PIC),利用Popgene 32软件计算观测杂合度(Ho)、期望杂合度(He)、有效等位基因数(Ne)和哈温平衡常数。采用SPSS 20软件的GLM程序对MyoD1基因SNP与生长性状的进行关联分析,因变量为中华鳖7项生长指标,自变量为筛选到的突变位点不同基因型。其生物统计模型为:Yij=μ+Gi+Sj+eij,式中,Yij表示某性状第i个标记在第j个个体上的观测值,μ表示试验观测的所有个体平均值,Gi表示第i个标记的基因型效应,Sj表示第i个标记的性别效应,eij表示对应个体观测值的随机残差效应。
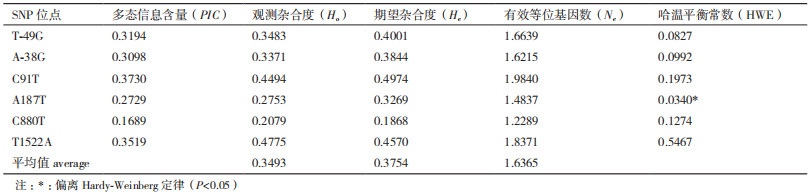
2 结果 2.1 MyoD1基因突变位点筛选通过序列比对,MyoD1基因有6个碱基位置发生突变,其中2个突变发生在启动子区域(T-49G和A-38G),2个突变发生在内含子1(C91T和A187T),1个位点突变发生在外显子2(C880T),还有1个突变发生在外显子2下游区域(T1522A)。其中,C880T位点为错义突变,导致所编码的氨基酸由丙氨酸(A)突变为缬氨酸(V),核酸位置以所参考序列的第一个碱基为参考值1。等位基因频率和基因型频率,见表 2。
对178只中华鳖MyoD1基因的6个SNP位点进行分型,统计其遗传参数(表 2)。结果表明,多态信息含量(PIC)为0.168 9-0.373 0,期望杂合度(He)为0.186 8-0.497 4,有效等位基因数(Ne)为1.228 9-1.984 0,PIC和He多数处于0.25-0.50之间(除C880T位点),说明多数SNP位点具有中度多态性。经卡方适合性检验,MyoD1基因除A187T位点外,其余5个位点在中华鳖群体中均处于Hardy-Weinberg平衡状态(P > 0.05)。
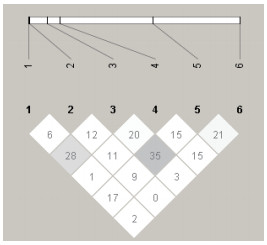
利用Haploview软件对中华鳖群体的MyoD1基因的6个SNP位点进行连锁分析,并且构建连锁图谱,结果如图 1可以看出,6个SNPs之间r2均没有大于或等于0.8,说明中华鳖群体连锁不紧密,没有形成连锁区块,故按照单标记分析进行突变位点与生长性状的关联分析。
|
| 图 1 中华鳖MyoD1基因6个多态位点连锁不平衡分析 图中数字为r2值,单位(%);Site 1= T-49G,Site 2= A-38G,Site 3= C91T,Site 4= A187T,Site 5= C880T,Site 6= T1522A |
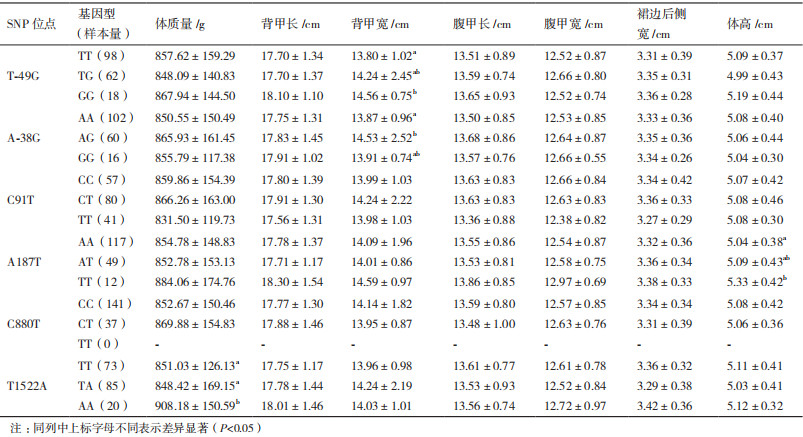
采用一般线性模型分析中华鳖MyoD1基因6个多态位点不同基因型与生长性状的相关性(表 4)。T-49G位点不同基因型个体间的背甲宽存在显著差异(P < 0.05),突变型(GG)显著大于野生型(TT),为优势基因型;A-38G位点不同基因型个体间的背甲宽存在显著差异(P < 0.05),突变型(AG)显著大于野生型(AA),为优势基因型;A187T位点不同基因型个体间的体高存在显著差异(P < 0.05),突变型(TT)显著大于野生型(AA),为优势基因型;T1522A位点不同基因型个体间的体质量存在显著差异(P < 0.05),突变型(AA)显著大于野生型(TT)和杂合型(TA),为优势基因型。
基因组中的SNPs多数位于非编码区域,因受到选择压力较小容易积累变异,而外显子变异率仅为周围序列的1/5[14-16]。本研究中,MyoD1基因在中华鳖群体中共检测到6个SNP位点,其中T-49G和A-38G位点位于基因启动子区域,C91T和A187T位点位于基因内含子1,C880T位于基因外显子2,T1522A位于基因外显子2下游区域。虽然基因非编码区的突变位点不参与氨基酸编码,但会改变基因表达效率进而影响机体的生命活动[17-19]。C880T位点仅存在CC和CT基因型,可能是实验群体经多代选育,人工选择使部分等位基因频率发生改变,需扩大样本群体做进一步研究。
生肌调节因子家族由MyoD、Myf5、MyoG和MrF4 4个成员组成,在肌肉生成、肌原纤维蛋白合成及肌纤维数量调节等方面起到重要作用,其中,MyoD基因在骨骼肌发育过程起关键的正向调控作用,促进骨骼肌的形成和分化[20-21]。研究表明,MyoD基因突变体会引起斑马鱼胚胎期体节肌肉减少[22]。MyoD基因多态性与生长性能的关联研究在水产动物中报道不多。于凌云等[23]在获取大口黑鲈MyoD基因序列后筛选出7个与生长性状相关联的突变位点;陈松波等[24]在牙鲆MyoD基因内含子1上发现2个SNP对体重、体长和体高等生长性状影响显著;Chen等[25]分析了MyoD1a基因和MyoD1b基因在虹鳟群体的多态性,发现多个突变位点对肉质性状有显著影响;陈静等[26]在草鱼MyoD基因内含子1上发现SNP在体质量、体宽、体高和眼间距等生长性状存在显著差异。
在本研究中MyoD1基因多态性位点与中华鳖生长性状的相关分析结果表明,基因启动子区域T-49G位点的不同基因型在背甲宽存在显著差异(P < 0.05),GG基因型显著大于TT基因型;基因启动子区域A-38G位点的不同基因型在背甲宽存在显著差异(P < 0.05),AG基因型显著大于AA基因型;内含子1 A187T位点的不同基因型在体高存在显著差异(P < 0.05),TT基因型均显著大于AA基因型,体重、背甲长、背甲宽、腹甲长、腹甲宽、裙边后侧宽虽无显著差异,但TT基因型也均大于AA和AT基因型。外显子2下游区域T1522 A位点的不同基因型在体质量存在显著差异(P < 0.05),AA基因型显著大于TT和TA基因型。因此,MyoD1基因可作为研究中华鳖生长性状的候选基因,下一步工作要增加关联的样本数,着重分析T-49G、A-38G、A187T和T1522A位点的影响效用,进一步筛选出中华鳖分子标记辅助选育的有效标记。
4 结论本研究在中华鳖MyoD1基因上鉴定出6个SNP位点(T-49G、A-38G、C91T、A187T、C880T和T1522A),其中C880T位于外显子上,属于错义突变。除A187T位点外,其余5个位点的基因型频率分布均符合Hardy-Weinberg定律。分析各位点与中华鳖生长性状之间的相关性发现,T-49G位点GG基因型个体的背甲宽显著大于TT基因型,A-38G位点AG基因型个体的背甲宽显著大于AA基因型,A187T位点TT基因型个体的体高显著大于AA基因型,T1522A位点AA基因型个体的体质量显著大于TT、TA基因型,其余位点不同基因型个体间的生长性状均不存在显著差异。
| [1] |
张群英.基于转录组测序的中华鳖微卫星标记的开发及MSTN基因的克隆表达[D].苏州: 苏州大学, 2014.
|
| [2] |
Zhang H, Xu X, He Z, et al. De novo transcriptome analysis reveals insights into different mechanisms of growth and immunity in a Chinese soft-shelled turtle hybrid and the parental varieties[J]. Gene, 2016, 605: 54-62. |
| [3] |
彭娜, 曾丹, 王晓清, 等. 中华鳖IGF2基因SNP标记与生长性状的关联分析[J]. 湖南农业大学学报:自然科学版, 2018, 44(1): 88-94. |
| [4] |
李纯, 陈辰, 赵建, 等. 中华鳖GHRL基因SNPs的筛选及生长性状的关联分析[J]. 水生生物学报, 2018, 42(2): 307-312. |
| [5] |
Buckingham M. Making muscle in mammals[J]. Trends in Genetics, 1992, 8(4): 144-149. DOI:10.1016/0168-9525(92)90373-C |
| [6] |
Ferri P, Barbieri E, Burattini S, et al. Expression and subcellular localization of myogenic regulatory factors during the differentiation of skeletal muscle C2C12 myoblasts[J]. Journal of Cellular Biochemistry, 2009, 108(6): 1302-1317. DOI:10.1002/jcb.v108:6 |
| [7] |
Weintraub H. The MyoD family and myogenesis:redundancy, networks, and thresholds[J]. Cell, 1993, 75(7): 1241-1244. DOI:10.1016/0092-8674(93)90610-3 |
| [8] |
Tan X, Du SJ. Differential expression of two MyoD genes in fast and slow muscles of gilthead seabream(Sparusaurata)[J]. Development Genes & Evolution, 2002, 212(5): 207-217. |
| [9] |
Hall TE, Cole NJ, Johnston IA. Temperature and the expression of seven muscle-specific protein genes during embryogenesis in the Atlantic cod Gadus morhua L[J]. Journal of Experimental Biology, 2003, 206(18): 3187. DOI:10.1242/jeb.00535 |
| [10] |
Urano A, Suzuki MM, Zhang P, et al. Expression of muscle-related genes and two MyoD genes during amphioxus notochord development[J]. Evolution and Development, 2010, 5(5): 447-458. |
| [11] |
梁宏伟, 李忠, 邹桂伟, 等. 黄颡鱼MyoD基因的克隆及其表达[J]. 武汉大学学报:理学版, 2012, 58(4): 347-353. |
| [12] |
李玉珑, 农小献, 李虹辉, 等. 鳜鱼生肌调节因子MyoD的克隆及其发育表达分析[J]. 湖南师范大学自然科学学报, 2013, 36(4): 63-68. |
| [13] |
晁珊珊, 张倡珲, 海蕾, 等. 长丝裂腹鱼MyoD1基因的克隆及序列分析[J]. 安徽农业科学, 2013, 41(11): 4750-4752. DOI:10.3969/j.issn.0517-6611.2013.11.018 |
| [14] |
Zhao Z, Fu YX, Hewett-Emmett D, et al. Investigating single nucleotide polymorphism(SNP)density in the human genome and its implications for molecular evolution[J]. Gene, 2003, 312: 207-213. DOI:10.1016/S0378-1119(03)00670-X |
| [15] |
樊佳佳, 刘小献, 白俊杰, 等. 草鱼柠檬酸合酶基因SNP筛选及与生长性状的关联分析[J]. 华中农业大学学报, 2014, 33(3): 84-89. DOI:10.3969/j.issn.1000-2421.2014.03.015 |
| [16] |
Nie Q, Lei M, Ouyang J, et al. Identification and characterization of single nucleotide polymorphisms in 12 chicken growth-correlated genes by denaturing high performance liquid chromatography[J]. Genetics Selection Evolution, 2005, 37(3): 339-360. DOI:10.1186/1297-9686-37-4-339 |
| [17] |
Yang ZH, Zhou CL, Zhu H, et al. A functional SNP in the MDM2 promoter mediates E2F1 affinity to modulate cyclin D1 expression in tumor cell proliferation[J]. Asian Pacific Journal of Cancer Prevention, 2014, 15(8): 3817-3823. DOI:10.7314/APJCP.2014.15.8.3817 |
| [18] |
Wang L, Li K, Xu Q, et al. Potential synergy between SNP and CpG-A or IL-1β in regulating transcriptional activity of IL-20 promoter[J]. Journal of Investigative Dermatology, 2014, 134(2): 389-395. DOI:10.1038/jid.2013.314 |
| [19] |
李胜杰, 姜鹏, 樊佳佳, 等. 大口黑鲈肌球蛋白重链基因SNPs的筛选及与生长性状的关联[J]. 水产学报, 2018, 42(3): 305-313. |
| [20] |
项露颉, 姜怀志, 马龙, 等. MyoD基因在不同品种肉羊肌肉中表达比较[J]. 中国兽医学报, 2018, 38(1): 210-216. |
| [21] |
Zhou D, Xu HQ, Chen W, et al. Study on the transcriptional regulatory mechanism of the MyoD1 gene in Guanling bovine[J]. Rsc Advances, 2018, 8(22): 12409-12419. DOI:10.1039/C7RA11795G |
| [22] |
Hinits Y, Williams VC, Sweetman D, et al. Defective cranial skeletal development, larval lethality and haplo in sufficiency in Myod mutant zebrafish[J]. Developmental Biology, 2011, 358(1): 102-112. |
| [23] |
于凌云, 白俊杰, 叶星, 等. 大口黑鲈MyoD基因结构和单核苷酸多态性位点的筛选[J]. 水产学报, 2009, 33(1): 1-8. |
| [24] |
陈松波, 龚丽, 范兆廷, 等. 牙鲆MyoD基因单核苷酸多态性位点的筛选[J]. 水生生物学报, 2013, 37(5): 863-868. |
| [25] |
Chen WX, Ma Y, Liu KH. Association of MyoD1a and MyoD1b gene polymorphisms and meat quality traits in rainbow trout[J]. Genetics and Molecular Research, 2015, 14(3): 9034-9044. DOI:10.4238/2015.August.7.12 |
| [26] |
陈静, 何吉祥, 樊佳佳, 等. 草鱼MyoD基因SNP和Indel标记的筛选及其与生长性状的关联分析[J]. 江苏农业学报, 2018, 34(3): 635-639. |