2. 河南科技学院动物科技学院,新乡 453003
2. College of Animal Science and Veterinary Medicine, Henan Institute of Science and Technology, Xinxiang 453003
尾静脉液压转基因技术(Hydrodynamics-based transgene,HDT),又称尾静脉大容量快速基因注射法(Hight capacity and quick injection,HQI),其原理是短时间内大量溶液从尾静脉运输到动脉时,导致大量溶液在下腔静脉聚积,产生很高的静脉压使肝门静脉打开,大量血液流入肝门静脉,致使肝窦孔径增大,肝细胞产生穿孔,膜透性增加,外源大分子进入肝细胞,以此达到基因瞬时转染的目的[1]。液压转基因技术具有操作简单、靶向性强、安全性好、转染率高、对转基因动物的生理功能无影响等优点。液压转基因技术已是一项成熟的技术,基于液压转基因的优点,此项技术已被广泛应用。例如,Hubner等[2]利用液压转基因技术对小鼠肝细胞进行遗传体内修饰的组成型和诱导型系统研究。Yamazaki等[3]基于液压转基因技术对小鼠尾静脉注射编码中和mAbs(Monoclonal antibodies)的质粒,其对致死性流感病毒感染具有治疗作用。然而该技术只能达到基因的瞬时转染,因此探索保持外源基因持续稳定表达的方法有着重要的意义。
乙二醇(Ethylene glycol,EG)是最简单的二醇,与甘氨酸分子构型相似,能调节甘氨酸核糖开关的终止子稳定性和适配子从属性,影响基因的转录[4];液态乙二醇还能维持纳米粒子表面荧光强烈和稳定的发射[5];乙二醇的高聚物聚乙二醇(Polyethylene glycol,PEG)是一种相转移催化剂,可以用于纯化质粒,也用于细胞融合;聚乙二醇通过质粒表面的聚乙二醇化和内部疏水作用增强了质粒DNA超螺旋结构稳定[6]。乙二醇也是一种有毒化合物,摄入后引起啮齿动物肝重增加、肝脂肪变性、透明气球样变和肝中心小叶退行性变。但目前对于在液压转基因中乙二醇对肝脏的作用和外源基因表达的影响尚未有研究,因此本研究用乙二醇和外源质粒pEGFP-C1共同进行尾静脉液压转基因后,检测肝脏损伤情况和绿色荧光蛋白表达率,探索液压转基因中乙二醇对小鼠肝脏外源基因表达的影响。
1 材料与方法 1.1 材料健康雄性小鼠,体重约23±2 g,由河南师范大学实验动物中心提供;表达质粒pEGFP-C1(购自美国BD Biosciences Clontech公司,绿色荧光蛋白的启动子来自巨细胞病毒,Cytomegalovirus,CMV);乙二醇(分子量62.07,河南焦作市化工三厂);冰冻切片机(德国,Leica,CM1850);荧光显微镜(日本,Nikon,ECLIPSE 80i)。
1.2 方法 1.2.1 质粒制备将购买的表达质粒pEGFP-C1转化大肠杆菌DH5α感受态细胞,涂布LB固体培养基平板(含100 μg/mL氨苄青霉素),37℃温箱中倒置培养过夜,挑选出含质粒pEGFP-C1的阳性菌株。将含质粒pEGFP-C1的阳性菌株接种到10 mL含100 μg/mL氨苄青霉素的LB培养液中,37℃震荡培养过夜。取少量上述菌液(约1-2 mL)接种到200 mL LB培养液中,37℃震荡培养过夜。低温离心收集菌体,NaOH-SDS碱裂解法裂解菌体,用酚/氯仿/异戊醇进行抽提,PEG-NaCl沉淀法纯化质粒,纯化的质粒用生理盐水溶解。核酸蛋白含量测定仪测定质粒浓度与纯度,260 nm/280 nm吸光值比值在1.8-2.0之间,且琼脂糖凝胶电泳检测无基因组DNA和RNA时合格备用。
1.2.2 小鼠肝脏液压转基因乙醚麻醉小鼠后,酒精棉球擦拭小鼠尾部,将无菌注射器针头在小鼠尾1/3处刺入静脉,快速均匀的将pEGFP-C1质粒溶液注入尾静脉,注射完后,用脱脂棉按住针眼处止血,最后在针眼处涂抹红霉素软膏以防止感染。
1.2.3 小鼠肝脏形态结构观察和绿色荧光蛋白基因表达情况检测小鼠尾静脉液压转基因后24 h、48 h和72 h时颈椎脱臼处死小鼠,取出肝叶液氮速冻10-15 s后,冰冻切片机内平衡30 min,制备7 μm冷冻切片。(1)将冷冻切片进行苏木素染色3-5 min,细水冲洗后酒精盐酸分色,自来水返蓝10-15 min,甘油封片,观察小鼠肝脏损伤;(2)在波长488 nm的荧光显微镜下观察绿色荧光蛋白(Green fluorescent protein,GFP)表达量,并随机选取3个不重叠的视野(10×)拍照,分别统计绿色荧光蛋白阳性细胞和DAPI复染的细胞核数目,计算阳性细胞占总细胞数的比率,计算转染率。
2 结果 2.1 液压转基因的条件依据本实验室之前所建立的小鼠液压转基因条件[7]:注射速度0.8 mL/s,质粒溶液注射量为小鼠体重的10%,质粒浓度30 μg /mL将质粒溶液均速注射到小鼠尾静脉中。
2.2 液压转基因后绿色荧光蛋白在小鼠肝内表达变化按照结果2.1液压转基因的条件进行小鼠尾静脉注射pEGFP-C1质粒,分别在尾静脉注射后6 h、24 h、48 h、72 h取小鼠肝右叶观察质粒转染情况,并计数绿色荧光蛋白阳性细胞比率。结果(图 1)表明,转基因后,小鼠肝脏发白膨胀,肝索紊乱,细胞间隙变大,并发现血管壁破裂现象,但随着恢复时间增加,症状减弱基本恢复正常。在转基因后6 h绿色荧光蛋白阳性细胞占2.22%,24 h阳性细胞比率最高为14.00%,48 h为3.11%,72 h为1.33%。
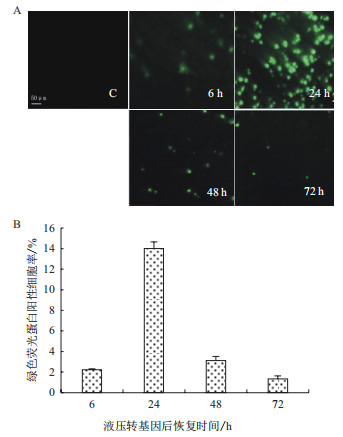
|
| 图 1 小鼠尾静脉液压转基因后绿色荧光蛋白基因在肝内的表达变化 A:荧光显微镜下观察小鼠尾静脉液压转基因后不同时间绿色荧光蛋白基因在肝内的表达;C:对照组(control);标尺:50 μm;B:小鼠尾静脉液压转基因后恢复期间绿色荧光蛋白阳性细胞比率 |
分别配制含0.05 mol/L、0.1 mol/L、0.25 mol/L和0.5 mol/L乙二醇的pEGFP-C1(30 μg/mL)质粒溶液,按照结果2.1液压转基因条件进行小鼠尾静脉注射,在尾静脉注射后24 h取小鼠肝脏右叶观察转染率和肝脏损伤情况,结果(图 2)表明,随着乙二醇浓度增加,肝脏损伤程度较重,出现大小不一,数量不等的空泡结构。统计绿色荧光蛋白阳性细胞率表明(图 3),乙二醇浓度为0.05 mol/L时占7.43%,0.1 mol/L时占3.96%,0.25 mol/L占3.72%,0.5 mol/L占1.93%。
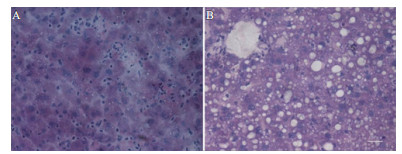
|
| 图 2 乙二醇作用下液压转基因后24 h时小鼠肝脏组织结 A:乙二醇浓度为0.05 mol/L;B:乙二醇浓度为0.5 mol/L。标尺:100 μm |
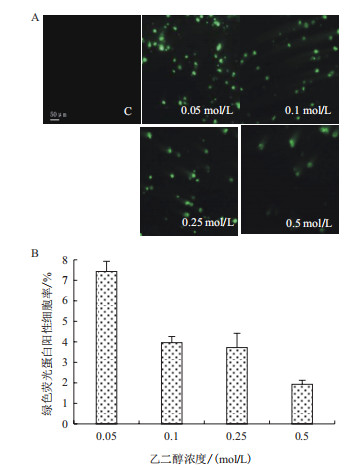
|
| 图 3 乙二醇-液压转基因24 h后绿色荧光蛋白基因在小鼠肝脏内的表达变化 A:荧光显微镜下观察乙二醇-液压转基因后24 h绿色荧光蛋白基因在小鼠肝脏内的表达变化;C:对照组(control);标尺:50 μm;B:乙二醇-液压转基因24 h后绿色荧光蛋白阳性细胞比率 |
液压转基因后72 h取小鼠肝脏右叶观察转染率和肝脏损伤情况,结果(图 4)表明,小鼠肝脏损伤程度减弱,逐渐恢复,空泡结构减少,但细胞间隙仍比较大。统计绿色荧光蛋白阳性细胞率(图 5)表明,乙二醇浓度为0.05 mol/L时占3.78%,0.1 mol/L时占9.67%,0.25 mol/L占10.11%,0.5 mol/L占15.96%。
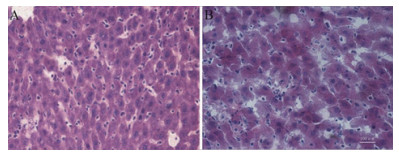
|
| 图 4 乙二醇作用下液压转基因后72 h小鼠肝脏组织结构 A:乙二醇浓度为0.05 mol/L;B:乙二醇浓度为0.5 mol/L。标尺:100 μm |

|
| 图 5 乙二醇-液压转基因后72 h绿色荧光蛋白基因在小鼠肝脏内的表达变化 A:荧光显微镜下观察乙二醇-液压转基因后72 h绿色荧光蛋白基因在小鼠肝脏内的表达变化;C:对照组(control);标尺:50 μm;B:乙二醇-液压转基因后72 h绿色荧光蛋白阳性细胞比率 |
尾静脉液压转基因技术(Hydrodynamics-based transgene,HDT)是一种有效地成体体内转基因方法,用于多种基因功能分析[8]、甘露聚糖结合凝集素介导的基因转移、RNA干扰研究[9]、基因治疗[10]等研究。本实验室过去对大鼠肝脏进行液压转基因研究表明,将大鼠体重9%的质粒溶液(质粒浓度为30 μg/mL),以2 mL/s的速度进行大鼠尾静脉注射,转基因后约6 h绿色荧光蛋白达到较高表达率[11]。在此基础上,我们以小鼠为实验材料进行液压转基因研究,将小鼠体重10%的质粒溶液(质粒浓度30 μg/mL),以0.8 mL/s的速度进行小鼠尾静脉注射,转基因后约24 h绿色荧光蛋白达到较高表达率。
乙二醇是一种无色透明,挥发性低,无臭有甜味的黏稠液体,易溶于水等极性溶剂,是合成纤维、制造树脂的主要原材料,并能用于多种化工生产。乙二醇具有一定的毒性[12],属低毒性化学物,但其代谢产物毒性较高。朱士胜等[13]研究发现SD大鼠急性乙二醇中毒后肝脏细胞发生坏死。乙二醇的聚合物聚乙二醇能够修饰一些药物进而改善药性,例如郑丽丽等[14]对聚乙二醇修饰甲硫氨酸脑啡肽静脉注射时对热板致痛小鼠的镇痛作用研究发现聚乙二醇能够修饰甲硫氨酸脑啡肽,然后静脉注射到小鼠体内时发现适当相对分子质量聚乙二醇修饰甲硫氨酸脑啡肽可提高镇痛强度和药效维持时间,对改善其成药性具有积极意义。少量的摄入乙二醇后,能迅速分布于血液和组织液中,随着血液循环输送到不同组织器官,在肝脏乙醇脱氢酶(Alcohol dehydrogenase,ADH)或其他肝酶催化下代谢生成羟乙醛、乙醇酸(Glycolic acid,GA)和乙醛酸[15]。随后,乙醛酸转化为草酸,草酸与钙形成草酸钙晶体,在肾脏和其他组织内沉淀,会对动物内脏器官有一定的损伤[16]。这并不能否认乙二醇具有一定的生物学作用。
本实验按照上述小鼠液压转基因条件进行乙二醇与质粒同时尾静脉注射,发现乙二醇浓度在0.05 mol/L-0.5 mol/L范围内,转基因后24 h时随着乙二醇浓度升高,绿色荧光蛋白阳性细胞率呈降低趋势;72 h时阳性细胞率随着乙二醇浓度升高而升高,且在72 h乙二醇浓度为0.5 mol/L时阳性细胞率较高。这一现象可能有两个原因,一是随着乙二醇浓度升高,小鼠肝脏损伤程度增大,24 h时肝脏损伤尚未恢复,致使绿色荧光蛋白基因在肝细胞中的表达量越低;而且随着恢复时间推移,肝脏逐渐恢复正常,进入肝细胞的质粒恢复正常表达;乙二醇浓度为0.5 mol/L时转基因后72 h阳性细胞率较高,可能是因为乙二醇浓度较高,对肝细胞毒性较大,增大了肝细胞的膜透性,液压转基因时进入肝细胞的质粒较多。二是乙二醇可能提高质粒超螺旋结构的稳定性。在乙二醇存在时,pEGFP-C1质粒不能解超螺旋转录表达,因此24 h时绿色荧光蛋白表达量较低,随着肝脏恢复,乙二醇被消耗,pEGFP-C1质粒恢复转录表达。
4 结论本研究利用液压转基因技术将含有乙二醇的pEGFP-C1质粒注射小鼠尾静脉中,检测对肝脏外源基因表达的影响。结果表明,乙二醇在液压转基因中能调节外源基因的表达,使外源基因表达高峰向后推移,但具体作用机制还不甚清楚。该研究为研究乙二醇对肝再生的影响及探索乙二醇的其他生物学作用奠定了基础。
| [1] |
Liu F, Song Y, Liu D. Hydrodynamics-based transfection in animals by systemic administration of plasmid DNA[J]. Gene Therapy, 1999, 6(7): 1258-1266. DOI:10.1038/sj.gt.3300947 |
| [2] |
Hubner EK, Lechler C, Rosner TN, et al. Constitutive and inducible systems for genetic in vivo modification of mouse hepatocytes using hydrodynamic tail vein injection[J]. Journal of Visualized Experiments Jov, 2018(132): e56613. |
| [3] |
Yamazaki T, Nagashima M, Ninomiya D, et al. Neutralizing antibodies induced by gene-based hydrodynamic injection have a therapeutic effect in lethal influenza infection[J]. Frontiers in Immunology, 2018, 9: 47. DOI:10.3389/fimmu.2018.00047 |
| [4] |
Hamachi K, Hayashi H, Shimamura M, et al. Glycols modulate terminator stem stability and ligand-dependency of a glycine riboswitch[J]. Biosystems, 2013, 113(2): 59-65. DOI:10.1016/j.biosystems.2013.05.004 |
| [5] |
Flessau S, Wolter C, Poselt E, et al. Fluorescence spectroscopy of individual semiconductor nanoparticles in different ethylene glycols[J]. Phys Chem Chem Phys, 2014, 16(22): 10444-10455. DOI:10.1039/C4CP00443D |
| [6] |
Adolph EJ, Nelson CE, Werfel TA, et al. Enhanced performance of plasmid DNA polyplexes stabilized by a combination of core hydrophobicity and surface PEGylation[J]. J Mater Chem B, 2014, 2(46): 8154-8164. DOI:10.1039/C4TB00352G |
| [7] |
郭学强.急性肝功能衰竭相关基因和蛋白的研究[D].新乡: 河南师范大学, 2016.
|
| [8] |
Hibbitt OC, Harbottle RP, Waddington S N, et al. Delivery and long-term expression of a 135 kb LDLR genomic DNA locus in vivo by hydrodynamic tail vein injection[J]. J Gene Med, 2007, 9(6): 488-497. DOI:10.1002/(ISSN)1521-2254 |
| [9] |
Wesche-Soldato DE, Lomas-Neira J, Perl M, et al. Hydrodynamic delivery of siRNA in a mouse model of sepsis[J]. Methods Mol Biol, 2008, 442: 67-73. DOI:10.1007/978-1-59745-191-8 |
| [10] |
Kamimura K, Yokoo T, Abe H, et al. Image-guided hydrodynamic gene delivery:current status and future directions[J]. Pharmaceutics, 2015, 7(3): 213-223. DOI:10.3390/pharmaceutics7030213 |
| [11] |
徐存栓, 邢雪琨, 谢来峰, 等. 液压转基因技术应用于大鼠肝脏转基因实验[J]. 解剖学报, 2009, 40(1): 103-107. DOI:10.3969/j.issn.0529-1356.2009.01.021 |
| [12] |
孙树森, 赵志刚. 临床药师与药物中毒:甲醇、乙二醇和异丙醇[J]. 药品评价, 2017, 14(2): 14-20. DOI:10.3969/j.issn.1672-2809.2017.02.002 |
| [13] |
朱士胜, 黄伟, 赵鹏, 等. SD大鼠急性乙二醇中毒的法医病理学研究[J]. 重庆医科大学学报, 2014, 38(1): 43-46. |
| [14] |
郑丽丽, 王冲, 文曙, 等. 聚乙二醇修饰甲硫氨酸脑啡肽静脉注射时对热板致痛小鼠的镇痛作用[J]. 中华临床医师杂志(OL/J), 2013, 7(7): 3040-3042. |
| [15] |
Lovric M, Granic P, Cubrilo-Turek M, et al. Ethylene glycol poisoning[J]. Forensic Science International, 2007, 170(2-3): 213-215. DOI:10.1016/j.forsciint.2007.03.025 |
| [16] |
胡芳芳, 何钉铃, 宁章勇, 等. 低剂量乙二醇对犬器官的损伤[J]. 中国兽医学报, 2015, 35(12): 2027-2031. |




