2. 牡丹江师范学院生命科学与技术学院,牡丹江 157011
2. Mudanjiang Normal University, Mudanjiang 157011
苏云金芽胞杆菌(Bacillus thuringiensis,简称Bt)是革兰氏阳性菌,其在生长代谢过程中可以产生分泌到胞外的营养期杀虫蛋白(Vegetative insecticidal proteins,简称VIPs)[1]和分泌型杀虫蛋白(Secreted insecticidal protein,简称SIPs)[2],母细胞在释放芽胞时也可以产生杀虫晶体蛋白(Insecticidal crystal proteins,简称ICPs)。杀虫晶体蛋白主要分为Cry和Cyt两类,围绕Bt Cry杀虫晶体蛋白的研究非常广泛,包括含有新cry基因菌株的发掘、cry基因的转录调控机制、Cry蛋白的结构与功能及Cry蛋白在田间应用的问题等[3]。随着Cry蛋白在微生物工程菌和转基因抗虫植物中的广泛应用,导致一些昆虫对Cry蛋白产生耐药性及抗性[4-5]。
营养期杀虫蛋白在氨基酸序列的进化上与Cry蛋白没有同源性,且杀虫位点与Cry蛋白也没有竞争关系[6-7]。Vips作为第二代生物杀虫剂对鳞翅目和双翅目具有广谱性,可以单独或与Cry蛋白结合来预防或延缓昆虫抗性的产生,扩大杀虫谱[8-10],是害虫治理的新策略[11]。
目前已经公布的vip基因根据它们的序列相似性分为四类,分别是vip1、vip2、vip3和vip4,其中vip3的研究较为深入[10, 12]。Bt毒素委员会记载的有65个vip3Aa,2个vip3Ab,1个vip3Ac,6个vip3Ad,1个vip3Ae,4个vip3Af,15个vip3Ag,2个vip3Ah,1个vip3Ai,2个vip3Ba,3个vip3Bb和4个vip3Ca(http://www.lifesci.sussex.ac.uk/home/Neil_Crickmore/Bt/vip.html)。已有研究发现通过基因工程技术改造已有的抗虫基因可以改变蛋白的杀虫活性或蛋白杀虫谱[13-14]。人工交换Cry1Ab和Cry1C的DomainⅢ构建了一个新的Cry蛋白(1Ab-1Ab-1C),该蛋白对甜菜夜蛾幼虫的杀虫活性比单纯Cry1Ab和Cry1C杀虫活性高出十倍以上[15]。而Cry1Ab、Cry1Ah的结构域交换后与出发蛋白相比,杂合蛋白AhAhAb丧失了对棉铃虫杀虫活性,降低了对玉米螟、小菜蛾杀虫活性。将Cry3Aa的DomainⅠ和Ⅱ与Cry1Ab的DomainⅢ嵌合获得的新蛋白能够对玉米根萤叶甲产生毒杀作用,而Cry3Aa和Cry1Ab对其没有活性[16]。而对vip的基因改造研究较少。
Vip3Aa蛋白对棉铃虫、甜菜夜蛾、斜纹夜蛾等鳞翅目昆虫具有较强的杀虫活性[17]。Vip3Ad对许多害虫没有杀虫活性[18]。本研究利用重叠PCR的方法,通过比较Vip3Aa39与Vip3Ad蛋白的功能域,构建了三种vip3AaAdAa型嵌合基因,将其转入大肠杆菌中表达嵌合蛋白,并测定了其对甜菜夜蛾的杀虫活性。旨在为深入了解Vip3A杀虫蛋白关键活性区域,进一步揭示Vip3A的杀虫机理提供了参考。
1 材料与方法 1.1 材料 1.1.1 菌株和质粒分别携带vip3Aa39和vip3Ad基因的pET21b质粒、E. coli BL21感受态细胞、表达载体pET21b由本实验室保存。
1.1.2 主要试剂胶回收试剂盒与质粒提取试剂盒购自美国Axygen公司,酶类购自TaKaRa公司,其它试剂为进口或国产分析纯。引物合成及基因克隆测序由生工生物工程(上海)股份有限公司完成。
1.1.3 培养基LB液体培养基:Yeast extract 0.5%,NaCl 1%,Tryptone 1%,pH调为7.0。LB固体培养基:在LB液体培养基中按1.3%的比例加入琼脂,121℃湿热灭菌20 min。
1.1.4 供试昆虫甜菜夜蛾(Spodoptera exigua)虫卵均购自河南省济源白云实业有限公司。待其产卵后,置于铺有吸水纸的塑料盒中,人工气候箱保持相对湿度在60%,温度30℃,待其孵化,初孵幼虫供生物测定使用。
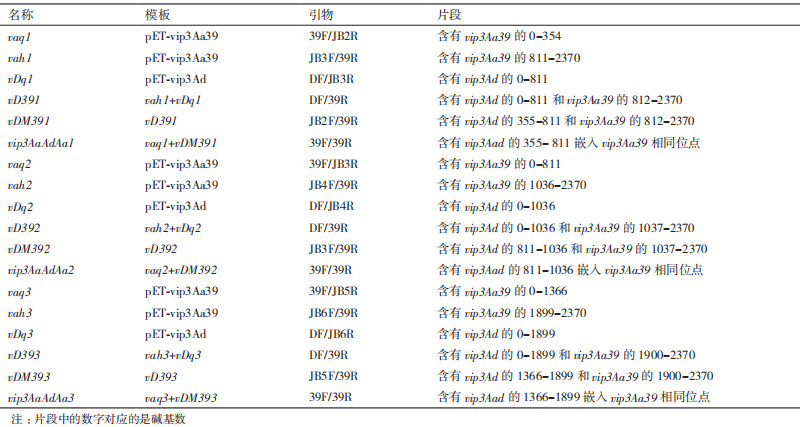
1.2 方法 1.2.1 嵌合基因片段的克隆Vip3AaAdAa基因是由vip3Aa39提供前段、后段序列,vip3Ad提供部分中间序列,拼接得到的嵌合基因。通过比对Vip3Aa39与Vip3Ad氨基酸序列,选取部分保守区域,设计了5对中间引物(JB2F、JB2R、JB3F、JB3R、JB4F、JB4R、JB5F、JB5R、JB6F和JB6R)及2对全长引物(39F、39R和DF、DR),在全长引物中分别加入了BamH I和Sal I酶切位点(下划线),见表 1。参考重叠延伸PCR法进行片段的互换[19],用KOD高保真酶进行扩增,回收PCR产物,将重组基因与pET21b质粒分别双酶切后4℃连接过夜,将重组质粒转入BL21感受态,挑取阳性克隆子送生工生物工程(上海)股份有限公司测序,使用NCBI数据库和DNAMAN软件对结果进行分析比对。
以嵌合基因vip3AaAdAa1的构建为例,先以本实验室保存的pET-Vip3Aa39质粒为模板,引物39F/JB2R、JB3F/39R进行PCR扩增,得到vip3Aa39的0-354、810-2370序列片段vaq1、vah1;继续以pET- Vip3Ad质粒为模板,用引物DF /JB3R进行PCR扩增,得到vip3Ad的0-810序列片段vDq1;切胶纯化后的产物vah1、vDq1为模板,通过引物DF/39R进行融合扩增,得到vipD391基因;以vipD391基因为模板,JB2F/39R为引物,扩增得到vDM391;最后以vaq1和vDM391为模板,用引物39F /39R进行PCR扩增,得到的嵌合基因即为vip3AaAdAa1。vip3AaAdAa2、vip3AaAdAa3的构建见图 1和表 2。

|
| 图 1 嵌合基因的构建 vip3AaAdAa1是将vip3Aa39的355-811片段用vip3Ad的对应片段替换;vip3AaAdAa2是将vip3Aa39的811-1036片段用vip3Ad的对应片段替换;Vip3AaAdAa3是将vip3Aa39的1366-1899片段用vip3Ad的对应片段替换。 |
将3个含有嵌合基因的重组质粒以及pET-Vip3Aa39和pET-Vip3Ad质粒转化到大肠杆菌BL21(DE3)菌株的感受态细胞后进行诱导IPTG表达蛋白,收集诱导物,离心,弃上清,用20 mmol/L Tris-HCl(pH8.0)缓冲液悬浮细胞并进行超声波破碎,取样进行SDS-PAGE分析[20]。
1.2.3 甜菜夜蛾的生物活性测定将粗提蛋白用20 mmol/L Tris-HCl稀释成不同的浓度,且取3.0 mL待测样品溶液加入到30 g饲料中混匀,室温晾置蒸发多余水分;分装于已消毒的24孔细胞培养板中;将初孵幼虫接于24孔板中,每孔一头;放置在27℃的人工气候箱中培养,光周期为14:10,湿度控制在65%左右。培养7 d后分别调查死、活虫数,计算死亡率。
1.2.4 胰蛋白酶消化将3个嵌合蛋白与Vip3Aa39与Vip3Ad蛋白用20 mmol/L Tris-HCl缓冲液定量到300 µg/mL。为确定嵌合蛋白的消化时间,先对Vip3Aa39与Vip3Ad蛋白进行不同时间下的胰蛋白酶(0.1 mg/mL)处理,按胰蛋白酶与定量后蛋白1:10的比例加入1.5 mL EP管中。快速混匀后加入37℃水浴锅中温育。在温育5 min后,快速加入上样缓冲液,沸水下变性10 min。然后进行SDS-PAGE电泳。
2 结果 2.1 嵌合基因的获取用KOD高保真酶进行扩增,回收PCR产物,将重组基因与pET21b质粒分别双酶切后连接过夜,将重组质粒转入BL21感受态,挑取阳性克隆子送测序,使用NCBI数据库和DNAMAN软件对结果进行分析比对证明插入片段大小正确,长度为2 370 bp(图 2)。
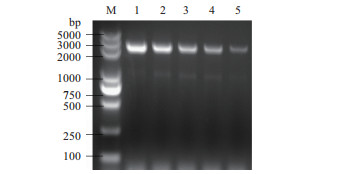
|
| 图 2 3种嵌合基因与初始基因的PCR鉴定 M:Marker;1:vip3AaAdAa1;2:vip3AaAdAa2;3:vip3AaAdAa3;4:vip3Aa39;5:vip3Ad |
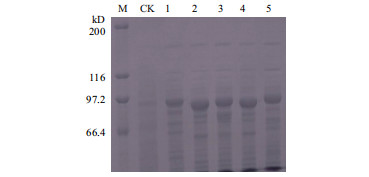
将3个含有嵌合基因的重组质粒以及pET-Vip3Aa39和pET-Vip3Ad质粒转化到大肠杆菌BL21(DE3)菌株的感受态细胞后进行诱导表达蛋白。SDS-PAGE结果(图 3)表明,在经IPTG诱导后的表达产物在分子量约为88 kD处有明显的特异性表达条带,与理论推算基本相符。
|
| 图 3 3种嵌合基因和初始基因在BL21中的蛋白表达 M:Protein marker;CK:pET21b空载体;1:Vip3AaAdAa1;2:Vip3AaAdAa2;3:Vip3AaAdAa3;4:Vip3Aa39;5:Vip3Ad |
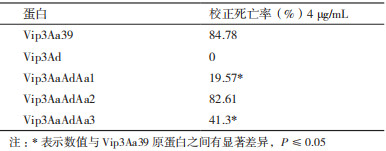
将Vip3Aa39、Vip3Ad和3种嵌合蛋白对甜菜夜蛾初孵幼虫进行生物活性测定,校正死亡率如表 3。Vip3Aa39和3种嵌合蛋白对甜菜夜蛾具有较高的杀虫活性,而Vip3Ad对甜菜夜蛾没有活性;嵌合蛋白Vip3AaAdAa1和Vip3AaAdAa3的校正死亡率均低于Vip3Aa39,且差异显著,其中Vip3AaAdAa1蛋白的校正死亡率比Vip3Aa39低76.9%,Vip3AaAdAa3蛋白的校正死亡率比Vip3Aa39低51.3%,而Vip3Aa-AdAa2蛋白与Vip3Aa39校正死亡率差异不显著。
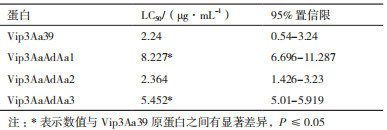
通过蛋白对甜菜夜蛾致死中浓度LC50的测定表明(表 4),Vip3Aa39、Vip3AaAdAa1和Vip3AaAd-Aa3对甜菜夜蛾具有比较高的杀虫活性,Vip3AaAd-Aa1蛋白的LC50 8.227µg/mL,比Vip3Aa39的LC50升高了2.7倍;Vip3AaAdAa3蛋白的LC50 5.452 µg/mL,比Vip3Aa39升高了1.4倍,且差异显著,可见嵌合蛋白Vip3AaAdAa1和Vip3AaAdAa3的杀虫活性均低于Vip3Aa39;而Vip3AaAdAa2蛋白的活性与Vip3Aa39差异不显著。
将3个嵌合蛋白用胰蛋白酶处理5 min发现,88 kD的蛋白条带消化后均得到62 kD的消化条带(图 4)。
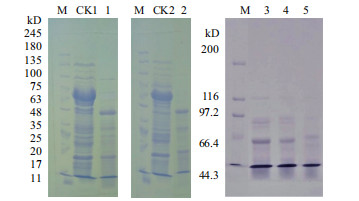
|
| 图 4 胰蛋白酶处理后的嵌合蛋白和初始蛋白SDS-PAGE图 M:Protein marker;CK1:未加胰蛋白酶Vip3Ad;1:Vip3Ad;CK2:未加胰蛋白酶Vip3Aa39;2:Vip3Aa39;3:Vip3AaAdAa1;4:Vip3AaAdAa2;5:Vip3AaAdAa3 |
苏云金芽胞杆菌营养期杀虫蛋白已被用于作物保护和延缓对现有杀虫性Cry毒素的抗性。然而,人们对Vip3A的行为或作用机制知之甚少,也不清楚其结构模型[21]。近年来发现,C末端缺失154个氨基酸可使Vip3A蛋白失去对甜菜夜蛾和斜纹夜蛾的杀虫活性,而对玉米螟的杀虫活性仅仅稍有降低[22]。Vip3A蛋白由~789个氨基酸组成,Vip3Ad与Vip3Aa39的氨基酸相似性为85%,差异性较大的部分集中在后半段。
本研究通过这两个蛋白的结构互换获得了3个嵌合蛋白,并对甜菜夜蛾进行抗虫性分析,结果表明,将Vip3Aa39的118-210氨基酸片段用Vip3Ad的对应片段替换后杀虫活性明显下降,嵌合蛋白Vip3AaAdAa1与Vip3Aa39相比仅有3个氨基酸差异,用缬氨酸(V)替代了134位的丙氨酸(A),用甲硫氨酸(M)替代了176位的异亮氨酸(I),用脯氨酸(P)替代了201位的丝氨酸(S);将Vip3Aa39的210-345氨基酸片段用Vip3Ad的对应片段替换后杀虫活性与Vip3Aa39相比无明显差异,Vip3AaAdAa2与Vip3Aa39相比也有3个氨基酸差异位点,用天冬酰胺(N)替代了338位的缬氨酸(V)和342位的天冬氨酸(D),用苏氨酸(T)替代了345位的丙氨酸(A);Vip3AaAdAa3是将Vip3Aa39的455-632氨基酸片段用Vip3Ad的对应片段替换,互换后有36个氨基酸位点发生改变,杀虫活性与Vip3Aa39相比下降了1.4倍。3个嵌合蛋白的杀虫活性与Vip3Aa39相比有所改变,证明新的序列插入改变了杀虫活性,活性改变的原因还需要继续研究。
在敏感昆虫肠液或Trypsin的作用下Vip3A蛋白能水解成分子量分别为62、45、33及22 kD的4条主带,其中62 kD片段能与甜菜夜蛾的刷状缘膜细胞(BBMV)相结合,形成离子孔道进行穿孔,诱发靶标昆虫细胞凋亡,细胞核溶解,导致昆虫死亡[23]。研究表明,3种嵌合蛋白和Vip3Aa、Vip3Ad均表达88 kD的蛋白,经胰蛋白酶消化后均出现62 kD的蛋白条带。62-66 kD的片段是Vip3Aa蛋白的活性中心。Vip3A蛋白既可被敏感昆虫的中肠液消化产生蛋白片段,同样也可被不敏感昆虫的中肠液消化产生同样的蛋白条带,但是活化后的Vip3A蛋白对非敏感昆虫依然没有毒性[24]。这说明活化只是Vip3A毒素发挥作用的开始,后续还有很复杂的过程。
4 结论利用重叠PCR的方法,通过比较对甜菜夜蛾具有高活性的Vip3Aa与无杀虫活性Vip3Ad蛋白的功能域,成功构建了3种vip3AaAdAa型嵌合基因,将其转入大肠杆菌中表达嵌合蛋白。结果显示,嵌合蛋白Vip3AaAdAa1和Vip3AaAdAa3对甜菜夜蛾具有比较高的杀虫活性,Vip3AaAdAa3蛋白的LC50值比Vip3Aa39增加了1.4倍,而Vip3AaAdAa1蛋白的LC50值比Vip3Aa39增加了2.7倍,导致嵌合蛋白Vip3AaAdAa1和Vip3AaAdAa3的杀虫活性均低于Vip3Aa39;Vip3AaAdAa2的杀虫活性与Vip3Aa39差异不显著。
| [1] |
Estruch JJ, Warren GW, Mullins MA, et al. Vip3A, a novel Bacillus thuringiensis vegetative insecticidal protein with a wide spectrum of activities against lepidopteran insects[J]. Proc Natl Acad Sci USA, 1996, 93(11): 5389-5394. DOI:10.1073/pnas.93.11.5389 |
| [2] |
张金波, 李海涛, 等. Bt菌株DQ89的sip基因的克隆、表达及杀虫活性分析[J]. 中国生物防治学报, 2015, 31(4): 598-602. |
| [3] |
彭琦, 周子珊, 张杰. 苏云金芽胞杆菌杀虫晶体蛋白研究进展[J]. 中国生物防治学报, 2015, 31(5): 712-722. |
| [4] |
Tetreau G, Stalinski R, David JP, et al. Monitoring resistance to Bacillus thuringiensis subsp. israelensis in the field by performing bioassays with each Cry toxin separately[J]. Mem Inst Oswaldo Cruz, 2013, 108(7): 894-900. DOI:10.1590/0074-0276130155 |
| [5] |
Tanaka S, Endo H, Adegawa S, et al. Functional characterization of Bacillus thuringiensis Cry toxin receptors explains resistance in insects[J]. FEBS J, 2016, 283(24): 4474-4490. DOI:10.1111/febs.2016.283.issue-24 |
| [6] |
Fang J, Xu X, Wang P, et al. Characterization of chimeric Bacillus thuringiensis Vip3 toxins[J]. Appl Environ Microbiol, 2007, 73(3): 956-961. DOI:10.1128/AEM.02079-06 |
| [7] |
Chakroun M, Banyuls N, Bel Y, et al. Bacterial vegetative insecticidal proteins(Vip)from entomopathogenic bacteria[J]. Microbiol Mol Biol Rev, 2016, 80(2): 329-350. DOI:10.1128/MMBR.00060-15 |
| [8] |
Chen W, Liu C, Lu G, et al. Effects of Vip3AcAa+Cry1Ac cotton on midgut tissue in Helicoverpa armigera(Lepidoptera:Noctuidae)[J]. J Insect Sci, 2018, 18(4). |
| [9] |
Chen WB, Lu GQ, Cheng HM, et al. Transgenic cotton co-expressing chimeric Vip3AcAa and Cry1Ac confers effective protection against Cry1Ac-resistant cotton bollworm[J]. Transgenic Res, 2017, 26(6): 763-774. DOI:10.1007/s11248-017-0048-8 |
| [10] |
Ferre J, Escriche B. Editorial for special issue:the insecticidal bacterial toxins in modern agriculture[J]. Toxins(Basel), 2017, 9(12): 396. |
| [11] |
Boukedi H, Tounsi S, Abdelkefi-Mesrati L. Insecticidal activity, putative binding proteins and histopathological effects of Bacillus thuringiensis Vip3(459)toxin on the lepidopteran pest Ectomyelois ceratoniae[J]. Acta Trop, 2018, 182: 60-63. DOI:10.1016/j.actatropica.2018.02.006 |
| [12] |
Song F, Chen C, et al. Transcriptional profiling analysis of Spodoptera litura larvae challenged with Vip3Aa toxin and possible involvement of trypsin in the toxin activation[J]. Sci Rep, 2016, 6: 23861. DOI:10.1038/srep23861 |
| [13] |
Bel Y, Sheets JJ, et al. Toxicity and binding studies of Bacillus thu-ringiensis Cry1Ac, Cry1F, Cry1C, and Cry2A proteins in the soyb-ean pests anticarsia gemmatalis and chrysodeixis(Pseudoplusia)includens[J]. Appl Environ Microbiol, 2017, 83(11). |
| [14] |
徐曼, 蒋健, 束长龙, 等. Cry1Ab_Cry1Ah杂合蛋白构建与功能研究[J]. 生物技术通报, 31(9): 91-96. |
| [15] |
De Maagd RA, Bakker PL, et al. Domain Ⅲ of the Bacillus thuringiensis delta-endotoxin Cry1Ac is involved in binding to Manduca sexta brush border membranes and to its purified aminopeptidase N[J]. Mol Microbiol, 1999, 31(2): 463-471. DOI:10.1046/j.1365-2958.1999.01188.x |
| [16] |
Walters FS, Defontes CM, et al. Lepidopteran-active variable-region sequence imparts coleopteran activity in eCry3. 1Ab, an engineered Bacillus thuringiensis hybrid insecticidal protein[J]. Appl Environ Microbiol, 2010, 76(10): 3082-3088. DOI:10.1128/AEM.00155-10 |
| [17] |
Wu ZL, Guo WY, Qiu JZ, et al. Cloning and localization of vip3A gene of Bacillus thuringiensis[J]. Biotechnol Lett, 2004, 26(18): 1425-1428. DOI:10.1023/B:BILE.0000045645.45536.3f |
| [18] |
Boukedi H, Ben Khedher S, Abdelkefi-Mesrati L, et al. Comparative analysis of the susceptibility/tolerance of Spodoptera littoralis to Vip3Aa, Vip3Ae, Vip3Ad and Vip3Af toxins of Bacillus thuringiensis[J]. J Invertebr Pathol, 2018, 152: 30-34. DOI:10.1016/j.jip.2018.01.006 |
| [19] |
Thornton JA. Splicing by overlap extension PCR to obtain hybrid DNA products[J]. Methods Mol Biol, 2016, 1373: 43-49. |
| [20] |
何晓明.苏云金芽胞杆菌新型vip3基因克隆、表达及活性分析[D].哈尔滨: 东北农业大学, 2011.
|
| [21] |
Kunthic T, Surya W, Promdonkoy B, et al. Conditions for homogeneous preparation of stable monomeric and oligomeric forms of activated Vip3A toxin from Bacillus thuringiensis[J]. Eur Biophys J, 2017, 46(3): 257-264. DOI:10.1007/s00249-016-1162-x |
| [22] |
Selvapandiyan A, Arora N, et al. Toxicity analysis of N-and C-ter-minus-deleted vegetative insecticidal protein from Bacillus thuringiensis[J]. Appl Environ Microbiol, 2001, 67(12): 5855-5858. DOI:10.1128/AEM.67.12.5855-5858.2001 |
| [23] |
Ahmad A, Javed MR, Rao AQ, et al. In-Silico determination of insecticidal potential of Vip3Aa-Cry1Ac fusion protein against lepidopteran targets using molecular docking[J]. Front Plant Sci, 2015, 6: 1081. |
| [24] |
Lee MK, Walters FS, Hart H, et al. The mode of action of the Bacillus thuringiensis vegetative insecticidal protein Vip3A differs from that of Cry1Ab delta-endotoxin[J]. Appl Environ Microbiol, 2003, 69(8): 4648-4657. DOI:10.1128/AEM.69.8.4648-4657.2003 |