2. 北京师范大学核科学与技术学院,北京 100875
2. College of Nuclear Science and Technology, Beijing Normal University, Beijing 100875
梨是我国栽培历史久、面积大、产量高的果树之一。据统计梨是我国第3大水果,目前全国年产量占全世界产量的75%[1]。梨果实在贮藏期间,时刻会受到病害的威胁,其中梨软腐病主要由匍枝根霉(Rhizopus stolonifer)引起[2],主要危害梨果实,在果实伤口多、贮藏期温度高时发生较重。高温时,5-6 d内可使病果全部软腐,造成巨大经济损失。匍枝根霉可以侵染多种果蔬,引起的软腐病已经成为一种世界性病害。
新鲜水果采后腐烂是一个全球性的问题。目前生产上常采用化学药剂防治梨采后病害,这样不仅造成环境污染,而且增加了农产品中农药的残留量,给人类健康带来潜在危害,同时也易诱导致病菌抗药性的产生而无法控制病害。生物防治利用物种间的拮抗作用来减少病害的发生,对人畜安全、环境兼容性好、病虫害不易产生抗药性,因而具有化学杀菌剂不具有的优势,正逐步成为代替化学杀菌剂的最佳方式。获得高效拮抗菌是生物防治的基础。枯草芽胞杆菌(Bacillus subtilis)是最早被报道用来防治柑橘病害的细菌[3]。随着研究的深入,人们已筛选并报道多种对果蔬采后病害具有防治效果的拮抗菌,主要是酵母菌、芽胞杆菌、假单胞菌和木霉菌[4]。几株微生物拮抗菌已经被授权专利并商业应用,如Aspire(Candida oleophila,USA)、Biosave(Pseudomonas syringae,USA)、“Shemer”(Metschnikowia Fructicola,Israel)等[4]。微生物拮抗菌可以产生具有高拮抗活性的广谱抗菌物质,具有极强的抗逆能力,同时具有无毒、无残留、无致病性、对人畜安全、环境相容性好等特点,满足了消费者对农产品质量和安全性的要求。
本研究拟从本实验室分离保存的来源于霍山石斛、花生及兰州百合的65株内生菌中,筛选对梨软腐病菌有较好拮抗活性的菌株,并对筛选得到的高活性拮抗菌,初步探讨其抑菌物质,为梨软腐病菌的防治提供生物资源。
1 材料与方法 1.1 材料 1.1.1 供试菌株、植物材料和培养基来自霍山石斛的内生菌22株,花生内生菌25株,兰州百合内生菌18株,以及梨软腐病菌(Rhizopus stolonifer)由本实验室分离保存。
1.1.2 主要培养基LB培养基:胰蛋白胨10 g,酵母提取物5 g,氯化钠10 g,水1 L,pH值7.4-7.6。用于细菌的培养。马铃薯葡萄糖琼脂培养基(PDA):马铃薯200 g、葡萄糖20 g、琼脂15 g、水1 L,pH值自然。马铃薯葡萄糖培养基(PDB):马铃薯200 g、葡萄糖20 g、水1 L,pH值自然。用于真菌的培养。121℃灭菌20 min。
1.2 方法 1.2.1 梨软腐病拮抗内生菌的筛选拮抗内生菌的筛选采用对峙培养法,直径8 mm的软腐病病菌接种在直径9 cm的PDA平板一侧,相对的一侧划线接种不同的内生菌株,两接种点相距3-4 cm,病原菌单独接种在PDA平板上做对照,均设3个重复,在25℃条件下培养,2 d后测量抑菌带宽度。
1.2.2 菌株R1B对梨软腐病菌菌丝生长的影响在PDA培养基上活化梨软腐病菌匍枝根霉,用8 mm的枪头在生长2 d的匍枝根霉边缘打取菌饼,研碎后接种于盛有50 mL的1/10 PDB培养基中,25℃,150 r/min培养2 d后,加入过夜培养的R1B菌悬液,使终浓度为1×107 CFU/mL,并以单独接种在接种在1/10 PDB培养基中的软腐病菌做对照。3个重复,在25℃条件下培养后镜检菌丝生长状况。
1.2.3 菌株R1B防治梨果实软腐病的效果测定河北水晶梨购自市场,选取外观整齐、无病虫害、无外伤的果实,先用自来水冲洗干净,然后用75%酒精棉球擦拭消毒,晾干后备用。菌株R1B活化后,接种在盛有50 mL LB液体培养基中的摇瓶中,30℃,150 r/min过夜培养备用。梨软腐病菌接种在PDA平板中培养5 d,在平板中加入无菌水刮下软腐病菌孢子,然后利用血球计数器计算孢子数目,用无菌水将软腐病菌孢子浓度调整到1×105 spores/mL。用1 mL枪头在梨果实表面赤道部位对称打两个直径8 mm、深度3 mm的伤口,在伤口内分别接种30 µL 5×107 CFU/mL的R1B菌悬液(R1B处理组)和等量无菌水(对照组),每处理8个果实,重复3次,室温放置1 d。然后分别在R1B处理组和对照组的伤口处接种梨软腐病菌孢子悬液30 µL,接种处理后放入PE密闭箱中在25℃,RH >90%条件下培养,定时观察并记录结果,并计算平均发病率(%)和平均病斑直径(mm)。利用Microsoft Excel 2010对数据进行方差分析,并采用t测验进行差异显著性检验(P < 0.05)。
1.2.4 菌株R1B的鉴定生理生化鉴定参照《常见细菌系统鉴定手册》[5]中芽孢菌属的鉴定方法。分子生物学鉴定:菌株R1B16S rDNA序列扩增及测序结果分析按照武利勤等[6]的方法。R1B基因组利用通用引物27F和1492R进行扩增,PCR产物经纯化后由北京诺赛有限公司测序。获得的16S rDNA基因序列在GenBank中进行BLAST比对,用Clustal X软件进行序列相似性分析,采用MEGA 5软件以Neighbor-joining方法构建系统发育树,用Bootstrap(1 000次重复)进行检验。
1.2.5 脂肽类抗菌活性物质合成相关基因的分析参考Mora等[7]的方法,PCR扩增菌株R1B基因组DNA,筛选其是否含有合成相关抗菌物质的基因,包括srfAA(surfactin表面活性素),ituC(iturin伊枯草菌素),bmyB(bacyllomicin杆菌抗霉素),fenD(fengycin丰原素),spaS(subtilin枯草菌素),以及bacA(bacilysin溶杆菌素)。表 1是使用的引物信息[7]。50 µL的PCR反应体系包括:Premix Taq 25 µL,浓度为10 μM的引物各2 µL,DNA 2 µL(20 ng),ddH2O补足至50 µL。PCR反应条件为:95℃预变性3 min,94℃变性1 min,退火1 min,70℃延伸1 min,共进行40个循环,循环结束后70℃延伸5 min,其中srfAA,ituC,fenD,bacA和spaS退火温度为58℃,bmyB退火温度为55℃。扩增产物由北京诺赛有限公司纯化后进行测序。测序获得的基因序列利用BLAST在GenBank数据库中进行同源性检索及比对分析,并提交到Genbank:bacA(MK174675)、ituC(MK174678)、bmyB(MK174676)及fenD(MK174677)。
2 结果 2.1 梨软腐病拮抗菌的筛选从霍山石斛、花生及兰州百合的叶片和根组织中分离获得的内生菌共65株,利用对峙培养法筛选拮抗软腐病菌的内生菌。软腐病菌生长迅速,1 d即可满皿(图 1-B),大多数内生菌被软腐病菌覆盖吞噬,无拮抗活性;而菌株R1B表现出一定的抑菌作用,R1B周围有明显的抑菌带(0.5-1 cm),10 d后依然清晰(图 1-A)。
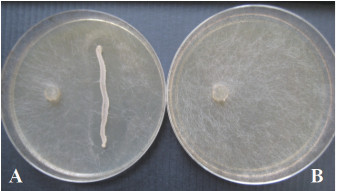
|
| 图 1 菌株R1B对软腐病菌的抑菌作用 A:菌株R1B与软腐病菌共培养;B:软腐病菌单独培养 |
结果如图 2所示,在菌株R1B作用下,软腐病菌几乎不能生长,菌丝断裂、自溶(图 2-A),而对照病菌菌丝生长旺盛(图 2-B)。说明菌株R1B可完全抑制软腐病菌菌丝的生长。

|
| 图 2 菌株R1B处理后软腐病菌菌丝形态的变化(放大倍数:400×) A:菌株R1B处理的软腐病菌;B:软腐病菌正常菌丝 |
菌株R1B对梨果实软腐病的防治作用如图 3、表 2所示,接种软腐病菌匍枝根霉后,对照组发病迅速,在接种软腐病菌2 d后,对照组病斑直径已达6-9 cm,R1B处理组可以完全抑制梨果实软腐病的发生;4 d后,对照组梨果实全部腐烂,渗出大量的液体,且布满黑色菌丝和孢子;而R1B处理组依然100%抑制梨果实软腐病的发生;12 d后R1B处理组开始发病。实验结果表明R1B对梨果实软腐病的发生有很好的防治作用。

|
| 图 3 菌株R1B对梨软腐病的防治作用 A:CK(水)处理;B:菌株R1B处理 |
菌株R1B在LB培养基上生长良好,生长2 d的菌落扁平圆形,乳白色不透明,边缘锯齿状,表面粗糙颗粒状。菌株R1B的生理生化特性如表 3所示,菌株R1B属于好氧菌,甲基红实验阴性,接触酶反应、明胶水解、淀粉水解、VP实验均为阳性;可以很好地利用葡萄糖、蔗糖和甘露醇以及D-木糖和D-阿拉伯糖;可以在10% NaCl中生长,具有较高的耐盐性;在50℃可以生长,但在28-37℃条件下生长最好。根据《常见细菌系统鉴定手册》,将菌株R1B初步鉴定为芽孢杆菌属(Bacillus)细菌。
将获得的菌株R1B 16S rDNA序列利用BLAST在GenBank中进行同源比对分析,选择同源性较高的序列作为参考序列,构建系统发育树。结果(图 4)显示,菌株R1B属于芽孢杆菌属Bacillus,与Bacillus velezensis典型菌株MG846018聚为一簇,具有最近的亲缘关系。

|
| 图 4 菌株R1B的16S rDNA系统发育树 注:基于16S rRNA基因序列建立邻接树,节点上的数字是基于1 000个重采样数据集的百分比引导值,只有≥ 50%的数值在节点显示。标尺代表每个位置的0.0005个核苷酸替换 |
利用6对引物,分别PCR扩增菌株R1B基因组DNA,获得4条目标片段。将其测序后进行BLAST同源性分析,结果表明从菌株R1B扩增的bacA基因(MK174675)与B. amyloliquefaciens RNB-92(AB973461)中溶杆菌素合成酶bacA基因的同源性为99%,bmyB基因(MK174676)与B. amyloliquefaciens(KY111359)杆菌抗霉素D合成酶基因bmyB同源性为99%,扩增获得的ituC基因(MK174678)与B. siamensis H1401(MG009462)和B. subtilis(AB050629)中的伊枯草菌素A合成酶基因ituC同源性为98%和99%,扩增的fenD基因(MK174677)与B. amyloliquefaciens 32a(KP453873)中的丰原素合成酶基因fenD同源性为97%。
根据测序结果,菌株R1B基因组中可能存在溶杆菌素、杆菌抗霉素、伊枯草菌素、丰原素合成的操纵子序列,菌株Y1B可能产生抗菌二肽溶杆菌素和2类脂肽类抗菌物质。
3 讨论果蔬软腐病可在世界范围内发生,软腐病菌匍枝根霉寄主广泛,可危害多种果蔬,其生长迅速,短时间内可引起果蔬的大量腐烂造成重大的经济损失。目前生产上主要采用化学农药来防治软腐病。由于全球对化学杀虫剂的滥用以及由此引起的对健康和环境严重的副作用的担心,迫切需要采取环境友好的生物防治方式[8-9]。能产生多种广谱性的抗菌活性物质[10],并且抗逆性强,在恶劣的条件下可以形成孢子度过不利的环境条件保存活力,相比其他生防菌具有明显优势的芽孢杆菌[11]是有希望能应用于生物防治的微生物。
本研究通过对实验室分离保存的多种植物内生菌进行筛选,获得了一株来自石斛的具有较好抑菌效果的菌株R1B,通过生理生化和分子鉴定,表明菌株R1B与贝莱斯芽孢杆菌Bacillus velezensis具有最近的亲缘关系。前期研究表明,贝莱斯芽孢杆菌对多种植物病原菌具有抑菌活性,孙平平等[12]报道贝莱斯芽孢杆菌L-1能够显著抑制梨灰霉与青霉菌的扩展;张新刚等[13]报道贝莱斯芽孢杆菌SFJ1可以防治黄瓜灰霉病;杜淑涛等[14]发现贝莱斯芽孢杆菌DL-59对白菜黑斑病具有良好的防治效果。我们的实验结果与前期的研究结论一致,在菌株R1B作用下,菌丝断裂自溶,几乎完全不能生长;R1B对梨果实软腐病的发生也具有良好的防治作用,在接种软腐病菌4 d后,对照组梨果实全部腐烂,而R1B处理组完全抑制梨果实软腐病的发生,说明菌株R1B在梨采后病害的生物防治方面有一定的开发利用潜力。
芽孢杆菌的拮抗活性主要是通过产生抗菌活性物质来发挥作用,包括非核糖体途径合成的抗菌多肽类、脂肽类和聚酮类化合物以及核糖体途径合成的抗菌蛋白如细菌素等[15],这些活性物质的产生与其生防效果具有密切的关系。脂肽类化合物是芽孢杆菌产生的主要的抑菌活性物质,主要包括表面活性素(Surfactin)、伊枯草菌素(Iturin)、丰原素(Fengycin)三大家族,其中伊枯草菌素、丰原素对真菌有强烈的拮抗作用[15],而表面活性素可以帮助芽孢杆菌在宿主上定殖[16]。通过PCR扩增菌株R1B基因组DNA,我们发现菌株R1B基因组中可能存在杆菌抗霉素(Bacyllomicin)、伊枯草菌素(Iturin)、丰原素(Fengycin)合成的操纵子序列,菌株R1B可能产生2大类脂肽类抗菌物质伊枯草菌素(Iturin)和丰原素(Fengycin)。
非核糖体合成的活性抗菌物质除了脂肽类外还包括许多其他次生代谢产物,如抗菌二肽溶杆菌素(Bacilysin)结构简单,仅由2个氨基酸组成,其可以抑制真菌和细菌细胞壁的合成,导致微生物细胞结构损伤,从而使细胞溶解死亡,对细菌和真菌都具有广谱抗菌活性[17],因此在农业和医药领域具有广阔的应用潜力。我们通过PCR探测到菌株R1B基因组中含有溶杆菌素合成的基因序列,R1B可能产生溶杆菌素发挥抗菌活性。
核糖体途径合成的细菌素是一类具有抗菌生物活性的蛋白质或多肽类物质[18],枯草菌素(Subtilin)是迄今为止研究得比较清楚的细菌素之一。因其具有高效抗菌活性和无残留毒副作用而被广泛地应用,并且细菌素无耐药性,极有可能替代传统抗生素应用于生物医药和生物防治领域[19-20]。但是我们在用PCR探测时,没有发现R1B基因组中含有合成枯草菌素的基因簇,说明R1B的抗菌活性可能是通过产生抗菌二肽溶杆菌素以及伊枯草菌素和丰原素发挥作用。
4 结论通过筛选不同植物来源的内生菌发现,来源于霍山石斛的菌株R1B具有显著的抗菌活性,可以强烈抑制梨软腐病菌匍枝根霉的生长,对梨软腐病具有良好的防治效果,具有开发成生物农药的潜力。经鉴定R1B与贝莱斯芽孢杆菌具有最近的亲缘关系。通过PCR探测R1B基因组,结果表明R1B可能产生抗菌二肽溶杆菌素以及伊枯草菌素和丰原素,而该菌株的抑菌活性是仅取决于其中一种活性物质,还是不同活性物质协同作用的结果,还有待进一步的实验来阐明。
| [1] |
孙平平, 王文辉. 2016/2017年世界苹果、梨、葡萄、桃及樱桃产量、市场及贸易情况[J]. 中国果树, 2017(2): 91-100. |
| [2] |
Kwon JH, Lee CJ. Rhizopus Soft Rot on Pear(Pyrus serotina)Caused by Rhizopus stolonifer in Korea[J]. Mycobiology, 2006, 34(3): 151-153. DOI:10.4489/MYCO.2006.34.3.151 |
| [3] |
Gutter Y, Littauer F. Antagonistic action of Bacillus subtilis against citrus fruit pathogens[J]. Bulletin of the Research Council of Israel, 1953, 33(3): 192-197. |
| [4] |
Sharma RR, Singh D, Singh R. Biological control of postharvest diseases of fruits and vegetables by microbial antagonists: A review[J]. Biological Control, 2009, 50(3): 205-221. DOI:10.1016/j.biocontrol.2009.05.001 |
| [5] |
东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001.
|
| [6] |
武利勤, 顾海科, 王青, 等. 石斛内生甲基营养芽胞杆菌的拮抗和促生作用研究[J]. 生物技术通报, 2016, 32(8): 200-206. |
| [7] |
Mora I, Cabrefiga J, Montesinos E. Antimicrobial peptide genes in Bacillus strains from plant environments[J]. International Microbiology, 2011, 14(4): 213-223. |
| [8] |
Alvindia DG, Natsuaki, K T. Biocontrol activities of Bacillus amyloliquefaciens DGA14 isolated from banana fruit surface against banana crown rot-causing pathogens[J]. Crop Protection, 2009, 28(3): 236-242. DOI:10.1016/j.cropro.2008.10.011 |
| [9] |
Gálvez A, Abriouel H, Benomar, et al. Microbial antagonists to food borne pathogens and biocontrol[J]. Curr Opin Biotechnol, 2010, 21(2): 142-148. DOI:10.1016/j.copbio.2010.01.005 |
| [10] |
Lee JP, Lee SW, Kim CS, et al. Evaluation of formulations of Bacillus licheniformisfrom the biological control of tomato gray mold caused by Botrytis cinerea[J]. Biological Control, 2006, 37(3): 329-337. DOI:10.1016/j.biocontrol.2006.01.001 |
| [11] |
Lalloo R, Maharajh D, Görgens J, et al. A downstream process for production of a viable and stable Bacillus cereus aquaculture biological agent[J]. Applied Microbiology & Biotechnology, 2010, 86(2): 499-508. |
| [12] |
孙平平, 崔建潮, 贾晓辉, 等. 贝莱斯芽孢杆菌L-1对梨灰霉和青霉病菌的抑制作用评价及全基因组分析[J]. 微生物学报, 2018, 58(9): 1637-1646. |
| [13] |
张新刚, 王海利, 张晓慷. 防治蔬菜灰霉病的生防菌SFJ1的鉴定及抑菌活性[J]. 农药, 2018, 57(3): 181-183. |
| [14] |
杜淑涛, 李术娜, 朱宝成. 白菜黑斑病拮抗细菌Bacillus velezensis DL-59的筛选鉴定及田间防效实验[J]. 河北农业大学学报, 2010, 33(6): 51-56. DOI:10.3969/j.issn.1000-1573.2010.06.011 |
| [15] |
陈中义, 张杰, 黄大昉. 植物病害生防芽孢杆菌抗菌机制与遗传改良研究[J]. 植物病理学报, 2003, 33(2): 97-103. DOI:10.3321/j.issn:0412-0914.2003.02.001 |
| [16] |
Lugtenberg BJJ, Dekkers L, Bloemberg GV. Molecular determinants of rhizosphere colonization by Pseudomonas[J]. Annual Review of Phytopathology, 2001, 39: 461-490. DOI:10.1146/annurev.phyto.39.1.461 |
| [17] |
Loeffler W, Tschen JSM, Vanittanakom N, et al. Antifungal effects of bacilysin and fengymycin from Bacillus subtilis F-29-3 A comparison with activities of other Bacillus antibiotics[J]. Journal of Phytopathology, 1986, 115(3): 204-213. DOI:10.1111/j.1439-0434.1986.tb00878.x |
| [18] |
Zheng G, Slavik MF. Isolation, partial purification and characterization of a bacteriocin produced by a newly isolated Bacillus subtilis strain[J]. Letters in Applied Microbiology, 1999, 28(5): 363-367. DOI:10.1046/j.1365-2672.1999.00545.x |
| [19] |
饶正华, 李丽蓓, 高生. 枯草菌素在饲料中的应用[J]. 中国饲料, 2001, 24: 17-18. |
| [20] |
Abee T, Krockel L, Hill C. Bacteriocins: modes of action and potentials in food preservation and control of food poisoning[J]. Int J Food Microbiol, 1995, 28(2): 169-185. DOI:10.1016/0168-1605(95)00055-0 |






