杜氏盐藻(Dunaliella salina),是一种嗜盐的单细胞真核藻类,属于绿藻门、团藻目、盐藻科、盐藻属,为绿色单细胞的浮游植物。盐藻细胞没有纤维质的细胞壁,细胞体形微小,长约为14-22 µm,宽3-14 µm,有椭圆、卵圆和长颈瓶等不同形态[1]。杜氏盐藻能在高盐(22%-30% NaCl)条件下生长,生活条件不良时盐藻细胞会大量合成β-胡萝卜素和血红素,藻体呈红色,会把湖水染成红色或粉红色[2]。盐藻很容易规模化培养,能够作为生物反应器表达一些重要的基因而合成积累目标化合物[3-4]。杜氏盐藻含有丰富的油脂、蛋白质和β-胡萝卜素等[5],在食品、医药保健以及化工等产业中具有独特经济价值。尤其是盐藻细胞油脂含量可达细胞干重的39%-44%[6],集约化养殖可联产优质食用油脂或生物柴油[7-8],具有不与人争地、争粮的优势[9-10]。鉴于杜氏盐藻含油量高、且含有较多的油酸和亚麻酸等多不饱和脂肪酸,盐藻被认为是生产优质食用油或工业用油脂的天然生物原料之一[11]。因此,研究盐藻细胞油脂合成积累及调控机制有助于富油盐藻株系的培育及其产业化应用。
β-酮脂酰-ACP合酶Ⅲ(β-ketoacyl-ACP syntha-se Ⅲ,KASⅢ)催化乙酰-CoA(acetyl-CoA)(2C)与丙二酰-ACP(malonyl-ACP)(3C)缩合生成乙酰乙酰-ACP(acetoacetyl-ACP)(4C)进入碳链延伸循环。乙酰乙酰-ACP经第一次还原、脱水、第二次还原反应生成丁酰-ACP(butyryl-ACP)(4C)。丁酰-ACP再次经缩合-还原-脱水-再还原循环延长碳链,每次循环添加2个C原子,直至14或16C。KASⅢ作为启动质体中脂肪酸从头合成的关键酶之一,在植物油脂合成代谢途径中发挥着重要的作用。已有研究表明,在植物体内,KASⅢ的活性影响脂肪酸合成速率,并且受到脂酰链延伸终产物(酯酰-ACP)的反馈抑制[12]。KASⅢ活性强弱决定着脂肪酸碳链的延伸长度。例如,在萼距花(Cuphea hookeriana)种子中,KASⅢ活性受到癸酰-ACP的抑制可产生不同长度的脂肪酸[13]。在烟草(Nicotiana tabacum)中,过表达菠菜(Spinacia oleracea)KASⅢ基因,棕榈酸(C16:0)含量明显增加[14]。将乳酸乳球菌KSAⅢ活性位点突变后,乳酸乳球菌不能在缺乏长链脂肪酸的培养基中正常生长,这表明KASⅢ也是细菌脂肪酸合成必需的关键酶[15]。
近年来,人们相继研究了油桐(Vernicia fordii)[16]、麻风树(Jatropha carcas)[17]和向日葵(Helianthus annuus)[18]等植物的KASⅢ基因及其功能。Du等[19]于2018年发现亚洲棉(Gossypium arboreum)GaKASⅢ酶保守域中氨基酸的改变能决定合成脂肪酸的种类。例如,在ACP_synthase_Ⅲ_C结构域的半胱氨酸(TGT)被精氨酸(CGT)取代,结果导致原先不生成棕榈油酸(C16:1)的种子大量合成并积累了C16:1[19]。杜氏盐藻作为一种重要的单细胞经济藻种,含有丰富的脂肪酸(如棕榈酸、油酸、亚油酸和亚麻酸等),然而还未见其KASⅢ基因和蛋白特征及功能的报道。为此,本文分离鉴定杜氏盐藻的DsKASⅢ基因,并系统分析其编码酶蛋白的理化特性和亚细胞定位及功能预测。重点检测氮胁迫条件下KASⅢ基因的表达谱及对藻细胞油脂和β-胡萝卜素合成积累的影响,以期为进一步全面解析盐藻油脂和β-胡萝卜素合成机制和建立盐藻规模化养殖富集油脂的调控技术提供新的科学参考。
1 材料与方法 1.1 材料本实验所用的杜氏盐藻(Dunaliella salina)藻株SXAU-DS-01来自山西农业大学能源微藻种质库。
1.2 方法 1.2.1 取样正常培养采用DM培养基,培养温度为25℃,光照强度为6 000 lx,光暗比为12 h:12 h。将正常培养生长的杜氏盐藻培养到8 d后,离心(8 000 r/min,3 min)收集藻体沉淀,经无菌水清洗后,一部分悬浮在缺1/2氮的DM培养基中,一部分悬浮于正常的(氮充足)DM培养基中,分别在培养1 d、3 d、6 d和9 d时,离心收集藻样,经液氮速冻后存于-80冰箱备用。
1.2.2 引物设计与合成从Phytozome v12.1数据库(https://phytozome.jgi.doe.gov/pz/portal.html )中查找杜氏盐藻的全基因组数据,并鉴定确认DsKASⅢ基因的完整序列(Dusal.0826s00002.1)[
采用ABM公司的RNA试剂盒提取藻样的总RNA,经1%琼脂糖凝胶电泳及其纯度检测后,将其反转录成为cDNA 20 µL。反转录体系为:AccuRT Reaction Stopper(5X)2 µL,5X All-In-One RT MasterMix 4 µL,RNA模板1 µg,用Nuclease-free H2O补足到20 µL。
1.2.4 DsKASⅢ基因的克隆以反转录得到的杜氏盐藻cDNA为模板进行PCR扩增,20 µL扩增体系包括:2 µL cDNA,0.4 µL正向引物与反向引物(表 1中DsKASⅢ引物,10 nmol/L),10 µL 2×Easypfu PCR SuperMix,7.2 µL Nuclease-free H2O。反应条件为:95℃预变性5 min,95℃变性30 s,58℃退火30 s,72℃延伸1 min,35个循环,72℃延伸10 min。1%琼脂糖凝胶电泳分离,割胶回收目标PCR产物。将PCR产物克隆到pEASY®-Blunt Zero-T载体并转化大肠杆菌DH5α,送至公司进行测序。
1.2.5 杜氏盐藻DsKASⅢ的序列分析 1.2.5.1 杜氏盐藻DsKASⅢ编码蛋白理化特性分析利用在线GSDS(http://gsds.cbi.pku.edu.cn)对DsKASⅢ进行基因结构(Intron-exon)分析,依据保守结构域数据库(Conserved Domain Database,CDD)(https://www.ncbi.nlm.nih.gov/Structure/cdd/)鉴定DsKASⅢ蛋白的保守域。通过ExPasy网站的ProtParam工具(http://web.expasy.org/protparam/)分析DsKASⅢ蛋白的理化性质。应用Target P 1.1 Server(http://www.cbs.dtu.dk/services/TargetP-1.1/)预测DsKASⅢ蛋白的亚细胞定位。依据TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)和ProtScale(http://web.expasy.org/protscale/)工具分析DsKASⅢ蛋白的跨膜结构和疏水区。运用SOPMA(http://metadatabase.org/wiki/SOPMA)和SWISS-MODEL(http://swissmodel.expasy.org/)分别预测DsKASⅢ的二级结构和三级结构。
1.2.5.2 杜氏盐藻DsKASⅢ蛋白的系统发育分析使用MEGA 6.06软件对DsKASⅢ的氨基酸序列与其他14种不同植物的KASⅢ蛋白的氨基酸序列进行ClustalW多序列比对。这14种植物包括江南卷柏(XP_002984971.1)、小立碗藓(XP_001754014.1)、深圳拟兰(PKA66631.1)、油麦菜(PLY93166.1)、海枣(XP_008802619.1)、大豆(NP_001237735.1)、短花药野生稻(XP_006652901.2)、小球藻(XP_005847747.1)、衣藻(GAX79646.1)、胶球藻(XP_005642863.1)、念珠藻(WP_012406929.1)、钝顶节旋藻(WP_006617507.1)、莱茵衣藻(PNW83774.1)、团藻(XP_002951005.1)、大肠杆菌(NP_415609.1)。然后采用邻接法(Neighbor-Joining,N-J)构建无根系统发育树,自举检验值设置1 000个循环,采用p-distance模式。
1.2.6 杜氏盐藻DsKASⅢ基因在氮胁迫条件下的表达分析取氮胁迫培养和正常培养不同时间的藻细胞样品,分别制备cDNA。以各样品cDNA为模板,采用荧光定量PCR分析DsKASⅢ基因的表达。PCR反应体系为:EvaGreen 2X qPCR MasterMix 10 µL,正向和反向引物各0.6 µL,cDNA 1 µL,补加7.8 µL的Nuclease-free H2O至总体积20 µL,设置3个重复。实验结果采用2-∆∆Cq法计算出相对表达量数值,并通过Excel和SPASS分析数据后绘制柱状图。
1.2.7 杜氏盐藻总脂肪酸提取及测定利用氯仿-甲醇法提取正常培养与缺氮培养条件下的杜氏盐藻的总脂。将杜氏盐藻培养到对数期(6 d),冷冻干燥得到藻粉。称取100 mg的藻粉,加入3 mL甲醇:氯仿(2:1)溶液,混匀4 000 r/min离心10 min。取上层有机相并加入0.8 mL的0.75%的NaCl溶液,振荡15 min。下层样品残渣中加入1 mL的氯仿溶液,混匀后4 000 r/min离心10 min。取上层有机相加入1 mL 0.75%的NaCl溶液,振荡15 min。收集振荡后的两管溶液于一个试管,混匀,离心(4 000 r/min,10 min)后,吸取下清有机相至已称重的新管中,55℃水浴蒸干后称管重。每个样品重复3次。计算方法:总脂含量=(加入样品蒸干后的管重-加入样品前的管重)/藻粉重
1.2.8 杜氏盐藻β-胡萝卜素的提取及测定取10 mL藻液,4 000 r/min离心5 min。弃上清,在藻细胞沉淀中加入10 mL 80%丙酮溶液提取色素,萃取2-3次,至藻体呈灰白色。最后将萃取液定容到50 mL。用分光光度仪检测萃取液在450 nm处的吸光值,根据Jensen[21]公式换算出β-胡萝卜素含量。
β-胡萝卜素(mg/L)=(OD450×稀释倍数×10×103)/2 500
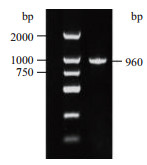
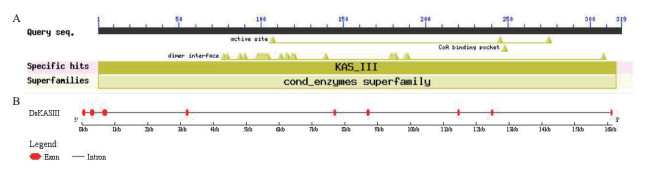
2 结果 2.1 杜氏盐藻DsKASⅢ基因的cDNA克隆与编码蛋白理化特征分析以杜氏盐藻SX-DS-01藻株的cDNA为模板,PCR扩增获得DsKASⅢ基因完整的开放阅读框(ORF),大小为960 bp(图 1),编码319个氨基酸。DsKASⅢ基因DNA序列长约16 kb,含有9个较短的外显子和8个较长的内含子(图 2-B)。保守结构域分析显示,DsKASⅢ蛋白在107 aa和244 aa处分别含有活性位点和辅酶A结合结构域,且含有众多二聚体结合点。该蛋白具有KASⅢ家族的典型特征(图 2-A),以二聚体形式发挥催化功能。DsKASⅢ蛋白相对分子量为33.29 kD,理论等电点(pI)为6.21。亚细胞定位预测该蛋白具有叶绿体转运肽,定位于质体。
|
| 图 1 杜氏盐藻KASⅢ基因PCR扩增产物的电泳图 |
|
| 图 2 DsKASⅢ蛋白的保守结构域(A)和基因结构(B) |
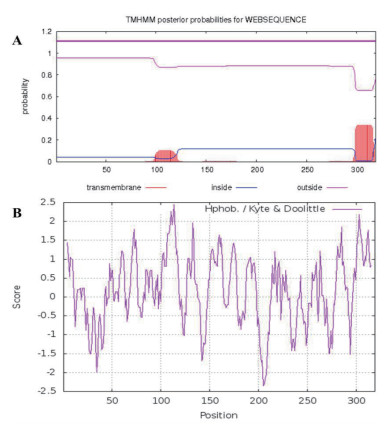
应用TMHMM分析蛋白跨膜结构域显示,DsKASⅢ蛋白中间部位(99-122 aa)和C末端(297-318 aa)在质体内膜上呈镶嵌状态。这种跨膜分布模式可能有助于该蛋白在催化脂肪酸合成过程从内膜上获取能量(图 3-A)。ProtScale分析DsKASⅢ蛋白疏水性/亲水性的结果(图 3-B)表明,该蛋白的C末端(279-291 aa和296-315 aa)和中间部分(101-119 aa,127-137 aa)均存在明显的疏水区,且位置大致和上述跨膜区相一致。这表明DsKASⅢ蛋白的中间区段可能主要结合并催化底物脂肪酰-ACP,而C末端可能负责将整个蛋白锚定在质体内膜上,对蛋白起一定的固定作用。
|
| 图 3 杜氏盐藻DsKASⅢ蛋白的跨膜结构域(A)和疏水结构域(B) |
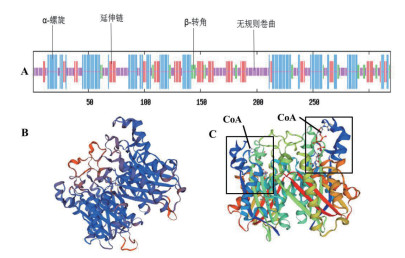
预测的DsKASⅢ蛋白二级结构主要包括ɑ-螺旋,β片层和无规则卷曲,分别为35.11%,25.71%和27.90%,而β-转角较少,仅为11.29%(图 4-A)。通过用PDB数据库中的大肠杆菌(E. coli)KASⅢ蛋白结构为模板(图 4-C),对DsKASⅢ蛋白进行同源建模发现,DsKASⅢ以同源二聚体形式存在,且均匀对称(图 4-B)。与E.coli KASⅢ不同,DsKASⅢ蛋白的外侧不存在辅酶A配体。E.coli KASⅢ和DsKASⅢ蛋白序列相似度为41.54%。
|
| 图 4 杜氏盐藻DsKASⅢ的二级结构(A)和三级结构(B) (注:C为大肠杆菌E.coli KASⅢ) |
利用MEGA 6.06软件对杜氏盐藻以及14个来源于其他植物的KASⅢ蛋白序列进行ClustalW多序列比对(图 5)。DsKASⅢ与原核大肠杆菌KASⅢ仅具有38%的序列相似性,而与真核衣藻KASⅢ的序列相似性高达57%。DsKASⅢ蛋白在第107位置为半胱氨酸(Cys),是KAS酶在脂肪酸循环过程中的酰化位点。DsKASⅢ还含有两个起催化作用的关键活性位点残基His244和Asn275。图 5还显示,KASⅢ蛋白在真核高等植物、微藻及细菌中的关键氨基酸(图 5红色框标注)是完全相同的,这表明尽管不同物种的KASⅢ蛋白序列差异较大,但在重要功能区,关键氨基酸则是高度保守的。这些位点在脂肪酸从头合成中发挥着至关重要的作用。
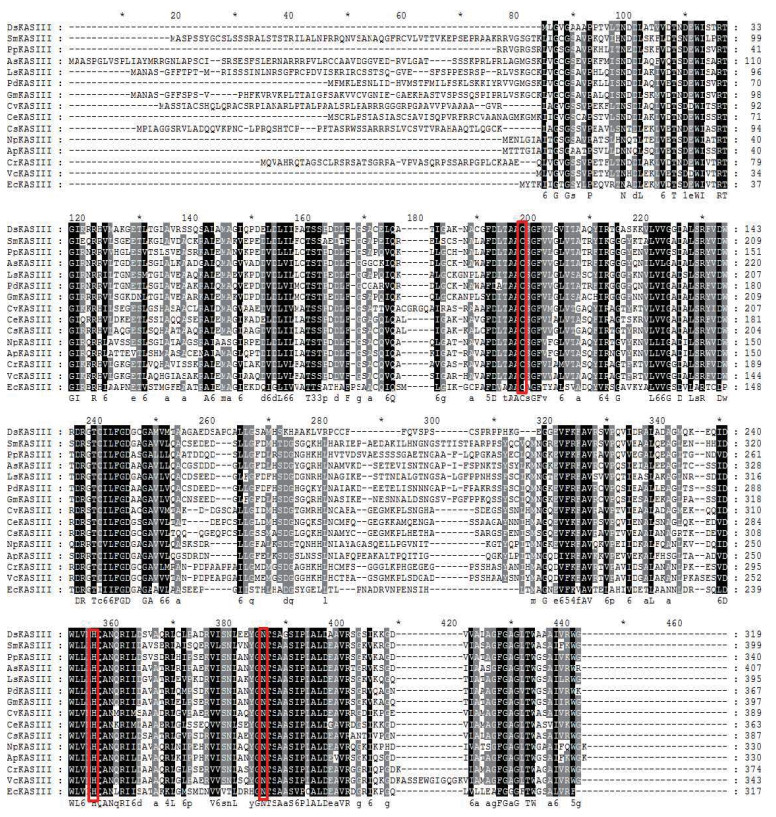
|
| 图 5 DsKASⅢ与其他物种KASⅢ的蛋白序列比对 |
采用邻接法(N-J法)对各物种KASⅢ蛋白构建系统发育树。结果(图 6)表明,杜氏盐藻DsKASⅢ蛋白与其他微藻的KASⅢ蛋白聚为一组,明显区别于高等植物组和原核组。尽管各物种KASⅢ可行使相同的功能,但在漫长进化过程中,原核类、真核微藻和真核高等植物KASⅢ蛋白亦产生了一定的结构和催化特性差异。在所检测的微藻中,DsKASⅢ和衣藻CeKASⅢ的同源关系最近,可能二者在进化过程中有着较近的祖先来源。
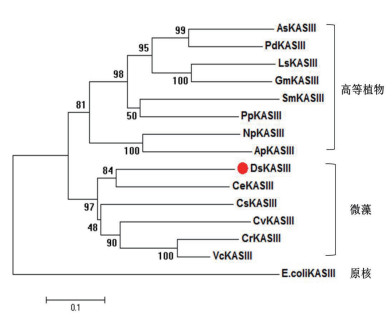
|
| 图 6 DsKASⅢ和其他物种KASⅢ蛋白的系统发育树 |
检测杜氏盐藻DsKASⅢ基因在正常培养(氮充足)与氮胁迫情况下的表达谱(图 7)显示,在正常培养和氮胁迫培养条件下,DsKASⅢ基因的表达均表现出先升高后降低的趋势,但在氮胁迫培养条件下DsKASⅢ表达量显著高于正常培养条件下的表达量。氮胁迫第3天时,DsKASⅢ表达量达峰值,比正常培养3 d的表达量提高了1.1倍。氮胁迫第3天DsKASⅢ表达量比第1天增加了72.94%。然而,DsKASⅢ在正常培养3 d的表达水平仅比1 d时提高了37.48%。氮胁迫培养第9天DsKASⅢ的表达量仍比正常培养第9天的表达量高1.39倍。总之,与正常培养相比,在氮胁迫培养前期,DsKASⅢ快速上调表达,培养后期表达量下降缓慢。
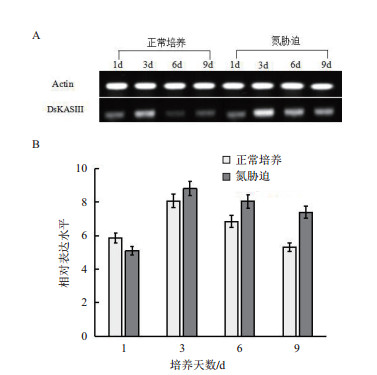
|
| 图 7 氮充足和氮胁迫培养条件下杜氏盐藻DsKASⅢ基因的表达分析(A:半定量PCR;B:qRT-PCR) |
取对数期生长的正常培养与氮胁迫培养的杜氏盐藻样品测试藻细胞总油脂含量(图 8-A)显示,与正常培养条件相比,氮胁迫培养的藻细胞总脂含量提高了49.05%。由图 8-B可知,氮胁迫能促进杜氏盐藻β-胡萝卜素的合成,β-胡萝卜素含量比正常培养藻细胞增加了33.20%。
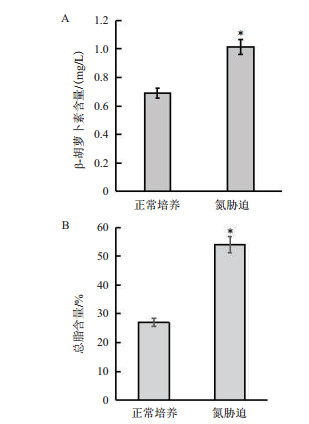
|
| 图 8 氮充足和氮胁迫培养条件下杜氏盐藻总脂和β-胡萝卜素的含量 |
杜氏盐藻及富油微藻是一类优异生物油脂资源[22],因其高效固碳、生长周期短、适应性强、容易大规模养殖等优点,正日益发展成为制备优质食用油脂及生物柴油等产业的原材料[23]。解析微藻油脂生物合成机制和建立提高微藻油脂积累的调控技术是微藻油脂商业化开发利用的关键任务之一。KASⅢ在脂肪酸合成第一步的缩合反应中催化乙酰-CoA和丙二酰-ACP生成乙酰乙酰-ACP。不少研究认为KASⅢ在脂肪酸生物合成起始反应中行使重要功能,是细胞油脂合成积累的限速酶之一[24]。研究表明,细菌、真菌、真核藻类和多种植物的KASⅢ蛋白在结构、作用底物及功能方面具有多样性。
本文分离鉴定了杜氏盐藻的DsKASⅢ基因并获得了杜氏盐藻中编码KASⅢ基因的cDNA序列全长。杜氏盐藻KASⅢ基因含有9个外显子,开放阅读框全长为960 bp,编码319个氨基酸,预测的等电点为6.21,分子量为33.3kD。DsKASⅢ蛋白具有叶绿体转运肽,定位于质体且镶嵌式锚定在叶绿体内膜上。DsKASⅢ以同源二聚体形式行使催化脂肪酸合成起始缩合反应的功能。DsKASⅢ蛋白与原核大肠杆菌EcKASⅢ蛋白不同,DsKASⅢ没有辅酶A配体。E.coli KASⅢ和DsKASⅢ蛋白序列相似度为41.54%,远高于不同细菌KASⅢ之间的相似度,如单黄胞菌(Xanthomonas oryzae)KASⅢ与大肠杆菌KASⅢ序列相似度仅为23.3%[25]。显然,不同物种之间KASⅢ蛋白序列差异性较大,其催化合成脂肪酸的方式和对底物的特异性结合也可能具有明显的差异[26]。DsKASⅢ蛋白含有3个起催化作用的关键活性位点残基Cys107,His244和Asn275。与DsKASⅢ这3个关键位点相一致的是,已有报道恶性疟原虫KASⅢ蛋白(PfKASⅢ)的催化中心也具有此类位点,分别为Cys159,His298和Asn328[27],进一步暗示这个基因编码DsKASⅢ蛋白。
杜氏盐藻DsKASⅢ基因在氮胁迫条件下第三天的表达量达到最高峰,比正常培养高1.1倍,表明氮胁迫明显诱导DsKASⅢ基因的上调表达。与之相似的是,氮胁迫可显著诱导杜氏盐藻DsFAD2基因的上调表达[28]。这些油脂合成相关基因的上调表达势必影响到藻细胞油脂的合成积累。总脂含量测定显示,氮胁迫条件下杜氏盐藻的总脂比对照提高了49.05%,且β-胡萝卜素含量也比对照增加了33.20%,可能DsKASⅢ基因的上调表达也促进了藻细胞油脂和β-胡萝卜素含量的升高。姚杰利用半连续缺氮方式培养的杜氏盐藻油脂含量比对照组提高了70.4%[29]。已有研究发现氮胁迫亦可诱导其他微藻大量合成积累油脂。例如,低氮(0.75g/L)培养的氮浓度下小球藻产油量明显升高,为标准氮浓度(1.5g/L)培养的藻细胞油脂含量的1.4倍[30]。Hu等[31]证明氮胁迫使杜氏盐藻细胞调整了N元素的代谢方向,叶绿素、蛋白等含氮化合物合成减少而糖含量增加,为脂类的合成积累提供了丰富的碳骨架,从而使油脂含量提高。这些研究结果表明,氮胁迫可显著上调藻细胞油脂的合成积累。孙辉等人发现氮元素的缺乏对杜氏盐藻合成β-胡萝卜素有促进作用[32],叶绿素是含氮的光合色素,而β-胡萝卜素是不含氮的色素。氮胁迫必然限制叶绿素的合成甚至降解。β-胡萝卜素的及时合成积累,可防护质体光合作用的进行[33]。亦有研究指出,油脂代谢产物为β-胡萝卜素的合成提供了起始原材料[32],这也许是在氮胁迫下,随着油脂合成升高,β-胡萝卜素积累增多的部分原因。进一步需要开展氮胁迫条件下杜氏盐藻多组学联合分析以期从分子水平上认识胁迫相应及代谢重构的分子机制。
4 结论本文分离获得了杜氏盐藻的DsKASⅢ基因,并系统解析了该酶蛋白的理化特性和在氮胁迫条件下DsKASⅢ基因表达谱及其对油脂和胡萝卜素积累的影响。杜氏盐藻KASⅢ基因含有9个外显子,ORF为960 bp,编码319个氨基酸。DsKASⅢ具有KASⅢ酶蛋白家族典型结构域,定位于叶绿体,以二聚体行使功能。缺氮胁迫诱导DsKASⅢ基因上调表达并促进盐藻细胞油脂和β-胡萝卜素的合成积累。本研究为全面解析微藻油脂和β-胡萝卜素合成调控机制以及后续应用基因工程策略提高杜氏盐藻目标化合物的富集等方面提供重要的科学依据。
| [1] |
梁秀芝, 刘成君, 彭峰, 等. 六种盐藻的营养成分[J]. 食品科技, 2007(1): 206-209. DOI:10.3969/j.issn.1005-9989.2007.01.062 |
| [2] |
宋程飞, 郝敬云, 程蔚兰, 等. 杜氏盐藻电击转化体系的优化, 山西农业大学学报:自然科学版, 2018, 38(3): 36-42[J]. 山西农业大学学报:自然科学版, 2018, 38(3): 36-42. |
| [3] |
汪本凡.杜氏盐藻纯化及生物学特性研究[D].安徽农业大学, 2004. http://cdmd.cnki.com.cn/Article/CDMD-10364-2004118223.htm
|
| [4] |
Lamers PP, Cc VDL, Kaasenbrood PS, et al. Carotenoid and fatty acid metabolism in light-stressed Dunaliella salina[J]. Biotechnology & Bioengineering, 2010, 106(4): 638-648. |
| [5] |
Rad FA, Aksoz N, Hejazi MA. Effect of salinity on cell growth and β-carotene production in Dunaliella sp. isolates from Urmia Lake in northwest of Iran[J]. African Journal of Biotechnology, 2011, 10(12): 2282-2289. |
| [6] |
朱松玲, 王怡洁. 盐度变化对杜氏盐藻的游离氨基酸和脂肪酸含量的影响[J]. 海洋科学, 2005(3): 8-11. DOI:10.3969/j.issn.1000-3096.2005.03.002 |
| [7] |
Ahmed RA, He M, Aftab RA, et al. Bioenergy application of Dunaliella salina SA 134 grown at various salinity levels for lipid production[J]. Sci Rep, 2017, 7(1): 8118. DOI:10.1038/s41598-017-07540-x |
| [8] |
Thakur, V. Biodiesel. An Alternative Method for Energy Crisis: A Review[J]. Journal of Biological and Chemical Chronicles 2, 2016, 14-26. |
| [9] |
Cho K, Hur SP, Lee CH, et al. Bioflocculation of the oceanic microalga Dunaliella salina, by the bloom-forming dinoflagellate Heterocapsa circularisquama, and its effect on biodiesel properties of the biomass[J]. Bioresour Technol, 2015, 202: 257-261. |
| [10] |
Chisti Y. Biodiesel from microalgae[J]. Biotechnol, 2007, Adv. 25(3), 294-306.
|
| [11] |
谷建勇. 藻类对动物的营养和保健作用[J]. 饲料与畜牧, 2002(4): 22-24. |
| [12] |
Garg S, Jin H, Yandeau-Nelson M, et al. Materials and methods for characterizing and using a 3-ketoacyl-acyl carrier protein(ACP)synthase Ⅲ(KASⅢ)for production of bi-functional fatty acids[J]. US20180051263[P], 2018. |
| [13] |
Fritzi M.Brück, Monika Brummel, Ricardo Schuch, et al. In-vitro evidence for feed-back regulation of β-ketoacyl-acyl carrier protein synthase Ⅲ in medium-chain fatty acid biosynthesis[J]. Planta, 1996, 198(2): 271-278. |
| [14] |
Dehesh K, Edwards P, Byrne J. Overexpression of 3-Ketoacyl-Acyl-Carrier Protein Synthase Ⅲs in Plants Reduces the Rate of Lipid Synthesis[J]. Plant Physiol, 2001, 125(2): 1103-1114. DOI:10.1104/pp.125.2.1103 |
| [15] |
Lai CY, Cronan JE. Beta-ketoacyl-acyl carrier protein synthase Ⅲ(FabH)is essential for bacterial fatty acid synthesis[J]. J Biol Chem, 2003, 278(51): 51494-51503. DOI:10.1074/jbc.M308638200 |
| [16] |
蒋桂雄.油桐种子转录组解析及油脂合成重要基因克隆[D].长沙: 中南林业科技大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10538-1015658963.htm
|
| [17] |
Li J, Li MR, Wu PZ, et al. Molecular cloning and expression analysis of a gene encoding a putative -ketoacyl-acyl carrier protein(ACP)synthase Ⅲ(KAS Ⅲ)from Jatropha curcas[J]. Tree Physiology, 2008, 28(6): 921-927. DOI:10.1093/treephys/28.6.921 |
| [18] |
González-Mellado D, Martínez-Force E. The role of beta-ketoacyl-acyl carrier protein synthase Ⅲ in the condensation steps of fatty acid biosynthesis in sunflower[J]. Planta, 2010, 231(6): 1277-1289. DOI:10.1007/s00425-010-1131-z |
| [19] |
Du X, Huang G, He S, et al. Resequencing of 243 diploid cotton accessions based on an updated A genome identifies the genetic basis of key agronomic traits[J]. Nature Genetics, 2018, 50(6): 796-802. DOI:10.1038/s41588-018-0116-x |
| [20] |
Polle JEW, Barry K, Cushman J, et al. Draft nuclear genome sequence of the halophilic and Beta-carotene-accumulating green Alga Dunaliella salina strain CCAP19/18[J]. Genome Announc, 2017, 5(43): e01105-e01117. |
| [21] |
Jensen A. Handbook of Phycological Metbods[M]. Cambridge Univ Press, 1978.
|
| [22] |
Díaz-Palma P, Stegen S, Queirolo F, et al. Biochemical profile of halophilous microalgae strains from high-andean extreme ecosystems(NE-Chile)using methodological validation approaches[J]. Journal of Bioscience & Bioengineering, 2012, 113(6): 730. |
| [23] |
Mogedas B, Casal C, Forján E, et al. beta-carotene production enhancement by UV-A radiation in Dunaliella bardawil cultivated in laboratory reactors[J]. Journal of Bioscience & Bioengineering, 2009, 108(1): 47-51. |
| [24] |
李璐, 梁倩, 安茜, 等. 紫苏β-酮脂酰ACP合成酶基因家族生物信息学分析[J]. 山西农业科学, 2017, 45(3): 321-324. DOI:10.3969/j.issn.1002-2481.2017.03.01 |
| [25] |
Li MJ, Li AQ, Xia H, et al. Cloning and sequence analysis of putative type Ⅱ fatty acid synthase genes from Arachis hypogaea L. J Biosci. 2009 Jun; 34(2): 227-38. PubMed PMID: 19550039.
|
| [26] |
Garg S, Yandeaunelson MD, Nikolau BJ. Substrate promiscuity of β-Ketoacyl ACP Synthase Ⅲ(KASⅢ): Understanding the structural basis for functional diversity of KASⅢ enzymes[J]. Biochemistry/Molecular Biology, 2013, 27(1): 1. |
| [27] |
Waters N, Kopydlowski K, Guszczynski T, et al. Functional characterization of the acyl carrier protein(PfACP)and beta-ketoacyl ACP synthase Ⅲ(PfKASⅢ)from Plasmodium falciparum[J]. Molecular & Biochemical Parasitology, 2002, 123(2): 85-94. |
| [28] |
宋亚楠, 安茜, 岳敏, 等. 杜氏盐藻DsFAD2基因的鉴定及缺氮胁迫下表达分析[J]. 山西农业大学学报:自然科学版, 2018, 38(3): 23-29. |
| [29] |
姚杰.基于油脂及其它高价值副产物导向的杜氏盐藻培养研究[D].武汉: 华中科技大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10487-1015905754.htm
|
| [30] |
程蔚兰, 邵雪梅, 宋程飞, 等. 氮胁迫对埃氏小球藻生长及油脂积累的影响[J]. 生物技术通报, 2017, 33(11): 160-165. |
| [31] |
Hu GR, Fan Y, Zhang L, et al. Enhanced lipid productivity and photosynthesis efficiency in a Desmodemus sp. Mutant induced by heavy carbon ions[J]. PLoS One, 2013, 8(4): e60700. DOI:10.1371/journal.pone.0060700 |
| [32] |
孙辉.盐藻的生长特性及逆境下β-胡萝卜素积累规律和机理研究[D].成都: 四川大学, 2005. http://cdmd.cnki.com.cn/Article/CDMD-10610-2005127292.htm
|
| [33] |
华汝成. 单细胞藻类的培养与利用[M]. 北京: 农业出版社, 1980: 87-88, 338-339.
|





