2. 石河子大学农学院,石河子 832003
2. College of Agronomy, Shihezi University, Shihezi 832003
甜瓜(Cucuumis melo L.)是葫芦科重要的经济作物之一,性别分化类型丰富,主要受两个基因控制——A基因和G基因[1, 2]。G基因(WIP1)抑制心皮发育导致雄花发育。研究表明,CmACS7在甜瓜完全花早期发育过程中引起雄蕊退化,产生雌雄异花同株和全雌系[2]。其中全雌系植株的产生是由于一个hAT转录因子家族的插入而引起的[1]。甜瓜性别分化是甜瓜单性材料育种的重要理论依据,而甜瓜单性花育种是培育新品种的重要目标之一。但是,通过传统表型选择方法筛选单性甜瓜材料,不仅要求丰富的经验而且耗费大量的人力、物力,而且甜瓜性别分化容易受多条件限制,培育优良单性品种需花费7-8年甚至十几年时间。因此,提高选择的效率和减少育种过程中的盲目性是育种工作的关键。
分子标记辅助选择(Marker-assisted selection,MAS)可以从分子水平快速准确地分析个体的遗传组成。前人甜瓜QTL主效基因的定位和克隆进行了较多的研究[5-8],但是应用到分子标记辅助选择育种过程中的标记较少。甜瓜性别分子标记研究较多[9-12],主要集中在控制雄全同株Cm-Acs-7(A基因)基因位点,张乔玲等[10]甜瓜纯合单性花材料与两性花材料在CmACS-7(A)基因缺失位点开发出了InDel-1标记,用于甜瓜性别早期选择。李凤梅等[11]建立了甜瓜单性花Cm-ACS7分子标记体系。前期研究主要集中在单性花基因Cm-ACS7上,对于共同筛选A、G基因的报道相对较少。
本研究利用已经克隆的甜瓜2个性别基因,设计分子标记,在苗期,利用A和G基因鉴定甜瓜的性别类型,可以大大缩短选择育种的年限,加速分子聚合育种的进程,为甜瓜其他性状的分子标记辅助育种提供方法。
1 材料与方法 1.1 材料甜瓜母本为WI998,厚皮网纹甜瓜,全雌系;父本为TopMark,厚皮网纹甜瓜,雄全同株,二者均来源于美国威斯康星大学瓜类遗传育种研究室。以单粒传的方式获得F8重组自交系群体,选择47个家系(以WT命名,按照顺序编号,每个家系种植12个单株)用于分子标记辅助选择,同时选择14份甜瓜材料为验证材料(表 1)。
选择甜瓜两片真叶展开时的新鲜叶片组织,利用CTAB法提取DNA,DNA浓度为15-50 ng/L。根据NCBI genbank(http://www.ncbi.nlm.nih.gov/)公布的甜瓜A基因(CmACS-7,ID:103492295)和G基因(WIP1+Gyno-hAT,ID:103491671)序列设计引物,CmACS-7转化Caps标记,命名为Cmacs7,引物序列为F:5' -CAGTGGC-ACCAGCAGTTA-3' ;R:5' -GGAAAGCGTATGATGA-AG-3' ,利用AluⅠ对其产物进行酶切。G基因位点设计2个引物,区分是否含有Gyno-hAT插入位点的引物Cmhat:F:5' -ATGGCAGACAGATTGTTATTAG-TG-3' ;R:5' -GAGTAGAAGGTACTCCAAATGAAT-GGC-3' ;区分G(g)位点杂合与纯合性引物Cms,F:5' -CGGTTCGGTCCAGTAACATT-3' ;R:5' -AGGGGGAAGAAAAAGGGATT-3' 。
PCR反应体系采用10×扩增缓冲液1 μL(MgCl2+)、dNTPs(1 mmol/L)0.2 μL、引物(5 pmol/L)2 μL、模板DNA(15-20 ng/μL)1 μL、Taq DNA聚合酶(1 U/μL)0.1 μL,ddH2O补至10 μL。
PCR扩增程序为94℃ 30 s;94℃ 30 s,50-68℃ 30 s,72℃ 40 s,25个循环;72℃ 5 min。扩增产物经8%聚丙烯酰胺凝胶电泳检测,拍照。Cmacs-7扩增产物在37℃下酶切3 h。
1.2.2 田间性状调查2013年、2014年及2018年分别种植验证材料及重组自交系群体,调查单株开花类型,记录植株性别:雌雄异花同株(雄花和雌花)、完全花植株(只着生完全花)、全雌株(只着生雌花)和雄全同株(雄花和完全花);2013年及2014年调查甜瓜重组自交系群体家系每个单株主蔓30节前所有雌花、雄花及完全花的开花率,验证性别表现;2018年调查植株开花类型;对DNA分子标记检测结果进行验证。
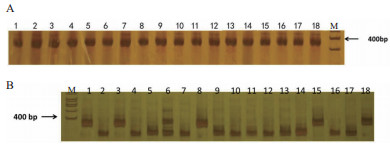
2 结果 2.1 CmACS-7基因位点检测结果分析利用CmACS-7标记对亲本、重组自交系群体及验证材料进行分析,所有供试材料在383 bp产生一个位点,经ALUⅠ酶切3 h后,酶切产物分为3种类型(图 1)。当PCR产物在383 bp被全部酶切,该位点所显示基因型为aa;当PCR产物不能被酶切时,该位点代表AA基因型,当酶切位点和PCR产物位点均有扩增条带时,代表基因型为Aa,呈杂合状态。
|
| 图 1 甜瓜CmACS-7扩增产物检测 A:甜瓜CmACS-7扩增产物;B:CmACS7 PCR产物酶切结果。M:marker;1:No.3-2-2(AAGG);2:TopMark(aaGG);3:WI998(AAgg);4:WI846(aaGG);5:7223H(aagg);6:No.3-2-2×TopMark-F1(AaGG);7:WI998×TopMark-F1(aaGG);8:WI998×No.3-2-2-F1(AAGg);9:ms5(aaGG);10:ms2(aaGG);11:1284(aaGG);12:1244(aaGG);13:绿皮甜瓜(aaGG);14:白皮甜瓜(aaGG);15:WT9(AAGG);16:WT31(aaGG);17:WT57(aagg);18:WT47(AAgg)。下同 |
利用NCBI公布的Gyno-hat序列与WIP1序列,设计2对引物,以期区分纯合位点与杂合位点,基因结构示意图与引物设计原则如图 2所示。由于插入3 kb GYno-hat序列,Cmhat引物扩增条带过大无法检测到,因此当Cmhat引物产生扩增条带(197 bp)时,说明该材料基因型为G,而该位点无产物则基因型为g;在gyno-hat共有序列WIP1连接处设计引物Cms,扩增产物在184 bp有条带时说明该位点为g,如果无扩增产物则为G。利用2对基因共同扩增待测DNA,即可检测G基因位点基因型。

|
| 图 2 Cmhat与Cms标记检测G位点结果 |
对甜瓜重组自交系群体的47个家系、3个F1及14个纯合品系进行分子标记的检测(表 2)。No.3-2-2和WI846为雌雄异花同株,与3年的田间鉴定结果相吻合,而且基因型纯合。WI998为全雌系,TopMark为雄全同株,与3年的田间检测结果吻合,基因型纯合。3个杂交组合F1代,分子检测结果和田间观察结果相同,基因型为杂合型。
对研究材料开展田间表型鉴定,以单株开花雌花、雄花及完全花的比率确定性别类型,61份材料中,59份材料基因型和表现型结果相互吻合,WT7-2为全雌株(表 2)。2013年田间检测为全雌株,2014年和2018年田间检测为雌雄异花同株;WT113基因型鉴定为雄全同株,2013年表型鉴定为雄全同株,2014年和2018年鉴定为雌雄异花同株;田间检测47个甜瓜重组自交系中19个家系为雌雄异花同株,4个家系为全雌株,24个家系雄全同株,1个家系株完全花株。分子标记选择效率为96.3%。结果表明,通过这两个分子标记能够分别鉴定基因纯合型和杂合型,并且能较为准确地鉴定甜瓜性别类型。
3 讨论DNA分子标记辅助选择是通过利用与目标性状紧密连锁的DNA分子标记对目标进行间接的选择,基因克隆技术和分子生物技术的飞速发展,使目的性状的选择越来越准确。通过分子标记的早期选择可以克服隐性基因识别难度的问题,并且能够区别基因纯合型及杂合型,从而提高育种效率,加速育种进程[13-15]。通常情况下,分子标记辅助选择是根据QTL找到与其紧密连锁的分子标记,通过标记进行筛选,瓜类作物一些重要的性状主效QTL的已经被报道[5, 16],这些瓜类性状紧密连锁的标记可直接用于分子标记辅助选择。但是分子生物信息学研究发现,即使与性状连锁距离小于1 cm,在连锁区域包含很多候选基因,而基因间的互作可能影响对目标性状鉴定的准确性。因此,通过获得目的基因序列,设计引物,能够更加直接有效地鉴定目的性状。
甜瓜性别基因的研究始终绕着甜瓜性别表达、甜瓜性别基因定位展开,直到2008年甜瓜性别基因A基因和G基因的克隆才为甜瓜性别类型的选择提供了重要的理论依据[1-2]。本研究根据已经克隆的A基因和G基因,设计引物,目的在于不仅能够鉴定甜瓜性别,而且还能区分基因纯合型及杂合型,可以直接用于甜瓜育种工作。本研究表明分子标记能够成功地鉴定甜瓜性别类型,而且杂合基因型也能够准确地鉴定。本研究中WT7-2和WT113基因型鉴定分别为全雌株和雄全同株,由于甜瓜的性别表现受到环境因素等多方面的影响,而且部分雌雄异花同株植株在花芽类型的开放顺序也不尽相同(有的早期大量开放雌花,后期开放雄花;有的早期大量开放雄花,后期开雌花),可能是造成田间性状统计结果不同的原因之一。
此外,本研究种植每个家系12个单株,统计平均值作为田间调查的依据对研究结果也存在一定影响。WT113分子基因型鉴定为雄全同株,2013年田间鉴定结果与分子鉴定结果相同,但是2014年和2018年田间表现均为雌雄异花同株,除了受到环境条件的影响之外,花器官发育相关基因的表达差异也是影响甜瓜性别表达的因素之一。研究者曾经对甜瓜不同性别转录组分析,挖掘甜瓜性别相关差异基因的研究中发现,花粉不育基因在雄全同株和雌雄异花同株中差异表达,WT113田间性状的变化及与分子鉴定结果的不同,也可能是通过环境变化诱导差异基因表达,形成不同植株类型。
4 结论利用已发表的甜瓜性别基因序列设计分子标记,在甜瓜苗期鉴定雄全同株、全雌株、雌雄异花同株及完全花株,并且能够区分鉴定基因杂合型位点。
| [1] |
Boualem A, Fergany M, Fernandez R, et al. A conserved mutation in an ethylene biosynthesis enzyme leads to andromonoecy in melons[J]. Science, 2008, 321(5890): 836-838. DOI:10.1126/science.1159023 |
| [2] |
Martin A, Troadec C, Boualem A, et al. A transposon-induced epigenetic change leads to sex determination in melon[J]. Nature, 2009, 461(7267): 1135-1138. DOI:10.1038/nature08498 |
| [3] |
叶振伟.甜瓜染色体片段置换系的初步构建及种子相关性状QTL分析[D].哈尔滨: 东北农业大学, 2017.
|
| [4] |
杨光华, 范荣, 杨小锋, 等. 甜瓜果实颜色3个质量性状基因的定位[J]. 园艺学报, 2014(5): 898-906. |
| [5] |
毕研飞, 徐兵划, 等. 分子标记辅助甜瓜抗蔓枯病基因的聚合及品种改良[J]. 中国农业科学, 2015, 48(3): 523-533. |
| [6] |
栾非时, 矫士琦, 盛云燕, 等. 甜瓜果实相关性状QTL分析[J]. 东北农业大学学报, 2017, 48(3): 1-9. |
| [7] |
杨旭辉, 华德平, 付金玉, 等. 甜瓜果肉颜色相关的分子标记开发和应用[J]. 西北植物学报, 2018, 38(4): 654-660. |
| [8] |
王学征, 邱果, 陈克农, 等. 基于BSA法开发CAPS标记定位甜瓜果面沟相关基因研究[J]. 东北农业大学学报, 2018, 45(9): 17-23. |
| [9] |
王吉明, 李楠楠, 尚建立, 等. 西瓜抗枯萎病种质资源的分子标记筛选研究[J]. 安徽农业科学, 2015(32): 200-202. DOI:10.3969/j.issn.0517-6611.2015.32.069 |
| [10] |
张乔玲, 华德平, 杨旭辉, 等. 甜瓜单性花共显性分子标记的开发及应用[J]. 分子植物育种, 2018, 8: 1-9. |
| [11] |
李凤梅, 张洪亮, 崔健, 等. 甜瓜单性花相关基因CmACS-7的分子标记开发与应用[J]. 分子植物育种, 2018, 16(14): 4715-4720. |
| [12] |
赵玉龙.甜瓜橙色果肉、全雌系及主要抗病性状MAS的建立与评价[D].哈尔滨: 东北农业大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10224-1017144375.htm
|
| [13] |
龚浩, 罗剑宁, 罗少波, 等. 黄瓜与甜瓜的性别决定分子机制研究进展[J]. 园艺学报, 2014, 41(2): 382-388. DOI:10.3969/j.issn.0513-353X.2014.02.021 |
| [14] |
王亚琦, 孙子淇, 郑峥, 等. 作物分子标记辅助选择育种的现状与展望[J]. 江苏农业科学, 2018, 46(5): 6-12. |
| [15] |
Wang YH, Wu DH, Huang JH, et al. Mapping quantitative trait loci for fruit traits and powdery mildew resistance in melon(Cucumis melo)[J]. Botanical Studies, 2016, 57(1): 19. DOI:10.1186/s40529-016-0130-1 |
| [16] |
侯艳.甜瓜SNP-CAPS标记的开发与主要果实性状QTL分析[D].哈尔滨: 东北农业大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10224-1017144503.htm
|
| [17] |
景丹龙, 郭启高, 陈薇薇, 等. 被子植物花器官发育的模型演变和分子调控[J]. 植物生理学报, 2018, 54(3): 355-362. |
| [18] |
盛云燕, 王霞, 王洋洋, 等. 甜瓜花器官发育相关基因的电子克隆及表达分析[J]. 园艺学报, 2014, 41(2): 349-356. DOI:10.3969/j.issn.0513-353X.2014.02.017 |