2. 内蒙古科技大学图书馆,包头 014010
2. The Library in Inner Mongolia University of Science & Technology, Baotou 014010
自然界中,为了抵御外界病原体的入侵,无脊椎动物发育形成了一套完整的先天免疫防御系统。其中,多巴脱羧酶作为无脊椎动物先天免疫应答中的一种关键酶,不仅参与免疫系统的调节,同时,它催化生成的多巴胺等神经递质在神经内分泌系统中也起到了重要作用,是研究无脊椎动物神经内分泌免疫系统的理想材料。多巴脱羧酶在自然界中广泛存在,针对多巴脱羧酶展开的研究也十分丰富,然而,基于此国内外对淡水小龙虾多巴脱羧酶的文献报道还是十分稀少,这对我们深入探索小龙虾的神经内分泌免疫系统造成了困难。在我国,淡水小龙虾(Procambarus clarkii)属于甲壳类动物,是一种重要的水产经济虾类,因其肉质鲜美、营养丰富而深受大众的喜爱。近些年来,淡水小龙虾因受到病原菌的感染,进而导致其养殖产量下降。细菌性疾病是淡水小龙虾的主要病因,因此探究小龙虾抵御细菌的免疫机制是目前亟待解决的重要科学问题。而小龙虾多巴脱羧酶的研究可以进一步为其神经内分泌免疫系统的探索提供科学依据,也为无脊椎动物多巴脱羧酶的研究作出重要补充。
1 神经内分泌免疫系统一直以来,在先天免疫领域研究的免疫学问题,从整体研究免疫系统与神经内分泌系统的相互作用在无脊椎动物中并不多见。神经系统、内分泌系统和免疫系统组成的神经内分泌免疫(Neuro-endocrine-immune regulatory system,NEI)系统是一个协调统一的整体[1]。它参与的信号识别、信号转导、免疫应答等相关生物学过程,在维持生物体的内环境稳态、增强环境适应性、提高免疫力方面发挥着重要的作用。近几十年,科研工作者为探索无脊椎动物整个免疫系统中不同基因之间的协调作用,进行了大量的实验研究。例如,刘晓玲等[2]对栉孔扇贝的Foxl 2蛋白进行了原核表达、纯化及多克隆抗体制备;在长牡蛎中RIG-I样受体(RIG-I like receptors,RLRs)识别并结合病毒后,通过与线粒体膜上的VISA蛋白结合,最终激活转录因子NF-κB和IRF3/7等,启动免疫反应[3];通过研究多肽对凡纳滨对虾生长、消化酶和免疫酶活力的影响,证明了添加合适比例的多肽可提高对虾生长率,加强对虾的免疫能力[4]。越来越多的实验结果表明,今后对NEI系统的探索将引领我们在生命科学的道路上走得更远。
在脊椎动物中,神经内分泌免疫调节是由下丘脑、垂体和内分泌腺组成的整体[5]。研究表明,高等脊椎动物神经系统调节免疫系统主要分为以下4个步骤:机体受到外界的刺激后,充分激活免疫应答;神经元会被一些细胞因子刺激,释放神经递质;神经递质一方面参与免疫应答,另一方面将信号传入中枢神经系统;当免疫反应达到阈值时,中枢神经系统会分泌神经递质和激素下调免疫,终止免疫应答。自从1955年首次报道证明了下丘脑和垂体的内在联系,近年来关于脊椎动物NEI系统的探索逐步增多。科学家们对NEI系统的基础研究越丰富,越有助于我们探究它的分子作用机制。已有研究证明:免疫细胞的产物能够影响中枢神经系统的功能、激素的分泌、神经性疾病的发生和内分泌系统的紊乱。反之,激素或神经递质也能够直接调控免疫细胞的功能、炎症反应的结果以及自免疫病和感染性疾病的发生[6]。
自然界中,低等生物与高等生物的进化大部分都遵循着相同的法则。因而,在进化的过程中也有许多保守的细胞因子及作用机制会一直沿用至今。研究发现,无脊椎动物的神经内分泌系统在结构组成上相对简单,它们拥有与脊椎动物类似甚至相同的免疫效应分子。包括阿黑皮素原(Pro-opiomelanocortin,POMC)、细胞因子(肿瘤坏死因子TNF、白细胞介素IL)、促肾上腺皮质激素(Adrenocorticotropic hormone,ACTH)等。此外,本实验室已进行的小龙虾转录组测序结果分析显示,其具有白介素增强子的结合因子和肿瘤坏死因子受体相关的因子,也具有与肿瘤形成相关的Wnt信号通路的多种重要成分[7]。功能研究证明,它们与高等动物中的同源分子相同,都具有参与免疫调控和神经内分泌的作用。这证明了在无脊椎动物中,免疫系统的正常工作也是通过神经内分泌系统的有效调节来调控的。例如,在软体动物中,NO系统能够抑制血淋巴细胞的凋亡,增强血细胞的吞噬能力并提升血淋巴上清的抗菌活性[8]。
无脊椎动物在自然界中分布广泛,说明其具有极强的环境适应能力,而这与NEI系统的调控密不可分。深入了解其神经内分泌免疫系统的特性,对于全面认识无脊椎动物乃至整个生物界免疫系统的组成和分子机制都具有重要意义。近十几年来,对于无脊椎动物NEI系统的关注越来越高。尤其是在软体动物中,蒋秋芬[9]指出,免疫刺激下,贝类儿茶酚胺能系统通过NE-α/β-AR-cAMP/Ca2+途径调控NO系统的活性水平;有研究发现,去甲肾上腺素可能通过与特定的血细胞受体作用,抑制海鞘血细胞NO的生成[10]。虽然对于无脊椎动物NEI系统的研究起步较晚,但经过科研工作者们的不断努力,目前,在软体动物中,已经先后鉴定到了儿茶酚胺系统、胆碱系统、脑啡肽系统、NO系统和氨基酸系统等NEI系统。
在众多的NEI系统中,儿茶酚胺(Catecholami-nes,CAs)系统是NEI系统的典型代表之一。生物体内具有活性的儿茶酚胺包括多巴胺(Dopamine,DA)、去甲肾上腺素(Norepinephrine,noradrenaline,NE)和肾上腺素(Epinephrine,adrenalin,E)[11]。经过本实验室研究结果证明,在小龙虾儿茶酚胺生成代谢通路中(图 1),多巴脱羧酶(Dopa decarbo-xylase,DDC)是催化生成多巴胺的关键酶,它直接调控DA等神经递质的表达水平,间接影响神经内分泌系统的调节。除此之外,DDC也参与了小龙虾等无脊椎动物的先天免疫应答,具有重要的研究价值和意义。
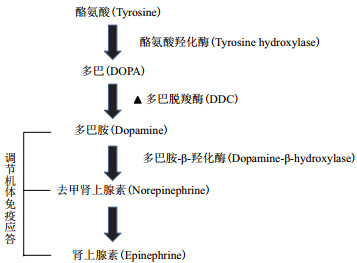
|
| 图 1 无脊椎动物儿茶酚胺生成代谢通路 |
长久以来,科学家们苦于NEI系统的结构组成过于复杂,囊括免疫、神经和内分泌系统。在摸索这三者之间的联系时,有时候耗时耗力也无法做到完整的阐述。为了解决这一难题,我们提出一个取巧的办法:寻找,探索一种在NEI系统中起连接作用的关键因子,如多巴脱羧酶。DDC作为无脊椎动物先天免疫系统中的一个重要成员,在发挥免疫防御功能上有着关键作用,具有潜在的研究意义。其次,无论是在高等动物还是低等动物中,DDC既是免疫应答的重要组成部分,也是神经内分泌系统的重要参与者,是我们探索无脊椎动物NEI系统的一把“新钥匙”。
2.1 多巴脱羧酶的研究现状多巴脱羧酶也被称为色氨酸脱羧酶(Tryptophane decarboxylase,AAD),对芳香族左旋氨基酸具有强烈脱羧作用。它最早发现于高等动物的肾组织,能起到促进肾上腺素合成的作用。DDC在生物体内分布较广,参与各种各样的生物学过程并发挥着关键作用。如在哺乳动物[12]中,人们发现DDC是黑色素合成途径中重要的酶。在昆虫[13]中,DDC能够调控昆虫的生长发育过程。在植物[14]中,DDC还能合成芳香生物碱,该物质是药物活性分子的前体物质。除此之外,DDC也是某些微量氨基酸合成过程中的限速酶,在内源性中枢神经递质生成中起重要作用,该酶可分别催化L-多巴和L-五羟色胺酸合成DA和五羟色胺(5-hydroxytryptamine,5-HT)。
迄今为止,科学家们对于DDC的探索大多数集中在脊椎动物这类高等动物中:张缘缘[15]等对人源DDC进行了表达、纯化以及高通量抑制剂筛选模型的建立;崔婷等[16]研究了DDC异常表达对大鼠抑郁行为的影响。而在低等无脊椎动物中,针对DDC的研究也尚未深入:徐秋雯[17]研究了虫酰肼及Methoprene对亚洲玉米螟幼虫DDC基因表达的影响;汪慧娟等[18]对异色瓢虫DDC基因序列进行了低温诱导表达分析。与此相对比,小龙虾多巴脱羧酶的研究还没有文献报道,甚至连基础性的基因克隆与蛋白纯化的研究也不是很多,是无脊椎动物DDC领域研究的一块空白。因此,探索小龙虾DDC的功能活性与理化性质是必要的。
2.2 多巴脱羧酶的分子结构为了摸索小龙虾DDC蛋白的功能活性,研究DDC的分子结构是十分重要的。关于小龙虾DDC蛋白的分子结构的文章至今未曾有人报道,我们只能借鉴无脊椎动物,如昆虫DDC蛋白的相关文献进行后续实验探索。
DDC属于转氨酶的α-家族,是一个结合磷酸吡哆醛(Pyridoxine phosphate,PLP)的二聚体分子,分子量约为50 kD[19]。科学研究证明,它的生物学机制大部分是通过其辅因子PLP来进行多种生物学反应,包括脱羧反应、脱氨基作用,半氨基转移以及环化反应。目前,人源DDC蛋白的分子结构已经被阐明[20]。结果表明,DDC整体结构显示了该酶的组织活性位点,以典型的折叠式磷酸吡哆醛结合酶的方式排列。
在昆虫中,科学家以斜纹夜蛾为研究材料,对斜纹夜蛾多巴脱羧酶基因的DNA序列及其编码的蛋白质序列进行了生物学分析[21]。得出以下结果:无脊椎动物的DDC氨基酸序列具有极高的同源性。通过SWISS-MODEL在线工具进行建模,预测DDC三维结构(图 2)。证明了斜纹夜蛾与果蝇属的多巴脱羧酶空间结构高度相似,这对我们探索小龙虾DDC的分子结构打开思路。可以猜想,小龙虾DDC的功能结构域或许也比较保守。

|
| 图 2 SWISS-MODEL预测的斜纹夜蛾DDC三维结构 |
DDC的作用主要在于引发脱羧反应,反应底物包括大部分芳香族氨基酸及α-甲基衍生物,甚至它可以在多种催化反应中调节底物或产物的浓度水平。科研工作者认为,它的这种催化机理主要取决于PLP的相关反应(图 3)[22]。

|
| 图 3 DDC催化的L-芳香族氨基酸脱羧反应 |
从DDC的催化机理流程图可以看出,它催化L-多巴生成DA的过程大致分为4步:第1步,以PLP和Lys-303氨基酸残基结合,形成内部醛亚胺结构;第2步,结合L-多巴后,从内部醛亚胺结构转化为外部醛亚胺;第3步,脱羧反应形成中间体——醌;第4步,醌在α-碳原子上被质子化,形成DA。DDC的催化机制大致上都可以遵循这四步过程,区别只在于底物的不同。目前,DDC的催化机理已研究得较为透彻。例如,在人、猪[23]和昆虫中[24]。
2.4 多巴脱羧酶与无脊椎动物先天免疫系统在无脊椎动物中,DDC主要参与先天性免疫应答。例如,它是黑色素合成过程中一种重要的酶。对于昆虫而言,黑色素是杀菌的重要组成部分。除此之外,DDC也参与无脊椎动物表皮形成过程中的骨化、先天性免疫的吞噬及黑化作用[25],并与昆虫蜕皮过程相关[26]。
2.4.1 与表皮形成相关表皮或者外壳在无脊椎动物先天免疫系统中十分重要,它们能够非特异性的阻挡一些外界刺激所带来的危害。作为免疫系统最外层的体表屏障,表皮的好坏、是否完整对病原菌的入侵直接相关。对于昆虫这类无脊椎动物来说,DDC与表皮的形成息息相关。昆虫表皮细胞能够吸收血淋巴中的多巴,经DDC的催化反应后进一步转化为DA。表皮细胞中转化而来的DA被转运到表皮黑色素前体微粒中,在酚氧化酶的作用下转化为黑色素[27]。除此之外,昆虫的蜕皮过程也有DDC的参与。蜕皮激素(Molting hormone,MH)作用于昆虫表皮细胞后,首先刺激蜕皮时相关酶类的合成,促使蛋白受体结合到蜕皮激素,转录后诱导细胞内DDC的合成,从而开启表皮的鞣化和硬化[28]。由此看出,DDC的正常运行,能促使无脊椎动物进行更好的免疫应答,从而大大提高其在恶劣环境中的生存效率。
2.4.2 与黑化反应相关此外,有研究证明DDC主要参与无脊椎动物的黑化反应。无脊椎动物的先天性免疫应答主要依赖于血细胞,包括吞噬作用、结瘤、黑化作用等。Sideri等[29]研究表明,昆虫的吞噬、黑化和骨化作用都可能依赖于DDC的活性。DDC是黑化作用过程中不可或缺的酶之一,它催化合成的神经递质DA和5-HT均参与昆虫伤口愈合、抵抗寄生虫、表皮硬化等过程。Nappi等[30]通过一个DDC缺陷的果蝇突变体首次证明了DA氧化途径参与黑色素的免疫反应。从化学反应的原理来说,黑色素是由连续的几个氧化反应过程组成的,期间会产生多个中间代谢产物。其中一些由二酚衍生成的醌类物质具有细胞毒性,它们能够抑制某些类型的DNA聚合酶的活性,对病原菌具有毒杀作用[31]。另一方面,Paskewitz等[32]将冈比亚按蚊DDC基因沉默后,发现其黑化作用明显减少。这些现象说明,多巴脱羧酶除了可以调控黑色素的产生,在受到病原体侵染的时候,它也可以直接发挥先天免疫活性。
3 多巴胺能神经内分泌系统有研究发现,以DA为代表的多巴胺能神经内分泌系统能够反向调控DA等神经递质及激素类物质的表达水平,从而达到调控免疫系统的目的。然而,无脊椎动物神经系统的结构与功能在不同种属的动物中,差异较大。以果蝇以及飞蝗为代表的昆虫,其神经系统主要由3部分组成,包括中枢神经系统、交感神经系统和外周神经系统。除此之外,甲壳类动物的内分泌系统则主要分为神经内分泌系统和非神经内分泌系统,神经内分泌系统与甲壳动物的生殖、发育、免疫防御等过程密切相关。其中,DDC参与了L-多巴向DA的转变,L-五羟色氨酸向5-HT的转变及L-色氨酸向色氨酸的转变。尽管从分子机制来说,DDC不是上述任一神经递质合成中的限速酶,但是其对三者翻译前后水平均起着调控作用[33]。综合近几年的文献,我们发现了DDC与DA在NEI系统中起到连接免疫系统与神经内分泌系统的作用,两者缺一不可又协调互作,是一个完整的“团队”。基于此,深入研究多巴胺能神经内分泌系统,能更好地帮助人们探索无脊椎动物NEI系统。
3.1 儿茶酚胺系统儿茶酚胺系统是已发现的一种典型的NEI系统,主要通过不同的CAs来协调机体的生长发育。从分子结构角度阐述,CAs是指含有邻苯二酚基本结构的胺类,它包含了DA为代表的一系列生物胺能神经内分泌系统。科学研究表明,CAs不仅是交感和中枢神经系统中的神经递质和神经调质,也是肾上腺髓质所分泌的激素。它能够在生物体内起到信号传递的作用,影响机体的免疫应答过程。儿茶酚胺生成代谢通路是一连串的酶催化反应过程,各种各样的酶在这之中起到主导作用。抑制某些酶的生物学活性甚至会阻断整个通路,而DDC是一个连接上下游通路的关键酶,它能直观的调控CAs的表达量。调查显示,在某些神经内分泌细胞中,儿茶酚胺在生物体内能够调控转录因子的表达(图 4)。
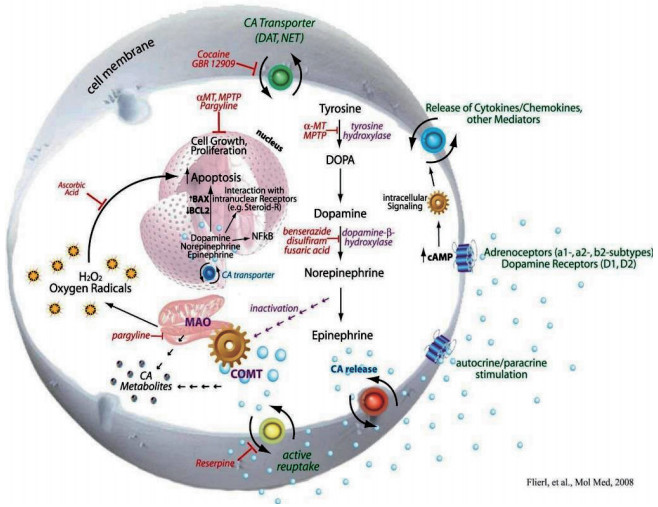
|
| 图 4 软体动物免疫细胞中完整的儿茶酚胺通路 |
生物体的免疫系统十分复杂,至今为止,科学家们对免疫系统的作用机理还未探索完全。对于免疫细胞内合成的内源性CAs,已经有研究证明它在多种生物学过程中起作用。内源性CAs不仅可以调节细胞的增殖与分化,甚至可以调控细胞的凋亡过程。它的作用机制和免疫细胞上的受体相关,CAs通过自分泌或旁分泌的形式释放到细胞中,最终结合免疫细胞上的受体,改变细胞内环磷酸腺苷(Cyclic AMP,cAMP)的浓度,以此达到免疫调节的目的。然而在无脊椎动物中,对于儿茶酚胺系统关键成分的研究并不多,只有少量的在果蝇、库蚊[34]、牡蛎[35]和扇贝[36]等几个物种中有所报道。
3.2 多巴胺多巴脱羧酶催化生成的多巴胺(Dopamine,DA)是一种代表性的儿茶酚胺类神经递质,它的化学式全名叫4-(2-乙胺基)苯-1,2-二酚。1910年,George Barger和James Ewens首次在英国伦敦Wellcome实验室合成得到DA[37]。由此,科学家们展开了对DA的大量探索与研究。已有的实验结果表明:DA的作用机制也是通过特异性结合细胞膜上受体,调节二级信使的浓度以达到调控机体的目的。多巴胺受体(Dopamine receptor,DAR)是一类具有七次跨膜结构域的GTP结合蛋白偶联受体(Gprotein-coupled receptors)。1979年,Kebabian[38]和Calne根据多巴胺受体对腺苷酸环化酶(Adenylcyclase,AC)活性的抑制或促进作用,将多巴胺受体分为D1和D2两种亚型。
其中,D1亚型的多巴胺受体主要通过与Gs蛋白偶联结合,增强AC活性,促使二级信使环磷酸腺苷(Cyclic adenosine monophosphate,cAMP)浓度上升,调控免疫系统;而与此相反的是,D2亚型的多巴胺受体会偶联Gαi蛋白,达到抑制AC活性的目的,下调cAMP的浓度[39]。DA与DAR之间的相互作用机制,进一步促进了对NEI系统的探索。
3.3 多巴胺及其受体在神经内分泌系统中的作用多巴胺能神经内分泌系统的正常运行离不开DA、DAR和DDC的参与和调控。在高等动物中,DA主要在脑细胞和肾上腺细胞中合成,以行使神经递质的功能为主。它是情绪、注意力甚至记忆力的调节器,涉及生物体对环境胁迫的长期适应过程。不同的多巴胺受体介导不同的细胞因子的分泌。如D3型受体能介导TNFα的分泌,而单独运作的D2型受体或者D1型受体和D5型受体协同作用,可以介导IL-10的分泌[40]。其次,有研究者发现,DA也是生物体内的局部化学信使。类比其他的激素类物质,DA也可以调控生物体体内某些生物学反应过程。如在肾脏中,DA可以促进钠和尿素的排泄[41];在血管中,DA对去甲肾上腺素起抑制作用,并促使血管扩张[42];在消化道中,它可以减缓肠胃的蠕动,从而达到保护肠黏膜的作用[43]。总而言之,DA作为一种神经递质或局部化学信使,能够对机体行为、心脑血管功能、内分泌及次级淋巴组织进行免疫调节。
在无脊椎动物中,DA除了有上述作用外,对细胞的吞噬功能也会产生影响,与脊椎动物相比这一点尤为显著。竹攸汀[44]认为CpG寡脱氧核苷酸(Oligodeoxynucleotide)能通过激活PKC信号通路引起酚氧化酶(Phenoloxidase,PO)的激活,而酪氨酸激酶通路则反向调控PO激活。Wenisch等[45]发现,高剂量的DA能够显著抑制细胞对细菌的吞噬能力和自由基的释放。由此可知,DA作为酪氨酸激酶通路中的组成部分,对无脊椎动物NEI系统的免疫调控发挥着重要作用。
4 展望综合以上的文献调查内容,可以看出,无脊椎动物的神经内分泌免疫复合系统具有与高等脊椎动物一样的结构基础,其在神经信号的传递与免疫调控方面协同地发挥着作用,而多巴脱羧酶与多巴胺在无脊椎动物的NEI系统中是十分重要的组成部分。目前,这个看似简单的NEI系统仅在栉孔扇贝、锯缘青蟹、中国明对虾、斑节对虾、凡纳滨对虾、长牡蛎和东亚飞蝗等几个物种中进行了相关研究,淡水小龙虾的神经内分泌免疫复合系统还没有得到科研工作者的重视和研究。除此之外,多巴脱羧酶在小龙虾NEI系统中的作用机理,没有得到充分的探索,仅仅是做了一些基因表达与黑化反应调控方面的工作。因此,我们以淡水小龙虾多巴脱羧酶作为研究对象,在基因克隆、重组表达、亲和纯化及抗体制备等研究内容的基础上,希望深入探索多巴脱羧酶发挥先天免疫作用的分子机制。揭示DDC作为神经系统重要调节分子与免疫调节分子协同作用的双重身份。
| [1] |
刘兆群.长牡蛎神经内分泌免疫系统调节机制的初步研究[D].北京: 中国科学院大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-80068-1017099446.htm
|
| [2] |
刘晓玲, 王振东, 孙涵甜, 等. 栉孔扇贝Foxl2蛋白的原核表达、纯化及多克隆抗体制备与检测[J]. 海洋渔业, 2018, 40(4): 447-453. DOI:10.3969/j.issn.1004-2490.2018.04.007 |
| [3] |
黄宝玉.长牡蛎RLR抗病毒天然免疫信号通路关键基因的功能研究[D].北京: 中国科学院大学, 2015. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2956614
|
| [4] |
廖栩峥, 陈金荣, 刘永胜, 等. 多肽对凡纳滨对虾生长、消化酶和免疫酶活力的影响[J]. 浙江海洋大学学报:自然科学版, 2018, 37(4): 308-312. |
| [5] |
Webster JI, Tonelli L, Sternbere EM. Neuroendocrine regulation of immunity[J]. Annu Rev Immunol, 2002, 20: 125-163. DOI:10.1146/annurev.immunol.20.082401.104914 |
| [6] |
Bilbo SD, Klein SL. Special Issue:the neuroendocrine-immune axis in health and disease[J]. Horm Behav, 2012, 62: 187-190. DOI:10.1016/j.yhbeh.2012.06.005 |
| [7] |
Du Z, Jin Y, Ren D. In-depth comparative transcriptome analysis of intestines of red swamp crayfish, Procambarus clarkii, infected with WSSV[J]. Sci Rep, 2016, 6: 26780. DOI:10.1038/srep26780 |
| [8] |
Jiang Q, Zhou Z, Wang L, et al. A scallop nitric oxide synthase(NOS)with structure similar to neuronal NOS and its involvement in the immune defense[J]. PLoS One 8, 2013, e69158. |
| [9] |
蒋秋芬.贝类NO系统及其在神经内分泌免疫调节网络中的作用机制研究[D].北京: 中国科学院大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-80068-1013299927.htm
|
| [10] |
Cintia M. De B, Andessa D, et al. Norepinephrine depresses the nitric oxide production in the ascidian hemocytes[J]. Journal of Invertebrate Pathology, 2012, 111(2): 182-185. DOI:10.1016/j.jip.2012.07.002 |
| [11] |
郑胜辉.儿茶酚胺代谢途径在蝙蝠冬眠中的分子变化机制[D].上海: 华东师范大学, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10269-1018821723.htm
|
| [12] |
宋巧娟, 奚耕思, 贾艺舒, 等. 多巴脱羧酶及其与神经类疾病的关联性研究进展[J]. 现代生物医学进展, 2017, 17(8): 1595-1600. |
| [13] |
Nagy L, Hinipi L. Role of tyrosine, DOPA and decarboxylase enzymes in the synthesis of monoamines in the brain of the locust[J]. Neurochemistry International, 2002, 41: 9-16. DOI:10.1016/S0197-0186(01)00141-3 |
| [14] |
Facchini PJ, Huber-allanach KL, Tari LW. Plant aromatic L-aminoacid decarboxylases:evolution, biochemistry, regulation, and metabolic engineering applications[J]. Phytochemistry, 2000, 54(2): 121-138. |
| [15] |
张缘缘, 邱军强, 周越洋, 等. 人源多巴脱羧酶的表达、纯化以及高通量抑制剂筛选模型的建立[J]. 生物学杂志, 2014, 31(6): 6-10. DOI:10.3969/j.issn.2095-1736.2014.06.006 |
| [16] |
崔婷, 谢炜, 伏萧燕, 等. CUS致大鼠抑郁行为涉及TPH2、DDC及MAO-A异常表达的实验研究[J]. 中国药理学通报, 2016, 32(12): 1677-1683. DOI:10.3969/j.issn.1001-1978.2016.12.009 |
| [17] |
徐秋雯.亚致死浓度虫酰肼及Methoprene对亚洲玉米螟幼虫多巴脱羧酶基因表达的影响[D].扬州: 扬州大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-11117-1017238833.htm
|
| [18] |
汪慧娟, 施佐堃, 徐风娇, 等. 异色瓢虫多巴脱羧酶基因序列及低温诱导表达分析[J]. 环境昆虫学报, 2016, 38(2): 271-279. |
| [19] |
Mariarita B. Mammalian dopa decarboxylase:Structure, catalytic activity and inhibition[J]. Archives of Biochemistry and Biophysics, 2014, 546: 1-7. DOI:10.1016/j.abb.2013.12.020 |
| [20] |
Giardina G, Montioli R, Gianni S, et al. Open conformation of human DOPA decarboxylase reveals the mechanicsm of PLP addition to group Ⅱ decarboxylases[J]. Proceedings of the National Academy of sciences, 2011, 108(51): 20514-20519. DOI:10.1073/pnas.1111456108 |
| [21] |
张文慧.虫酰肼对斜纹夜蛾幼虫多巴脱羧酶基因表达的影响[D].泰安: 山东农业大学, 2014. http://www.cnki.com.cn/Article/CJFDTotal-ZNYK201408007.htm
|
| [22] |
Burkhard P, Dominici P, Borri-voltattorni C, et al. Structural insight into Parkinson's disease treatment from drug-inhibited DOPA decarboxylase[J]. Nature Structural Biology, 2001, 8: 963-967. DOI:10.1038/nsb1101-963 |
| [23] |
Votattorni CB, Minelli A, Dominici P. Interaction of aromatic amino acids in D-and L-forms with 3, 4-dihydroxyphenylalanine decarboxylase from pig kidney[J]. Biochemistry, 1983, 22(9): 2249-2254. DOI:10.1021/bi00278a030 |
| [24] |
宋巧娟.多巴脱羧酶(DDC)对拟黑多刺蚁生长发育的调控及其与蜕皮激素受体(EcR)和雌激素相关受体(ERR)关联性研究[D].西安: 陕西师范大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10718-1018056778.htm
|
| [25] |
杨松. 昆虫黑化反应的分子机制研究进展[J]. 国外医学(寄生虫病分册), 2003(4): 164-168. DOI:10.3760/cma.j.issn.1673-4122.2003.04.005 |
| [26] |
王梅仙.昆虫几个蜕皮相关酶的表达和功能分析[D].杭州: 浙江大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10335-1015643553.htm
|
| [27] |
Hiruma K, Riddiford LM. The molecular mechanisms of cuticular melanization:The ecdysone cascade leading to dopa decarboxylase expression in Manduca sexta[J]. Insect Biochemistry and Molecular Biology, 2009, 39(4): 245-253. DOI:10.1016/j.ibmb.2009.01.008 |
| [28] |
张文慧, 侯海霞, 杨琼, 等. 虫酰肼对斜纹夜蛾幼虫多巴脱羧酶基因表达的影响[J]. 中国农业科学, 2014, 47(8): 1512-1521. DOI:10.3864/j.issn.0578-1752.2014.08.007 |
| [29] |
Sideri M, Tsakas S, Markoutea E, et al. Innate immunity in insects:surface-associated dopa decarboxylase-dependent pathways regulate phagocytosis, nodulation and melanization in medfly haemocytes[J]. Immunology, 2008, 123(4): 528-537. DOI:10.1111/imm.2008.123.issue-4 |
| [30] |
Nappi AJ, Vass E. Melanogenesis and the generation of cytotoxic molecules during insect cellular immune reactions[J]. Pigment Cell Research, 1993, 6(3): 117-126. DOI:10.1111/pcr.1993.6.issue-3 |
| [31] |
李黎.家蚕黑化免疫初探[D].重庆: 西南大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10635-1013265650.htm
|
| [32] |
Paskewitz SM, Andreev O. Silencing the genes for dopa decarboxylase or dopachrome convesion enzyme reduces melanization of foreign targets in Anopheles gambiaz[J]. Comparative Biochemistry and Physiology B-Biochemistry & Molecular biology, 2008, 150(4): 403-408. |
| [33] |
Ma JZ, Beuten J, Payne TJ, et al. Haplotype analysis indicates an association between the DOPA decarboxylase gene and nicotine dependence[J]. Hum Mol Genet, 2005, 14(12): 1691-1698. DOI:10.1093/hmg/ddi177 |
| [34] |
孙玲, 付文博, 闫振天, 等. 中国库蚊属四十个种(亚种)的分子系统发育关系研究(双翅目:蚊科)[J]. 昆虫学报, 2018, 61(1): 103-113. |
| [35] |
孙颖.长牡蛎肿瘤坏死因子(CgTNF-1)免疫调节机制的初步研究[D].北京: 中国科学院大学, 2014.
|
| [36] |
史晓委.栉孔扇贝(Chlamys farreri)胆碱能神经免疫调系统的初步研究[D].北京: 中国科学院大学, 2012.
|
| [37] |
Fa hn, S. The history of dopamine and levodopa in the treatment of Parkinson's disease[J]. Movement Disord, 2008, 23: S497-S508. DOI:10.1002/mds.v23:3+ |
| [38] |
Kebabian JW, Calne DB. Multiple receptors for dopamine[J]. Nat, 1979, 277: 93-96. DOI:10.1038/277093a0 |
| [39] |
贾云珂.多巴胺、5-羟色胺能系统参与调节海洋无脊椎动物内环境稳态的初步研究[D].北京: 中国科学院大学, 2018.
|
| [40] |
李美佳.氨基酸类神经递质对长牡蛎(Crassostrea gigas)免疫系统调节作用的初步研究[D].北京: 中国科学院大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-80068-1016205737.htm
|
| [41] |
杨剑.胰岛素对肾脏近曲小管多巴胺D-5受体表达与功能的调节在尿钠代谢中的作用研究[D].重庆: 第三军医大学, 2009. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1802305
|
| [42] |
潘世龙, 张金明. 钾、镁、多巴胺加用血管扩张药治疗顽固性心衰48例临床观察[J]. 临床荟萃, 1994(11): 523. |
| [43] |
张旋.添加不同营养素的肠内营养对改善脑外伤大鼠肠黏膜屏障功能和多巴胺受体表达的相关性研究[D].福州: 福建医科大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10392-1012037461.htm
|
| [44] |
竹攸汀.中华绒螯蟹血细胞免疫效应因子的抗菌功能研究[D].上海: 华东师范大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10269-1016141434.htm
|
| [45] |
Wenisch C, Parschalk B, Weiss A, et al. High-dose catecholamine treatment decreases polymorphonuclear leukocyte phagocytic capacity and reactive oxygen production[J]. Clinical and diagnostic laboratory immunology, 1996, 3(4): 423-438. |




