2. 国家城市供水水质监测网重庆监测站,重庆 400060
2. Chongqing Monitoring Station, Water Quality Monitoring Network of National Urban Water Supply, Chongqing 400060
近年来,内分泌干扰物(Endocrine disrupting chemicals,EDCs)环境问题引起全球范围的密切关注和重视,是国际环境科学领域研究的前沿和热点课题之一,美国、欧盟、日本、世界卫生组织(WHO)、联合国环境规划署(UNEP)、经济合作与发展组织(OCED)等国家和组织已制定管理法规和管控措施,中国也在《水污染防治行动计划》(国发[2015]17号)中提出严格控制环境激素类化学品污染并评估风险,实施管控措施[1-3]。类固醇雌激素(Steroid estrogens,SEs)可分为天然和人工合成两大类,是雌情活性最强、最受关注的一类EDCs,在环境中被广泛检测出,主要来源于城市污水处理厂和集约化畜禽养殖场[4-7]。环境中极其微量的SEs便可强烈干扰人类和动物的内分泌系统,导致发育、生殖、神经、免疫等问题[1],长期暴露于高浓度SEs环境中还会导致鱼类雌性化、雌雄同体、植物生长损伤、微生物功能及群落多样性变化等问题[8-9],而且不同SEs间存在着复合毒性协同效应,造成的危害更大[10]。酶具有催化效率高、活化能低、反应条件温和、环境友好等特点,被誉为“绿色催化剂”,在SEs的去除中起到重要作用并广受关注[11-17]。本文总结了环境中酶对自由及结合态SEs的去除作用及其反应机理,阐明不同形态SEs的主要酶降解、转化路径,并对酶在环境中SEs去除的应用进行了展望,以期对环境中两种形态雌激素的酶降解转化的研究提供理论借鉴。
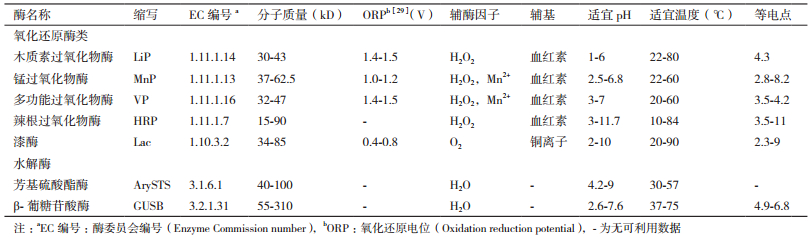
1 环境中降解转化SEs酶的基本性质环境中天然SEs可分为自由态(Free estrogens,FEs)和结合态(Conjugated estrogen,CEs),其结构示意如图 1所示。天然SEs降解、转化过程常用的酶主要分为两大类:(1)氧化还原酶类(Oxidoreductases),通过催化氧化FEs形成聚合产物,如过氧化物酶(Peroxidases,PODs,EC 1.11.1.X)和漆酶(Laccase,Lac,EC 1.10.3.2)[18-21];(2)水解酶类(Hydrolases),通过解离结合基团将CEs水解为相对应的FEs,如芳基硫酸酯酶(Arylsulfatase,ArySTS,EC 3.1.6.1)和β-葡糖苷酸酶(β-glucuronidase,GUSB,EC 3.2.1.31)[22-25]。典型SEs降解、转化酶的物理化学性质及三维结构,见表 1和图 2。除以上几种酶外,还有一些细菌产生的酶对SEs具有降解、转化作用,如亚硝化单胞菌属(Nitrosomonas sp.)可产生单加氧酶(Monooxygenase)、诺卡氏菌属(Nocardia sp.)及不动杆菌属(Acinetobacter sp.)可产生双加氧酶(Dioxygenase)、红球菌属(Rhodococcus sp.)及鞘氨醇单胞菌属(Sphingomonas sp.)可产生单加氧酶、双加氧酶、羟基类固醇脱氢酶(Hydroxysteroid dehydrogenase,HSD)等[26-27]。

|
| 图 1 天然SEs结构示意图 |
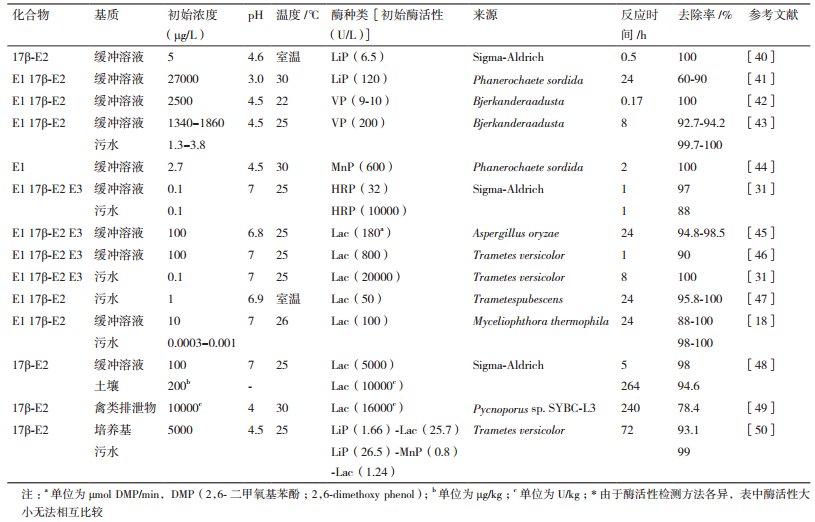
FEs主要包括雌酮(Estrone,E1)、17α-雌二醇(17α-Estradiol,17α-E2)、17β-雌二醇(17β-Estradiol,17β-E2)、雌三醇(Estriol,E3)。氧化还原酶去除FEs的主要作用机制为氧化耦合反应,催化FEs A环酚羟基形成高氧化潜能、高活性的C2、C4位自由基与C3位苯氧自由基等自由基中间体(图 3),通过C-O-C、C-C共价键自耦合、相互耦合形成二聚体,同时受到溶剂类型、pH、A环取代位置等影响[14, 18, 21, 31-32]。FEs A环C3位氧原子的电荷密度较高而自旋密度较低,因此与C-O-C键相比,在动力学上更有利于形成C-C键聚合产物[33]。二聚体可继续形成自由基,作为酶的底物继续氧化耦合生成三聚体、低聚体,甚至高聚体,但聚合物的溶解度随相对分子质量增加急剧降低,难以进一步耦合形成高分子量的聚合物[32, 34]。氧化还原酶催化FEs生成的聚合产物溶解度较低,在污水处理过程中易于通过吸附、过滤、沉淀等作用被去除。氧化还原酶的催化能力通常与氧化还原电位(表 1)和糖基化程度相关,高氧化还原电位有利于酶对SEs的催化氧化,在一定范围内,酶的稳定性随糖基化程度的增加而提高,其中LiP的糖基化程度较高,为20%-30%,高于HRP(18%-22%)、Lac(10%-20%)和MnP(5%-15%)[35-36]。PODs和Lac催化机理的主要区别在于电子受体,通常PODs以H2O2作为电子受体催化其活性,同时还需要辅酶因子的参与,而Lac以空气或水中的氧分子作为电子受体,不需额外添加氧化剂[17, 34, 37-39]。FEs在Lac催化体系中的去除速率低于PODs,但PODs不稳定,在复杂基质及过量H2O2条件下易于失活,而Lac的稳定性更强[34]。另外,与A环C3位相结合的CEs(如E1-3S、17β-E2-3S、E1-3G、17β-E2-3G)受到硫酸盐或葡糖苷酸盐基团的保护,不易被氧化还原酶催化氧化形成自由基[22]。不同基质中氧化还原酶对FEs的去除效率如表 2所示。
|
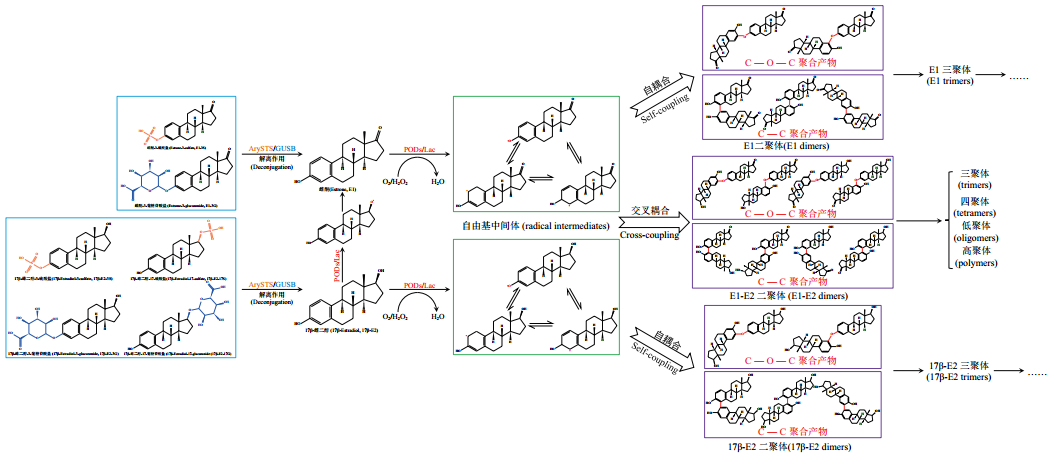
| 图 3 自由及结合态SEs的酶降解、转化路径图 |
PODs在自然界中分布广泛,可由动植物、真菌、细菌产生,根据是否含血红素分为血红素(Heme-peroxidases)及非血红素过氧化物酶(Non-heme peroxidases)[51-52]。在FEs的催化氧化中应用较多的PODs主要为血红素过氧化物酶,包括两大类:(1)真菌分泌的胞外木质素降解酶(Lignin modifying enzymes,LMEs),如LiP、MnP、VP。(2)植物产生的HRP[51]。PODs的催化机理为:血红素蛋白被H2O2或小分子过氧化物氧化为化合物Ⅰ(卟啉π阳离子自由基氧铁基团,FeⅣ=O·+),随后化合物Ⅰ从底物得到一个电子还原为化合物Ⅱ(氧铁基团,FeⅣ=O),再氧化底物得到一个电子将酶还原为基态FeⅢ,其中最后一步为限速步骤[13, 53],FEs被催化氧化生成自由基后通过耦合反应生成聚合产物。
2.1.1 木质素降解酶LiP在酸性条件下催化去除FEs效果较好,Wang等[41]实验结果表明,在pH3,0.2 mol/L H2O2条件下,120 U/L LiP对2.7 mg/L E1和17β-E2的去除率为60%-90%。Mao等[19]实验表明在pH4.6,0.05 mmol/L H2O2条件下,2.5 mg/L 17β-E2可被20 U/L LiP完全去除,主要产物为17β-E2低聚物,少量转化为中间产物E1。藜芦醇作为白腐真菌(White-rot fungi,WRF)的次生代谢产物以及与LiP共生的活性底物,具有较强的氧化能力,在LiP催化FEs过程中可被氧化成阳离子自由基,保护LiP避免失活并增强其活性,且对失活的LiP有一定的恢复作用[19, 32, 40]。无藜芦醇时,初始浓度为5 mg/L的17β-E2反应60 min后去除率仅为40%,而添加藜芦醇能够提高LiP对FEs的催化去除效率,反应20 min便能将5 mg/L 17β-E2完全去除[19]。
MnP是一类以多种形式存在的糖基化血红素过氧化物酶,其结合位点的结构与其他PODs有所不同,通过将Mn2+氧化为Mn3+完成催化氧化[54]。Tamagawa等[44]试验结果表明,经600 U/L MnP处理1 h后,0.01 mmol/L E1被完全去除,2 h后雌激素活性得以完全去除。
VP是一种混合酶,结合了LiP和MnP两种酶的底物特异性,在H2O2、Mn2+以及底物的共同作用下,将Mn2+氧化为Mn3+,催化氧化FEs形成聚合产物[21]。Eibes等[42]考察了VP对E1和17β-E2的去除,结果表明在低酶活性(10 U/L)条件下,反应25 min内两种化合物能够被完全去除。Taboada-Puig等[21, 43]实验结果表明,在最优条件下,VP可去除污水中高浓度(1.3-8.8 mg/L)及环境浓度(1.2-6.1 μg/L)的E1和17β-E2,并形成二聚体、三聚体和羟基雌酮(Hydroxyestrone,OH-E1)等产物。
2.1.2 辣根过氧化物酶HRP是一种含铁卟啉辅基的PODs,含有两个不同的金属中心:血红素和两个钙原子,主要由植物分泌,在辣根(Horseradish)中含量最高,并因此而得名[35, 55]。Auriol等[18, 56]研究发现在pH为7,温度为25℃条件下,被H2O2激活后,32 U/L HRP在1 h内可去除人工污水中97%的100 ng/L E1、17β-E2或E3,反应5 h后去除率为99%;但在实际污水中,去除相同浓度的FEs需添加8 000-10 000 U/L HRP,说明复杂污水基质成分使得HRP氧化能力受到抑制,从而显著影响了FEs的氧化去除。
值得注意的是,H2O2作为PODs的电子受体,同时又是这几种酶的抑制剂,过量H2O2会使反应过程中过渡态化合物形成无反应活性的化合物Ⅲ(铁超氧化物,FeⅢ=O2·-),称之为“自杀性失活”(Suicide inactivation)[13, 57]。而作为一种混合酶,VP的“自杀性失活”更加复杂,由于其存在3个氧化位点及多个催化产物,对H2O2浓度最敏感[57]。有研究表明,添加稳定剂可保护酶活性避免失活,如聚乙二醇(Polyethylene glycol,PEG)、聚乙烯醇(Polyvinyl alcohol,PVA)、聚乙烯(Polythene,PE)、明胶(Gelatin)、多糖(Polysaccharide)等[13, 36]。
2.2 漆酶的催化氧化作用Lac是一类多酚氧化酶,自然界中Lac可由高等植物、昆虫、细菌、真菌产生,其中真菌漆酶(Fungal Laccase)的底物特异性低,氧化能力强,应用最为广泛[14, 37, 51-52]。Lac催化活性中心通常含有4个铜离子,三环的铜簇位点以空气或水中的氧分子作为电子受体,形成自由基后,T1铜中心参与FEs单电子氧化,将O2还原为水,生成C-O-C、C-C聚合产物[11, 55, 58]。FEs在A环C3位含有酚羟基,能够被Lac催化产生苯氧自由基,通过氧化耦合反应形成二聚体、三聚体,有研究表明Lac还可将17β-E2氧化为E1[20, 39, 50, 59],而与之相反,Singh等[48]在反应产物中未检测出E1和E3。
Lloret等[39]研究发现,在水相反应体系中,pH4时Lac的酶活性最高,但稳定性较低,而其酶活性在pH7时较低,但稳定性高,同时可观察到反应初期Lac在pH4时有显著失活,而在pH7条件下,6 h内酶活性较稳定。Singh等[55]实验研究表明,在2 500 U/L Lac条件下,在水相体系中反应5 h后0.2 mg/L 17β-E2去除率为93%,而在土壤中去除率为87.1%。土壤含水率对Lac处理效果也有影响,经24 h 10 U/g Lac处理后,非饱和土壤中0.2 mg/g 17β-E2去除率仅为32.1%,而在饱和土壤中去除率达到62.6%,这可能由于Lac酶分子在水相中有利于与17β-E2接触,从而去除效果增强[48]。在pH为7,温度为25℃条件下,20 000 U/L Lac在1 h内可完全去除人工及实际污水中100 ng/L E1、17β-E2或E3,实验结果表明其催化FEs耦合反应受污水基质成分的影响较小[46]。有研究表明在相同浓度下,Lac催化氧化E1的反应速率仅为17β-E2的60%,其区别在于二者在C17位与Lac的亲和性[22]。Lac的稳定性在水相和土壤体系中有较大差异,虽然在水相(0.46 h-1)中其失活速率比在土壤(0.003 1 h-1)中快很多,但水相中Lac对17β-E2的去除速率比在土壤中高100多倍[48],Lac在土壤中的活性持续时间较长、稳定性强的特点弥补了其反应速率慢的缺点。
漆酶介导反应体系(Laccase mediator system,LMS)指Lac在介体和氧分子存在时进行催化氧化的反应体系,介体的氧化还原电位较高,可分为天然及人工合成介体,如紫脲酸(Violuric acid,VA)、丁香醛(Syringaldehyde,SA)、1-羟基苯并三氮唑(1-hydroxy-benzotriazole,HBT)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2-azinobis(3-ethylbenzothiazoline-6-sulfnoic acid),ABTS)等[45-46, 60-62]。介体在酶和目标化合物间起到“电子穿梭”的作用,作用机制主要包括氢自由基转移、电子转移以及离子氧化,添加介体可提高FEs的氧化程度,从而增强Lac催化去除FEs反应[17, 61, 63]。Auriol等[46]实验结果表明,当Lac酶活性低于20 000 U/L时添加HBT可提高17β-E2的去除效率,而当酶活性高于20 000 U/L时,两种条件下17β-E2的去除率没有明显差异。Sei等[64]实验结果表明,在无介体条件下,300 U/L Lac反应6-12 h后可完全去除20 mg/L 17β-E2和E3,24 h后E1的去除率为90%,添加介体ABTS或HBT后E1仅在3 h内可被Lac完全去除。Lloret等[62]实验表明,不添加介体条件下,经Lac处理24 h后17β-E2得以完全去除,而E1不易去除,在Lac-VA、Lac-HBT和Lac-SA体系中E1的去除率分别为100%、88%和74%。在以后的研究中,应探索成本低、性质稳定、毒性低及水溶性好的介体。
2.3 有机质对氧化还原酶催化FEs的影响土壤与水体环境中富含有机质,有研究表明高浓度有机质可显著降低FEs的酶催化去除速率,这是由于有机质含有大量酚类官能团,形成自由基后可与FEs及其自由基相互耦合,形成交叉耦合化合物,从而抑制FEs自耦合产物的形成[33-34, 65-66]。Mao等[32]试验证实,藜芦醇对LiP催化能力的增强会受到有机质的抑制。当有机质和藜芦醇同时存在时,二者在LiP表面活性位点产生竞争,导致17β-E2的去除率有所降低,这是由于有机质和17β-E2的交叉耦合反应抑制了藜芦醇对LiP去除17β-E2的增强作用[23, 40]。Huang等[65]研究了有机质对HRP去除17β-E2的影响,发现有机质不仅抑制17β-E2的去除,还会影响17β-E2氧化自耦合产物二聚体、三聚体的形成。Sun等[66]研究发现有机质可与Lac表面活性位点竞争或与17β-E2结合,从而抑制17β-E2的酶催化氧化去除,且其抑制率随有机质浓度增加而升高,有机质浓度为50 mg/L时,Lac对17β-E2的去除率不足5%。夏青[55]通过试验研究表明,有机质对HRP去除E1、17β-E2的抑制作用并不明显,去除率仍高于80%,而在Lac催化体系中,有机质对E1、17β-E2的去除有抑制作用,说明有机质对HRP活性的影响较小。
3 水解酶对CEs的降解转化作用FEs羟基可与硫酸盐或葡糖苷酸盐通过酯化作用形成CEs,其中单羟基化合物E1的结合态为单一形式,多羟基化合物E2、E3则可与一个或多个结合基团形成硫酸盐(CSEs)、葡糖苷酸盐(CGEs)、硫酸盐-葡糖苷酸盐(CS-GEs)形式的CEs。与FEs相比,CEs的水溶性、迁移性高,而吸附性较低。研究普遍认为CEs无生物毒性,但其解离后又重新生成雌情活性高的FEs,潜在的生态风险不应被忽视。CEs结合基团的解离主要为ArySTS和GUSB的作用,其活性与温度及微生物丰度密切相关,酶催化条件下CEs的解离在热力学上不可逆[16]。CGEs可被GUSB解离为相对应的FEs,ArySTS通过水解硫酯键将CSEs酶解为其对应的FEs[25, 67]。研究表明,GUSB和ArySTS活性与有机质含量、土壤黏粒显著相关[23, 68-69]。目前有关CEs酶降解、转化的研究多集中在E1及E2的结合态,而有关E3结合态形式酶解的研究相对较少。
3.1 芳基硫酸酯酶的水解作用ArySTS可由微生物、动植物分泌,在污水及活性污泥中活性和含量水平较高[70-71]。土壤中ArySTS主要以吸附态存在于腐殖质、黏土矿物,稳定性增加且不易失活,而很少以游离态形式存在[68],Bai等[72]研究也表明ArySTS仅在土壤吸附相中保持活性,而在水相中几乎没有活性。水体中ArySTS主要来自底泥微生物的分泌,也可通过径流、合流制污水管网溢流等方式携带产生ArySTS的微生物进入水体[25, 70]。然而,由于环境中ArySTS活性与丰富度水平相对较低,CSEs硫酯键的解离作用通常较弱[73]。Liu等[74]的实验结果表明,在1 mL pH5的缓冲液,55℃条件下,添加50 μL ArySTS反应3 h后,E1-3S和E3-3S的解离效率超过75%,而17β-E2-3S的解离效率低于60%。Bai等[72, 75]实验表明,ArySTS对17β-E2-17S的解离作用仅为A环羟基化作用的1/10,主要产物为OH-17β-E2-17S和diOH-17β-E2-17S。Ma和Yates[76-77]也发现农田土壤、河水及沉积物中17β-E2-3S主要通过C17位羟基的氧化生成初级代谢产物E1-3S,而酶的解离作用次之。另外,氧化还原条件也会影响ArySTS的活性,Zheng等[78]测定了奶牛养殖场污水17α-E2-3S的转化产物,结果表明,在有氧条件下主要通过D环C17位的羟基氧化为酮基,从而生成E1-3S,而在厌氧条件下A环C3位硫酯键的酶解占据主导代谢地位。
值得注意的是,芳基磺基转移酶(Arylsulfotran-sferase,ArySULT,EC 2.8.2.1)与ArySTS的作用则相反,能够将FEs重新转化为CSEs[67]。Goeppert等[67, 79]研究了土壤中17β-E2的转化路径,结果表明17β-E2可先降解为E1,随后在ArySULT的作用下转化为E1-3S。
3.2 β-葡糖苷酸酶的水解作用GUSB属糖苷类水解酶,细菌、真菌及高等动植物均可产生,广泛存在于污水、活性污泥、土壤、沉积物中[23]。在河水及沉积物中,Ma和Yates[76-77]观察到17β-E2-3G主要通过C3位结合基团的解离生成17β-E2,而在农田土壤中主要为C17位羟基氧化作用生成E1-3G,这可能由于土壤中GUSB含量水平不足所致。Kumar等[80]实验结果表明,在河水中反应5 d后,E1-3G完全解离为E1,而仅有64%的17β-E2-3G解离为17β-E2及随后的转化产物E1,这可能由于GUSB对两种CGEs的解离存在差异。
粪大肠菌群,例如埃希氏大肠杆菌(Escherichia coli,E.coli)可合成GUSB和ArySTS,从蜗牛(Helix pomatia,H.pomatia)中提取的GUSB-ArySTS混合酶也广泛应用于CEs的酶解及检测[71, 74]。E.coli合成的ArySTS较少且活性、亲和性相对较弱,H.pomatia中提取的GUSB-ArySTS混合酶中ArySTS活性也相对较低[23, 81],因此与CGEs相比,CSEs在环境中的稳定性和持久性更强[80, 82]。Ben等[82]实验表明,10 μmol/U酶抑制剂STX 64和D-葡糖二酸-1,4-内酯可分别有效抑制污水中ArySTS和GUSB活性,从而阻碍CEs的解离。结合基团(硫酸盐或葡糖苷酸盐)及位置(A和/或D环)的差异会影响CEs的酶降解、转化过程。D’Ascenzo等[83]的实验结果表明,A环(E1-3G、17β-E2-3G、E3-3G)CGEs比D环(17β-E2-17G、E3-16G)CGEs易于解离,不过一旦反应启动,一天内均可完全解离为相对应的FEs;而对于CSEs,E1-3S、17β-E2-3S和E3-3S完全解离需6-8 d,说明污水中ArySTS活性相比于GUSB弱得多。Liu等[16]比较了5种CEs的解离速率,并划分为低(E1-3S)、中等(E1-3G、17β-E2-3S和E3-3G)和高(E3-16G)解离速率。Gomes等[84]通过活性污泥批试验表明,CEs(E1-3S、E1-3G和E3-16G)在微生物分泌的酶作用下可解离为FEs,而灭菌条件下未检测到FEs,解离优先顺序为E1-3G>E3-16G>E1-3S,其影响因素为:结合基团>基团位置>SEs类型。
水解酶通过解离硫酸盐或葡糖苷酸盐结合基团将CEs水解为相对应的FEs,氧化还原酶可催化FEs形成C2、C4位自由基及C3位苯氧自由基中间体,通过C-O-C、C-C共价键自耦合、交叉耦合形成二聚体、三聚体,甚至高聚体。环境中自由及结合态SEs的酶降解、转化路径如图 3所示。
4 展望酶对环境中自由及结合态SEs的去除的应用受到诸多因素限制,对今后酶在SEs降解转化的规模化应用、机理研究、联合应用、固定化酶、酶工程等方面进行了展望。
酶催化去除SEs的研究大多处于小试、中试试验阶段,在污水、污染土壤修复中的应用相对较少[31, 43, 47, 49, 52],由于理论研究与实际应用存在差异,评估酶在实际应用中的可行性十分重要。污水中各种干扰因素会对酶的催化氧化效果产生影响,如pH、温度、盐度、溶解氧、重金属、抑制物质等[36]。应进一步研究酶处理含SEs污水的工作机理和环境因素的影响,将理论应用于实际工业化处理中。酶膜反应器(Enzymatic membrane reactor,EMR)可应用于污水中有机污染物连续处理[14, 38, 85],目前已有研究在小试阶段应用EMR处理FEs,去除效率可达到80%-100%[20, 43, 60],常用的膜材料有醋酸纤维素(Cellulose acetate,CA)、硝酸纤维素(Nitrocellulose,NC)、聚四氟乙烯(Polytetrafluoroethylene,PTFE)、聚丙烯腈(Polyacrylonitrile,PAN)、聚醚砜(Poly-ethersulfone,PES)、聚酰胺(Polyamide,PA)等[85]。在规模化应用时,需要解决酶失活以及膜的持续性能问题,同时,EMR在SEs特别是CEs去除方面的应用仍需进一步开发和研究。酶催化应用于SEs污染土壤修复不会产生二次污染,然而不同土壤类型、气候条件、微生物群落等均会对酶修复SEs污染土壤产生影响,实现场地修复仍需要长期系统地研究。
在酶处理SEs过程中伴随着中间产物的产生,且有些产物仍具有雌情活性,而大多数研究没有检测反应后总雌情活性,以及对降解、转化产物进行鉴定。随着高分辨质谱(HRMS)、核磁共振(NMR)等分析检测技术的发展[58, 86],应在反应中间产物的鉴定,自由基的生成,C-O-C、C-C键聚合产物优先顺序及比例等方面展开研究,进一步阐明SEs的酶催化反应机理,比较不同类型的酶对SEs的去除效率,深入分析SEs的降解、转化产物及路径。
WRF(如Trametes versicolor、Phanerochaete chr-ysosporium)可分泌Lac、LiP、MnP,且不同种类的菌分泌的酶类型存在差异,利用WRF分泌的胞外酶体系催化氧化FEs,可作为规模化应用发展的方向[51, 59]。通常污水、污泥、土壤中存在着多种类型的自由态和结合态SEs,是十分复杂的混合体系,而单一种类的酶很难同时去除不同形态的SEs。在GUSB-Lac联用酶体系处理污水中不同形态SEs(E1、17β-E2、17β-E2-3G)的试验中,Tanaka等[22]发现几种化合物均能够得到有效去除。水解酶与氧化还原酶联用同时处理复杂基质中的FEs和CEs(CSEs和CGEs),或产生这些酶的微生物的联合使用(如WRF和E.coli)可作为今后研究的重要课题。
溶解态的游离酶在污水中存在易变性失活、易流失、难以回收等问题,从而导致处理成本过高,限制了其大规模应用。酶固定化技术可以提高酶的稳定性,实现重复利用,并在SEs的去除中得以应用[54, 87-89],主要分为物理法(如吸附)和化学法(如包埋、微胶囊、交联、共价结合),且各有优缺点,载体材料及固定化技术的选择取决于酶的类型和催化过程[54, 90]。探寻经济、高效、生物相容且环境友好的固定化材料,降低酶活性损失并提高稳定性是未来发展的方向。
自然条件下微生物产生酶的量非常少,提高酶产量和催化效率,降低应用成本等是需要解决的主要难题,可通过酶工程(如纳米酶、修饰酶和超酶)、基因编辑、DNA重组等技术提高酶产量、稳定性及活性、催化效率及降低酶的别构调节[51-52, 91]。
| [1] |
Jacobs MN, Marczylo EL, Guerrerobosagna C, et al. Marked for life:Epigenetic effects of endocrine disrupting chemicals[J]. Annual Review of Environment & Resources, 2017, 42(1): 105-160. |
| [2] |
杨先海, 刘会会, 刘济宁, 等. 国外环境内分泌干扰物管控现状及我国的对策[J]. 生态与农村环境学报, 2018, 34(2): 104-113. |
| [3] |
国务院.水污染防治行动计划[EB/OL]. http://www.gov.cn/zhengce/content/2015-04/16/content_9613.htm.
|
| [4] |
Yu WW, Du BH, Yang L, et al. Occurrence, sorption, and transfor-mation of free and conjugated natural steroid estrogens in the envi-ronment[J]. Environmental Science and Pollution Research, 2019, 26(10): 9443-9468. DOI:10.1007/s11356-019-04402-z |
| [5] |
宋晓明, 杨悦锁, 温玉娟, 等. 雌激素在地下环境中的归宿及其生态调控[J]. 中国环境科学, 2016, 36(9): 2828-2840. DOI:10.3969/j.issn.1000-6923.2016.09.042 |
| [6] |
余薇薇, 朱家悦, 陈垚, 等. 集约化养殖场中类固醇雌激素的环境行为与处理途径[J]. 环境工程, 2017, 35(3): 174-178. |
| [7] |
万巧玲, 王龙, 余薇薇. 在线SPE-UPLC-MS-MS快速检测水样中3种痕量类固醇雌激素[J]. 化学研究与应用, 2018, 30(7): 1186-1189. DOI:10.3969/j.issn.1004-1656.2018.07.026 |
| [8] |
Adeel M, Song X, Wang Y, et al. Environmental impact of estrogens on human, animal and plant life:A critical review[J]. Environ-ment International, 2016, 99: 107-119. |
| [9] |
Czarny K, Szczukocki D, Krawczyk B, et al. The impact of estrogens on aquatic organisms and methods for their determination[J]. Crit Rev Environ Sci Technol, 2017, 47(11): 909-963. DOI:10.1080/10643389.2017.1334458 |
| [10] |
王明泉, 李圭白, 贾瑞宝, 等. 城市水系统雌激素综合毒性效应的CALUX分析法优化[J]. 中国给水排水, 2015, 31(23): 72-76. |
| [11] |
Cabana H, Jones JP, Agathos SN. Elimination of endocrine disrupting chemicals using white rot fungi and their lignin modifying enzymes:A review[J]. Engineering in Life Sciences, 2007, 7(5): 429-456. DOI:10.1002/(ISSN)1618-2863 |
| [12] |
李阳, 蒋国翔, 牛军峰, 等. 漆酶催化氧化水中有机污染物[J]. 化学进展, 2009, 21(10): 2028-2036. |
| [13] |
冯义平, 毛亮, 董仕鹏, 等. 过氧化物酶催化去除水体中酚类内分泌干扰物的研究进展[J]. 环境化学, 2013(7): 1218-1225. |
| [14] |
Gasser CA, Ammann EM, et al. Laccases to take on the challenge of emerging organic contaminants in wastewater[J]. Appl Microbiol Biotechnol, 2014, 98(24): 9931-9952. DOI:10.1007/s00253-014-6177-6 |
| [15] |
Cajthaml T. Biodegradation of endocrine-disrupting compounds by ligninolytic fungi:mechanisms involved in the degradation[J]. Environmental Microbiology, 2015, 17(12): 4822-4834. DOI:10.1111/1462-2920.12460 |
| [16] |
Liu ZH, Lu GN, et al. Removal of natural estrogens and their conjugates in municipal wastewater treatment plants:a critical review[J]. Environ Sci Technol, 2015, 49(9): 5288-5300. DOI:10.1021/acs.est.5b00399 |
| [17] |
Barrios-Estrada C, De JRM, et al. Emergent contaminants:Endocrine disruptors and their laccase-assisted degradation-A review[J]. Sci Total Environ, 2017, 612: 1516-1531. |
| [18] |
Auriol M, Filali-Meknassi Y, et al. Natural and synthetic hormone removal using the horseradish peroxidase enzyme:temperature and pH effects[J]. Water Res, 2006, 40(15): 2847-2856. DOI:10.1016/j.watres.2006.05.032 |
| [19] |
Mao L, Huang Q, Lu J, et al. Ligninase-mediated removal of natural and synthetic estrogens from water:I.Reaction behaviors[J]. Environ Sci Technol, 2009, 43(2): 374-379. DOI:10.1021/es801791v |
| [20] |
Lloret L, Eibes G, Moreira MT, et al. Removal of estrogenic compounds from filtered secondary wastewater effluent in a continuous enzymatic membrane reactor.Identification of biotransformation products[J]. Environ Sci Technol, 2013, 47(9): 4536-4543. DOI:10.1021/es304783k |
| [21] |
Taboada-Puig R, Eibes G, Lloret L, et al. Fostering the action of versatile peroxidase as a highly efficient biocatalyst for the removal of endocrine disrupting compounds[J]. New Biotechnology, 2015, 33(1): 187-195. |
| [22] |
Tanaka T, Tamura T, Ishizaki Y, et al. Enzymatic treatment of estrogens and estrogen glucuronide[J]. Journal of Environmental Sciences, 2009, 21(6): 731-735. DOI:10.1016/S1001-0742(08)62332-3 |
| [23] |
Duong CN, Lee JH, Lim BJ, et al. Biodegradation of estrogen conjugates by bacteria isolated from river sediments[J]. Water Science & Technology, 2011, 64(8): 1750-1758. |
| [24] |
Scherr FF, Sarmah AK, Di HJ, et al. Degradation and metabolite formation of 17β-estradiol-3-sulphate in New Zealand pasture soils[J]. Environment International, 2009, 35(2): 291-297. DOI:10.1016/j.envint.2008.07.002 |
| [25] |
阳春, 纪中旭, 胡碧波, 等. 污水中基于酶活性分析的硫酸雌酮雌激素效应[J]. 中国环境科学, 2018, 38(1): 369-373. DOI:10.3969/j.issn.1000-6923.2018.01.041 |
| [26] |
Chen YL, Yu CP, Lee TH, et al. Biochemical mechanisms and catabolic enzymes involved in bacterial estrogen degradation pathways[J]. Cell Chemical Biology, 2017, 24(6): 1-13. |
| [27] |
田克俭, 孟繁星, 霍洪亮. 环境雌激素的微生物降解[J]. 微生物学报, 2019, 59(3): 442-453. |
| [28] |
Enzyme Database - BRENDA[EB/OL]. http://www.brenda-enzymes.info/index.php.
|
| [29] |
Harms H, Schlosser D, Wick LY. Untapped potential:exploiting fungi in bioremediation of hazardous chemicals[J]. Nature Reviews Microbiology, 2011, 9(3): 177-192. DOI:10.1038/nrmicro2519 |
| [30] |
Research Collaboratory for Structural Bioinformatics Protein Data Bank, RCSB PDB.[EB/OL]. http://www.rcsb.org.
|
| [31] |
Auriol M, et al. Removal of estrogenic activity of natural and synthetic hormones from a municipal wastewater:Efficiency of horseradish peroxidase and laccase from Trametes versicolor[J]. Chemosphere, 2008, 70(3): 445-452. DOI:10.1016/j.chemosphere.2007.06.064 |
| [32] |
Mao L, Lu J, et al. Ligninase-mediated removal of natural and syn-thetic estrogens from water:Ⅱ.Reactions of 17β-estradiol[J]. Environ Sci Technol, 2010, 44(7): 2599-2604. DOI:10.1021/es903058k |
| [33] |
Mao L, Huang Q, et al. Ligninase-mediated removal of 17β-estradiol from water in the presence of natural organic matter:efficiency and pathways[J]. Chemosphere, 2010, 80(4): 469-473. DOI:10.1016/j.chemosphere.2010.03.054 |
| [34] |
夏青, 谢卫平, 刘国强, 等. 漆酶催化氧化水中雌激素的研究[J]. 环境科学, 2013, 34(8): 3119-3124. |
| [35] |
洪伟杰, 张朝晖, 芦国营. 辣根过氧化物酶的结构与作用机制[J]. 生命的化学, 2005, 25(1): 33-36. DOI:10.3969/j.issn.1000-1336.2005.01.014 |
| [36] |
Asif MB, Hai FI, Hou J, et al. Impact of wastewater derived dissolved interfering compounds on growth, enzymatic activity and trace organic contaminant removal of white rot fungi - A critical review[J]. J Environ Manage, 2017, 201: 89-109. DOI:10.1016/j.jenvman.2017.06.014 |
| [37] |
Rivera-Hoyos CM, Morales-Álvarez ED, Poutou-Piñales RA, et al. Fungal laccases[J]. Fungal Biol Rev, 2013, 27(3-4): 67-82. DOI:10.1016/j.fbr.2013.07.001 |
| [38] |
Ba S, Arsenault A, Hassani T, et al. Laccase immobilization and insolubilization:from fundamentals to applications for the elimination of emerging contaminants in wastewater treatment[J]. Critical Rev Biotechnol, 2013, 33(4): 404-418. DOI:10.3109/07388551.2012.725390 |
| [39] |
Lloret L, Eibes G, Feijoo G, et al. Degradation of estrogens by laccase from Myceliophthora thermophila in fed-batch and enzymatic membrane reactors[J]. J Hazard Materi, 2012, 213-214(2): 175-183. |
| [40] |
Mao L, Lu J, Gao S, et al. Transformation of 17β-estradiol mediated by lignin peroxidase:the role of veratryl alcohol[J]. Arch Environ Contam Toxicol, 2010, 59(1): 13-19. |
| [41] |
Wang J, Majima N, Hirai H, et al. Effective removal of endocrine-disrupting compounds by lignin peroxidase from the white-rot fungus Phanerochaete sordida YK-624[J]. Current Microbiology, 2012, 64(3): 300-303. DOI:10.1007/s00284-011-0067-2 |
| [42] |
Eibes G, Debernardi G, Feijoo G, et al. Oxidation of pharmaceutically active compounds by a ligninolytic fungal peroxidase[J]. Biodegradation, 2011, 22(3): 539-550. DOI:10.1007/s10532-010-9426-0 |
| [43] |
Taboada-Puig R, Lu-Chau TA, Eibes G, et al. Continuous removal of endocrine disruptors by versatile peroxidase using a two-stage system[J]. Biotechnology Progress, 2015, 31(4): 908-916. DOI:10.1002/btpr.2116 |
| [44] |
Tamagawa Y, Yamaki R, Hirai H, et al. Removal of estrogenic activity of natural steroidal hormone estrone by ligninolytic enzymes from white rot fungi[J]. Chemosphere, 2006, 65(1): 97-101. DOI:10.1016/j.chemosphere.2006.02.031 |
| [45] |
Nguyen LN, Hai FI, Price WE, et al. Degradation of a broad spectrum of trace organic contaminants by an enzymatic membrane reactor:Complementary role of membrane retention and enzymatic degradation[J]. Int Biodeter Biodegr, 2015, 99: 115-122. DOI:10.1016/j.ibiod.2014.12.004 |
| [46] |
Auriol M, Filali-Meknassi Y, Tyagi RD, et al. Laccase-catalyzed conversion of natural and synthetic hormones from a municipal wastewater[J]. Water Res, 2007, 41(15): 3281-3288. DOI:10.1016/j.watres.2007.05.008 |
| [47] |
Spina F, Cordero C, Schilirò T, et al. Removal of micropollutants by fungal laccases in model solution and municipal wastewater:evaluation of estrogenic activity and ecotoxicity[J]. Journal of Cleaner Production, 2015, 100: 185-194. DOI:10.1016/j.jclepro.2015.03.047 |
| [48] |
Singh R, Cabrera ML, Radcliffe DE, et al. Laccase mediated transformation of 17β-estradiol in soil[J]. Environmental Pollution, 2015, 197: 28-35. DOI:10.1016/j.envpol.2014.11.023 |
| [49] |
Liu J, Luo Q, Huang Q. Removal of 17 β-estradiol from poultry litter via solid state cultivation of lignolytic fungi[J]. Journal of Cleaner Production, 2016, 139: 1400-1407. DOI:10.1016/j.jclepro.2016.09.020 |
| [50] |
Nicotra S, Intra A, Ottolina G, et al. Laccase-mediated oxidation of the steroid hormone 17β-estradiol in organic solvents[J]. Tetrahedron Asymmetry, 2004, 15(18): 2927-2931. DOI:10.1016/j.tetasy.2004.06.034 |
| [51] |
Sharma B, Dangi AK, Shukla P. Contemporary enzyme based technologies for bioremediation:A review[J]. J Environ Manage, 2018, 210: 10-22. DOI:10.1016/j.jenvman.2017.12.075 |
| [52] |
Alneyadi AH, Rauf MA, Ashraf SS. Oxidoreductases for the remediation of organic pollutants in water - a critical review[J]. Critical Rev Biotechnol, 2018, 38(7): 1-18. |
| [53] |
Pollegioni L, Tonin F, Rosini E. Lignin-degrading enzymes[J]. FEBS Journal, 2015, 282(7): 1190-1213. DOI:10.1111/febs.2015.282.issue-7 |
| [54] |
Voběrková S, Solčány V, Vršanská M, et al. Immobilization of ligninolytic enzymes from white-rot fungi in cross-linked aggregates[J]. Chemosphere, 2018, 202: 694-707. DOI:10.1016/j.chemosphere.2018.03.088 |
| [55] |
夏青.酶催化氧化耦合反应去除有机污染物的机理及应用研究[D].南京: 南京农业大学, 2013.
|
| [56] |
Auriol M, Filali-Meknassi Y, Tyagi RD, et al. Oxidation of natural and synthetic hormones by the horseradish peroxidase enzyme in wastewater[J]. Chemosphere, 2007, 68(10): 1830-1837. DOI:10.1016/j.chemosphere.2007.03.045 |
| [57] |
Ruiz-Dueñas FJ, MartãNez AT. Microbial degradation of lignin:how a bulky recalcitrant polymer is efficiently recycled in nature and how we can take advantage of this[J]. Microbial Biotechnology, 2009, 2(2): 164-177. DOI:10.1111/mbt.2009.2.issue-2 |
| [58] |
孙凯, 李雅欣, 李舜尧, 等. 采用HRMS结合13C-同位素比值技术探究水环境中新兴污染物的归趋和转化机制[J]. 环境化学, 2018, 37(6): 1223-1231. |
| [59] |
Shreve MJ, Brockman A, Hartleb M, et al. The white-rot fungus Trametes versicolor reduces the estrogenic activity of a mixture of emerging contaminants in wastewater treatment plant effluent[J]. Int Biodeter Biodegr, 2016, 109: 132-140. DOI:10.1016/j.ibiod.2016.01.018 |
| [60] |
Nguyen LN, van de Merwe JP, Hai FI, et al. Laccase-syringaldehyde-mediated degradation of trace organic contaminants in an enzymatic membrane reactor:Removal efficiency and effluent toxicity[J]. Bioresour Technol, 2016, 200: 477-484. DOI:10.1016/j.biortech.2015.10.054 |
| [61] |
Ashe B, Nguyen LN, Hai FI, et al. Impacts of redox-mediator type on trace organic contaminants degradation by laccase:Degradation efficiency, laccase stability and effluent toxicity[J]. Int Biodeter Biodegr, 2016, 113: 169-176. DOI:10.1016/j.ibiod.2016.04.027 |
| [62] |
Lloret L, Eibes G, Lú-Chau TA, et al. Laccase-catalyzed degradation of anti-inflammatories and estrogens[J]. Biochemical Engineering Journal, 2010, 51(3): 124-131. DOI:10.1016/j.bej.2010.06.005 |
| [63] |
Yang S, Hai FI, Nghiem LD, et al. Understanding the factors controlling the removal of trace organic contaminants by white-rot fungi and their lignin modifying enzymes:a critical review[J]. Bioresour Technol, 2013, 141(4): 97-108. |
| [64] |
Sei K, Takeda T, Soda SO, et al. Removal characteristics of endocrine-disrupting chemicals by laccase from white-rot fungi[J]. J Environ Sci Health A, 2008, 43(1): 53-60. |
| [65] |
Huang W, Song H, Xie H, et al. Impacts of dissolved organic matter on the removal of 17β-Estradiol using horseradish peroxidase[J]. Water Air & Soil Pollution, 2013, 224(1359): 1-10. |
| [66] |
Sun K, Luo Q, Gao Y, et al. Laccase-catalyzed reactions of 17β-estradiol in the presence of humic acid:Resolved by high-resolution mass spectrometry in combination with 13C labeling[J]. Chemosphere, 2016, 145: 394-401. DOI:10.1016/j.chemosphere.2015.11.117 |
| [67] |
Goeppert N, Dror I, Berkowitz B. Fate and transport of free and conjugated estrogens during soil passage[J]. Environmental Pollution, 2015, 206: 80-87. DOI:10.1016/j.envpol.2015.06.024 |
| [68] |
张玉兰, 陈利军. 土壤芳基硫酸酯酶及其活性和农业措施影响[J]. 土壤通报, 2006, 37(4): 792-798. DOI:10.3321/j.issn:0564-3945.2006.04.039 |
| [69] |
Shrestha SL, Casey FX, Hakk H, et al. Fate and transformation of an estrogen conjugate and its metabolites in agricultural soils[J]. Environ Sci Technol, 2012, 46(20): 11047-11053. DOI:10.1021/es3021765 |
| [70] |
张真真.典型环境因素影响AryS活性和CE-S水解机制的初步研究[D].重庆: 重庆大学, 2014.
|
| [71] |
Stressler T, Seitl I, Kuhn A, et al. Detection, production, and application of microbial arylsulfatases[J]. Applied Microbiology & Biotechnology, 2016, 100(21): 9053-9067. |
| [72] |
Bai XL, Casey FXM, Hakk H, et al. Dissipation and transformation of 17β-estradiol-17-sulfate in soil-water systems[J]. J Hazard Materi, 2013, 260(2): 733-739. |
| [73] |
Scherr FF, Sarmah AK, Di HJ, et al. Modeling degradation and metabolite formation kinetics of estrone-3-sulfate in agricultural soils[J]. Environ Sci Technol, 2008, 42(22): 83-88. |
| [74] |
Liu ZH, Lu GN, Yin H, et al. Sample-preparation methods for direct and indirect analysis of natural estrogens[J]. Trends in Analytical Chemistry, 2015, 64: 149-164. DOI:10.1016/j.trac.2014.09.003 |
| [75] |
Bai XL, Shrestha SL, Casey FXM, et al. Modeling coupled sorption and transformation of 17β-estradiol-17-sulfate in soil-water systems[J]. J Contam Hydrol, 2014, 168(6): 17-24. |
| [76] |
Ma L, Yates SR. Degradation and metabolite formation of estrogen conjugates in an agricultural soil[J]. Journal of Pharmaceutical & Biomedical Analysis, 2017, 145: 634-640. |
| [77] |
Ma L, Yates SR. Degradation and metabolite formation of 17β-estradiol-3-glucuronide and 17β-estradiol-3-sulphate in river water and sediment[J]. Water Res, 2018, 139: 1-9. DOI:10.1016/j.watres.2018.03.071 |
| [78] |
Zheng W, Zou YH, Li XL, et al. Fate of estrogen conjugate 17α-estradiol-3-sulfate in dairy wastewater:comparison of aerobic and anaerobic degradation and metabolite formation[J]. J Hazard Materi, 2013, 258-259(1): 109-115. |
| [79] |
Goeppert N, Dror I, Berkowitz B. Detection, fate and transport of estrogen family hormones in soil[J]. Chemosphere, 2014, 95(1): 336-345. |
| [80] |
Kumar V, Johnson AC, Nakada N, et al. De-conjugation behavior of conjugated estrogens in the raw sewage, activated sludge and river water[J]. J Hazard Materi, 2012, 227-228(16): 49-54. |
| [81] |
Blackwell BR, Johnson BJ, Buser MD, et al. Transformation kinetics of trenbolone acetate metabolites and estrogens in urine and feces of implanted steers[J]. Chemosphere, 2015, 138: 901-907. DOI:10.1016/j.chemosphere.2014.10.091 |
| [82] |
Ben WW, Zhu B, Yuan XJ, et al. Transformation and fate of natural estrogens and their conjugates in wastewater treatment plants:Influence of operational parameters and removal pathways[J]. Water Res, 2017, 124: 244-250. DOI:10.1016/j.watres.2017.07.065 |
| [83] |
D'Ascenzo G, Di CA, Gentili A, et al. Fate of natural estrogen conjugates in municipal sewage transport and treatment facilities[J]. Sci Total Environ, 2003, 302(1): 199-209. |
| [84] |
Gomes RL, Scrimshaw MD, Lester JN. Fate of conjugated natural and synthetic steroid estrogens in crude sewage and activated sludge batch studies[J]. Environ Sci Technol, 2009, 43(10): 3612-3618. DOI:10.1021/es801952h |
| [85] |
Singh J, Saharan V, Kumar S, et al. Laccase grafted membranes for advanced water filtration systems:a green approach to water purification technology[J]. Critical Rev Biotechnol, 2017, 38(6): 1-19. |
| [86] |
Ma L, Yates SR. A review on structural elucidation of metabolites of environmental steroid hormones via liquid chromatography-mass spectrometry[J]. TrAC-Trends Anal Chem, 2018, 109: 142-153. DOI:10.1016/j.trac.2018.10.007 |
| [87] |
Cabana H, Jones JP, Agathos SN. Utilization of cross-linked laccase aggregates in a perfusion basket reactor for the continuous elimination of endocrine-disrupting chemicals[J]. Biotechnology & Bioengineering, 2009, 102(6): 1582-1592. |
| [88] |
Taboada-Puig R, Junghanns C, Demarche P, et al. Combined cross-linked enzyme aggregates from versatile peroxidase and glucose oxidase:production, partial characterization and application for the elimination of endocrine disruptors[J]. Bioresour Technol, 2011, 102(11): 6593-6599. DOI:10.1016/j.biortech.2011.03.018 |
| [89] |
Lloret L, Eibes G, Feijoo G, et al. Continuous operation of a fluidized bed reactor for the removal of estrogens by immobilized laccase on Eupergit supports[J]. Journal of Biotechnology, 2012, 162(4): 404-406. DOI:10.1016/j.jbiotec.2012.04.007 |
| [90] |
Zdarta J, Meyer AS, Jesionowski T, et al. Developments in support materials for immobilization of oxidoreductases:A comprehensive review[J]. Advances in Colloid and Interface Science, 2018, 258: 1-20. DOI:10.1016/j.cis.2018.07.004 |
| [91] |
李卓轩, 封开政, 张薇, 等. 纳米酶的催化机制及应用[J]. 科学通报, 2018, 63(21): 2128-2139. |