2. 中国农业大学生物学院,北京 100083;
3. 北京食品营养与人类健康高精尖创新中心,北京 100083
2. College of Biology, China Agricultural University, Beijing 100083;
3. Beijing Advanced Innovation Center for Food Nutrition and Human Health, Beijing 100083
趋磁细菌(Magnetotactic bacteria,MTB)是一种依靠体内生物矿化所产生的磁性纳米颗粒,能够在外磁场的作用下定向运动的革兰氏阴性菌[1-2],一般为微好氧或厌氧型。其内部的磁性纳米颗粒为磁小体(Bacterial magnetosomes,BMs),在MTB体内组装成长链状,沿菌体长轴排列,在外磁场中引导菌体的运动。目前,MTB主要存在于细菌域的五大谱系内,其中3个属于变形杆菌门,分别是α-变形杆菌纲(Alphaproteobacteria)、γ-变形杆菌纲(Gammaproteobacteria)和δ-变形杆菌纲(Deltaproteobacteria),剩下两个分别属于Latescibacteria门和Omnitrophica门[3]。此外还有未被培养的MTB属于硝化螺旋菌门[4]。2017年,Liu[5]等在海底马里亚纳火山沉积物中发现了16种新型MTB,证实了MTB的种类多样性与其在进化中的生物矿化密不可分。
BMs主要由外层脂质膜和内部磁铁矿晶体构成,BMs的外膜由MTB细胞膜内陷生成。磁铁矿晶体形态多样,大小均一,为单磁畴纳米颗粒,具有较好的生物相容性、磁控性、磁热性、超顺磁性和较低的毒性。
目前有关MTB的改造工作主要基于改变菌体内BMs的形态、组成等达到间接改造MTB的目的,且主要通过化学修饰和物理修饰这两种策略对BMs进行功能化,进而在BMs表面修饰抗体、核酸、药物等多种物质应用于生物传感和癌症治疗等多个领域。当前用于BMs磁性检测的手段主要有Schüler等[6]的Camg法和在Camg法基础上改进的Ramg法[7]。在生物传感方面,与人工合成的磁性纳米粒子相比,BMs的应用主要局限于在膜的表面修饰上抗体,利用抗原抗体特异性免疫反应来实现目标物质的检测,形式比较单一。
1 趋磁细菌的基本特性及特点 1.1 趋磁细菌的结构组成及基本特性MTB通常是微好氧或者厌氧型的革兰氏阴性菌,具有丛生、一端或两端生的鞭毛[5],可以在外磁场的作用下沿磁感线方向运动。目前研究发现的MTB的种类与其所处环境有一定关系,主要有杆菌、球菌、螺旋菌、弧菌和卵菌等[8],分布在海洋、淡水等水体的沉积物中,丰度高低与沉积物的颗粒大小正相关[9]。不同类型的MTB所产生的磁性纳米颗粒,即BMs的形态也各不相同,因此不同种类MTB所具有的磁性也有很大差异。此外,其活菌具有一定的高热适应性(活菌可作为研究生物非热噪音的一种工具)[10]。
MTB产生BMs的过程称为生物矿化(图 1),虽然其具体机制尚未得到细致的解答[11],但可分为以下几个重要阶段:(1)细胞膜内陷形成磁小体膜;(2)磁小体链的组装;(3)环境中游离的铁离子通过细胞膜上的多种跨膜蛋白协助进入磁小体膜内[12];(4)空腔中的铁离子聚集;(5)铁离子形成磁铁矿晶体。MTB内部数量不等的BMs呈长链状,沿着细菌体内的肌动蛋白丝排列[13],沿长轴分布。MTB根据链状BMs提供的磁偶极矩沿着地磁场线运动,寻找适宜生存的低氧浓度区域得以存活,将三维空间中的运动转变为沿着地磁场线的一维运动,便于寻找适宜的生存区域[13],因此其生存区域常位于有氧无氧界面,即水与污泥交界面上[5]。在海洋河流等流动性的生存环境中,磁场可使得具有磁性的MTB克服水中的逆流并进行长距离的运动[14]。由于地理南北极和地磁场南北两极的划分,MTB的运动方向通常有所不同:一般认为在北半球分离得到的MTB会沿着地磁线向地磁南极游动,而在南半球分离得到的MTB会向地磁北极游动,处在赤道的MTB具有两极趋向性。
1.2 趋磁细菌的分离与筛选技术MTB本身以及其产生的BMs具有很高的应用价值,在各领域的需求量逐渐增多,但是细菌对于环境和营养的要求高、生长速率缓慢、遗传复杂性高,人工大量培养困难。并且由于缺乏对于MTB的筛选,品质优良且大量的BMs更难得到。因此人们需要提高MTB富集、收集和筛选的技术。首先需要采集泥样,根据MTB的生境,一般是在水与污泥交界面取水泥样品再进行富集。当前对于MTB的富集方法主要是利用化学培养基培养来实现,Blakemore等[16]使用一种以奎尼酸铁和琥珀酸盐作为铁离子来源和碳源的化学培养基富集到了淡水湖中的微好氧双鞭毛磁螺菌,这种培养基沿用至今,可对好氧及微好氧MTB进行分离及纯化。实验室针对MTB的收集主要有3种方法:一是用根据Matsunaga的反扣法设计的MTB收集器收集[17-19];二是用磁泳法收集,也可二者联用分离出不同种类的MTB[20];三是电磁诱导法收集,即利用通电螺线管产生磁场诱导MTB的原理进行收集[21]。
收集之后需要根据研究内容对收集到的MTB进行筛选。目前筛选MTB的方法一般是通过电子显微镜观察,并结合菌落颜色进行观察或使用Cmag法,而分离一般是用磁偶极子或诱导偶极子在磁场梯度的作用下拉下目标细菌。由于MTB的运动难以准确控制,会增加筛选难度。在最近发表的研究中,Tay等[22]开发了一种可以根据MTB的表型分离AMB-1的磁棘轮系统,可以自动、实时、定量筛选MTB。该磁棘轮筛选平台使用了高磁导率的镍铁导磁合金,合金柱水平排列组成微柱阵列,形成一个持续且循环的磁场,磁场产生的强大移动磁势陷阱可以捕捉AMB-1从而限制AMB-1的运动,在棘轮芯片上的AMB-1的传输受磁力的平衡控制而减少运动对筛选造成的影响。通过对磁场磁力的控制,可以筛选出不同类型的MTB。由此筛选得到的AMB-1可含有比一般AMB-1数量多2.2倍的BMs(大约25个)。
2 磁小体的基本特性及特点 2.1 磁小体的结构及组成BMs是一种由趋磁细菌产生的磁性纳米粒子,其主要结构分为外部生物被膜与内部矿物晶体两部分。BMs膜主要由磷脂、脂肪酸以及大量与BMs形成相关的近蛋白质(BMs膜蛋白Mam、磁粒子膜蛋白Mms等)组成,与生物体内的细胞膜系统成分相似[23],是由MTB细胞膜内陷形成。矿物晶体主要是由磁铁矿(氧化铁,Fe3O4)或胶黄铁矿(硫化铁,Fe3S4)矿物组成[15],晶体大小约为30-120 nm,经常使用的AMB-1和MSR-1所产BMs晶体直径为45-55 nm,个体形状一致[1],均为单磁畴磁性颗粒[24]。在高分辨率透射电镜的观察下,目前可以培养得到的MTB的BMs晶体结构主要有方形、矩形、六角形或子弹头形等,而这些结构都是基于立方体、八面体以及十二面体的延伸。不论是氧化铁晶体还是硫化铁晶体在室温下均具有永久磁矩,便于磁化。此外,在BMs中还发现了一些微量的其他金属元素的存在,如铜、金和钙等[25]。
2.2 磁小体的基本特性BMs独特的组成和结构给予其生化上与众不同的特性,在各领域被广泛应用。
2.2.1 磁小体表面膜修饰多样性与生物相容性BMs表面包被的生物膜富含磷脂和蛋白质,整体带负电[26],目前已有大约30种特异性蛋白被证实出现在BMs膜上,因而BMs表面膜结构具有多态性,可以利用其表面的特异性基团进行人工修饰使BMs具有不同的功能特性[27],如利用人血清白蛋白包裹磁铁矿可以作为药物的靶向运输载体和磁共振成像(MRI)的增强剂[28]。BMs膜由MTB天然形成,因而与一般的生物膜成分类似,具有很好的生物相容性[29],可参与药物靶向治疗或癌细胞检测。
2.2.2 磁小体的磁性与磁热效应BMs在MTB菌体内成链式结构,使之成为了细胞的“磁铁棒”,可以感受地磁场的变化,进而对MTB进行地磁导航,使得MTB在水体中长距离定向运动甚至克服逆流,此特性不仅可用于研究BMs作为药物靶向载体在体内的运动,还可用于研究地球地磁场的变化[30]。BMs还具有超顺磁性,即当外加磁场时BMs可以受外加磁场的引导,而撤掉外加磁场后BMs不再受其影响[31],因而可用作MRI的增强剂[32]。作为铁磁体的一种,BMs同样具有磁热效应,即在绝热的磁场条件下,BMs的温度随磁场强度增大而升高,可在癌症热疗中使用BMs来提高治疗的针对性。此外,基于法拉第电磁感应定律,纯化后的BMs和MTB可以在螺线管中发电[33]。
2.2.3 磁小体的低毒性BMs在低浓度下不会对生态系统造成任何影响[34]。目前的研究主要针对人体红细胞、WBC、小鼠巨噬细胞系(J774)、洋葱根尖和鱼(Oreochromis mossambicus)等多种模型对BMs的毒性进行评估。在以上模型中生物体存活率均高于90%。在体外纯化和灭菌后的BMs对于小鼠成纤维细胞也是无毒的[35]。此外,在医学和兽医昆虫学的研究上,磁性纳米颗粒(MNPs)对于疾病恶性疟原虫和登革病毒的传播载体—蚊子的幼虫和蛹都是有毒性的,这些毒性可以帮助研究人员研发抗疾病传播的BMs药物[36]。
2.3 磁小体的获取方法以BMs为研究对象,我们需要得到数量尽可能多、纯化程度高的BMs颗粒。目前被广泛使用的获取BMs的方法主要有物理破碎和化学消化两种,这两种方法也可叠加使用。物理破碎的一般流程为使用缓冲液或者蒸馏水将待处理MTB细胞充分悬浮,使用法式压榨机挤破细胞,之后使用超声波破碎装置将细胞破碎,然后通过离心外加钐钴磁铁的方式除去除BMs以外的其他物质,最后收集BMs[35, 37]。化学消化在物理法的基础上去掉了破碎的过程,增加了使用化学试剂或者酶消化细胞物质的过程,同样使用缓冲液或者蒸馏水清洗后离心,磁铁收集BMs[38-39]。二者联用效率更高,如在2011年新发明的一种纯化BMs的方法中,Guo等[39]用高压匀浆器破坏细胞,用低功率超声波和尿素处理BMs,蛋白酶K去除吸附和表面蛋白,电洗液去除核酸;利用该方法可大大减少纯化时间,增加纯化效率,也可通过增加层析柱(磁选柱)来提高BMs的纯化度。如Grünberg等[40]在物理法离心收集沉淀后,增加了一个MACS柱来收集BMs,在洗脱的过程中可以消除静电吸附造成的污染,提高BMs的纯化程度。
3 趋磁细菌的改造策略 3.1 对趋磁细菌及其内部磁铁矿晶体形态的改造环境对于生物生长、发育、繁殖影响深远,Kundu等[41]研究了环境中高浓度的锌和镍对MS-1的生长和BMs形成的影响,研究发现,当培养环境中存在大量的锌离子时,MTB的长度会随BMs大小和数量的增加而增加。锌作为MTB所需的微量元素,过高的浓度却没有对细菌产生毒害作用,根据这一特性,可以通过在培养基中添加金属盐离子(锌离子)来提高MTB的质量和产量。Tanaka等[42]在研究AMB-1的生物矿化过程时发现,在体外实验中缺失Mms6基因的突变株形成了晶体面较小的长条形磁铁矿晶体,而互补组和野生组均形成高度有序的立方八面体晶体,进而推测膜蛋白质Mms6在该过程中负责调节BMs晶体形状,研究表明蛋白质通过对金属离子进行选择性结合,推迟晶体成核反应,进而调控BMs形态大小[43]。通过人工控制Mms6的表达和作用,可以达到改造BMs晶体形状的目的。
3.2 对趋磁细菌组成的改造相对于对BMs膜进行修饰,对MTB膜进行改造的研究相对较少。Chen等[44]根据MTB的能动性和可控性,使用兔抗MO-1细胞多克隆抗体来覆盖MO-1细胞表面,使用蛋白A来做连接,制造出了简单的磁性细菌微型机器人,在微流控芯片中,磁导使这种微型机器人移动到病原菌富集区,携带并分离病原菌。
3.3 在趋磁细菌培养中掺杂其他金属Li等[45]在MTB培养基中添加钴离子,得到的BMs利用x射线磁性圆二色性(XMCD)分析,得到了金属钴掺杂在BMs内的有力证据。该分析表明由于钴离子在磁铁矿的八面体位置中取代Fe离子而与BMs内部晶体融合在一起,而且钴在晶体内的分布是不均匀的。Tanaka等[46]根据最小抑制浓度(MIC)系统分析第一次得到了Cu2+在MTB中最高掺杂度为15.6%,且发现在相同培养条件下,MTB更易摄取过渡金属,可以通过增加培养环境中的过渡金属离子Mn2+和Co2+的浓度来提高金属掺杂度,掺杂金属钴培养得到的BMs具有很好的矫顽值和比较低的Verway转变温度。此外,在生长培养基中添加微量钴可以显著地促进MTB的细胞生长和磁体形成[47]。
4 磁小体的功能化策略 4.1 化学修饰化学修饰是指在BMs膜表面连接固定化学物质或将BMs的膜替换为人工合成聚合物。前者主要包括固定化酶,利用交联剂连接抗体、药物,生物素化等,后者主要指BMs重构。经过化学修饰后的BMs,可以定向连接其他物质,将其原有的表面修饰能力变得更有针对性,能够更好地应用于靶向载药、病原菌与癌细胞检测、生物传感等方面。
4.1.1 固定化酶固定化酶技术是用载体将酶束缚在一定的空间范围内、保留其活性、可反复利用和回收的一项技术。因此,固定化酶的载体材料不能影响酶的活性,还要保证回收率。Matsunaga等[38]发现BMs可以用于固定生物活性物质,与先前使用的大尺寸磁性白蛋白微球相比,BMs尺寸小且可受磁场控制,可作为良好的固定化酶载体。其研究团队使用γ-氨丙基三乙氧基硅烷作为连接物分别在BMs和人工磁铁矿、锌铁氧化颗粒上固定葡萄糖氧化酶和尿酸酶。结果发现在BMs上固定化酶的活性比人工磁铁矿或锌铁氧体颗粒高出整整40倍,而且BMs固定化酶在反复使用5次后仍保留活性。
4.1.2 交联剂-磁小体复合物交联剂可以作为BMs和特征物质之间的黏着剂,对交联剂的要求是:不影响磁BMs和特征物质的活性,保证二者的稳定连接。针对不同特征物质选用的交联剂种类与数目不同,主要的特征物质有抗体、药物、探针等。Xiong等[48]在之前研发出高磁化、均匀尺寸和正电荷的氧化铁磁性纳米团(MNCs)的基础之上,生产出了高性能富集循环肿瘤细胞(CTC)的仿生磁小体(IMSs)(图 2)。使用静电相互作用,将MNCs与白细胞膜片段结合起来形成具有细胞同源性的磁性纳米颗粒(LMNC),当仿生磁小体在外周血中遇到白细胞时就能产生排斥,从而降低富集背景中的白细胞干扰。在白细胞膜片段外表面结合上叠氮化物(N3),之后使用点击化学将二苯环辛烯组修饰的抗体(DBCO-Ab)结合到叠氮化物上形成高富集效率的仿生免疫磁小体。大约90%的罕见肿瘤细胞都能在15 min之内富集完毕。Pi等[49]使用化学吸附法,用1-(3-二甲基氨基丙基)-3-乙基碳二酰亚胺做化学链接剂链接黄曲霉素B1多克隆抗体和BMs来提取黄曲霉毒素B1。Deng等[26]根据BMs表面存在大量氨基酸残基和蛋白质,富含磷脂酰乙醇胺而带负电的特性,利用双功能交联试剂GP实现癌症药物阿拉伯胞嘧啶糖苷(Ara-C)与BMs表面氨基酸残基的连接,减少癌症药物的副作用。Dai等[50]利用聚乙烯亚胺(PEI)作为交联剂合成BMs-PEI-siRNA复合体。PEI是一种聚合物基体,可以用于传递DNA、siRNA以及寡核苷酸;通过静电相互作用,将上述基因片段装载在PEI上,PEI对siRNA还有保护作用,可以防止其被核糖核酸酶降解。
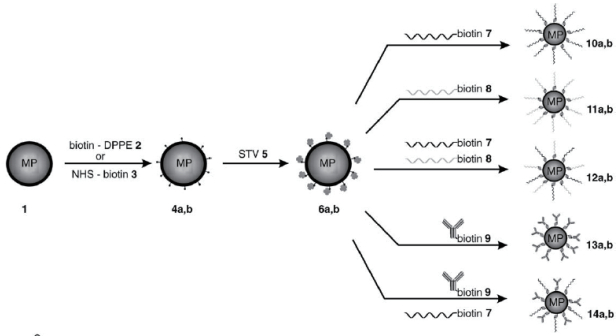
4.1.3 生物素化磁小体利用生物素对BMs表面进行修饰,以链酶亲和素(STV)为连接体,可将各种生物素化的物质连接在BMs上。Ceyhan等[51]利用BMs表面丰富的基团对BMs进行了改造,实现了对核酸的检测(图 3)。首先BMs表面生物素化:可以使用生物素化的脂质生物素-DPPE直接参与脂膜形成,也可以利用NHS-生物素对BMs表面蛋白质进行修饰,使其表面携带生物素;然后使用STV与生物素进行连接,形成STV-biotin-MPs复合物,接下来,可以使用生物素化的多种物质进行连接。例如,生物素化的寡聚核苷酸(DNA)用于检测单核苷酸多态性(SNP)[52]、生物素化的抗体用于制备免疫磁珠[53-54]等,上述连接物质还可同时连接。利用生物素化BMs还可将检测SNP的分子探针交联在BMs表面,如Ota等[52]设计出了仅有9个碱基长度且具有特异性的分子探针用于检测TGF-β1的SNP并使用NHS-生物素修饰BMs,利用STV将同样生物素化的DNA固定在BMs表面,随后Matsunag等[55]利用同样的修饰方法,基于等位基因特异性寡核苷酸杂交和生物素化BMs颗粒进行热离解曲线分析的半自动化系统对SNP进行高通量检测,与传统的基于序列的方法相比,基于半自动化的BMs的SNP检测系统具有高可靠性。
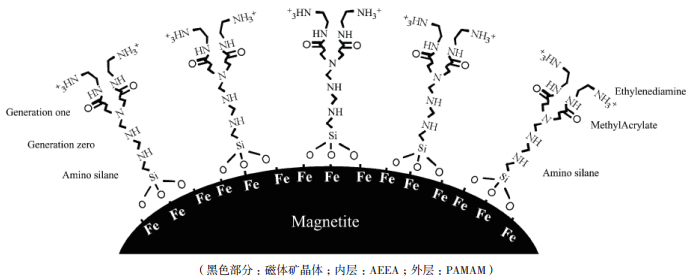
4.1.4 磁小体重构BMs重构指的是BMs结构的重新组装,包括BMs单独个体的重构,也包括BMs整体的重构,这种重构一般是将BMs膜去除后包裹其他聚合物等物质,经过重构的BMs可获得某方面的特殊性质。Yoza等[56]就将BMs膜去除,使用具有多氨基的3-[2-氨基乙基]-乙基胺基-乙基甲氧基硅烷(AEEA)重新包裹BMs内的晶体(图 4),使得重构后的BMs表面阳离子增多,可与带负电的DNA充分结合,DNA提取率高;再使用一种树状的多胺(PAMAM)分子通过级联反应在改造后的BMs表面生成一种致密的外胺壳。随外壳层数增加,胺浓度上升,进而阳离子数目的大量增加有助于生成胶体悬浮液,增加表面积,用于DNA提取。该外壳还可减少BMs之间的聚集,增加分散性。Matsunaga等[57]利用BMs表面蛋白A-LgG的结合域将生物素标记的BMs固定在具有条纹聚苯乙烯微球上,构建了微球-磁小体复合物,以增加其分散性和磁性,这种复合物的检测效率比单独使用BMs高,而且检测上限大,可用于开发高通量、全自动的生物分析工具。
4.2 生物修饰生物修饰主要是将生物成分加工到BMs结构中,或者利用MTB的生物矿化过程将物质带入BMs内部,如通过蛋白质、多肽等代替交联剂连接抗体,使BMs表面携带绿色荧光蛋白(GFP)等。
4.2.1 蛋白质/多肽-磁小体复合物在化学修饰中提到的多种化学交联剂,虽然交联能力强,但用量大、价格昂贵,还存在所连接抗体取向不一,可变区与BMs连接的问题。使用多样化的蛋白质或多肽来替代交联剂也可达到相近的效果,甚至还可实现使用交联剂达不到的效果。例如,同样是连接抗体,可以利用金黄色葡萄球菌的胞壁蛋白蛋白A基因与磁细菌MSR-1膜上表达量最多的MamC和表达量第二多的MamF基因整合后表达出融合蛋白,重组之后的BMs可以与多数哺乳动物IgG的Fc片段结合形成功能性BMs[58-59]。Takahashi等[60]通过使用MmsC-NS多肽链融合蛋白的方式将由4个天冬酰胺和1个丝氨酸残基组成的长度为100个氨基酸的NS多肽链修饰在BMs表面,多肽链末端可连接蛋白G,该复合物增强了BMs的分散性和特异性结合能力。
4.2.2 荧光蛋白-磁小体复合物Lang和Schüler等[61]通过将GFP基因与相关蛋白质基因共表达,形成融合蛋白,使BMs表面蛋白质携带荧光基团。小组用这种荧光蛋白-磁小体复合物,在流式细胞法、荧光显微镜和生物化学分析等帮助下,研究了微好氧MTB中融合蛋白在BMs中的定位和表达。该方法克服了相互排斥的高荧光和磁铁矿合成的矛盾,建立了可以保证MTB正常生长、正常进行生物矿化和GFP荧光团正常形成的最佳(氧气)条件。并在这些优化的条件下,利用荧光显微技术和免疫印迹技术,研究了GFP标记的MamC,MamF和MamG的胞内定位和表达。其中MamC-GFP表现出最强烈的荧光(表达量最高),纯化得到的MamC-GFP所标记的BMs对洗涤剂敏感,但在广泛的温度和盐浓度范围下稳定。该研究团队认为GFP融合蛋白荧光标记法最适合用于MamC的检测。根据MamC与GFP的高适应性,Mickoleit等[62]在基因改造的水平上,利用酶阵列基因表达,制备出了具有放大催化活性的多功能BMs(图 5)。他们使用5个大肠杆菌β-葡糖醛酸酶(GusA)构成一个酶的微阵列,并与荧光团mEGFP基因(即细菌的增强型GFP)、BMs膜表面表达量最多且具有亲水性N端的MamC融合,高度表达形成杂合蛋白,修饰在BMs表面,3个蛋白质的基因位于同一启动子之后。其中mEGFP蛋白与MamC连接后,可以稳定并增强BMs的荧光[63],MamC起到了膜定位的作用。即使增加GusA单体的数量也不会影响BMs磁性、荧光以及催化活性的稳定性,可为将BMs应用于医疗提供便利。
5 磁细菌的产业化应用 5.1 在重金属污染废水中的应用工业生产如电镀、电子设备制造厂排放废液中的重金属离子会污染环境(如铅、铜、镍和镉等),破坏生态,有时我们也需要对废液中的重金属离子进行二次回收生产其他产品。化学沉淀法、溶剂萃取法、离子交换法等许多传统方法都有助于缓解这种危害性。但是当金属离子浓度低于100 mg/L时,所有这些方法都是高成本且无效的,有些甚至会造成二次污染[64]。MTB在磁场下可以实现对废液重金属离子的吸附,这种生物吸附法是环保的,如MTB对Pd/AL废液系统的吸附,无论是对Pd2+还是对AL3+吸附过程都十分快速,其中对Pd2+具有优先吸附性,二者的吸附均符合拟二阶吸附动力学模型。并且随着磁场强度的增加,分离效果提高的同时,分离速率也会显著提高[65]。此外,MTB还可实现对Cr[66]以及Cu[64]等其他金属离子的吸附回收。
5.2 在生物学、地理学、医学等方面的应用在生物学方面,对于古MTB化石的研究有助于科学家探究地球生命的起源问题[67]。在地理学层面,MTB可帮助我们恢复古环境、了解沉积剩磁状况和推测古地磁方向。在35亿-38亿年前,古MTB已在地球上出现,其生长发育、BMs的生物矿化过程与环境密不可分,在地磁场线排列和运动也与地磁场的变化联系紧密。彭先芝等[68]收集了不同环境黄土剖面L6-S5-L5层段中的MTB,通过对其形态大小、数量以及BMs结构的研究,发现MTB的分布与古环境气候存在联系,并以此推测出了黄土高原古气候频繁波动的状态和自北向南的变化趋势。MTB在医学方面的研究潜力无限,2014年,Chen等[44]利用金黄色葡萄球菌胞壁蛋白A连接兔抗MO-1细胞多克隆抗体和磁细菌MO-1,制造出了简单的磁性细菌微型机器人。该机器人可在微流控芯片中,受磁导移动到病原菌富集区,携带并分离病原菌。该方案可能将在未来医学检测中被广泛应用。
6 磁小体的产业化应用 6.1 在食品检测中的应用BMs经过功能化修饰后可携带抗体成为免疫磁珠,与食品中的病原菌或毒性物质特异性结合达到分离效果,通过连接一些检测装置达到检测的效果[69]。Xu等[59]使用生物修饰法构建了LgG-SpA(金黄色葡萄球菌胞壁蛋白A)-磁小体复合物,并结合实时荧光定量PCR技术(RT-qPCR)用于检测海产品中的副溶血性弧菌的数量,结果表明,一毫克的复合物能够捕捉多达1.74×107个弧菌细胞。Pi等[70]利用黄曲霉毒素B1多克隆抗体和BMs制备免疫磁珠探针提取植物油中的黄曲霉毒素B1。他们使用化学吸附法通过1-(3-二甲基氨基丙基)-3-乙基碳二酰亚胺做化学偶联剂连接黄曲霉毒素B1多克隆抗体和BMs,与传统的Fe3O4磁性纳米颗粒-黄曲霉毒素B1抗体探针相比,该免疫磁珠在植物油中对黄曲霉毒素B1的吸收高出28倍,回收率高达93.7%;Wu等[71]使用同样方法构建出的葡萄球菌肠毒素B(SEB)抗体-磁小体复合物可回收并检测牛奶中的SEB,检测范围为0.05-5 ng/mL,回收效率高达118%;Peng等[54]利用免疫磁珠分离技术结合荧光标记DNA适体文库作为直接特异性报告者,快速检测了猪仔体内的大肠杆菌K88。
6.2 在癌症治疗中的应用BMs具有良好的生物相容性、超顺磁性和低毒性,体积微小且均一,相比于人工磁性纳米粒子而言,天然产生的BMs在癌症治疗中举足轻重。BMs不仅仅可以作为MRI的对比剂,还可以作为MRI的特异性标记分子与成像探针[72]。Boucher等[72]使用生物修饰法,构建脑瘤整合素合成必需RGD肽表达载体,实现BMs表面Mamc-RGD肽融合蛋白的表达,并使用荧光蛋白作为标记基因,增加MRI检测脑瘤细胞的特异性。在交变磁场控制下,BMs可侵入肿瘤细胞,从而抑制肿瘤细胞增殖。根据BMs这一特性可以将清除肿瘤细胞的药物与BMs结合在一起,实现药物靶向运输,增加肿瘤治疗的特异性和靶向性。余水生团队[73]使用BMs靶向运输阿霉素/pHSP70-shPLK1双重药物实现了对骨肉瘤的治疗。利用生物修饰法,他们将构建的pHP70-shPLK1载体导入BMs内部,并使阿霉素均匀覆盖在BMs表面,该复合物可有效降低肿瘤细胞的增殖、侵染能力,提高肿瘤细胞的凋亡率。Deng等[26]利用化学修饰法通过双功能交联试剂GP实现药物Ara-C与BMs表面氨基酸残基的连接,减少癌症药物的毒性。在磁热疗方面,BMs可充分发挥它在磁场中的热特性[74],增加升温的针对性,缩小升温的范围,从而提高了肿瘤细胞的死亡率而减少了副作用,将磁热疗技术与免疫磁珠联用,还可用于体内灭菌,Chen等[44]利用该法发现50%与MTB发生接触的金黄色葡萄球菌经过磁热作用后死亡。
7 总结和展望总体来说,目前对于MTB的改造策略主要通过改变菌体内BMs的形态和组成等间接达到改造MTB的目的,且MTB主要用于废水中重金属的吸附和去除。对于BMs的功能化策略,主要分为化学修饰法和生物修饰法,通过在BMs膜的表面修饰上各种功能活性基团比如酶、抗体、核酸、药物等将BMs应用于医疗、检测等各个领域。
对MTB直接进行改造,可借鉴BMs功能化方法,利用MTB膜表面的活性基团在其表面共价或非共价修饰上各种物质;或采用融合蛋白法,使MTB膜表面上的某一种蛋白质、脂质或其他生物分子等大量生成,利用MTB膜表面这些大量生成的生物分子来连接功能活性物质;这可大大拓宽MTB的应用范围。另外,目前向MTB的BMs磁铁矿晶体内掺杂金属仍处于研究阶段,且研究主要局限于过渡金属,应用极少。可使用富含Co2+的培养基得到掺杂金属Co的BMs;其具有较强的矫顽力,稳定性较好,且无毒害作用,可用于提高磁热疗的效果。
此外,BMs目前主要应用于医疗领域作为药物递送载体、MRI造影剂或成像探针等。而在检测领域主要通过在BMs表面修饰上抗体,利用抗原抗体之间的特异性免疫反应来吸附病原菌、病毒、毒素等靶物质,进而实现对目标物质的检测,方法较单一。这是今后基于BMs构建检测技术需要克服的关键问题之一。抗体稳定性较差,易失去活性,制备成本高;而功能核酸稳定性好,形式多样且易于制备。因此,可以利用BMs表面丰富的氨基共价修饰上核酸并利用BMs的天然磁性实现对金属离子、生物小分子等其他靶物质的高效检测。还可以将功能化BMs与试纸条等检测技术联用,实现靶物质的快速检测等。
| [1] |
林巍, 田兰香, 潘永信. 趋磁细菌磁小体研究进展[J]. 微生物学通报, 2006, 33(3): 133-137. DOI:10.3969/j.issn.0253-2654.2006.03.026 |
| [2] |
江淼, 马胜伟, 吴洽儿. 趋磁细菌研究进展[J]. 生物学杂志, 2017, 34(5): 93-97. DOI:10.3969/j.issn.2095-1736.2017.05.093 |
| [3] |
陈明杰, 卫扬保. 趋磁细菌及磁小体研究的回顾和展望[J]. 微生物学杂志, 1995(1): 53-57. |
| [4] |
Lefèvre CT, Bazylinski DA. Ecology, diversity, and evolution of magnetotactic bacteria[J]. Microbiology & Molecular Biology Reviews Mmbr, 2013, 77(3): 497-526. |
| [5] |
Jia L, Zhang W, Li X, et al. Bacterial community structure and novel species of magnetotactic bacteria in sediments from a seamount in the Mariana volcanic arc[J]. Sci Rep, 2017, 7(1): 17964. DOI:10.1038/s41598-017-17445-4 |
| [6] |
Schüler D, Uhl R, Bäuerlein E. A simple Light scattering method to assay magnetism in Magnetospirillumgryphiswaldense[J]. FEMS Microbiology Letters, 1995, 132(1-2): 139-145. DOI:10.1111/fml.1995.132.issue-1-2 |
| [7] |
Zhao L, Wu D, Wu LF, et al. A simple and accurate method for quantification of magnetosomes in magnetotactic bacteria by common spectrophotometer[J]. Journal of Biochemical & Biophysical Methods, 2007, 70(3): 377-383. |
| [8] |
Islam T, Peng C, Ali I. Morphological and cellular diversity of magnetotactic bacteria:A review[J]. Journal of Basic Microbiology, 2018, 58(5): 378-389. DOI:10.1002/jobm.v58.5 |
| [9] |
Xu C, Zhang W, Pan H, et al. Distribution and diversity of magnetotactic bacteria in sediments of the Yellow Sea continental shelf[J]. Journal of Soils & Sediments, 2018(1-4): 1-13. |
| [10] |
Nagard ll, Barkley S, Zhu X, et al. Measuring the effective temperature of single magnetotactic bacteria as a tool to study non-thermal biological noise[J]. Biophysical Journal, 2018, 114(3): 328a-329a. |
| [11] |
Peigneux A, Valverde-Tercedor C, Lopez-Moreno R, et al. Learning from magnetotactic bacteria:a review on the synthesis of biomimetic nanoparticles mediated by magnetosome-associated proteins[J]. Journal of Structural Biology, 2016, 196(2). |
| [12] |
Nies D H. How iron is transported into magnetosomes[J]. Molecular Microbiology, 2011, 82(4): 792-796. DOI:10.1111/j.1365-2958.2011.07864.x |
| [13] |
刘伟伟, 孙秀兰, 张银志, 等. 一株微好氧趋磁细菌TH-1的分离及其磁小体研究[J]. 食品与生物技术学报, 2012, 31(6): 634-639. DOI:10.3969/j.issn.1673-1689.2012.06.012 |
| [14] |
Rismani YS, Nosrati R, Stevens CA, et al. Magnetotaxis:magnetotaxis enables magnetotactic bacteria to navigate in flow[J]. Small, 2018, 14(5): 1870019. DOI:10.1002/smll.v14.5 |
| [15] |
Faivre D, Schüler D. Magnetotactic bacteria and magnetosomes[J]. Chemical Reviews, 2008, 108(11): 4875-4898. DOI:10.1021/cr078258w |
| [16] |
Blakemore RP, Maratea D, Wolfe RS. Isolation and pure culture of a freshwater magnetic spirillum in chemically defined medium[J]. Journal of Bacteriology, 1979, 140(2): 720. |
| [17] |
卫扬保, 张洪霞. 趋磁细胞研究:I.武昌东湖水体中趋磁细胞WD-1的分离[J]. 武汉大学学报:自然科学版, 1994(6): 115-120. |
| [18] |
Fan GC, Li RS, Li XG, et al. Distribution of magnetotactic bacteria in China and characterization of magnetosomes[J]. Chiese Science Bulletin, 1996(11): 944-948. |
| [19] |
阮颖, 谭周进, 任文辉, 等. 趋磁细菌的分离研究[J]. 湖南农业大学学报:自然科学版, 1998(3): 238-240. |
| [20] |
陈龙, 王国斌, 陶凯雄. 趋磁细菌纳米磁小体的培养与分离及其在医学上的应用进展和前景[J]. 现代生物医学进展, 2008, 8(7): 1327-1333. |
| [21] |
解宇, 汪浩. 磁性细菌的电磁诱导分离及人工培养[J]. 健康研究, 2007, 27(4): 217-221. |
| [22] |
Tay A, Murray C, Di Carlo D. Phenotypic selection of Magnetospirillum magneticum(AMB‐1)overproducers using magnetic ratcheting[J]. Advanced Functional Materials, 2017, 27(41). |
| [23] |
Grünberg K, Müller E C, Otto A, et al. Biochemical and proteomic analysis of the magnetosome membrane in Magnetospirillum gryphiswaldense[J]. Applied & Environmental Microbiology, 2004, 70(2): 1040. |
| [24] |
李宁.应用微流实验系统研究趋磁细菌对环境氧浓度和磁场变化的响应[D].北京: 北京大学, 2012.
|
| [25] |
Farina M. Gold and silver trapping by uncultured magnetotactic cocci[J]. Geomicrobiology Journal, 2005, 22(1-2): 55-63. DOI:10.1080/01490450590922550 |
| [26] |
Deng Q, Liu Y, Wang S, et al. Construction of a novel magnetic targeting anti-tumor drug delivery system:cytosine arabinoside-loaded bacterial magnetosome[J]. Materials, 2013, 6(9): 3755. DOI:10.3390/ma6093755 |
| [27] |
Kutralam-Muniasamy G, Perez-Guevara F. Recombinant surface engineering to enhance and expand the potential of biologically produced nanoparticles:A review[J]. Process Biochemistry, 2016, 59: 4-17. |
| [28] |
Erdal E, Demirbilek M, Yeh Y, et al. A comparative study of receptor-targeted magnetosome and HSA-coated iron oxide nanoparticles as MRI contrast-enhancing agent in animal cancer model[J]. Applied Biochemistry & Biotechnology, 2017, 185(1): 91-113. |
| [29] |
Boucher M, Geffroy F, Prévéral S, et al. Genetically tailored magnetosomes used as MRI probe for molecular imaging of brain tumor[J]. Biomaterials, 2017, 121: 167-178. DOI:10.1016/j.biomaterials.2016.12.013 |
| [30] |
Chang SBR, Kirschvink JL. Magnetofossils, the magnetization of sediments, and the evolution of magnetite biomineralization[J]. Annual Review of Earth & Planetary Sciences, 1989, 17(1): 169-195. |
| [31] |
Valverdetercedor C, Perezgonzalez T, Sanchezquesada MS, et al. Size control of in vitro synthesized magnetite crystals by the MamC protein of Magnetococcus marinus strain MC-1[J]. Applied Microbiology & Biotechnology, 2015, 99(12): 5109-5121. |
| [32] |
Orlando T, Mannucci S, Fantechi E, et al. Characterization of magnetic nanoparticles from Magnetospirillum gryphiswaldense as potential theranostics tools[J]. Contrast Media & Molecular Imaging, 2015, 11(2): 139-145. |
| [33] |
Smit BA, Van Zyl E, Joubert JJ, et al. Magnetotactic bacteria used to generate electricity based on faraday's law of electromagnetic induction[J]. Letters in Applied Microbiology, 2018, 66(5): 362-367. DOI:10.1111/lam.2018.66.issue-5 |
| [34] |
Revathy T, Jayasri MA, Suthindhiran K. Toxicity assessment of magnetosomes in different models[J]. Biotech, 2017, 7(2): 126. |
| [35] |
Xiang L, Wei J, Jianbo S, et al. Purified and sterilized magnetosomes from Magnetospirillum gryphiswaldense MSR-1 were not toxic to mouse fibroblasts in vitro[J]. Lett Appl Microbiol, 2007, 45(1): 75-81. DOI:10.1111/lam.2007.45.issue-1 |
| [36] |
Murugan K, Wei J, Alsalhi MS, et al. Magnetic nanoparticles are highly toxic to chloroquine-resistant Plasmodium falciparum, dengue virus(DEN-2), and their mosquito vectors[J]. Parasitology Research, 2017, 116(2): 1-8. |
| [37] |
李金华, 潘永信, 刘青松, 等. 趋磁细菌Magnetospirillum magneticum AMB-1全细胞和纯化磁小体的磁学比较研究[J]. 科学通报, 2009(21): 3345-3351. |
| [38] |
Matsunaga T, Kamiya S. Use of magnetic particles isolated from magnetotactic bacteria for enzyme immobilization[J]. Applied Microbiology & Biotechnology, 1987, 26(4): 328-332. |
| [39] |
Guo F, Liu Y, Chen Y, et al. A novel rapid and continuous procedure for large-scale purification of magnetosomes from Magnetospirillum gryphiswaldense[J]. Applied Microbiology & Biotechnology, 2011, 90(4): 1277-1283. |
| [40] |
Grünberg K, Wawer C, Tebo BM, et al. A Large gene cluster encoding several magnetosome proteins is conserved in different species of magnetotactic bacteria[J]. Applied & Environmental Microbiology, 2001, 67(10): 4573. |
| [41] |
Kundu S, Kale AA, Banpurkar AG. On the change in bacterial size and magnetosome features for Magnetospirillum magnetotacticum(MS-1)under high concentrations of zinc and nickel[J]. Biomaterials, 2009, 30(25): 4211-4218. DOI:10.1016/j.biomaterials.2009.04.039 |
| [42] |
Tanaka M, Mazuyama E, Arakaki A, et al. MMS6 protein regulates crystal morphology during nano-sized magnetite biomineralization in vivo[J]. J Biol Chem, 2011, 286(8): 6386-6392. DOI:10.1074/jbc.M110.183434 |
| [43] |
马坤, 赵宏鑫, 李倩, 等. 磁小体膜蛋白Mms6功能与应用研究进展[J]. 生物技术通报, 2017, 33(9): 48-55. |
| [44] |
Chen CY, Chen CF, Yi Y, et al. Construction of a microrobot system using magnetotactic bacteria for the separation of Staphylococcus aureus[J]. Biomedical Microdevices, 2014, 16(5): 761-770. DOI:10.1007/s10544-014-9880-2 |
| [45] |
Li J, Menguy N, Arrio MA, et al. Controlled cobalt doping in the spinel structure of magnetosome magnetite:new evidences from element- and site-specific X-ray magnetic circular dichroism analyses[J]. Journal of the Royal Society Interface, 2016, 13(121): pii20160355. DOI:10.1098/rsif.2016.0355 |
| [46] |
Tanaka M, Brown R, Hondow N, et al. Highest Levels of Cu, Mn and Co doped into nanomagnetic magnetosomes through optimized biomineralisation[J]. Journal of Materials Chemistry, 2012, 22(24): 11919-11921. DOI:10.1039/c2jm31520c |
| [47] |
李金华, 潘永信.磁小体磁铁矿晶格中钴的掺杂及其磁学效应[C]. 2014年中国地球科学联合学术年会论文集, 2014: 225-225.
|
| [48] |
Xiong K, Wei W, Jin Y, et al. Biomimetic immuno-magnetosomes for high-performance enrichment of circulating tumor cells[J]. Advanced Materials, 2016, 28(36): 7929-7935. DOI:10.1002/adma.201601643 |
| [49] |
Pi F, Sun J, Liu W, et al. Elimination of aflatoxin B1, in vegetable oil based on immuno- magnetosomes probes from a novel magnetotactic bacterium[J]. Food Control, 2017, 80: 319-326. DOI:10.1016/j.foodcont.2017.04.004 |
| [50] |
Dai Q, Long R, Wang S, et al. Bacterial magnetosomes as an efficient gene delivery platform for cancer theranostics[J]. Microbial Cell Factories, 2017, 16(1): 216. DOI:10.1186/s12934-017-0830-6 |
| [51] |
Ceyhan B, Alhorn P, Lang C, et al. Semisynthetic biogenic magnetosome nanoparticles for the detection of proteins and nucleic acids[J]. Small, 2006, 2(11): 1251-1255. DOI:10.1002/(ISSN)1613-6829 |
| [52] |
Ota H, Takeyama H, Nakayama H, et al. SNP detection in transforming growth factor-β1 gene using bacterial magnetic particles[J]. Biosensors and Bioelectronics, 2003, 18(5-6): 683-687. DOI:10.1016/S0956-5663(03)00015-0 |
| [53] |
Li AH, Zhang HY, Xin Z, et al. Rapid separation and immunoassay for Low Levels of Salmonella, in foods using magnetosome-antibody complex and real-time fluorescence quantitative PCR[J]. Journal of Separation Science, 2010, 33(21): 3437. DOI:10.1002/jssc.v33:21 |
| [54] |
Peng Z, Ling M, Ning Y, et al. Rapid fluorescent detection of Escherichia coli K88 based on DNA aptamer library as direct and specific reporter combined with immuno-magnetic separation[J]. Journal of Fluorescence, 2014, 24(4): 1159-1168. DOI:10.1007/s10895-014-1396-x |
| [55] |
Matsunaga T, Maruyama K, Takeyama H, et al. High-throughput SNP detection using nano-scale engineered biomagnetite[J]. Biosens Bioelectron, 2007, 22(10): 2315-2321. |
| [56] |
Yoza B, Arakaki A, Matsunaga T. DNA extraction using bacterial magnetic particles modified with hyperbranched polyamidoamine dendrimer[J]. Journal of Biotechnology, 2003, 101(3): 219. DOI:10.1016/S0168-1656(02)00342-5 |
| [57] |
Matsunaga T, Maeda Y, Yoshino T, et al. Fully automated immunoassay for detection of prostate-specific antigen using nano-magnetic beads and micro-polystyrene bead composites, 'Beads on Beads'[J]. Analytica Chimica Acta, 2007, 597(2): 331-339. DOI:10.1016/j.aca.2007.05.065 |
| [58] |
李爱华, 唐涛, 张惠媛, 等. 细菌磁小体的修饰及其在病原物检测中的应用[J]. 生物物理学报, 2010, 26(8): 680-690. |
| [59] |
Xu J, Hu J, Liu L, et al. Surface expression of protein A on magnetosomes and capture of pathogenic bacteria by magnetosome/antibody complexes[J]. Front Microbiol, 2014, 5(2): 136. |
| [60] |
Takahashi M, Yoshino T, Matsunaga T. Surface modification of magnetic nanoparticles using asparagines-serine polypeptide designed to control interactions with cell surfaces[J]. Biomaterials, 2010, 31(18): 4952. DOI:10.1016/j.biomaterials.2010.02.048 |
| [61] |
Lang C, Schüler D. Expression of green fluorescent protein fused to magnetosome proteins in Microaerophilic magnetotactic bacteria[J]. Applied & Environmental Microbiology, 2008, 74(15): 4944. |
| [62] |
Mickoleit F, Schüler D. Generation of multifunctional magnetic nanoparticles with amplified catalytic activities by genetic expression of enzyme arrays on bacterial magnetosomes[J]. Advanced Biosystems, 2018, 2(1): 1700109. DOI:10.1002/adbi.v2.1 |
| [63] |
Borg S, Hofmann J, Pollithy A, et al. New vectors for chromosomal integration enable high-Level constitutive or inducible magnetosome expression of fusion proteins in Magnetospirillum gryphiswaldense[J]. Applied & Environmental Microbiology, 2014, 80(8): 2609-2016. |
| [64] |
Song H, Li X, Sun J, et al.Heavy metals removal from wastewater by magnetic field-magnetotactic bacteria technology[C]. Annual Meeting, 2006.
|
| [65] |
宋慧平, 李鑫钢, 孙津生, 等. 生物吸附-磁分离法处理含Pd(Ⅱ)/AL(Ⅲ)的废液[J]. 化学工程, 2008, 36(10): 5-8. DOI:10.3969/j.issn.1005-9954.2008.10.002 |
| [66] |
Qu Y, Zhang X, Xu J, et al. Removal of hexavalent chromium from wastewater using magnetotactic bacteria[J]. Separation & Purification Technology, 2014, 136(136): 10-17. |
| [67] |
Mckay DS, Jr GE, Thomaskeprta KL, et al. Search for past Life on Mars:possible relic biogenic activity in martian meteorite ALH84001[J]. Science, 1996, 273(5277): 924-930. DOI:10.1126/science.273.5277.924 |
| [68] |
彭先芝, 贾蓉芬, 李荣森, 等. 黄土-古土壤序列中趋磁细菌分布和磁小体形成的古环境研究[J]. 科学通报, 2000(S1): 2710-2715. |
| [69] |
徐晓可, 吴清平, 张菊梅, 等. 免疫磁珠分离技术在常见食源性致病菌检测中的应用[J]. 中国卫生检验杂志, 2009(5): 1196-1198. |
| [70] |
Pi F, Sun J, Liu W, et al. Elimination of aflatoxin B1 in vegetable oil based on immuno-magnetosomes probes from a novel magnetotactic bacterium[J]. Food Control, 2017, 80: 319-326. DOI:10.1016/j.foodcont.2017.04.004 |
| [71] |
Wu L, Gao B, Zhang F, et al. A novel electrochemical immunosensor based on magnetosomes for detection of staphylococcal enterotoxin B in milk[J]. Talanta, 2013, 106(6): 360. |
| [72] |
Boucher M, Geffroy F, Prévéral S, et al. Genetically tailored magnetosomes used as MRI probe for molecular imaging of brain tumor[J]. Biomaterials, 2017, 121: 167-178. DOI:10.1016/j.biomaterials.2016.12.013 |
| [73] |
Cheng L, Ke Y, Yu S, et al. Co-delivery of doxorubicin and recombinant plasmid pHSP70-PLk1-shRNA by bacterial magnetosomes for osteosarcoma therapy[J]. International Journal of Nanomedicine, 2016, 11: 5277. DOI:10.2147/IJN |
| [74] |
Molcan M, Petrenko VI, Avdeev MV, et al. Structure characteriza-tion of the magnetosome solutions for hyperthermia study[J]. Journal of Molecular Liquids, 2017, 235: 11-16. DOI:10.1016/j.molliq.2016.12.054 |