白刺花(Sophora davidii)属豆科槐属落叶灌木,广泛分布于西北、华北、华中、华东和西南地区,云南主要生长于昆明、曲靖、楚雄、玉溪、红河、大理、丽江、迪庆等海拔850-2 500 m地区[1]。白刺花因根系深而强大,耐旱、耐贫瘠、耐火烧、耐践踏及固氮能力强等特性,常成为石漠化治理优良的本地树种[2]。白刺花根、茎、叶、花及果实含生物碱,具有清热利咽、解暑和凉血消肿等药用价值[3]。此外,粗蛋白含量高(20.79%),矿质元素含量丰富,并含有多种维生素,适量的纤维素、碳水化合物、果胶等,具有重要的食用价值[4]。白刺花行种子繁殖,虽结实量大,但种子硬实[5],具有一定的休眠性[6],因此,幼苗稀少,成为通过种子繁殖来扩大种群数量的瓶颈之一。植物体细胞胚再生方式具有来源于单个的原始胚性细胞、遗传相对稳定、繁殖系数高、可作为外源基因遗传转化受体等特点,因此已成为遗传改良、快速繁育和商品化生产种苗的重要途径[7]。
最早的植物体细胞胚发生成功的报道来自于Steward和Reinert对胡萝卜根的培养,之后一段时期内体细胞胚的研究成果多来自于草本植物,而在母本植物研究方面,最早的研究工作始于Rao[8]对檀香(Santalum album Linn.)组培研究中发现体细胞胚结构,但未获得再生植株,直到Gupta等[9]首次报道挪威云杉体细胞胚胎发生成功以来,世界范围内,已通过体胚发生途径诱导并培育出180余种木本植物再生植株。如花旗松(Pseudotsuga menziesii)、火炬松(Pinus taeda)、辐射松(Pinus radiata)、挪威云杉(Picea abies)、水曲柳(Fraxinus mandshurica)、杂交鹅掌楸(Liriodendron hybrids)。这些植物通过体胚诱导的再生植株已成功应用于生产实践。然而,迄今为止,有关白刺花体细胞胚胎发生的研究尚见报道。
本研究以白刺花下胚轴和子叶为外植体进行胚性愈伤组织诱导和体细胞胚发生、萌发的研究,以期建立白刺花体细胞胚发生、发育及其调控技术体系,为利用组培技术解决白刺花种子繁殖的瓶颈问题提供科学依据。
1 材料与方法 1.1 材料于2015年8-10月在曲靖师范学院校园里采集白刺花种子,脱去外壳剔除有虫害的种子后,自然风干保存备用。实验于2016-2018年曲靖师范学院生物资源与食品工程学院生物技术实验室及云南省高校云贵高原动植物多样性及生态适应性进化重点实验室完成。
1.2 方法 1.2.1 白刺花无菌苗获得将健康饱满无损害的种子用刀片划破种皮,70%的酒精消毒30 s,0.1% HgCl2消毒12 min,无菌水冲洗5-6次,吸干水分接种于不添加任何激素的MS(蔗糖30 g/L+琼脂7 g/L)培养基上,25℃,10 μmol/m2·s弱光培养14 d后取下胚轴和子叶。
1.2.2 愈伤组织及胚性愈伤组织的诱导取无菌苗下胚轴、子叶分别接种于B5和MS诱导培养基上,两种培养基均添加1.0和2.0 mg/L 2,4-D、0.5 mg/L 6-BA、0.5 mg/L TDZ、40 g/L蔗糖、100 mg/L谷氨酰胺和7.0 g/L琼脂,pH 5.8。每种外植体每种培养接种25瓶,每5瓶为1重复,5次重复,接种后,暗培养15 d;然后转移到25℃、10 μmol/m2·s的光照培养箱中培养,白天14 h/黑暗10 h,培养40 d,观察并统计愈伤组织诱导情况及诱导率。
愈伤组织诱导率=诱导出愈伤组织外植体的数量/接种外植体的数量×100%;
胚性愈伤组织诱导率=诱导出胚性愈伤组织外植体的数量/接种外植体的数量×100%
1.2.3 胚性愈伤组织的保持与增殖将上述诱导获得的胚性愈伤组织分别接种于MS培养基(含0.5 mg/L TDZ、0.5 mg/L 6-BA、2,4-D、40 g/L蔗糖、100 mg/L谷氨酰胺和7 g/L琼脂,pH 5.8),2,4-D浓度分别为0.1、0.2、0.3、0.4和0.5 mg/L,每处理接种25瓶,每5瓶为1重复,5次重复,光照强度为10 μmol/m2·s,白天14 h/黑暗10 h,25 d左右继代一次,共继代2次。继代之后,测定愈伤组织的增殖重量和增值率。
胚性愈伤组织增殖量(鲜重)G0=G2-G1,G1为接种后培养瓶全重,G2为增殖后培养瓶全重。
1.2.4 体细胞胚发生将胚性愈伤组织转接到体细胞胚发生的分化培养基上(MS+0.2 mg/L 2,4-D+2.0 mg/L 6-BA+40 g/L蔗糖+100 mg/L谷氨酰胺+7 g/L琼脂,pH 5.8),ABA分别为0、1.0、5.0、10.0、15.0和20.0 mg/L,每处理接种25瓶,每5瓶为1重复,5次重复,20 μmol/m2·s光照培养,白天14 h/黑暗10 h,温度25℃。培养40 d后,统计体细胞胚的发生率及不同培养基上每克鲜重愈伤组织的体细胞胚总数。
胚性愈伤组织诱导、增殖及体细胞胚发生的诱导过程中,分别观察和记录胚性愈伤组织和体细胞胚发生数量,在显微镜和解剖镜下观察胚性愈伤组织的质地和形态。
体细胞胚发生率(%)=产生体细胞胚的愈伤组织数/接种胚性愈伤组织的外植体数×100%
1.2.5 体细胞胚胎的萌发及植株再生将获得的体细胞胚胎接种于1/3 MS培养基上(0.2 mg/L NAA+0.1 mg/L 6-BA+2 g/L活性炭+25 g/L蔗糖+7 g/L琼脂,pH 5.8),30 μmol/m2·s光照培养,直至获得完整植株,统计体胚萌发率。然后将幼苗炼苗后移栽至装有基质(腐殖土:珍珠岩:= 2:1)的花盆中,30 d后统计植株成活率。
体细胞胚萌发率(%)=萌发成幼苗的体胚/接种的体胚×100%
植株成活率(%)=移栽成活的植株(株)/移栽的总株数(株)×100%
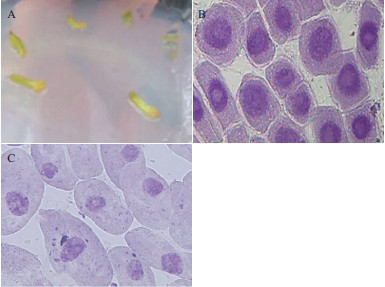
2 结果 2.1 接种后愈伤组织生长状况将白刺花下胚轴、子叶接种于诱导培养基上,10-15 d后发现从下胚轴一端或子叶边缘明显膨大有愈伤产生(图 1-A),20-40 d愈伤长得最快,50 d后愈伤开始干涸褐化。形成的愈伤组织主要有3种类型,第Ⅰ类颜色偏绿,质地较硬,结构紧密,不易分开,生长缓慢,胚性差不易长期继代,属于非胚性愈伤组织。
|
| 图 1 胚性愈伤组织的诱导 A:下胚轴开始形成愈伤组织;B:胚性愈伤组织细胞;C:非胚性愈伤组织细胞 |
第Ⅱ类颜色偏白,透明或半透明、水渍状、结构疏松,易褐化死亡,分化能力差,属于非胚性愈伤组织。
第Ⅲ类颜色淡黄色或黄绿色,质地较碎,结构疏松、表面颗粒状,具有分化胚状体的能力且能继代培养,属胚性愈伤组织。显微镜及解剖镜下使用改良苯酚品红染液对细胞压片观察,胚性愈伤组织细胞壁明显要厚,细胞小,细胞核稍大,有的细胞还可以看见核仁(图 1-B);非胚性愈伤组织细胞大,形状圆形、椭圆形及其他不规则形状,细胞核常偏向一侧且相对小(图 1-C)。
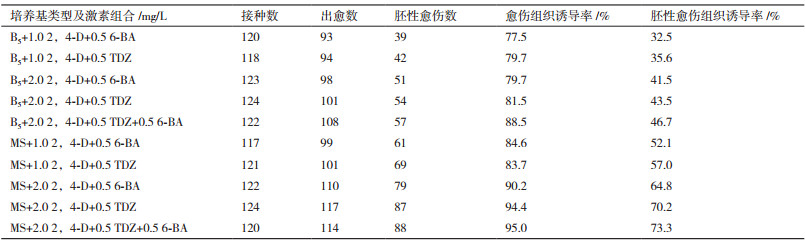
2.2 不同培养基对白刺花下胚轴胚性愈伤组织诱导的影响将白刺花下胚轴接种在B5和MS培养基上,其愈伤组织和胚性愈伤组织诱导率存在一定差异(表 1),B5培养基上,当6-BA或TDZ浓度为0.5 mg/L时,随着2,4-D浓度的增加,愈伤组织和胚性愈伤组织诱导呈递增趋势,当2,4-D浓度相同时,同一浓度的细胞分裂素6-BA诱导效果不及TDZ,2,4-D、6-BA和TDZ 3种激素配合使用其效果优于2,4-D与单一的细胞分裂组合。
MS培养基上的诱导效果与B5培养基类似,愈伤组织诱导率从84.6%升高至95%,胚性愈伤组织诱导率也从52.1%升至77.3%。随着2,4-D浓度的增加,愈伤组织诱导率和胚性愈伤组织诱导率均呈上升趋势。结果表明,培养基中的成分和含量对白刺花下胚轴愈伤组织和胚性愈伤组织诱导率有影响,不同的激素种类也会影响其诱导效果,2,4-D浓度的高低对愈伤组织和胚性愈伤组织诱导产生较大影响。
2.3 不同培养基对白刺花子叶胚性愈伤组织诱导的影响白刺花子叶接种在B5和MS培养基上,结果(表 2)表明,MS和B5培养虽均能诱导白刺花子叶形成愈伤组织和部分胚性愈伤组织,但MS培养基诱导效果优于B5培养基。在MS培养基上,白刺花诱导率随2,4-D浓度的不同而不同,当2,4-D增至2.0 mg/L时,白刺花愈伤组织诱导率从76.7%上升至92.6%,胚性愈伤组织诱导率也从19.2%增加到41.0%。相同浓度的TDZ和6-BA 2种激素相比,TDZ的诱导效果优于6-BA。B5培养基上诱导效果与MS培养基类似。
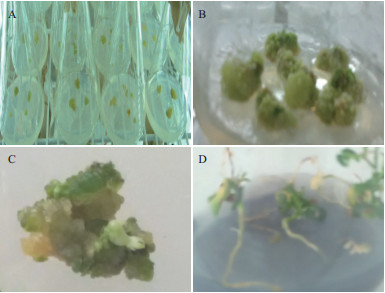
白刺花下胚轴和子叶诱导形成的胚性愈伤组织经增殖培养2次后,胚性愈伤组织不断增殖,接种前7 d内愈伤组织外部没有多大变化,7-20 d明显增大(图 2-A,图 2-B),超过25 d愈伤增殖缓慢,开始在一侧有褐化产生(表 3)。从表 3可以看出,以下胚轴为外植体的胚性愈伤组织增殖中,愈伤组织的增殖量随着2,4-D浓度的增加而递增,当2,4-D为0.1 mg/L时,胚性愈伤组织的增殖量为1.39 g,增殖率为100.72%,而当2,4-D为0.5 mg/L时胚性愈伤组织的增殖量为2.29 g,增殖率为172.18%,但从后期体细胞胚诱导中,过高的2,4-D浓度反而对体细胞胚的诱导产生不利影响,而2,4-D在0.2-0.3 mg/L的浓度诱导体细胞胚的效果较好,诱导频率较高,质量较好。以子叶为外植体的胚性愈伤组织增殖培养中,对2,4-D的反应不及下胚轴的明显,虽愈伤组织的增殖量也随2,4-D浓度的增加有所上升,但几个浓度水平间差异不大,2,4-D为0.4 mg/L,增值率最高为149.63%。
|
| 图 2 愈伤组织增殖及体细胞胚胎发生 A:胚性愈伤组织继代;B:胚性愈伤组织增殖;C:体细胞胚发生;D:再生植株 |
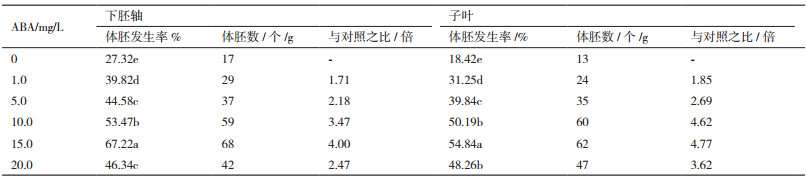
将0.2 mg/L 2,4-D增殖培养基上的胚性愈伤组织接种于不同浓度的ABA体细胞胚发生诱导培养上(表 4,图 2-C),6种不同浓度的ABA上均能诱导产生体细胞胚,但浓度不同,体细胞胚发生率和每克愈伤组织上形成的体细胞胚数都不相同,其中以下胚轴为外植体的体细胞胚诱导中,没添加ABA时,体细胞胚发生率仅27.32%,体细胞胚数为17个/g;当ABA浓度为1.0 mg/L时,体细胞胚发生率增加了12.60%,体细胞数增加了12个/g,且随着ABA浓度增至15 mg/L时,获得了最高体细胞胚发生率(67.22%)和体细胞胚数(68个/g),与对照相比,体细胞发生数量增加了4.0倍,ABA浓度超过15 mg/L,体细胞胚发生率和每克愈伤组织上体细胞胚数反而下降。
以子叶为外植体的体细胞胚诱导中,与胚轴的结果类似,当ABA浓度为1.0-15 mg/L时,体细胞胚发生率和体细胞胚数随ABA浓度的增加而增加,ABA浓度为15 mg/L时,体细胞胚发生率最高为62%,体细胞胚数62个/g,与对照相比,体细胞胚数增加了4.77倍,ABA浓度超过15 mg/L时,体细胞胚发生率和体细胞胚数反而下降。
2.6 体细胞胚胎萌发及植株再生将从2种外植体上获得的成熟体细胞胚轻轻转至体细胞胚萌发培养基(1/3MS+0.2 mg/L NAA+0.1 mg/L 6-BA+2.0 g/L活性炭+25 g/L蔗糖+7 g/L琼脂)中,7 d以后开始从下胚轴一端首先长出主根,20 d后可以观察到完整的小幼苗,再经20 d培养,健康的幼苗已完全长出(图 2-D),通过统计2种外植体诱导的体细胞胚其体细胞胚萌发率均在80%以上。将得到的幼苗炼苗移栽至温室花盆中,30 d后幼苗移栽成活率达90%以上。
3 讨论通过体细胞胚胎发生被认为是植物再生植株获得的重要途径之一,由于再生植株来源于单个胚性细胞,克服了遗传嵌合性问题,为高等植物在细胞水平上进行遗传操作及品种改良提供一条有效的途径[10]。然而在体细胞胚形成过程中,诸多因素影响其培养效果,如外植体类型、培养基、植物生长调节剂等。体细胞胚诱导研究中,以幼胚[11-13]、成熟胚[14-15]、下胚轴[16-18]、子叶[19]、叶片[20]等为外植体均有报道,Trolinder等[21]对棉花叶片、茎段、子叶、中胚轴、上胚轴和下胚轴进行研究,认为下胚轴最容易诱导体细胞胚的发生,子叶次之。孙艳香等[22]通过对保丰苜蓿的研究发现下胚轴和叶柄产生愈伤组织及体细胞胚的能力较强,而子叶和真叶较弱。
本研究中,下胚轴是胚性愈伤组织诱导的最佳外植体,培养基类型也是影响植物体细胞胚发生又一因素,据目前报道的资料显示,70%的植物体细胞胚的诱导使用的是MS培养基,MS培养基中含有较高浓度的硝酸盐和螫合铁,营养元素相对比较全面,对多数植物的体细胞胚发生具有促进作用[23]。陈金慧等[10]对鹅掌楸的体胚发生的研究认为MS培养基最有利于体细胞胚的诱导。郭祖宝等[24]采用B5培养基成功诱导了胡萝卜体胚发生。本研究MS培养基对白刺花愈伤组织及胚性愈伤组织的诱导效果优于B5培养基研究证明2,4-D在诱导胚性愈伤组织中是必不可少的,特别是2,4-D与多种激素的配合使用更有利于体细胞胚的诱导[25]。2,4-D过高或过低都会对体细胞胚的形成和增殖产生影响,本研究中以下胚轴为外植体的胚性愈伤组织增殖中,2,4-D 0.5 mg/L时胚性愈伤组织的增殖量为2.29 g,增殖率为172.18%,但从后期体细胞胚诱导中,过高的2,4-D浓度反而对体细胞胚的诱导产生不利影响,而2,4-D在0.2-0.3 mg/L的浓度诱导体细胞胚的效果较好,诱导频率较高,质量较好。以子叶为外植体的胚性愈伤组织增殖培养中,几个浓度水平间差异不大。
ABA可促进体细胞的发育和体胚的成熟早有报道[26],通常认为,ABA可促进细胞内脂类、蛋白质、淀粉等生物大分子物质的积累,从而促进体细胞胚的成熟,但不同植物所需ABA的最佳浓度及其处理时间都有所不同。本研究中,没添加ABA时,以下胚轴为外植体的体细胞胚发生率仅27.32%,而添加了ABA后,体细胞胚发生率和体胚数随ABA浓度增加而增加,以子叶为外植体的体细胞胚诱导中,也得出了类似下胚轴的结果,ABA超过15 mg/L时,体细胞胚发生率和体细胞胚数反而下降。
4 结论白刺花外植体种类及培养基类型均会影响胚性愈伤组织的诱导,其中MS培养基较适合启动细胞脱分化形成愈伤组织,下胚轴比子叶更易诱导胚性愈伤组织。适量浓度的2,4-D能促进愈伤组织的增殖,反之则会抑制体细胞胚的发生。
| [1] |
陈强, 王达明, 李品荣, 等. 白刺花的育苗造林技术及开发利用前景[J]. 中国野生植物资源, 2003, 21(6): 30-31. DOI:10.3969/j.issn.1006-9690.2003.06.011 |
| [2] |
李芳兰, 包维楷, 吴宁. 白刺花幼苗对不同强度干旱胁迫的形态与生理响应[J]. 生态学报, 2009, 29(10): 5406-5416. DOI:10.3321/j.issn:1000-0933.2009.10.027 |
| [3] |
毛晓健, 温敏, 蒋孝悝. 白刺花水煎剂的部分药效学研究[J]. 云南中医中药杂志, 2009, 30(2): 44-46. DOI:10.3969/j.issn.1007-2349.2009.02.033 |
| [4] |
樊建, 桂明英, 赵天瑞, 等. 野生苦刺花食用价值研究[J]. 中国野生植物资源, 2005, 24(1): 23-25. DOI:10.3969/j.issn.1006-9690.2005.01.007 |
| [5] |
吴丽芳, 陆伟东, 魏晓梅, 等. 不同处理方法对白刺花硬实种子萌发特性的影响研究[J]. 当代畜牧, 2014, 2(6): 47-49. |
| [6] |
吴丽芳, 魏晓梅, 陆伟东, 等. 白刺花硬实种子的休眠机制及休眠解除[J]. 南方农业学报, 2018, 49(5): 944-949. DOI:10.3969/j.issn.2095-1191.2018.05.17 |
| [7] |
胡颂平, 刘选明. 植物细胞组织培养技术[M]. 北京: 中国农业大学出版社, 2014.
|
| [8] |
Rao PS. In vitro induction of embryonal profiferation in Santulum album L.[J]. Phytomorphology, 1965(15): 175-179. |
| [9] |
Gupta PK, Durzan DJ. Plantlet regeneration via somatic embryogenesis from subcultured callus of mature embryos of Picea abies(Norway spruce)[J]. In Vitro Cellular and Developmental Biology-Plant, 1986, 22: 685-688. DOI:10.1007/BF02623484 |
| [10] |
Cheliak WM, Klimaszewska K. Genetic variation in somatic embryogenic response in open-pollinated families of black spruce[J]. Theor Appl Genet, 1991, 82(2): 185-190. DOI:10.1007/BF00226211 |
| [11] |
陈金慧, 施季森, 诸葛强, 等. 杂交鹅掌楸体细胞胚胎发生研究[J]. 林业科学, 2003, 39(4): 49-54. DOI:10.3321/j.issn:1001-7488.2003.04.008 |
| [12] |
习洋, 胡瑞阳, 王欢, 等. 刺槐未成熟合子胚的体细胞胚胎发生和植株再生[J]. 林业科学, 2012, 48(1): 60-69. DOI:10.3969/j.issn.1672-8246.2012.01.009 |
| [13] |
李清清, 叶建仁, 朱丽华, 等. 黑松未成熟胚的体细胞胚胎发生和植株再生[J]. 林业科学, 2012, 48(12): 39-44. DOI:10.11707/j.1001-7488.20121206 |
| [14] |
Pinto G, Santos C, Neves L, et al. Somatic embryogenesis and plant regeneration in Eucalyptus globulus Labill[J]. Plant Cell Rep, 2002, 21(3): 208-213. DOI:10.1007/s00299-002-0505-5 |
| [15] |
伊丽米努尔, 李宏. 天山云杉成熟与未成熟合子胚的胚性愈伤组织诱导及增殖研究[J]. 新疆农业科学, 2017, 54(2): 262-271. |
| [16] |
米贯勋.光照对棉花下胚轴体细胞胚诱导能力的影响[D].新疆: 石河子大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10759-1015511253.htm
|
| [17] |
李玉珠, 李巧璐, 范艳红, 等. 苜蓿下胚轴愈伤组织诱导和体细胞胚的发生与观察[J]. 中国草地学报, 2014, 36(6): 97-102. |
| [18] |
丁喜莲, 曲延英, 李琼, 等. 六个海岛棉品系体细胞胚胎发生及再生体系的研究[J]. 生物技术通报, 2016, 32(1): 97-102. |
| [19] |
Firoozabady E, DeBoer DL. Plant regeneration via somatic embryogenesis in many cultivars of cotton(Gossypium hirsutum L.)[J]. In Vitro Cellular & Developmental Biology-Plant, 1993, 29(4): 166-173. |
| [20] |
Kintzios S, Manos C, Makri O. Somatic embryogenesis from mature leaves of rose[J]. Plant Cell Rep, 1999, 18(5): 467-472. |
| [21] |
Trolinder N, Goodin JR. Somatic embryogenesis in cotton(Gossypium): I. Effects of source of explant and hormone regime[J]. Plant Cell, Tissue and Organ Culture, 1988, 12(1): 31-42. |
| [22] |
孙艳香, 杨红梅, 尹军, 等. 紫花苜蓿高频体细胞胚与次生胚再生体系的建立[J]. 南开大学学报:自然科学版, 2007, 40(4): 1-6. |
| [23] |
王进茂, 杨敏生, 杨文利, 等. 我国木本植物体细胞胚胎发生研究进展[J]. 河北林果研究, 2004, 19(3): 295-301. DOI:10.3969/j.issn.1007-4961.2004.03.021 |
| [24] |
郭祖宝, 李学红, 孙培良. 影响胡萝卜体胚发生因素的研究[J]. 安徽农学通报, 2006, 12(12): 35-36. DOI:10.3969/j.issn.1007-7731.2006.12.015 |
| [25] |
李明, 王树香, 冯大领. 植物体细胞胚发生及发育研究进展[J]. 中国农学通报, 2011, 27(3): 237-241. |
| [26] |
Ammirato PV. The effects of abscisic acid on the development of somatic embryos from cells of caraway(Carum carvi L.)[J]. Botanical Gazette, 1974, 135(4): 328-337. DOI:10.1086/336769 |