抗体类药物是近年来研发数量最多、销售增长速度最快的治疗性重组蛋白药物,它具有靶向明确、安全性高和循环半衰期长等优点,已被批准用于癌症、免疫性疾病、病毒感染等多种疾病的治疗[1]。抗体类药物生产用最主要的宿主细胞是CHO细胞,这是因为由CHO细胞表达的重组蛋白具有与人体血清蛋白高度相似的糖链结构[2]。而抗体类药物的糖链结构(如唾液酸化、半乳糖化、岩藻糖化和高甘露糖比例等)与蛋白分子的电荷分布、稳定性和溶解性等理化性质以及药物的药代动力学和生物学活性等体内药效密切相关[3-4],因此糖基化是抗体类药物的关键质量属性之一。随着动物细胞大规模培养技术的不断进步,细胞生长和产物表达水平明显提高。目前在优化的CHO细胞流加培养过程中,最高活细胞密度和产物表达量分别能达到1-2×107 cells/ml和g/L级[5]。然而在产物大量合成的高密度细胞培养过程中,培养环境更为复杂,较易发生过程参数渗透压和二氧化碳分压累积以及代谢副产物氨的浓度升高的情况,会对细胞生长与维持和产物表达与糖基化过程产生不利影响[6-8]。
氨是动物细胞培养过程中的主要代谢副产物之一,它主要是由细胞代谢谷氨酰胺和天冬酰胺生成,少部分是谷氨酰胺自发降解产生[9]。在高密度细胞流加培养过程中氨的浓度往往不断升高,细胞维持期(产物表达期)的氨浓度通常达到6-10 mmol/L[5, 10],有些培养过程中甚至超过10 mmol/L[11]。高浓度的氨通过扩散作用进入胞浆以及线粒体、高尔基体和内质网等细胞器,导致胞浆和这些细胞器内的pH升高,进而影响了正常的胞内生化反应,如物质和能量代谢、糖链加工、蛋白质翻译等[9, 12]。研究表明,在初始培养时提高氨的浓度会影响产物表达和糖基化过程[13-15],由于在初始培养时提高氨的浓度会同时影响细胞生长和代谢水平,而产物表达和糖基化过程与培养前期的细胞生长和代谢水平密切相关[16-17],导致在这些研究中氨本身对产物表达和糖基化过程的影响更为复杂。考虑到在细胞培养过程中,细胞生长期的氨浓度和产物表达量较低,而在产物大量合成的细胞维持期氨浓度较高。因此,细胞维持期氨对产物的表达和糖链结构的影响更应该被关注。
为此,本研究考察了在表达抗体融合蛋白的CHO细胞流加培养过程中,不同的氨浓度在细胞维持期对细胞维持与代谢、抗体融合蛋白表达以及N-糖基化的作用,认识氨浓度升高对抗体融合蛋白的表达和N-糖链结构的影响,从而对表达抗体类药物以及其它治疗性重组蛋白的细胞培养过程开发与控制奠定部分基础。
1 材料与方法 1.1 材料本研究所用的细胞为表达抗体融合蛋白的重组CHO细胞株。种子细胞传代培养基和基础培养基相同,为本实验室自主开发的无血清无蛋白培养基[18]。流加培养基为葡萄糖和氨基酸的浓缩液。用于配制培养基的所有试剂和原料均从Sigma-Aldrich公司购买。配制完的培养基经0.22 μm滤膜(Millipore)过滤除菌后使用。
1.2 方法 1.2.1 种子细胞培养从液氮罐中取出冻存的CHO种子细胞,加入至含有10 mL种子传代培养基的离心管中,经1 000 r/min离心5 min后弃去培养上清。用适量种子传代培养基重悬细胞,控制活细胞密度为5.0-8.0×105 cells/mL。将细胞悬液转移至125 mL摇瓶中(美国Corning公司),置于培养箱中的摇床上(杭州奥盛仪器有限公司)进行培养,培养条件为37℃、5% CO2和120 r/min。每天对种子细胞进行传代,控制传代后种子细胞的活细胞密度为5.0-8.0×105 cells/mL。
1.2.2 流加培养取处于对数生长期的种子细胞,经1 000 r/min离心5 min后弃去培养上清,用基础培养基重悬细胞,控制活细胞密度为1.0×106 cells/mL,接种体积为80 mL。将细胞悬液转移至250 mL摇瓶中(美国Corning公司),置于培养箱中的摇床上进行培养,培养条件为37℃、5% CO2和120 r/min。每天添加3%(V/V)的流加培养基。当细胞生长至最大活细胞密度时(培养第5天),一次性添加不同浓度的氯化铵浓缩液,分别使培养液中的氨浓度升高0(不添加)、2、4和6 mmol/L后继续培养。每组实验设置3个重复。每天取样1 mL进行细胞密度和活率检测,培养液经10 000 r/min离心5 min后取上清液于-80℃保存,用于主要代谢物和副产物浓度、抗体融合蛋白表达量和纯化后的糖基化检测。
1.2.3 细胞密度和活率检测细胞培养液用磷酸缓冲液和0.4%(W/V)台盼蓝染色液稀释后,加到血球计数板中计录活细胞数和死细胞数,活细胞数占总细胞数的百分比即为活率。同时采用Countstar细胞计数仪(上海睿钰生物科技有限公司)记录细胞形态。
1.2.4 细胞凋亡检测使用Dead Cell Apoptosis Kit(美国Thermo Fisher公司)对凋亡细胞比例进行检测。首先取细胞1.0×106 cells/mL,离心除去培养液并用PBS缓冲液清洗细胞两次。将细胞沉淀重悬于100 μL 1×Annexin binding buffer中,检测样本添加1 μL PI溶液和5 μl Annexin V-FITC溶液,同时设置不添加PI和Annexin V-FITC溶液的检测对照组,室温避光放置15 min后加入400 μL 1×Annexin binding buffer并充分混匀。采用流式细胞仪(美国BD公司)检测结果,用Flowjo软件(美国BD公司)进行数据分析。
1.2.5 主要代谢物和副产物浓度检测培养上清中的主要代谢物葡萄糖和谷氨酰胺、代谢副产物乳酸和氨的浓度采用生化分析仪Nova BioProfile 400(Nova Biomedical)测定。
1.2.6 抗体融合蛋白表达量检测培养上清中抗体融合蛋白的表达量采用尺寸排阻色谱的方法进行检测,色谱柱为G3000SWXL,7.8×300 mm(TOSOH)。具体步骤见参考文献[19]。
1.2.7 抗体融合蛋白纯化抗体融合蛋白的纯化采用Protein A亲和层析的方法,纯化柱为Mab Select SuRe(GE Healthcare)。具体步骤见参考文献[19]。
1.2.8 抗体融合蛋白唾液酸含量检测按照2015年版《中国药典》(三部)中间苯二酚显色法检测抗体融合蛋白的唾液酸含量。
1.2.9 抗体融合蛋白N-糖链结构检测抗体融合蛋白的N-糖链结构采用2-对氨基苯甲酰胺标记法进行检测[20]。首先用糖苷酶PNGase F(New England BioLabs)将N端糖链从抗体融合蛋白上切除,随后加入-20℃的乙醇,12 000 r/min离心10 min后吸取上清,置于真空离心浓缩仪(Thermo)中挥发溶液。然后使用2-对氨基苯甲酰胺荧光标记物(Prozyme)按照试剂盒说明书要求与糖链反应,最后通过TSK-GEL Amide-80,4.6×250 mm(TOSOH)色谱柱检测样品的N-糖链结构,流动相A为50 mmol/L甲酸铵(pH4.4),流动相B为乙腈,梯度条件为在140 min内由30%-55%流动相A的线性梯度洗脱,流速为0.4 mL/min。检测器为荧光检测器(Waters),激发波长为330 nm,发射波长为420 nm。
1.2.10 10数据分析抗体融合蛋白的比生成速率qp(pg/cell/day)的计算公式如下:
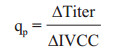
其中Titer为抗体抗体融合蛋白的表达量(mg/L);IVCC(Integrated viable cell concentraion)为活细胞密度对培养时间的积分(109 cells·day/L)。
培养上清中主要代谢物和副产物的比生成/消耗速率qm(pmol/cell/day)的计算公式如下:

其中Concentration为代谢物或副产物的浓度(mmol/L)。
抗体融合蛋白的唾液酸化(Sialylation)、半乳糖化(Galactosylation)、岩藻糖化(Fuosylation)程度的计算公式如下:

其中抗体融合蛋白的G0、G2、A2F等糖链的具体结构参考图 1。
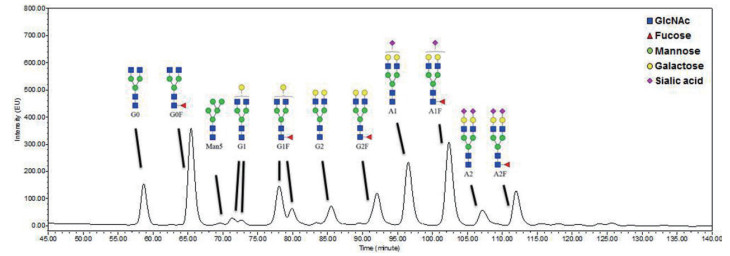
|
| 图 1 抗体融合蛋白的N-糖链结构谱图 |
为了排除维持期细胞密度对抗体融合蛋白的表达以及N-糖链结构的影响,在细胞生长至最高活细胞密度时(培养第5天),往培养液中一次性加入不同浓度的氯化铵浓缩液使氨浓度分别上升0(对照组)、2、4和6 mmol/L,以营造只有氨浓度不同的细胞维持期培养环境。同时,为了避免因细胞后期死亡而释放至培养液的宿主蛋白酶和糖苷酶对抗体融合蛋白及其糖链的降解,在培养第11天时(细胞活率 > 90%)结束培养。
图 2是不同氨浓度条件下的CHO细胞生长、细胞活率、抗体融合蛋白表达以及维持期氨浓度的情况。首先由图 2-A可知,培养前期细胞快速生长,至培养第5天时达到最高活细胞密度为(7.88±0.32)×106 cells/mL。此后细胞进入维持期,培养第5-9天活细胞密度不变。培养第9天以后活细胞密度开始缓慢下降,至培养结束时,对照组的活细胞密度为(7.02±0.11)×106 cells/mL。由图 2-B可知,在细胞生长期以及维持期的前3天(培养第0-8天),细胞活率较高(> 98%)。培养第8天以后细胞活率开始缓慢下降,至培养结束时,对照组的细胞活率为90.96±0.95%。尽管通过氯化铵的添加使细胞维持期的氨浓度分别升高了2、4和6 mmol/L,氨浓度最高达到12.08±0.28 mmol/L(图 2-D),但培养结束时的活细胞密度和细胞活率与对照组相比均没有显著差别。由此可见,细胞维持期氨浓度升高(< 12 mmol/L)对细胞维持和最终活率没有影响,至培养结束时4个条件下的细胞活率均大于90%。

|
| 图 2 不同氨浓度条件下的CHO细胞维持(A)、细胞活率(B)、抗体融合蛋白表达(C)及氨浓度(D)情况 |
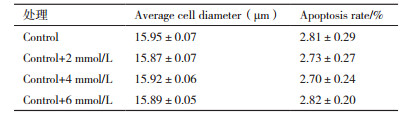
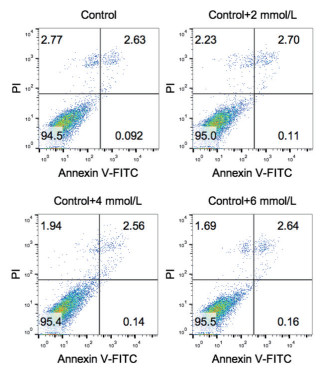
图 3是不同氨浓度条件下培养结束时的细胞形态,由图可知,4组条件下细胞形态较为接近。表 1总结了培养结束时的平均细胞直径,由表可知,4组条件下均没有显著差异,可见维持期氨浓度在5-12 mmol/L范围内对细胞大小没有影响。此外,本研究进一步分析了培养结束时的凋亡细胞比例,图 4为不同氨浓度条件下培养结束时凋亡细胞比例的流式检测图,图谱的右上方和右下方分别为晚期凋亡和早期凋亡的细胞及其占总细胞的比例,由图可知,4组条件下培养结束时的晚期凋亡细胞和早期凋亡细胞分布较为接近,总凋亡比例较低(< 3%)。经计算,4组条件下的凋亡细胞比例没有显著差异(表 1),可见维持期氨浓度在5-12 mmol/L范围内对细胞凋亡也没有影响。
|
| 图 3 不同氨浓度条件下培养结束时的细胞形态 (白圈标记为死细胞) |
|
| 图 4 不同氨浓度条件下培养结束时凋亡细胞比例的流式检测图 |
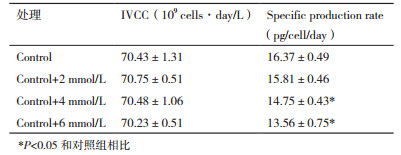
抗体融合蛋白表达方面,由图 2C可知在细胞生长期,抗体融合蛋白的表达量只有130.50±23.35 mg/L。进入细胞维持期后,抗体融合蛋白开始大量表达,至培养结束时对照组抗体融合蛋白的表达量达到1 152.31±22.23 mg/L。其中细胞维持期抗体融合蛋白的表达量为1 021.81±22.67 mg/L,占培养过程中总表达量的比例高达88.67%,因此这一培养阶段也称为产物表达期。培养结束时氨浓度升高2 mmol/L条件下的抗体融合蛋白表达量不变,而升高4和6 mmol/L条件下的抗体融合蛋白表达量分别只有对照组的90.22%(P < 0.05)和82.65%(P < 0.05)。可见随着氨浓度的升高(> 9 mmol/L),抗体融合蛋白的表达量逐渐降低。由于培养过程的最终产物表达量是IVCC和产物比生成速率的乘积,而4个条件下的IVCC没有差异(表 2),因此抗体融合蛋白表达量的降低是比生成速率的减少导致的。经计算,在氨浓度升高4和6 mmol/L条件下,抗体融合蛋白的比生成速率比对照组显著减少了9.88%和17.72%(P < 0.05)。
以上结果表明,细胞维持期氨浓度在5-12 mmol/L范围内对CHO细胞的维持、培养结束时的细胞活率、形态以及凋亡比例没有影响,但当氨浓度超过9 mmol/L时,抗体融合蛋白的表达能力开始下降。
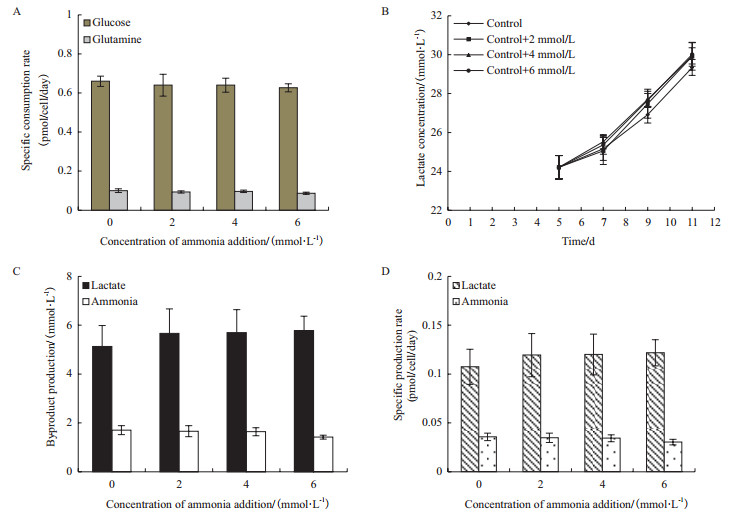
2.2 氨浓度升高对CHO细胞代谢的影响图 5是不同氨浓度条件下细胞维持期主要营养物葡萄糖和谷氨酰胺的消耗以及主要代谢副产物乳酸和氨的累积情况。由图 5-A可知,细胞维持期对照组的葡萄糖和谷氨酰胺比消耗速率分别为0.66±0.03 pmol/cell/day和0.10±0.01 pmol/cell/day,其它3组氨浓度升高条件下的葡萄糖和谷氨酰胺比消耗速率与对照组相比没有显著差异。
|
| 图 5 不同氨浓度条件下细胞维持期的葡萄糖和谷氨酰胺的比消耗速率(A)、乳酸浓度(B)、乳酸和氨的生成(C)以及乳酸和氨的比生成速率(D)情况 |
乳酸是葡萄糖代谢的主要副产物。由图 5-B可知,在细胞生长期(培养0-5 d),乳酸浓度累积至24.21±0.60 mmol/L。细胞维持期细胞继续分泌乳酸,至培养结束时对照组的乳酸浓度达到29.34±0.41 mmol/L,共生成了5.13±0.86 mmol/L(图 5-C),这一阶段的乳酸比生成速率为0.11±0.02 pmol/cell/day(图 5-D)。氨是细胞消耗谷氨酰胺所产生的主要代谢副产物,由图 2-D可知,细胞维持期氨持续生成,对照组的氨生成量为1.70±0.18 mmol/L(图 5-C),这一阶段的氨比生成速率为0.036±0.004 pmol/cell/day(图 5-D)。与对照组相比,其它3组氨浓度升高条件下无论是乳酸和氨的总生成量,还是两者的比生成速率均没有显著变化。
以上结果表明,细胞维持期氨浓度升高(< 12 mmol/L)对CHO细胞的葡萄糖和谷氨酰胺的消耗以及乳酸和氨的生成均没有产生影响。
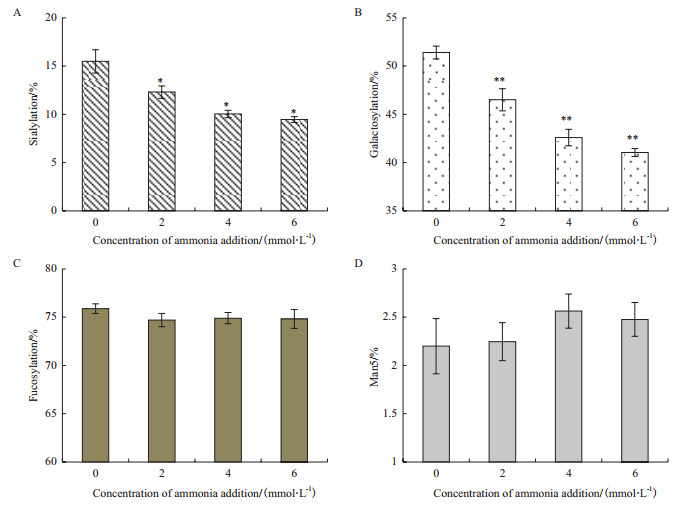
2.3 氨浓度升高对抗体融合蛋白的N-糖链结构以及唾液酸含量的影响糖基化是抗体类药物的关键质量属性之一,糖基化的有效控制与最终药物的临床安全性和有效性密切相关。图 6为不同氨浓度下培养结束时抗体融合蛋白的4种主要N-糖链结构(唾液酸化、半乳糖化、岩藻糖化和高甘露糖)的比例。唾液酸(Sialic acid)位于N-糖链的末端,唾液酸化比例是指N-糖链中所有含唾液酸的糖链所占的比例(图 1)。由图 6-A可知,氨浓度升高导致培养结束时抗体融合蛋白的唾液酸化比例显著降低。其中,氨浓度仅升高2 mmol/L就能导致唾液酸化比例从15.49±1.21%显著降低到12.30±0.65%(P < 0.05),且随着氨浓度的升高,抗体融合蛋白的唾液酸化比例会继续降低。
|
| 图 6 不同氨浓度条件下培养结束时抗体融合蛋白的唾液酸化比例(A)、半乳糖化比例(B)、岩藻糖化比例(C)以及高甘露糖比例(D) *P < 0.05,**P < 0.01和对照组相比 |
半乳糖化比例是指N-糖链中所有含半乳糖(Galactose)的糖链所占的比例(图 1)。由于半乳糖的连接是唾液酸加工至N-糖链上的前提,半乳糖化程度会直接影响最终N-糖链的唾液酸化程度。由图 6-B可知,对照组培养结束时抗体融合蛋白的半乳糖化比例为51.41±0.67%,在氨浓度升高2、4和6 mmol/L条件下,抗体融合蛋白的半乳糖化比例分别只有46.50±1.15%、42.59±0.85%和41.04±0.41%。可见随着氨浓度的升高,抗体融合蛋白的半乳糖化比例也在不断降低。
岩藻糖化比例是指N-糖链中所有含岩藻糖(Fucose)的糖链所占的比例(图 1)。高甘露糖是N-糖基化过程早期形成的末端含有多个甘露糖(Mannose)的不完整糖型,在图 1所示的抗体融合蛋白的N-糖链结构中,高甘露糖比例特指Man5糖型的比例。由图 6-C可知,培养结束时抗体融合蛋白的大部分N-糖链(> 70%)含有岩藻糖,氨浓度升高对岩藻糖化比例没有明显影响。而图 6-D显示,培养结束时抗体融合蛋白的Man5比例较低(< 3%),氨浓度升高条件下Man5比例没有发生改变。
抗体融合蛋白的唾液酸含量是指导最终产品放行的关键质量指标之一。图 7为不同氨浓度下培养结束时抗体融合蛋白的唾液酸含量。可以看出,随着氨浓度的升高,培养结束时抗体融合蛋白的唾液酸含量不断降低。在氨浓度升高2、4和6 mmol/L条件下,抗体融合蛋白的唾液酸含量分别只有对照组的92.06%,86.64%和83.97%。氨浓度的升高量与最终抗体融合蛋白的唾液酸含量具有较好的负相关性(R2=0.953 6)。
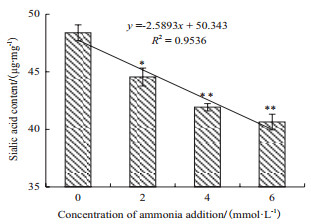
|
| 图 7 不同氨浓度条件下培养结束时抗体融合蛋白的唾液酸含量 *P < 0.05,**P < 0.01和对照组相比 |
运用动物细胞培养技术生产抗体类药物已成为当今生物制药行业的主流趋势。随着细胞株构建、培养基开发以及过程优化技术的不断进步,细胞生长和产物表达水平明显提高,同时培养环境也更为复杂。其中代谢副产物氨的累积会对细胞产生毒副作用,导致细胞生长与代谢、产物表达和糖基化过程受到影响[13-15]。由于细胞密度和代谢水平的不同也会影响产物表达和糖基化过程[16-17],因此本研究系统考察了在培养前期细胞密度和代谢水平相同的条件下,氨浓度升高对细胞维持期CHO细胞维持、细胞代谢、抗体融合蛋白的表达以及N-糖链结构的影响。
细胞的诸多生理代谢反应如糖酵解和磷酸戊糖途径在胞浆进行,氨能通过扩散作用进入细胞,使胞浆pH异常升高,导致细胞的代谢反应受到影响,进而影响细胞的生理状态[9, 14]。研究表明,在初始细胞培养时提高氨浓度至超过5 mmol/L后,细胞的比生长速率和最高活细胞密度减少[13, 21]。由于在实际培养过程中氨是持续生成的,培养前期的氨浓度往往较低,而在产物大量合成的细胞维持期氨浓度才会较高。因此,细胞维持期氨对过程结果的影响更应该被关注。本研究发现,细胞维持期氨浓度在5-12 mmol/L范围内对CHO细胞的维持、培养结束时的细胞活率、形态以及凋亡比例没有影响。可见氨对不同培养阶段细胞的影响是不同的。
产物的最终表达量是IVCC和产物比生成速率共同决定的[22]。在维持细胞密度相同的情况下,细胞的最终活率将直接影响IVCC。此外,细胞需要消耗大量葡萄糖和谷氨酰胺为产物合成提供能量[23]。因此在维持细胞密度相同的条件下,抗体融合蛋白的最终表达量与细胞的维持情况和代谢水平密切相关。本研究发现细胞维持期氨浓度维持在5-12 mmol/L时,虽然CHO细胞的维持情况、葡萄糖和谷氨酰胺的消耗以及副产物乳酸和氨的生成没有受到影响,但当氨浓度超过9 mmol/L时,抗体融合蛋白的比生成速率显著减少,导致最终表达量显著降低。此外,有文献报道[13, 15],当氨浓度超过10 mmol/L后,最终产物的表达量降低。由于这些研究是在初始细胞培养时提高氨的浓度,对培养前期的细胞生长也造成影响,导致IVCC下降。在本研究中,相同的IVCC更能体现氨对细胞表达产物能力的负作用。
抗体类药物的唾液酸化程度、高甘露糖糖型比例、半乳糖化程度和岩藻糖化程度分别与药物的循环半衰期、补体依赖的细胞毒性(Complement-dependent cytotoxicity,CDC)和抗体依赖的细胞毒性(Antibody dependent cell cytotoxicity,ADCC)等临床表现相关[24]。产物的糖基化过程控制是生物制药界面临的难题之一。研究表明,氨能通过扩散作用进入高尔基体,扰乱其正常的pH环境,使重要的功能酶(如糖基转移酶)的作用受到影响,最终导致产物的糖链结构发生变化[12, 25]。本研究发现随着细胞维持期氨浓度的升高,抗体融合蛋白的半乳糖化程度和唾液酸化程度均不断降低,而岩藻糖化程度和高甘露糖糖型比例则没有发生变化,明确了氨影响糖基化过程的作用位点。与蛋白表达过程相比,糖基化过程对氨更为敏感,氨浓度超过5 mmol/L就能导致抗体融合蛋白的糖基化过程受到影响。此外,Yang等[13]发现,当氨浓度超过5 mmol/L后,最终产物的糖基化程度降低。Hoog等[21]同样发现,当氨浓度超过5 mmol/L后,最终产物的半乳糖化程度降低,但其它糖链结构的比例则没有变化。然而,这些研究仍是在初始培养时提高氨的浓度,导致培养前期的细胞生长、细胞对营养物的消耗以及代谢副产物的生成情况改变,而细胞密度以及代谢水平的差异也可能会影响糖基化加工。在本研究中,由于实验排除了维持细胞密度和细胞代谢水平对糖基化过程的影响,结果更直观地体现了氨对糖基化过程的作用。
产物的高效表达是细胞培养过程建立的首要目标。而糖基化是抗体类药物的关键质量属性之一,各国药品监管机构均要求对抗体类药物的糖链结构进行严密的控制[2]。氨作为高密度细胞流加培养过程中累积的主要代谢副产物之一,会直接影响产物表达和糖基化过程。因此,正确认识氨对产物表达和糖基化过程的作用,同时结合药物的作用机制和具体的糖基化控制要求设定合理的氨浓度控制区间,对运用质量源于设计(Quality by design,QbD)方法建立高效的细胞培养过程及其后续的过程放大策略具有重要的指导意义。
4 结论本研究考察了细胞维持期氨浓度升高对CHO细胞维持、细胞代谢、抗体融合蛋白表达和N-糖基化的影响。结果表明,氨浓度升高(5-12 mmol/L)对CHO细胞的维持、葡萄糖和谷氨酰胺的消耗以及副产物乳酸和氨的生成情况没有明显影响,但不利于抗体融合蛋白的表达和N-糖基化过程。氨浓度大于5 mmol/L即可对抗体融合蛋白的半乳糖化程度和唾液酸化程度产生不利影响,但氨浓度升高对岩藻糖化程度和高甘露糖糖型比例没有作用。而当氨浓度升高至大于9 mmol/L后,抗体融合蛋白的比生成速率开始显著减少,导致最终表达量显著降低。
| [1] |
Miller KL, Lanthier M. Innovation in biologic new molecular entities:1986-2014[J]. Nat Rev Drug Discov, 2015, 14(1): 83. |
| [2] |
Alonde ME, Durocher Y. Therapeutic glycoprotein production in mammalian cells[J]. J Biotechnol, 2017, 251(10): 128-140. |
| [3] |
Reusch D, Tejada ML. Fc glycans of therapeutic antibodies as critical quality attributes[J]. Glycobiology, 2015, 25(12): 1325-1334. DOI:10.1093/glycob/cwv065 |
| [4] |
Jefferis R. Recombinant antibody therapeutics:the impact of glycosylation on mechanisms of action[J]. Trends Pharmacol, 2009, 30(7): 356-362. DOI:10.1016/j.tips.2009.04.007 |
| [5] |
Reinhart D, Damjanovic L, Kaisermayer C, et al. Benchmarking of commercially available cho cell culture media for antibody production[J]. Appl Microbiol Biot, 2015, 99(11): 4645-4657. DOI:10.1007/s00253-015-6514-4 |
| [6] |
Lee JH, Jeong YR, Kim YG, et al. Understanding of decreased sialylation of Fc-fusion protein in hyperosmotic recombinant Chinese hamster ovary cell culture:N-glycosylation gene expression and N-linked glycan antennary profile[J]. Biotechnol Bioeng, 2017, 114(8): 1721-1732. DOI:10.1002/bit.26284 |
| [7] |
王晨, 汪嘉琪, 赵亮, 等. 二氧化碳分压和渗透压升高对CHO细胞维持期生长、代谢和产物表达的影响[J]. 生物技术通报, 2018, 34(3): 217-224. |
| [8] |
Gawlitzek M, Ryll T, Lofgren J, et al. Ammonium alters N-Glycan structures of recombinant TNFR-IgG:degradative versus biosynthetic mechanisms[J]. Biotechnol Bioeng, 2000, 68(6): 637-646. DOI:10.1002/(ISSN)1097-0290 |
| [9] |
Schneider M, Marison IW, Von Stockar U. The importance of amm-onia in mammalian cell culture[J]. J Biotechnol, 1996, 46(3): 161-185. DOI:10.1016/0168-1656(95)00196-4 |
| [10] |
Mccracken NA, Kowle R, Ouyang A. Control of galactosylated glycoforms distribution in cell culture system[J]. Biotechnol Progr, 2014, 30(3): 547-553. DOI:10.1002/btpr.1906 |
| [11] |
Ha TK, Lee GM. Effect of glutamine substitution by TCA cycle intermediates on the production and sialylation of Fc-fusion protein in Chinese hamster ovary cell culture[J]. J Biotechnol, 2014, 180: 23-29. DOI:10.1016/j.jbiotec.2014.04.002 |
| [12] |
Rivinoja A, Hassinen A, Kokkonen N, et al. Elevated Golgi pH impairs terminal N-glycosylation by inducing mislocalization of golgi glycosyltransferases[J]. J Cell Physiol, 2009, 220(1): 144-154. DOI:10.1002/jcp.v220:1 |
| [13] |
Yang M, Butler M. Effects of ammonia on CHO cell growth, erythropoietin production, and glycosylation[J]. Biotechnol Bioeng, 2000, 68(4): 370-380. DOI:10.1002/(ISSN)1097-0290 |
| [14] |
孙祥明, 张元兴. 重组CHO细胞培养过程中氨对细胞代谢的影响[J]. 生物工程学报, 2001, 17(3): 304-309. DOI:10.3321/j.issn:1000-3061.2001.03.017 |
| [15] |
Ha TK, Kim YG, Lee GM. Understanding of altered N-glycosyla-tion-related gene expression in recombinant Chinese hamster ovary cells subjected to elevated ammonium concentration by digital mRNA counting[J]. Biotechnol Bioeng, 2015, 112(8): 1583-1593. DOI:10.1002/bit.v112.8 |
| [16] |
Ayyar BV, Arora S, Ravi SS. Optimizing antibody expression:The nuts and bolts[J]. Methods, 2017, 116(1): 51-62. |
| [17] |
Hossler P, Khattak SF, Li ZJ. Optimal and consistent protein glycosylation in mammalian cell culture[J]. Glycobiology, 2009, 19(9): 936-949. DOI:10.1093/glycob/cwp079 |
| [18] |
谭文松, 孙亚婷, 赵亮.适于动物细胞表达产品大规模生产的化学成分明确培养基[P].中国, CN 104328158 A, 2015-02-04.
|
| [19] |
Liu J, Chen X, Fan L, et al. Monitoring sialylation levels of Fc-fusion protein using size-exclusion chromatography as a process analytical technology tool[J]. Biotechnol Lett, 2015, 37(7): 1371-1377. DOI:10.1007/s10529-015-1815-3 |
| [20] |
Grainger RK, James DC. CHO cell line specific prediction and control of recombinant monoclonal antibody N-glycosylation[J]. Biotechnol Bioeng, 2013, 110(11): 2970-2983. DOI:10.1002/bit.24959 |
| [21] |
Hong J, Cho S, Yoon S. Substitution of glutamine by glutamate enh-ances production and galactosylation of recombinant IgG in Chinese hamster ovary cells[J]. Appl Microbiol Biot, 2010, 88(4): 869-876. |
| [22] |
Zhu J. Mammalian cell protein expression for biopharmaceutical production[J]. Biotechnol Adv, 2012, 30(5): 1158-1170. DOI:10.1016/j.biotechadv.2011.08.022 |
| [23] |
Wurm FM. Production of recombinant protein therapeutics in cultivated mammalian cells[J]. Nat Biotechnol, 2004, 22(11): 1393-1398. DOI:10.1038/nbt1026 |
| [24] |
Liu L. Antibody glycosylation and its impact on the pharmacokine-tics and pharmacodynamics of monoclonal antibodies and fc-fusion proteins[J]. J Pharm Sci-US, 2015, 104(6): 1866-1884. DOI:10.1002/jps.24444 |
| [25] |
Axelsson MAB, Karlsson NG, Steel DM, et al. Neutralization of pH in the Golgi apparatus causes redistribution of glycosyltransferases and changes in the O-glycosylation of mucins[J]. Glycobiology, 2001, 11(8): 633-644. DOI:10.1093/glycob/11.8.633 |