2. 福建师范大学生命科学学院,福州 350108
2. College of Life Sciences, Fujian Normal University, Fuzhou 350108
燃料乙醇作为一种可再生的清洁替代能源,具有可持续发展的意义,它的发展备受各国关注。2017年全球燃料乙醇产量是270.5亿加仑,中国是8.75亿加仑,仅占比3%[1]。国家能源局《生物质能发展“十三五”规划》要求到2020年,燃料乙醇利用规模达到400万t。但目前其大规模发展也存在一些问题:首先,生产原料受限,欧美等国家主要以玉米、小麦和甜菜等粮食作为生产原料,容易造成“与人争粮”的局面。其次,利用能源甘蔗生成燃料乙醇可以弥补利用粮食作为原材料的不足。然而,发酵终点高浓度的乙醇对生产菌株酵母细胞生长和乙醇发酵具有强烈抑制作用,从而降低了乙醇产量。因此选育乙醇耐性高、产率高的酵母菌株成为研究重点[2-3]。
肌醇(Inositol)是酵母的生长因子,是磷脂酰肌醇(Phosphatidylinositol,PI)合成的前体。Chi等[4]研究发现,在酵母乙醇发酵过程中,当细胞磷脂酰肌醇的含量较高时,其乙醇产率和产量都较高。季冉等[5]通过外加不同浓度的肌醇,考察其对嗜鞣管囊酵母产乙醇能力及耐乙醇能力的影响。研究发现,当培养基中乙醇起始浓度为10%和12%时,随着肌醇添加量的增加,乙醇产量也均呈上升趋势;肌醇浓度为0.2 g/L时,乙醇净生成量均达到最大。Furukawa等[6]研究也发现,在乙醇存在下,酵母细胞肌醇含量水平对提高细胞活力、耐高乙醇是极其重要的。以上表明,肌醇对酵母耐高乙醇及产乙醇能力起着重要的作用。
肌醇的生物合成途径清晰,其中肌醇-3-磷酸合成酶是关键酶。Hisashi等[7]通过过表酿酒酵母肌醇-3-磷酸合成酶基因ino1,获得了产肌醇的工程菌株。在乙醇胁迫下,ino1基因的表达被证明不可缺少[6]。Hong[8]等研究发现过表达酿酒酵母4个内源基因(msn2、hal1、dog1和ino1)能够提高乙醇的耐性。其中过表达ino1的酵母菌具有最高的乙醇耐性,该菌株在初始葡萄糖浓度为300 g/L培养基中发酵,乙醇体积产率为1.30 g/L/h,比出发菌株提高了35%。
综上,本研究尝试通过过表达肌醇生物合成的关键酶基因ino1来改造酿酒酵母,使菌体自身大量分泌肌醇,从而提高乙醇耐性,进一步筛选获取能够利用甘蔗汁发酵产燃料乙醇的工程菌株。
1 材料与方法 1.1 材料 1.1.1 菌种与质粒酿酒酵母S288C:上海交通大学微生物代谢国家重点实验室赵心清教授馈赠;酿酒酵母Y01(二倍体)保存于福建师范大学生命科学学院。pSH65载体本实验室保藏。pURIH本实验室构建。
1.1.2 主要试剂和仪器实验所用的葡萄糖、蔗糖、酵母粉、蛋白胨、硫酸铵、浓硫酸、七水硫酸镁、无水乙醇等试剂为国产分析纯。肌醇和色谱用葡萄糖、无水乙醇为色谱纯。DNA Marker、Plasmid Mi-niPrep Ki、Fastpfu Fly DNA Polymerase购自北京全式金生物技术有限公司;反转录试剂盒购自fermentas公司;G418、Zeocin、琼脂糖和氨卞青霉素钠均购自上海生工生物工程有限公司。主要仪器:Applied Biosystems 270 PCR仪;美国thermoD-37520高速冷冻离心机;Applied Biosystems 7500 Real-Time PCR System;Agilent 7890A气相色谱。
1.1.3 培养基(1)发酵培养基(g/L):酵母粉8、蔗糖200、硫酸铵(NH4)2SO4 5、磷酸二氢钾(KH2PO4)2、七水硫酸镁(MgSO4·7H2O)2。(2)甘蔗汁发酵培养基(g/L):酵母粉8、硫酸铵(NH4)2SO4 5、磷酸二氢钾(KH2PO4)2、七水硫酸镁(MgSO4 ·7H2O)2,用煮沸后过滤的甘蔗汁配制,加蔗糖调糖度。(3)YPG诱导培养基(g/L):半乳糖20、蛋白胨20、酵母提取物10。(4)YPD完全培养基(g/L):葡萄糖20、蛋白胨20、酵母提取物10。
1.2 方法 1.2.1 ino1基因整合表达载体pURIH的构建、转化pURIH载体的构建、转化以及ino1表达量的分析方法详见参考文献[9-10]。
1.2.2 过表达菌株的乙醇耐受性分析接种活化后的出发菌株Y01和过表达菌株YI2-1、YI2-2于YPD液体培养基中过夜振荡培养;检测3菌株的菌液浓度,当同步生长时,取菌液做梯度稀释后,各取2 μL相同浓度的菌液接种于乙醇浓度分别为5%、8%、9%、10%(V/V)的YPD固体培养基中,30℃培养30 h。观察菌落大小。为进一步分析菌株乙醇耐力,分别将过表达菌株和出发菌株接种到YPD液体培养基,进行30℃摇瓶培养至菌浓(OD600)达0.3,每份菌液中分别加入5%(V/V)的乙醇,或加入5%的水为空白对照。培养1 h后,菌体暴露在含不同乙醇浓度的PYD液体培养基中,在96孔板上孕育2 h。稀释50倍点样到YPD平板上培养48 h,观察细胞生长活力情况。
1.2.3 乙醇标准曲线的制作准确吸取色谱用无水乙醇1 mL、2 mL、3 mL、4 mL、5 mL、7.5 mL和10 mL至50 mL容量瓶中,用ddH2O定容,配置成乙醇浓度分别为2%、4%、6%、8%、10%、15%、20%的标准样品,用Agilent 7890A气相色谱检测。气相色谱检测条件:色谱柱为HP-FFAP(19091F-413);FID检测器,检测温度300℃;载气用氮气;分流比20:1;气化室温度为200℃;柱箱升温程序为:130℃稳定4 min,后运行200℃ 2.5 min。根据乙醇体积分数与色谱峰面积的关系,以乙醇体积分数为横坐标,色谱峰面积平均值作为纵坐标,制成乙醇标准曲线。
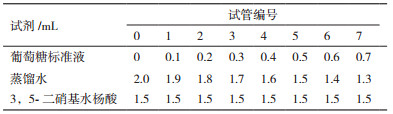
1.2.4 葡萄糖标准曲线的制作(3,5-二硝基水杨酸DNS法)称取无水葡萄糖100 mg,加水定容至50 mL,振荡摇匀后,得到浓度为2.00 mg/mL的葡萄糖标准溶液。再分别按表 1,添加各试剂。
将各管混匀,置于沸水浴中5 min显色后,立即置于水中冷却至室温,再向每管加入蒸馏水使其总体积为10 mL,振荡摇匀,在540 nm下用0号管作为对照,分别取1-7号管的葡萄糖浓度为横坐标,对应的OD540值为纵坐标,绘制葡萄糖的标准曲线。
1.2.5 菌株蔗糖酶酶活的测定测定方法参考文献[11]。取5 mL发酵液4 000 r/min离心6 min收集菌体,ddH2O洗涤两次后将细胞重悬于5 mL的乙酸钠缓冲液中(pH4.6),取200 μL加入到5 mL的乙酸钠配制的8%蔗糖溶液中,混合后30℃水浴30 min,取出放冰上,立即做适当稀释,用DNS法测稀释液中的还原糖。
1.2.6 酿酒酵母厌氧发酵培养(1)种子液的培养:接种Y01、YI2-1、YI2-1△KP于装有50 mL YPD液体培养基的250 mL三角瓶中,30℃、220 r/min,保持通气良好,过夜培养。次日取2mL菌液测菌浓,培养至各种子液细胞浓度一致。(2)按8%的接种量接种至100 mL的甘蔗汁发酵培养基中,通气良好下30℃ 220 r/min培养8 h。(3)在超净台内将8层纱布换成灭过菌的发酵栓,并在发酵栓里加2 mL 40%的硫酸,以隔绝外界空气进入。发酵装置(图 1)静置于30℃恒温培养箱内培养。

|
| 图 1 发酵装置 |
每隔12 h吸取2 mL发酵液在4℃下6 000 r/min离心5 min,用0.22 μm的过滤器过滤,滤液于样品瓶内,Agilent 7890A气相色谱仪分析其乙醇含量,色谱分析的条件参见乙醇标准曲线的制作。
1.2.8 工程菌株的遗传稳定性将过表达菌株YI2-1、YI2-1△KP接种至YPD液体培养基中30℃,220 r/min摇床培养,隔36 h转接至另一新鲜YPD液体培养基中,连续转接20代,取菌液稀释后涂布于YPD平板上。挑取单菌落用引物rDNA-F、rDNA-R进行PCR验证,确定其遗传稳定性。
2 结果 2.1 过表达ino1酿酒酵母菌株的获得将pURIH载体转化酿酒酵母Y01,经G418抗性浓度梯度(0.5-2 g/L)平板筛选,PCR验证,获得重组菌YI1。为获得更高ino1表达量的菌株,以YI1菌株为出发菌株再次转化。经筛选获得重组菌株YI2-1、YI2-2。Real-Time PCR分析ino1表达量,结果(图 2)显示YI2-1、YI2-2菌株ino1基因mRNA转录水平分别是Y01的16.235倍和11.163倍。将抗性基因KanMX敲除后的菌株命名为YI2-1△KP。

|
| 图 2 ino1基因的表达分析 |
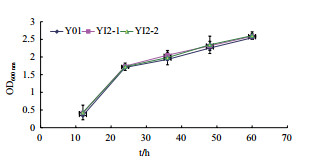
为验证过表达菌株的耐乙醇能力,分别在含5%和10%(V/V)乙醇的YPD平板上培养,在含5%乙醇浓度下液体培养与平板培养结果相符,菌株的生长状况没多大差别(图 3,图 4)。在含10%(V/V)乙醇浓度培养条件下,过表达菌株YI2的生长速率及菌落生长情况较好于出发菌株(图 5,图 6),表明过表达菌株的乙醇耐受性高于出发菌株,有较强的细胞活力,ino1的表达水平影响其活力。

|
| 图 3 菌株在含5%(V/V)乙醇的YPD平板上的生长状况 |
|
| 图 4 菌株在含有50 g/L乙醇浓度下的摇瓶培养生长曲线 |
|
| 图 5 菌株在含10%(V/V)乙醇的YPD平板上的生长状况 |

|
| 图 6 菌株在含有100 g/L乙醇浓度下的摇瓶培养生长曲线 |
将过表达菌株连续转接传代20代后,提基因组进行PCR验证。结果显示(图 7),电泳条带大小约为2 667 bp,与预期相符。表明ino1基因通过rDNA介导整合在酿酒酵母基因组上,过表达菌株YI2-1、YI2-1△KP具有很高的遗传稳定性。

|
| 图 7 YI2-1、YI2-1△KP遗传稳定性验证 1-2:YI2-1基因组PCR扩增片段;3-4:YI2-1△KP基因组PCR扩增片段;M:DL 5000 DNA Marker |
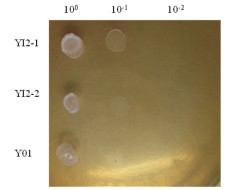
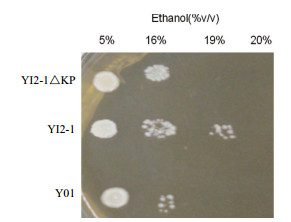
不同浓度的乙醇耐力分析发现,YI2-1、YI2-1△KP两菌株都能在在含9%(V/V)乙醇的YPD平板上生长(图 8),生长状况没多大差别。通过进一步的乙醇耐力分析方法处理后,培养结果见图 9,过表达菌YI2-1的乙醇耐性最高,可耐19%(V/V)的乙醇。

|
| 图 8 过表达菌株在含9%乙醇的YPD平板上的生长状况(48 h) |
|
| 图 9 不同菌株的乙醇耐力分析 |
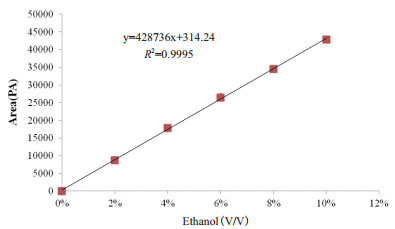
乙醇标准曲线的制作:配制不同浓度的乙醇的标准溶液进行气相色谱分析,绘制乙醇标准曲线(图 10)。其回归方程为y=428736x+314.24(R2)=0.999 5。
|
| 图 10 乙醇标准曲线 |
气相色谱检测发酵液中乙醇含量:将酵母菌株活化达到相同菌浓后,按照8%接种量,接入20°Bx甘蔗汁发酵培养基中。30℃,150 r/min培养8 h后,装上发酵栓进行厌氧培养。不同时间点取样,气相色谱分析乙醇含量,结果(图 11)表明,过表达菌株与出发菌株的乙醇最高积累量分别在96 h和84 h达到,其中过表达菌株YI2-1的最大乙醇积累量为13.10%(V/V),出发菌株为12.07%(V/V),较出发菌提高8.55%。而过表达菌株YI2-1△KP的最大乙醇积累量为13.17%(V/V),较出发菌提高9.16%。

|
| 图 11 20°Bx甘蔗汁培养基厌氧发酵乙醇产量变化 |
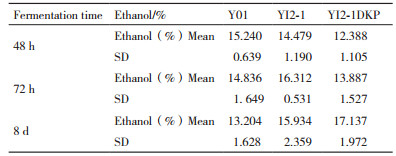
同上接种方法,利用29°Bx甘蔗汁发酵培养基,进行厌氧发酵。不同时间取样,测定发酵醪液的酒精度。结果如表 2。过表达菌株表现出相对较突出的的高渗透压胁迫耐受性,酵母菌YI2-1 72 h的乙醇积累量为16.31%(V/V),较出发菌株最高乙醇积累量15.24%,提高了7.03%(V/V)。而过表达菌株YI2-1△KP静止发酵8 d后,测定的乙醇积累量达到17.14%(V/V)。
为研究肌醇表达量的不同对蔗糖酶分泌的影响,细胞培养72 h后,测定了蔗糖酶比活的大小。根据DNS法测得菌体分泌蔗糖酶酶解蔗糖溶液产生的还原糖,及菌体干重,计算得Y01、YI2-1和YI2-1△KP,72 h的蔗糖酶比活分别为76.3 U/mg,81.1 U/mg,83.6 U/mg。过表达菌株比出发菌株的蔗糖酶比活要高,表明肌醇对蔗糖酶分泌具有一定的调控作用。
3 讨论选育乙醇耐受性和发酵性能优良的酿酒酵母菌株,是提高乙醇产量的一条必要途径。通过基因工程改造选育是热点[12]。本研究通过过表达酿酒酵母ino1基因,构建获得重组菌,并对其乙醇耐性和发酵性能进行了研究。
在含有100 g/L乙醇浓度下的摇瓶培养生长曲线显示,过表达菌株对数期菌体生长速率均比出发菌株快,菌株的高乙醇耐受性分析显示过表达菌YI2-1可耐19%(V/V)的乙醇,比出发菌株高,表明乙醇存在下,酵母细胞ino1基因表达量水平对提高细胞活力,耐高乙醇是极其重要的,与Furukawa[6]的研究一致。可能原因有:一方面,肌醇量能够影响细胞膜透性,低浓度肌醇影响细胞内物质的泄漏,如核苷酸、磷和钾等,进而影响细胞内pH、H+-ATPase的活性,改变细胞质离子稳态,影响膜透性屏障。高的肌醇量使ATPase的活性提高,抵偿质子流入量,触发改变脂质组成,最终提高乙醇耐受性[13]。另一方面,肌醇是磷脂酰肌醇(PI)合成的前体,而在真核细胞中,多种磷酸化形式的PI对于细胞信号传导、各种生理功能发挥极其重要作用[11]。
甘蔗汁培养基发酵实验,乙醇产量分析显示,过表达菌株YI2-1△KP的最大乙醇积累量为13.17%(V/V),较出发菌提高了9.16%。实验结果表明,乙醇耐受性实验可在一定程度上反应乙醇产量,过表达菌株的乙醇耐受性强,从而使乙醇的积累量得到提高。高糖度甘蔗汁(29°Bx)厌氧发酵乙醇产量分析显示,过表达菌株具有较突出的高渗透压胁迫耐受性,这与肌醇量能够影响细胞膜透性是一致的。
综上所述,过表达ino1基因能够明显的提高酿酒酵母的乙醇耐受性。本研究构建的工程菌株能够利用能源甘蔗汁发酵,生产较高体积产率的乙醇。后期需要继续对发酵工艺优化等进行研究,有望进一步提高乙醇产量。最后,乙醇耐性机理比较复杂,还尚未明晰。酿酒酵母的乙醇耐受性受多种基因控制,所以研究者仍然需要对酵母菌分子机制做进一步研究。
4 结论在酿酒酵母中过表达ino1基因可提高重组酿酒酵母的乙醇耐受性及产量。对过表达菌株的乙醇耐受性进行分析,YI2-1可耐19%(V/V)的乙醇。为生物安全性考虑,利用YPG诱导培养基,诱导表达cre重组酶切除KanMX抗性基因,获得无有害抗性基因的过表达菌株YI2-1△KP,并进行了连续传代培养,结果表明过表达菌株具有很高的遗传稳定性。利用甘蔗汁为碳源进行发酵培养,采用气相色谱(GC)对发酵产物乙醇进行检测,重组菌YI2-1△KP的最大乙醇积累量为13.17%(V/V),与出发菌株相比提高了9.16%。研究表明通过过表达酿酒酵母ino1基因能够有效提高菌株细胞活力、乙醇耐受性。
| [1] |
REN21. Renewables 2018 global status report[R]. Paris: REN21, 2018.
|
| [2] |
尤亮, 丁东栋, 崔志峰. 乙醇耐受性酿酒酵母菌株选育的研究进展[J]. 工业微生物, 2016, 46(3): 51-55. DOI:10.3969/j.issn.1001-6678.2016.03.010 |
| [3] |
Voordeckers K, Kominek J, Das A, et al. Adaptation to high ethanol reveals complex evolutionary pathways[J]. PLoS Genetics, 2015, 11(11): e1005635. DOI:10.1371/journal.pgen.1005635 |
| [4] |
Chi Z, Kohlwein SD, Paltauf F. Role of phosphatidylinositol(PI)in ethanol production and ethanol tolerance by a high ethanol producing yeast[J]. J Ind Microbiol Biotechnol, 1999, 22(1): 58-63. DOI:10.1038/sj.jim.2900603 |
| [5] |
季冉, 袁兴中, 等. 外加肌醇对嗜鞣管囊酵母发酵的酒精产量及其耐酒精能力的影响[J]. 生物技术通报, 2008(2): 163-167, 171. |
| [6] |
Furukawa Keiji, Obata Hiroshi, Kitano Hideyuki, et al. Effect of cellular inositol content on ethanol tolerance of Saccharomyces cerevisiae in sake brewing[J]. Journal of Bioscience and Bioengineering, 2004, 98(2): 107-113. DOI:10.1016/S1389-1723(04)70250-9 |
| [7] |
Hisashi S, Yusuke M. Microorganism producing inositol with high yield, and method for manufacturing inositol by using same: WO, 2013125666 A1[P]. 2013-08-29.
|
| [8] |
Hong ME, Lee KS, et al. Identification of gene targets eliciting improved alcohol tolerance in Saccharomyces cerevisiae through inverse metabolic engineering[J]. J Biotechnol, 2010, 149(1/2): 52-59. |
| [9] |
黄贞杰, 陈玲, 张积森, 等. Scino1基因克隆及酵母多基因多拷贝整合表达载体的构建[J]. 福建师范大学学报:自然科学版, 2012, 28(6): 100-105. |
| [10] |
黄贞杰, 陈由强, 陈丽霞, 等. 产肌醇酿酒酵母基因工程菌的构建[J]. 微生物学通报, 2016, 43(7): 1540-1546. |
| [11] |
张厚程, 池振明. ino1基因在粟酒裂殖酵母中的表达及对蔗糖酶分泌和磷脂合成的影响[J]. 山东大学学报:理学版, 2002, 37(6): 544-547. |
| [12] |
赵华, 谌文菊. 基因工程在构建酿酒酵母酒精发酵菌的研究进展[J]. 世界最新医学信息文摘, 2017, 17(68). |
| [13] |
张苗苗, 陆栋, 剡倩, 等. 细胞膜对酿酒酵母乙醇耐受性影响的研究进展[J]. 中国酿造, 2016, 35(9): 16-19. |