在土壤生态系统中,大部分细菌虽然存在而且有明显的生物学活性,但难以被传统的富营养培养基分离,不同的微生物学家使用很多术语来描述这些细菌,包括“寡营养细菌”[1]和“活的不可培养(Viable but non-culturable,VBNC)细菌”[2]等。寡营养细菌数量巨大、种类繁多、基因资源丰富,因此开发此类微生物已成为国内外研究热点。现阶段的研究策略主要分为两大类:一方面不断改进现有的微生物培养技术;另一方面结合生物化学和分子生物学的原理建立与发展非培养方法,如磷酸脂肪酸(Phosphohpids fattyacid,PLFA)分析、Biology微孔板法及宏基因组测序等[3]。
虽然以组学为代表的非培养方法推动了微生物资源的挖掘与利用,但这类方法也存在一些问题:首先,很难在细胞水平上对微生物进行实验研究,无法深入了解微生物细胞的生命活动规律;其次,很难科学地描述和验证微生物群落中不同种群之间的相互作用关系。因此,在利用非培养方法研究微生物多样性的同时,有必要不断优化现有微生物培养技术,二者结合以帮助我们深入研究微生物生命活动规律并探索其重要的生物学功能,在真正意义上实现微生物资源的开发与利用。
寡营养细菌难以分离的原因及应对策略:(1)少数易培养微生物的竞争性干扰。根据MacArthur提出的“R-K选择”理论,易培养细菌是环境中的“R选择”者,能在短时间内迅速倍增。而寡营养细菌作为环境中占多数的“K选择”者,能对有限资源进行最有效地利用,保持极低的生长率,以适应生境中的低营养条件。利用传统的富营养培养基可对易培养细菌进行有效富集,然而其生长必然伴随着营养物质的大量消耗以及有害代谢产物的积累,进而抑制多数寡营养细菌的生长,使得最终分离的不一定是生境中密度最高或发挥主要功能的细菌。Button等[4]使用稀释培养法,即当把样品中的微生物群体稀释至痕量时,样品中的“K选择”者可以不受“R选择”者的干扰,大大提高寡营养细菌被分离的可能性。(2)传统培养基无法提供不同种类微生物生长所需的全部营养物质。自然界中微生物种类丰富,不同种类的微生物生长代谢类型不同,对反应的底物要求也存在差异。传统培养基大大简化了营养组成,无法提供不同微生物生长繁殖所必需的某些化学物质。为弥补这一缺陷,通常将土壤浸出液添加到合成培养基中,但添加比例通常为1:100-1 000[5-6],这在很大程度上稀释了其中所含生长因子的有效浓度。(3)传统富营养培养基营养成分相对丰富或氧化环境的压力。1 g土壤中通常含有106-109个微生物细胞[7],分配到每一个微生物细胞,其可利用的营养物质极度匮乏,多数处于“寡营养”状态,传统分离方法通常将微生物迅速置于富营养状态,突然的营养变化凸显了一些细菌固有的基因缺陷,甚至成为其生长的主要障碍。这其中就包括有毒物质的形成,如半乳糖苷增多、氧代谢形成有毒产物或自由基积累过快不可逆转的对部分细胞造成损伤。研究表明,丙酮酸钠与过氧化氢酶能降解培养过程中产生的毒性氧[8],对恢复微生物可培养性具有良好效果。
植物根际往往存在一类被称为植物根际促生菌[9](Plant growth promoting rhizobacteria,PGPR)的微生物,它们能通过固氮、溶磷、拮抗病原菌以及产生铁载体、各类水解酶和植物激素等方式显著促进植物生长[10]。寡营养细菌难以被传统的富营养培养基分离得到,不仅仅是由于营养水平的限制,而是上述因素的综合效应。因此,本研究基于稀释培养法,直接使用土壤浸出液配制寡营养培养基,以更好地模拟土壤原生境的营养成分,同时辅以丙酮酸钠和过氧化氢酶以降解毒性氧物质,来分离寡营养细菌,并通过测定其产生铁载体能力以及降解蛋白质能力探索菌株在农业上的应用价值。
1 材料与方法 1.1 材料供试植株选用黄瓜(Cucumis sativus L.)于山东农业大学温室培育,于2017年2月播种,4月定植,常规栽培管理,植株长势良好,至8月采集根际土壤样品。
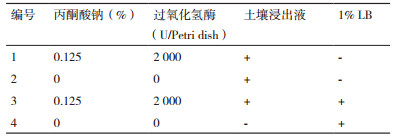
1.2 方法 1.2.1 培养基(1)土壤浸出液:土壤50.00 g,去离子水1 L,pH自然,混匀后用四层纱布粗滤,4℃,10 000 r/min离心1 min,取上清液于4℃冰箱保存备用。(2)本实验所设计4类培养基配方详见表 1,具体配制过程如下:1、2号培养基灭菌前成分相同,即只含土壤浸出液,因此将1×105 Pa灭菌的土壤浸出液与0.22 μm微孔滤膜过滤除菌的土壤浸出液等体积混合后,倒板;3号培养基灭菌前为使用土壤浸出液配制2% LB:胰蛋白胨0.20 g,酵母提取物0.10 g,NaCl 0.20 g,土壤浸出液1 L,pH自然,1×105 Pa灭菌20 min,待培养基冷却至50-60℃与0.22 μm微孔滤膜过滤除菌土壤浸出液等体积混合,倒板;4号培养基灭菌前为使用去离子水配制1% LB:胰蛋白胨0.10 g,酵母提取物0.05 g,NaCl 0.10 g,去离子水1 L,pH自然,1×105 Pa灭菌20 min,倒板。(3)2.27 mol/L丙酮酸钠溶液:丙酮酸钠0.25 g,去离子水1 mL,0.22 μm微孔滤膜过滤除菌,吸取100 μL涂布于对应培养基平板上,使涂布平板最终含有0.125%的丙酮酸钠。(4)1×107 U/L过氧化氢酶溶液:过氧化氢酶2.00 g,0.05 mol/L磷酸二氢钾-氢氧化钠缓冲液1 L,pH 7.0,0.22 μm微孔滤膜过滤除菌,吸取200 μL涂布于对应培养基平板上,使涂布平板最终含有2 000 U的过氧化氢酶。(5)CAS检测培养基[11]。(6)干酪素培养基:干酪素10.00 g,琼脂15.00 g,去离子水1 L,pH 7.4。(7)产蛋白酶细菌发酵培养基:干酪素10.00 g,去离子水1 L,pH 7.4。上述(5)-(7)培养基1×105 Pa灭菌20 min。
2017年11月9日从山东农业大学温室(36°11′N,117°06′E)采集黄瓜的根际土壤样品。经多次预试验后选稀释度10-6-10-7的土壤悬液各取100 μL涂布于寡营养培养基平板上,于37℃温箱中培养。然后挑取不同形态的菌落,在平板上划线分离单菌落并结合镜检至菌落形态单一为止,并对菌株进行编号,分别保藏于4℃和﹣20℃冰箱备用。
1.2.3 菌株分离鉴定菌落与细胞形态鉴定参照《伯杰氏系统细菌学手册》[12]。部分生理生化鉴定参照《常见细菌系统鉴定手册》[13],通过Biology微生物鉴定系统进行生长实验与化学敏感实验。利用基因组快速抽提试剂盒(生工SK8255)提取基因组,提取方法参照配套说明书。采用细菌16S rRNA基因通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′),扩增片段长度约为1 500 bp;gyrB基因引物XgyrB1F(5′-ACGAGTACAACCCGGACAA-3′)和XgyrB1R(5′-CCCATCARGGTGCTGAAGAT-3′),扩增片段长度约为700 bp。对提取的菌株基因组DNA进行PCR扩增,采用50 μL PCR扩增反应体系:模板1 μL,引物(F)1 μL,引物(R)1 μL,5×TransStart FastPfu Buffer 10 μL,2.5 mmol/L dNTPs 4 μL,TransStart FastPfu DNA Polymerase 1 μL,加超纯水补足到50 μL。反应程序为:95℃预变性2 min;95℃变性20 s;55℃退火20 s;72℃延伸1 min(gyrB 30 s),30个循环后,72℃延伸5 min,PCR扩增产物于4℃保存。对扩增后的产物进行1%琼脂糖凝胶电泳检测。基因序列由上海生物工程服务有限公司进行测定,将所获得序列利用BLAST比对分析,从NCBI的GeneBank数据库中挑选相似性序列并得到序列号信息,运用MEGA7.0软件生成N-J进化树,分析同源性关系较近的菌株。
1.2.4 菌株对植物促生功能的检测参照王君[14]的方法对菌株的蛋白酶和铁载体产生能力进行测定,蛋白酶活性测定参照《微生物学实验》[15]。其中,试验所采用阴性对照为链状副球菌(Paracoccus alkenifer),是本实验室保存的一株无蛋白酶与铁载体产生能力的细菌。
2 结果 2.1 菌株鉴定结果 2.1.1 分离菌株的形态观察结果培养7 d后,本研究所设计的4种培养基上的菌落数分别为:1号培养基32个,2号培养基23个,3号培养基40个,4号培养基8个。根据菌落形态差异,从上述培养基上挑取菌落数较多、生长速度较慢得1类菌,用三区划线法进行纯化,将其命名为S35。通过细胞形态观察及革兰氏染色进行初步鉴定,S35为G-菌、无内生孢子、短杆状、菌落较小微凸呈黄色、表面光滑湿润不透明(图 1)。

|
| 图 1 菌株S35革兰氏染色 放大倍数:1000倍 |
本研究共测定了菌株S35的77项生理生化特性(表 2),其中脲酶阴性,氧化酶、鸟氨酸脱羧酶、赖氨酸脱羧酶、脂酶和精氨酸双水解酶阳性,利用L-丙氨酸、L-组氨酸、L-乳酸及柠檬酸,能够利用葡萄糖、麦芽糖和乳糖产酸,与模式株S. maltophilia的生理生化结果一致。
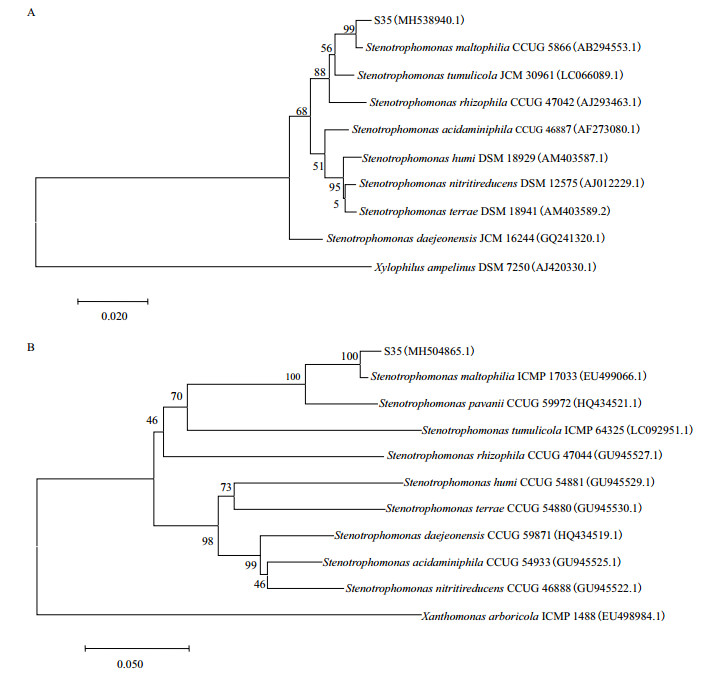
菌株S35经PCR扩增的16S rRNA基因片段大小为1 438 bp,在GenBank中进行序列比对分析,与Stenotrophomonas maltophilia(登录号:FJ906801.1)一致性为100%;gyrB基因片段大小为695 bp,与S. maltophilia(登录号:EU499066.1)一致性为100%。使用MEGA 7.0软件通过N-J法分别构建系统发育树(图 2),S35菌株与嗜麦芽寡养单胞菌均处同一支,遗传进化距离最近。
|
| 图 2 基于16S rRNA(A)和gyrB(B)基因序列构建菌株S35系统发育树 发育树节点的数值表示Bootstrap值;标尺表示序列差异的分支长度;括号内数值为GenBank数据库的登录号 |
其中,gyrB的基因序列为:GAATCATCATCATGACCGACGCCGACGTCGACGGCGCCCACATCCGCACCCTGCTGCTGACGTTCTTCTACCGTCAGATGCCGGAGCTGATCGAGCGCGGTTACGTCTACATCGGCCTGCCGCCGCTGTACAAGATCAAGCAGGGCAAGCAGGAGCTGTACCTGAAGGACGACCCGGCGCTGGACAGCTACCTGGCCAGCAGCGCAGTGGAAAACGCTGCACTGGTGCCGGCCACCGGCGAGCCCGGCATCGAAGGCCTTGCGCTGGAGAAGCTGCTGCTGGCCTACGCGGCCGCGCTGGATTCGATCGAGCGCAACGCACATCGCTACGACCGCAACCTGCTTGAAGCGCTGGTCGATTTCGTACCGATGGACCTGCTGCCGGTGAAGGCGAGGGCCTGGATGCACTGGCCAAGCGCCTCAACCAGGCCGCGCTTGCAGGAAGCCAACGACGAGCGCCCGGCCGCTGTGCTGGTGACCCGTCGCCACATGGGTGAACAGCACATCCAGGTGCTGCCGATGTCGGCCTTCGAAAGCGGCGAACTGCGCGCAATCCACCAGGCATCGAAGCTGCTGCACGGTCTGGTGCGACCATTTCCCGCGGTGCCAAGTCGATCGAAGTCGACAGCTTTGCCAAGGCACAGAACTGGCTGCTCGAGGAGGCCAAGCGCGGCCGCCAGATCCAGCGATTCAAGG。
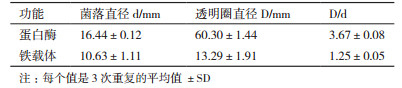
2.2 菌株S35蛋白酶与铁载体产生能力检测结果将菌株S35接种到干酪素检测培养基和通用CAS检测培养基上,在培养72 h后菌株周围均出现明显水解圈和显色圈,根据其直径大小可以判定S35产蛋白酶和铁载体的能力大小(图 3和表 3),说明菌株S35具有产蛋白酶和铁载体的能力。经干酪素发酵培养基培养48 h后菌株S35在40℃,pH 11的条件下测定的蛋白酶活力为36 U/mL。

|
| 图 3 菌株S35产蛋白酶与铁载体检测结果 阴性对照为链状副球菌,无蛋白酶与铁载体的产生能力 |
一般认为,自然环境中微生物数量庞大,其可利用的营养物质极度匮乏,多数处于“寡营养”状态,且一些微生物适宜生长在与自然环境相近的基质中[16]。因此,采用低营养或辅以含少量生长因子的土壤浸出液制成的培养基会获得较好的培养效果[17]。通过比较本研究所设计的4种培养基上的菌落数,可以看出丙酮酸钠、过氧化氢酶以及土壤浸出液的使用确实可增加寡营养培养基上可培养的菌落数,进一步证实上述推论。当然,我们应充分重视自然生境中微生物的分布可能是随营养渐变而呈现梯度分布,所以培养策略不应是全营养或100%稀释后的简单选择,后续研究应使用不同营养梯度来深入分析营养浓度对菌株分离的影响。
研究表明[18-19],使用常见细菌培养基很难分离得到的嗜麦芽寡养单胞菌。本研究发现,嗜麦芽寡养单胞菌在100% LB培养基上纯培养时,生长速度快、菌落较大且饱满,推测其在通常情况下不易分离得到的原因是在富营养培养基上受具有生长优势的细菌的干扰。因此,实验采用稀释培养法同时配合低营养物质浓度确实可以分离获得在传统富营养培养基上不易分离的细菌。其中,土壤浸出液的使用最大限度模拟土壤原生境,因此更加有利于植物根际环境中优势菌的生长。
本研究利用寡营养培养基从黄瓜根际土壤中分离得到S. maltophilia S35。嗜麦芽寡养单胞菌是一种革兰氏阴性杆菌,属于黄单胞菌目黄单胞菌科。该菌于1958年首次分离发现,1993年有学者根据其无黄单胞菌素,无植物病原性,且能在37℃生长等特性提议将此菌命名为嗜麦芽寡养单胞菌。2017年,Singh等[20]首次报道S. maltophilia SBP-9具有ACC脱氨酶活性并在盐胁迫下可赋予小麦全植株的耐受性,增强小麦对生物和非生物胁迫的抗性。因此,接下来我们将进一步探索此菌在植物根际促生方面的应用潜力。
4 结论本研究利用土壤浸出液为基础培养基,适当添加能够降低活性氧的成分来分离土壤中寡营养微生物是一类行之有效的方法。利用上述方法从黄瓜根际土壤分离得到嗜麦芽寡养单胞菌,该菌株具有产蛋白酶和铁载体的能力。
| [1] |
Giovannoni SJ, Stingl U. Molecular diversity and ecology of microbial plankton[J]. Nature, 2005, 437(7057): 343-348. DOI:10.1038/nature04158 |
| [2] |
Barer MR, Harwood CR. Bacterial viability and culturability[J]. Advances in Microbial Physiology, 1999, 41: 93-137. DOI:10.1016/S0065-2911(08)60166-6 |
| [3] |
王保军, 刘双江. 环境微生物培养新技术的研究进展[J]. 微生物学通报, 2013, 40(1): 6-17. |
| [4] |
Button DK, Schut F, Quang P, et al. Viability and isolation of marine bacteria by dilution culture:theory, procedures, and initial results[J]. Appl environ Microbiol, 1993, 59(3): 881-891. |
| [5] |
周德庆. 微生物学教程[M]. 北京: 高等教育出版社, 2002: 247-248.
|
| [6] |
李阜棣. 农业微生物学实验技术[M]. 北京: 中国农业出版社, 1996.
|
| [7] |
张伟.纯培养和土壤中微生物形成的腐殖质研究[D].长春: 吉林农业大学, 2014.
|
| [8] |
Olson JB, Lord CC, McCarthy PJ. Improve recoverability of microbial colonies from the marine sponge samples[J]. MicrobEcol, 2000, 40: 139-147. |
| [9] |
刘丹丹, 李敏, 刘润进. 我国植物根围促生细菌研究进展[J]. 生态学杂志, 2016, 35(3): 815-824. |
| [10] |
Kloepper JW, Zablotowicz RM, Tipping EM, et al. Plant growth promotion mediated by bacterial rhizosphere colonizers[M]//Keister KL, Cregan PB. The rhizosphere and plant growth. Dordecht: Kluwer Academic Publishers, 1991: 315-326.
|
| [11] |
田方, 丁延芹, 朱辉, 等. 烟草根际铁载体产生菌G-229-21T的筛选、鉴定及拮抗机理[J]. 微生物学报, 2008(5): 631-637. DOI:10.3321/j.issn:0001-6209.2008.05.011 |
| [12] |
阮继生. "伯杰氏系统细菌学手册(第二版)"第5卷与我国的放线菌系统学研究[J]. 微生物学报, 2013, 53(6): 521-530. |
| [13] |
东秀珠. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 371.
|
| [14] |
王君.蓝莓根际促生细菌的筛选、鉴定及其促生效果[D].泰安: 山东农业大学, 2016.
|
| [15] |
沈萍, 陈向东. 微生物学实验[M]. 北京: 高等教育出版社, 2007: 189.
|
| [16] |
Palleroni NJ, Bradbury JF. Stenotrophomonas, a new bacterial genus for Xanthomonas maltophilia(Hugh 1980)Swings et al. 1983[J]. International Journal of Systematic Bacteriology, 1993, 43(3): 606-609. DOI:10.1099/00207713-43-3-606 |
| [17] |
Willems A, Falsen E, Pot B, et al. Acidovorax, a new genus for Pseudomonas facilis, Pseudomonas delafieldii, E. Falsen(EF)group 13, EF group 16, and several clinical isolates, with the species Acidovorax facilis comb. nov. Acidovorax delafieldii comb. nov. and Acidovorax temperans sp.[J]. International Journal of Systematic Bacteriology, 1990, 40(4): 384-398. DOI:10.1099/00207713-40-4-384 |
| [18] |
Adjidé CC, De Meyer A, Weyer M, et al. A sensitive, specific and predictive isolation medium developed for Stenotrophomonas maltophilia study in healthcare settings[J]. Pathology Biology(Paris), 2010, 58(1): 11-17. DOI:10.1016/j.patbio.2009.07.004 |
| [19] |
岳秀娟, 余利岩, 李秋萍, 等. 自然界中难分离培养微生物的分离和应用[J]. 微生物学通报, 2006, 33(3): 77-81. DOI:10.3969/j.issn.0253-2654.2006.03.015 |
| [20] |
Singh RP, Jha RN. The PGPR Stenotrophomonas maltophilia SBP-9 augments resistance against biotic and abiotic stress in wheat plants[J]. Frontiers in Microbiology, 2017, 8: 1945. DOI:10.3389/fmicb.2017.01945 |