2. 中国热带农业科学院热带生物技术研究所,海口 570100
2. Institute of Tropical Biotechnology, Chinese Academy of Tropical Agricultural Sciences, Haikou 570100
海洋微生物是海洋天然产物的主要来源之一。尤其是海洋真菌,遗传背景复杂、代谢产物种类丰富,已成为海洋微生物新天然产物挖掘的重要资源[1]。据不完全统计,海洋真菌产生结构类型多样的新天然产物,包括萜类、聚酮类、肽类、甾体、酰胺、脂肪酸、生物碱等。这些新天然产物呈现出包括抗菌、抗肿瘤、抗寄生虫、抗污损和抗病毒等多种生物活性[2],引起了国内外众多天然产物研究者的广泛关注。
海洋真菌分布广泛,栖息于海洋的各种生态环境,包括海水、海底沉积物、海水漂浮木、海洋动植物表面及内部组织等[3]。其中,海洋动植物是海洋真菌的良好宿主,海洋真菌与这些宿主形成了附生、共生或者内生的相互关系,这种相互影响不仅使海洋真菌产生与其他海洋真菌不一样的次级代谢产物,甚至还有可能产生与宿主相同或相似的活性物质[4]。因此,近年来海洋共附生真菌已成为海洋微生物天然产物研究的热点[5-6]。
海绵、珊瑚和海草是海洋底栖生长的主要动植物种类,是海洋生态系统中的重要生物种群,蕴含着丰富的共附生真菌资源,并能产生丰富的次级代谢产物[7-8]。因此,对这三种海洋生物的共附生真菌种类进行广泛深入地分离和研究,不仅对海洋环境的生态保护具有重要意义,也对发现与挖掘新的活性天然产物具有重要的利用价值。基于此,本研究采集海南文昌近海域的海绵、石珊瑚和海草为研究对象,对其共附生真菌进行分离、鉴定和抗菌活性分析,旨为这类海洋共附生真菌资源的进一步开发和利用奠定基础。
1 材料与方法 1.1 材料 1.1.1 实验材料海草、海绵、石珊瑚样品采集于海南文昌海域。样品采集后,4 h内带回实验室-20℃冰箱保存备用。抗菌活性指示菌:金黄色葡萄球菌和枯草芽孢杆菌为实验室保存。
1.1.2 培养基配置分离培养基Ⅰ:麦芽提取粉,20 g;陈海水,1 L;自然pH;琼脂,20 g。分离培养基Ⅱ:葡萄糖,10 g;蛋白胨,5 g;KH2PO4,1 g;MgSO4·7H2O,0.5 g;陈海水,1 L;自然pH;琼脂,20 g。分离培养基Ⅲ:蛋白胨,5 g;葡萄糖10 g;磷酸二氢钾1 g;硫酸镁0.5 g;琼脂15 g;孟加拉红0.03 g;蒸馏水1 000 mL;氯霉素0.1 g。抑制剂:100 mg/L的羧苄青霉素和链霉素(加入所有分离培养基中)。2号发酵培养基:麦芽提取粉,20 g;葡萄糖,20 g;酵母膏,5 g;蛋白胨,10 g;陈海水,1 L;自然pH。4号发酵培养基:甘露醇,20 g;葡萄糖,20 g;酵母膏,5 g;蛋白胨,10 g;KH2PO4,0.5 g;MgSO4·7H2O,0.3 g;陈海水,1 L;pH6.0。
1.2 方法 1.2.1 真菌菌株分离将采集的海草、海绵和石珊瑚样品分别用无菌水清洗三次,剪碎,取1 g置于无菌研钵中,加5 mL无菌水研磨成匀浆,吸取上清液按1:10、1:100、1:1 000的比例稀释,取稀释液100 μL分别涂布于分离培养基上,28℃,培养3-5 d,挑取单菌落到PDA培养基上,反复纯化。纯化后的菌株分别保存于PDA斜面和-20℃的无菌甘油(20%)。
1.2.2 真菌菌株鉴定纯化得到的菌株根据平板上的形态特征进行初步排重,选取形态特征差异较大的菌株做ITS序列分析。各菌株基因组DNA提取及rDNA-ITS扩增参照陈吉良[9]等的方法。即取0.2 mL 10%(W/V)的Chelex-100溶液加入到无菌的离心管中,再从平板上挑取绿豆大小的菌丝体置于Chelex-100溶液中,在旋涡混合器上振荡4-5 s至菌株与溶液混合,然后沸水浴10 min;冷却至室温之后,10 000 r/min离心10 min。取上清作为PCR扩增的模板,PCR引物为ITS1:5′-TCCGTAGGTGAACCTGCGG-3′,ITS4:5′-TCCTCCGCTTATTGATATGC-3′。扩增产物送往上海生物工程有限公司进行测序。所得序列利用NCBI中BLAST在线比对服务进行同源性比较分析,并确定菌株的种属。
1.2.3 真菌菌株抗菌活性分析分别接种菌株于发酵培养基2号和4号中静止常温下培养30 d,三倍体积乙酸乙酯萃取3次,萃取液合并后经减压旋蒸浓缩得粗提物。将粗提物用甲醇配制成1 mg/mL浓度,10 000 r/min离心10 min。取10 μL的上清液加在直径为6 mm的滤纸片上,待滤纸片风干后,贴在已分别接种了金黄色葡萄球菌和枯草杆菌的琼脂营养培养基表面(菌体浓度1×106/mL),28℃培养1 d,采用十字交叉法测定抑菌圈直径,重复3次。
2 结果 2.1 真菌的分离纯化本研究共采用了3种分离培养基对采集于海南文昌海域的10种海草、9种海绵和11种石珊瑚的共附生真菌进行分离纯化,一共获得了113株纯化的真菌。其中海绵中分离得到的菌株最多,为53株真菌,占比46.9%;石珊瑚次之,为42株真菌,占比37.2%;海草最少,为18株真菌,占比15.9%(图 1)。

|
| 图 1 3种海洋生物中分离的共附生真菌所占比例 |
通过形态排重,选取32株代表性菌株进行了ITS序列分析。结果(表 1)表明,32株真菌归属于3个门(子囊菌门、担子菌门和半知菌门),8个目(丛梗孢目、曲霉目、丝孢目、壳霉目、盘菌目、球壳目、刺盾炱目和多孔菌目)和10个属(枝孢属、曲霉属、地霉属、青霉属、拟青霉属、篮状菌属、弯孢聚壳属、伪壶担菌属、小囊菌属和隔孢伏革属),以及1个未定属的炭角菌科。
其中9株菌属于曲霉属(Aspergillus),6株菌属于地霉属(Geotrichum),4株菌属于弯孢聚壳属(Eutypella),2株菌属于枝孢属(Cladosporium),1株属于隔孢伏革属(Peniophora),2株菌属于青霉属(Penicillium),1株菌属于篮状菌属(Talaromyces),1株属于小囊菌属(Microascus),1株菌属于拟青霉属(Paecilomyces),1株菌属于伪壶担菌属(Pseudolagarobasidium),1株属于炭角菌科(Xylariaceae),1株属于多孔菌目(Polyporales),2株属于刺盾炱目(Chaetothyriales)。海绵样品中分离的真菌种类最丰富,10个属的真菌都有分布。而石珊瑚和和海草样品中分离到的真菌种类最少。此外,曲霉属真菌分离率最高,其他种属则较低。
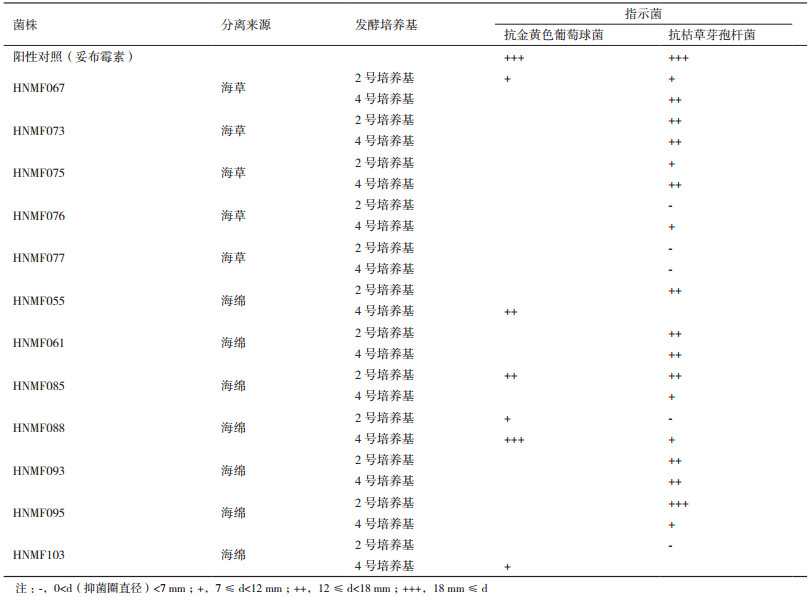
2.3 真菌发酵产物的的抗菌活性采用两种培养基对分离的真菌进行静置发酵,并分别提取发酵产物进行抑菌活性分析。结果(表 2)发现有12株真菌对两种指示细菌显示出不同程度的抑菌作用,并且在不同发酵培养基条件下对真菌代谢产物的抑菌能力产生一定的影响。其中,菌株HNMF055、HNMF085、HNMF093和HNMF095在2号发酵培养基上对枯草芽孢杆菌的抑制活性相对较强。在4号发酵培养基上,菌株HNMF067和HNMF075则对枯草芽孢杆菌具有很强的抑制效果。而菌株HNMF073和HNMF061和HNMF093在两种发酵培养基对枯草芽孢杆菌都表现出较强的抗性。此外,菌株HNMF067、HNMF055、HNMF085、HNMF088和HNMF103对金黄色葡萄球菌具有抑制作用,其中菌株HNMF088的抑制效果最强。
本研究从海南文昌海域采集的海绵、石珊瑚和海草样品中共分离到113株海洋真菌,鉴定了32株独立的真菌。其中曲霉属真菌是所有样品分离率最高的类群,这与前人的报道一致[10-15]。海绵样品中除了分离到常见的Aspergillus属和Penicillium属真菌外,还分离出不常见的Cladosporium、Microascus、Paecilomyces、Talaromyces和Xylariaceae,以及未见报道的Geotrichum、Eutypella、Peniophora、Pseudolagarobasidium等真菌。海草和石珊瑚样品中除了常见的Aspergillus属真菌,也发现不常见的Cladosporium属和Talaromyces属真菌。总体看来,这些海洋生物共附生真菌种类丰富多样,寄主既有普遍性,又存在特异性。其中曲霉属真菌的寄主分布广泛,而其他属真菌的寄主则具有一定的特异性。曲霉属真菌不仅是海洋最常见的真菌种类之一,也是海洋新天然产物开发的重要资源。据统计,该属真菌能产生物碱、聚酮、甾体、萜类、脂肪酸、卤代物、糖苷、肽类等结构类型多样的天然产物,并呈现出多种生物活性,包括抑菌、抗癌、抗寄生虫和清除自由基等[16],这些新天然产物正成为海洋药物开发的先导化合物。例如,海洋曲霉属真菌Aspergillus ustus的天然产物halimide的衍生物plinabulin(NPI-2358),作为一种新型的血管阻断剂抗癌药,目前已经进入了Ⅲ期临床研究[17-18]。而其他稀有类群海洋真菌的新天然产物在海洋真菌天然产物的研究中也占有重要地位[1]。因此,本研究分离到的113株海洋真菌中,既有常见的曲霉属真菌种类,也有稀有的如Pseudolagarobasidium等真菌类群。目前还未见对该海域的海洋真菌的相关报道,预示这些共附生真菌在海洋天然产物的挖掘上具有潜在的利用价值。
此外,本研究采用两种发酵培养基对分离菌株进行发酵培养,结果仅12株真菌的发酵产物表现出抗菌活性,且12株菌中大部分菌株的抗菌活性在两种培养基呈现出较大差异,表明培养条件如培养基种类对海洋真菌代谢产物的表达具有重要影响。海洋真菌的次级代谢产物合成相关基因簇在实验室条件下大部分处于沉默状态,环境条件的改变能够使得某些沉默的基因得以表达从而产生不同的次生代谢产物[19]。因此,其它未表现出活性的菌株可能与选用的培养基不适宜有关,有待进一步采用单菌株多次级代谢产物策略(One strain many compounds,OSMAC)[20]改变现有培养条件,激发沉默基因簇的表达,促使其产生更多结构新颖、生理活性好的次生代谢产物。
总之,本研究对海南文昌海域的海草、海绵和石珊瑚共附生真菌的多样性进行了初步探讨,既分离到常见的曲霉属真菌,也获得比较稀有的其他真菌种类;通过抗菌活性初筛,部分真菌的发酵产物具有良好的抗菌活性,这为后续海洋真菌活性代谢产物的开发利用研究奠定了基础。
4 结论本研究从海南文昌海域采集的海绵、石珊瑚和海草样品中共分离到113株海洋真菌,鉴定了32株独立的真菌,32株真菌归属于3个门(子囊菌门、担子菌门和半知菌门),8个目(丛梗孢目、曲霉目、丝孢目、壳霉目、盘菌目、球壳目、刺盾炱目和多孔菌目)和10个属(枝孢属、曲霉属、地霉属、青霉属、拟青霉属、篮状菌属、弯孢聚壳属、伪壶担菌属、小囊菌属和隔孢伏革属),以及1个未定属的炭角菌科。采用两种发酵培养基对分离菌株进行发酵培养,结果仅12株真菌的发酵产物表现出抗菌活性,且12株菌中大部分菌株的抗菌活性在两种培养基呈现出较大差异,表明培养条件如培养基种类对海洋真菌代谢产物的表达具有重要影响。
| [1] |
朱统汉, 马颖娜, 王文玲, 等. 非曲霉(青霉)属海洋真菌新天然产物(1951-2014)[J]. 中国海洋药物, 2015(4): 56-108. |
| [2] |
Imhoff JF. Natural products from marine fungi-still an underrepresented resource[J]. Marine Drugs, 2016, 14(1): 19. DOI:10.3390/md14010019 |
| [3] |
Tisthammer KH, Cobian GM, Amend AS. Global biogeography of marine fungi is shaped by the environment[J]. Fungal Ecology, 2016, 19: 39-46. DOI:10.1016/j.funeco.2015.09.003 |
| [4] |
Debbab A, Aly AH, Proksch P. Bioactive secondary metabolites from endophytes and associated marine derived fungi[J]. Fungal Diversity, 2011, 49(1): 1-12. DOI:10.1007/s13225-011-0114-0 |
| [5] |
张翠仙, 郭光天, 何细新, 等. 中国海洋共附生真菌次生代谢产物最新研究进展[J]. 天然产物研究与开发, 2013, 25(9): 1284-1291. DOI:10.3969/j.issn.1001-6880.2013.09.028 |
| [6] |
Kong FD, Huang XL, Ma QY, et al. Helvolic acid derivatives with antibacterial activities against Streptococcus agalactiae from the marine-derived fungus Aspergillus fumigatus HNMF0047[J]. Natural Products, 2018, 81: 1869-1876. DOI:10.1021/acs.jnatprod.8b00382 |
| [7] |
Surganarayanan TS. The diversity and importance of fungi associated with marine sponges[J]. Botanica Marina, 2012, 55(6): 553-564. |
| [8] |
Liu MT, Sun WG, Wang JP, et al. Bioactive secondary metabolites from the marine-associated fungus Aspergillus terreus[J]. Bioorganic Chemistry, 2018, 80: 525-530. DOI:10.1016/j.bioorg.2018.06.029 |
| [9] |
陈吉良, 黄小龙, 吴安迪, 等. 一种快速高效提取病原真菌DNA作为PCR模板的方法[J]. 菌物学报, 2011, 30(1): 147-149. |
| [10] |
张丹, 蒋群, 李英新, 等. 中国南海海绵和珊瑚共附生真菌多样性及其抑菌活性研究[J]. 中国海洋药物, 2015, 34(2): 1-9. |
| [11] |
Panno L, Bruno M, Voyron S, et al. Diversity, ecological role and potential biotechnological applications of marine fungi associated to the seagrass Posidonia oceanica[J]. New Biotechnology, 2013, 30(6): 685-694. DOI:10.1016/j.nbt.2013.01.010 |
| [12] |
Kirichuk NN, Pivkin MV. Filamentous fungi associated with the seagrass zostera marina linnaeus, 1753 of rifovaya bay(Peter the Great Bay, the Sea of Japan)[J]. Russian Journal of Marine Biology, 2015, 41(5): 351-355. DOI:10.1134/S1063074015050053 |
| [13] |
Venkatachalam A, Thirunavukkarasu N, Suryanarayanan TS. Distribution and diversity of endophytes in seagrasses[J]. Fungal Ecology, 2015, 60-65. |
| [14] |
Xu W, Guo SS, et al. Phylogenetic survey and antimicrobial activity of cultivable fungi associated with five scleractinian coral species in the South China Sea[J]. Botanica Marina, 2018, 61(1): 75-84. DOI:10.1515/bot-2017-0005 |
| [15] |
肖胜蓝, 雷晓凌, 徐佳, 等. 徐闻8种珊瑚共附生真菌的分离及初步鉴定[J]. 广东海洋大学学报, 2011, 31(6): 91-95. DOI:10.3969/j.issn.1673-9159.2011.06.015 |
| [16] |
赵成英, 刘海珊, 朱伟明. 海洋曲霉来源的新天然产物[J]. 微生物学报, 2016, 56(3): 331-362. |
| [17] |
Kanoh K, Kohno S, Asari T, et al. (-)-PHENYLAHISTIN:A new mammalian cell cycle inhibitor produced by Aspergillus ustus[J]. Bioorganic & Medicinal Chemistry Letters, 1997, 7(22): 2847-2852. |
| [18] |
Yeh S. Transformational science advancing oncology[M]. New York: BeyondSpring, 2015.
|
| [19] |
许佳怡, 宋双. OSMAC策略在海洋天然产物研究中的应用综述[J]. 中山大学研究生学刊, 2016(2): 39-47. |
| [20] |
Bode HB, Bethe B, Hofs R, et al. Big effects from small changes:possible ways to explore nature's chemical diversity[J]. Chem Bio Chem, 2002, 3: 619-627. DOI:10.1002/1439-7633(20020703)3:7<619::AID-CBIC619>3.0.CO;2-9 |