铀矿是重要的战略资源和能源,随着国防军工和核电发展的需求的不断增加,大量的铀矿资源被开采和利用,在铀矿冶过程中不可避免地产生了大量难以处理的含铀污染废水[1],含铀废水如不经处理直接排放到环境中,铀会通过食物链积累在人体,从而危害人体健康[2]。目前含铀废水的处理方法有物理法、化学法和生物吸附法,其中生物吸附法中的植物处理法因其成本低、无二次污染等优点成为近年来广泛研究的热点[3-4]。
伊乐藻(Elodea nuttallii)是一种优质、速生、高产的沉水植物。伊乐藻适应力极强,只要水上无冰即可栽培,气温在5℃以上即可生长,在寒冷的冬季能以营养体越冬,当苦草、轮叶黑藻尚未发芽时,该植物已大量生长。目前,国内外污染土壤修复主要以陆生植物为主,利用伊乐藻处理水体中的重金属的研究有了一定的报道,韩华杨等[5]研究发现将伊乐藻与固定化脱氮微生物联用,能提高亲水河的氮素脱除能力,张饮江等[6]研究发现伊乐藻对镉有较好的去除效果。但是很少有利用伊乐藻处理含铀废水的相关报道。因此,本研究以沉水植物伊乐藻为研究对象,研究在不同初始铀浓度胁迫下,伊乐藻的生理生化指标的响应,以及伊乐藻对铀的富集特征,旨为其应用于含铀废水的处理和水体修复提供一定的理论依据和实践参考。
1 材料与方法 1.1 材料 1.1.1 实验材料和实验环境实验材料伊乐藻购置于绵阳信捷公司,将伊乐藻在1/4倍Hoagland营养液中培育13-14 d,从中筛选出形态差异不大的植株用于实验。实验于2018年1月-2018年5月,在西南科技大学材料环境降解及安全性评价实验大棚进行。
1.1.2 主要仪器FW-100高速万能粉碎机(北京永光明医疗仪器有限公司);BSA223S-CW电子天平(德国Sartorius集团);611UF超纯水系统(德国Sartorius集团);Multiwave3000微波消解仪(奥地利安东帕公司);PF6非色散原子荧光光度计(北京普析通用仪器有限责任公司生产);7700x电感耦合等离子体串联质谱仪(美国安捷伦科技有限公司);U-3900紫外分光光度计(日立公司);M-PEA荧光仪(英国Hansatech公司)。
1.1.3 主要试剂乙酸双氧铀(UO2(CH3COO)2·2H2O)、Hoagland营养液[7]、双氧水(30% H2O2)、浓硝酸(65%-68% HNO3),本实验采用的试剂均为分析纯。
1.2 方法 1.2.1 实验设计用UO2(CH3COO)2·2H2O配制初始浓度分别为10、20、30 mg/L的溶液,每个处理的体积为10 L,每组设置3个平行。将所有溶液的pH调节至5.5±0.01,称取40.0±0.2 g的伊乐藻,放入装有10 L处理液的27 L的整理箱,进行10 d的水培实验,每3 d改变一次水培整理箱的位置。
1.2.2 抗氧化酶活性测定[7]SOD活性的测定方法为氮蓝四唑还原法(NBT);POD活性的测定方法为愈创木酚法;CAT活性采用的测定方法为紫外分光光度法。
1.2.3 MDA含量测定按照王志昊等[8]的方法分别测量450、532和600 nm吸光度。
1.2.4 叶绿素含量测定按照董杰等[7]的方法分别测量665、649和470 nm吸光度。
1.2.5 叶绿素荧光参数测定测定仪器使用M-PEA(英国Hansatech公司),测量前用暗适应夹片处理叶片20 min,随后测定[9]。用于JIP-test分析数据[10-11]。
1.2.6 伊乐藻生物量的测定10 d后,将伊乐藻从溶液中取出,用去离子水反复冲洗3次并用滤纸吸干表面水分,并用电子天平(BSA223S-CW)进行准确称量。
1.2.7 伊乐藻的铀富集量测定[12]使用中药粉碎机(北京永光明)将烘干后的植物粉碎,准确称取样品0.2 g,加入5.0 mL浓硝酸和2.0 mL 30%双氧水,在Synthos 3000消解仪(奥地利安东帕公司)中消解,随后定容至50 mL后经0.45 μm的滤膜过滤,使用Agilent 7700x ICP-MS(美国安捷伦公司)测定其中铀含量。
1.2.8 叶片光合气体交换参数测定采用LC Pro-S+全自动便携式光合仪(澳作生态仪器有限公司)测定伊乐藻光合气体交换参数,选取距顶端第4片成熟叶片测定,每个处理测3次,取平均值。
1.2.9 计算方法与数据分析[13]生物富集系数(BCF)=植物干物质中重金属含量(mg/kg DW)/水体重金属初始浓度(mg/L)。
单株U总提取量=植物干物质U浓度(mg/kg)×植物干重(kg)。
使用DPS 7.5进行数据分析,应用Origin Pro 8.5软件作图。
2 结果 2.1 铀对伊乐藻生物量的影响由图 1-A可以看出,随着初始铀浓度增加,伊乐藻的鲜重先上升后下降,均小于实验对照组,分别较处理前下降14.6%、6.2%和7.6%。由图 1-B可以看出,随初始铀浓度增加,伊乐藻的干重先增大后减小,都高于对照组,分别较对照组上升2.1%、12.1%和10.6%,干重在初始铀浓度20 mg/L下最大,为1.54 g。
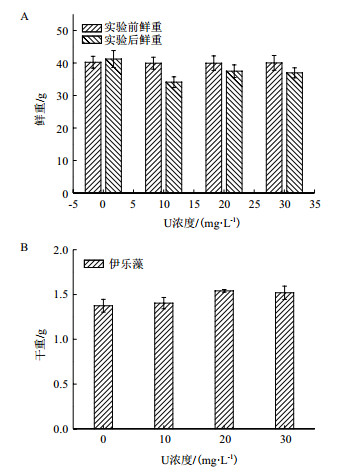
|
| 图 1 不同初始铀浓度对伊乐藻生物量的影响 |
由图 2-B可以看出,随着初始铀浓度增加,伊乐藻的生物富集系数(Bioconcentration Factors,BCF)先增大后减小,但均小于1,BCF在初始铀浓度10 mg/L下最大,为0.712 5。由图 2-A和图 2-C可以看出,富集量和总提取量均随初始铀浓度的增加而逐渐增大,对铀的富集量和总提取量在初始铀浓度30 mg/L时达到最大,分别为14 mg/kg、21.266 μg。
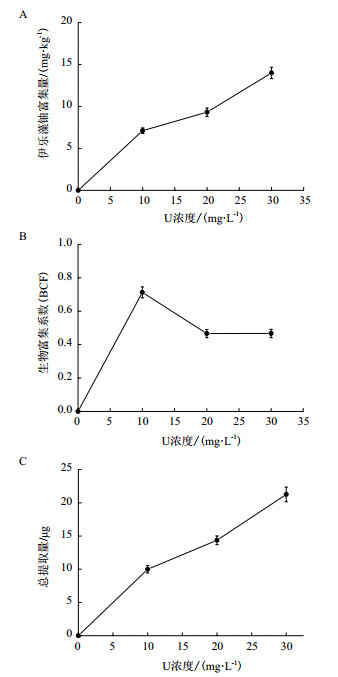
|
| 图 2 不同初始铀浓度下伊乐藻的富集特性 |
由图 3可以看出,随着初始铀浓度升高超氧化物歧化酶(Superoxide dismutase,SOD)呈现逐渐下降的趋势,过氧化物酶(Peroxidase,POD)活性、过氧化氢酶(Catalase,CAT)活性、丙二醛(Malondialdehyde,MDA)含量呈现现先上升后下降的趋势。所有初始铀浓度下,SOD活性均低于对照组,而POD活性、CAT活性、MDA含量均高于对照组。SOD活性在初始铀浓度30 mg/L下最小,较对照组下降86.3%。POD和CAT的活性在初始铀浓度10 mg/L处理下最大,分别较对照组上升412.8%、833.3%。MDA含量在初始铀浓度20 mg/L下最大,较对照组上升152.2%。
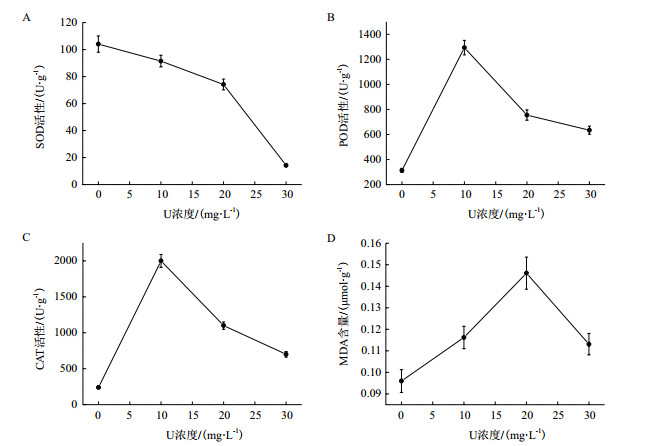
|
| 图 3 伊乐藻在铀胁迫下的抗氧化酶活性和丙二醛变化 |
由图 4-A和4-B可以看出,在铀胁迫下伊乐藻的光合色素含量呈现出不同的变化趋势。伊乐藻的叶绿素a、叶绿素b均出现下降趋势,类胡萝卜素含量出现了先上升后下降的趋势。在初始铀浓度30 mg/L下,叶绿素a、叶绿素b含量较对照组分别下降27.7%和26.7%。类胡萝卜素含量较对照组分别下降46.3%、17.3%和35.7%。

|
| 图 4 伊乐藻类胡萝卜素含量和叶绿素含量 |
由图 5-A、图 5-B和图 5-C看出,随初始铀浓度的增加,Fv/Fm、PIABS、ABS/CS0、RC/CS0、TRo/CS0和ETo/CS0荧光参数均呈现逐渐降低的趋势,在初始铀浓度30 mg/L下最小,分别较对照组下降47.7%、83.8%、68.7%、90.0%、87.7%和87.3%。从图 5-D看出,伊乐藻叶片的快速叶绿素荧光曲线J、I和P点处的荧光值大小为初始铀浓度0 mg/L > 10 mg/L > 20 mg/L > 30 mg/L,且随着初始铀浓度的增加曲线形状趋于平缓。同时在初始铀浓度30 mg/L下,J、I和P处荧光值分别较对照组下降41.4%、46.5%和49.2%。

|
| 图 5 伊乐藻在铀胁迫下的荧光指数 |
由图 6可以看出,随着初始铀浓度升高,净光合速率(Pn)、气孔导度(Ga)、胞间CO2浓度(Ci)均呈现下降趋势。在初始铀浓度30 mg/L下,三者分别较对照组下降82.1%、20.5%和6.4%,且光合速率下降得较为显著,而胞间二氧化碳浓度变化幅度不大。

|
| 图 6 伊乐藻在铀胁迫下的光合参数变化 |
目前大量研究发现,水生植物空心莲子草等对铀具有富集能力[14],这为植物修复铀污染废水提供了可能。贾文甫等[15]发现生物量是植物对逆境胁迫响应的常用指标,且单株总提取量能很好的反应出植物的富集能力[16]。在本实验中,在一定浓度内的铀促进伊乐藻生长,如初始铀浓度20 mg/L处理促进了伊乐藻生长,但仅干重显著高于对照组,此后,随着初始铀浓度的升高伊乐藻生长性能下降,这与姚天月等[17]研究的情况相似,说明伊乐藻对铀有一定的耐受性,低浓度的铀对伊乐藻生长有一定促进作用。当水体中铀浓度超过一定阈值,伊乐藻出现了生长抑制的现象。
随着初始铀浓度不断上升的同时,伊乐藻对铀的富集量也相应增加,当初始铀浓度为30 mg/L时达到最高为14.0 mg/kg干重(Dry weight,DW),这与韩旭等[13]研究发现相似,说明伊乐藻能在一定范围初始铀浓度下正常生长,同时对铀有较好的富集特性。伊乐藻的单株总提取量随着初始铀浓度升高,也逐渐上升。在初始铀浓度为30 mg/L时达到最大,为21.266 μg。在初始铀浓度为10 mg/L时,BCF系数达到最高。可能是铀溶液浓度较低时,有利于伊乐藻吸收和转运物质。伊乐藻的单株总提取量在初始铀浓度为30 mg/L时,为21.266 μg,且BCF < 1,不满足重金属超富集植物的其中指标(Cd为100 mg/kg,Pb为1 000 mg/kg等,BCF > 1)[15],因此在本实验条件下伊乐藻不是铀超富集植物。
植物在逆境下会通过抗氧化酶的变化来抵抗胁迫[18-20]。本实验中,随着初始铀浓度增加,POD活性、CAT活性呈现先上升后下降的趋势。在铀胁迫下,伊乐藻SOD活性呈现下降趋势,在30 mg/L的初始铀浓度下时最低,且显著低于对照组,与谢晓红[21]研究相似,说明伊乐藻内部的自由基累积量超过了自身SOD的清除能力。当溶液中初始铀浓度为10 mg/L时POD活性达到最大,当初始铀浓度大于10 mg/L时,出现下降趋势,可能是初始铀浓度大于10 mg/L时POD的活性受到了抑制,清除过氧化物的能力下降。当初始铀浓度为10 mg/L时CAT活性达到最大随之逐渐下降但仍高于对照组,可能是由于CAT活性逐渐下降导致植物体内H2O2的积累,造成细胞膜结构的损害。植物在逆境胁迫时主要产物MDA是反应膜脂过氧化强弱的指标[22]。马剑敏等[23]研究发现,植物MDA含量随着重金属浓度的增加,会出现先上升后下降的趋势,本实验也出现相同的趋势。在初始铀浓度为20 mg/L时MDA含量达到最大,此时伊乐藻叶片膜质过氧化程度加剧,植物受害加重。当初始铀浓度大于20 mg/L时,MDA含量下降,说明此时的伊乐藻已经慢慢失去对铀胁迫的应激能力,膜结构的破坏程度也逐渐上升。可见,伊乐藻抗氧化酶在应对铀胁迫时产生了抵抗作用,MDA含量在铀胁迫时也高于对照组含量,对铀具有较好的耐受性。
植物叶绿素含量通常可以反映出植物的生长情况[24]。叶绿素在植物受到胁迫时伊乐藻的叶绿素含量,随着初始铀浓度升高,呈现下降趋势。当初始铀浓度为30 mg/L时,叶绿素a、叶绿素b达到最低。原因可能是随着铀浓度的增加导致伊乐藻的叶绿体整体结构受到破坏,最终表现为叶绿素总含量下降。说明伊乐藻的叶绿素对铀胁迫较为敏感。随着铀浓度增加,类胡萝卜素含量呈现先升高在降低的趋势,在初始铀浓度为20 mg/L时,类胡萝卜素最高仅次于对照组,说明此时伊乐藻类胡萝卜素含量的增加有利于增加天线色素的热耗散,此时降低了PSⅡ反应中心的破坏程度。当铀浓度继续增大的同时,类胡萝卜素含量下降,说明此时PSⅡ反应中心的破坏程度加剧。
PSⅡ系统是植物内部对重金属离子作用最敏感的部位[25],本实验中伊乐藻的最大光化学效率(Fv/Fm)和光合性能指数(PIABS)均随着初始铀浓度上升呈现下降的趋势,与谢佳佳等[26]研究相似,说明伊乐藻的PSⅡ系统受到不同程度的影响。随着初始铀浓度的不断上升使得伊乐藻的ABS/CS0 RC/CS0、TR0/CS0、ET0/CS0均呈现下降趋势,在30 mg/L初始铀浓度下,伊乐藻的PSⅡ受到了严重的影响。许多研究发现[27-30],植物的荧光动力指数会随着胁迫程度的上升,出现下降的趋势。本研究也出现了相似的趋势,可能是铀胁迫下导致伊乐藻PSⅡ反应中心活性和原初光能转换效率降低,PSⅡ潜在活性被抑制,PSⅡ的电子传递能力下降,使得伊乐藻的PSⅡ活性下降。典型的快速荧光动力学曲线在荧光上升阶段有O、J、I和P相,由图 5-D可以看出,伊乐藻的曲线形状随着初始铀浓度的增加逐渐变得平缓,与Appenroth等[31]研究紫背萍在镉胁迫下的趋势相似,说明铀胁迫下引起伊乐藻的荧光曲线改变,同时反应出在铀胁迫下损伤了PSⅡ受体侧的电子传递[32-34]。表明铀胁迫对伊乐藻的叶片光合机构影响主要是PSⅡ及光系统反应中心受到损伤,电子传递过程受到了抑制。
植物在受到胁迫时其光合速率下降受到气孔限制和非气孔限制两方面影响[35]。随着初始铀浓度的增加,伊乐藻的Pn、Ga、Ci均呈现下降趋势,同时伊乐藻Ci随Ga下降而下降,说明Pn下降主要受气孔限制的影响。
4 结论本实验对不同初始铀浓度下伊乐藻的生理响应及富集特性进行研究,从伊乐藻的抗氧化酶活性、丙二醛含量、荧光动力学指标、叶绿素、光合参数的变化情况来看,伊乐藻对铀有耐受能力。但是伊乐藻未达到铀超富集植物的标准,且在封闭室内条件下进行存在一定的限制,不会造成生态破坏,而伊乐藻在开放的环境下的生理特性和富集特性还需要进行更深入的探究。
| [1] |
黄君仪, 易树平, 商建英, 等. 铀在放射性废物处置场周边土壤中的吸附行为及机理研究[J]. 南方能源建设, 2018, 5(1): 14-21. |
| [2] |
罗蓝, 罗学刚, 韩旭, 等. 酸模对水中U、Cd、As、Mn的富集特征与去除能力[J]. 环境科学与技术, 2018, 41(1): 85-89. |
| [3] |
李曼, 刑伟明. 生物法处理水体重金属污染研究进展[J]. 河南农业, 2017, 4: 59-61. |
| [4] |
张玲. 水体重金属污染的现状及生态效应[J]. 江西化工, 2017, 6: 138-139. DOI:10.3969/j.issn.1008-3103.2017.03.043 |
| [5] |
韩华杨, 李正魁, 王浩, 等. 伊乐藻-固定化脱氮微生物技术对入贡湖河道脱氮机制的影响[J]. 环境科学, 2016, 37(4): 1397-1403. |
| [6] |
张饮江, 易冕, 王聪, 等. 3种沉水植物对水体重金属镉去除效果的实验研究[J]. 上海海洋大学学报, 2012, 21(5): 784-793. |
| [7] |
董杰, 陈新新, 杨倩, 等. 高光、水分和盐胁迫下小麦光合特性和抗氧化酶系统的比较[J]. 麦类作物学报, 2018, 38(3): 315-322. |
| [8] |
王志昊, 叶冬梅, 何炎红, 等. 5种沙生植物丙二醛、脯氨酸和2种氧化物酶比较[J]. 分子植物育种, 2018, 12(1): 1-6. |
| [9] |
Ganesh KS, Basharan L, Rajasekaran S, et al. Chromium stress induced alterations in biochemical and metabolism in aquatic and terrestrial plants[J]. Colloids and Surfaces B: Biointerfaces, 2008, 63(2): 159-163. DOI:10.1016/j.colsurfb.2007.11.016 |
| [10] |
Srivastava A, Strasser RJ. Stress and stress management of land plants during a regular dayp[J]. J Plant Physiol, 1996, 148: 445-455. DOI:10.1016/S0176-1617(96)80278-1 |
| [11] |
Zhu XG, Zhang QD. Advances in the research on the effects of NaCl on photosynthesis[J]. Chinese Bulletin of Botany, 1996, 16(4): 332-338. |
| [12] |
贾文甫.铀及伴生重金属富集植物特性分析和评价[D].绵阳: 西南科技大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10619-1016116902.htm
|
| [13] |
韩旭, 罗学刚, 司慧, 等. 铀胁迫对2种植物荧光生理及累积特性的影响[J]. 环境科学与技术, 2016, 39(11): 36-41. |
| [14] |
胡南, 丁德馨, 李广悦, 等. 五种水生植物对水中铀的去除作用[J]. 环境科学学报, 2012, 32(7): 1637-1645. |
| [15] |
贾文甫, 罗学刚, 陈功亮, 等. 黄秋葵对铀胁迫的光合生理响应及吸收特征[J]. 环境科学与技术, 2015, 38(10): 41-47. |
| [16] |
张慧, 王超, 王沛芳, 等. 不同磷营养水平对2种沉水植物在Cd·Zn复合污染下的影响[J]. 安徽农业科学, 2011, 39(3): 1654-1658. DOI:10.3969/j.issn.0517-6611.2011.03.145 |
| [17] |
姚天月, 王丹, 李泽华, 等. 8种花卉植物对土壤中铀富集特性研究[J]. 环境科学与技术, 2016, 39(2): 24-30. |
| [18] |
李旭新, 刘炳响, 郭智涛, 等. NaCl胁迫下黄连木叶片光合特性及快速叶绿素荧光诱导动力学曲线的变化[J]. 应用生态学报, 2013, 24(9): 2479-2484. |
| [19] |
Sabehat A, Weiss D, Luris S. Heat-shock proteins and cross-tolerance in plants[J]. Physiol Plant, 1998, 103: 437-441. DOI:10.1034/j.1399-3054.1998.1030317.x |
| [20] |
代亮亮, 郭亮亮, 吴中奎, 等. 不同浓度藻类水华对两种沉水植物的影响[J]. 中国环境科学, 2016, 36(9): 2765-2773. DOI:10.3969/j.issn.1000-6923.2016.09.035 |
| [21] |
谢晓红. 植物抗氧化酶系统研究进展[J]. 化工管理, 2015(32): 99-100. DOI:10.3969/j.issn.1008-4800.2015.32.083 |
| [22] |
成小英, 雍佳君. 伊乐藻对硝氮、磷胁迫的急性响应[J]. 安全与环境学报, 2014, 14(6): 336-340. |
| [23] |
马剑敏, 靳萍, 吴振斌. 沉水植物对重金属的吸收净化和受害机理研究进展[J]. 植物学报, 2007, 24(2): 232-239. DOI:10.3969/j.issn.1674-3466.2007.02.016 |
| [24] |
刘俊初, 于丹, 刘春花. 春季不同程度低水位对四种沉水植物生理的影响[J]. 水生生物学报, 2016, 40(3): 532-537. |
| [25] |
孙德智, 韩晓日, 彭靖, 等. 外源水杨酸和一氧化氮对盐胁迫番茄幼苗光系统Ⅱ功能及激发能分配利用的影响[J]. 植物营养与肥料学报, 2018, 24(1): 170-178. |
| [26] |
谢佳佳, 芦丽娜, 石岱龙, 等. 交替呼吸途径对CuCl2胁迫下菜豆叶片光系统Ⅱ的保护作用[J]. 植物研究, 2018, 1: 75-80. DOI:10.7525/j.issn.1673-5102.2018.01.009 |
| [27] |
王亚林, 高园园, 于丹, 等. 3种沉水植物对夏季高温强光照环境的生理响应[J]. 水生态学杂志, 2015, 36(5): 74-80. |
| [28] |
Su L, Dai Z, Li S, et al. A novel system for evaluating drought-cold tolerance of grapevines using chlorophyll fluorescence[J]. BMC Plant Biology, 2015, 15(1): 1-12. |
| [29] |
Andrew SC, Kemp DJ. Stress tolerance in a novel system: Genetic and environmental sources of(co)variation for cold tolerance in the butterfly Eurema smilax[J]. Austral Ecology, 2016, 41(5): 529-537. DOI:10.1111/aec.12341 |
| [30] |
李金洵.血球藻在系诶条件下叶绿素荧光特性的研究[D].武汉: 湖北工业大学, 2016.
|
| [31] |
Appenroth KJ, Stockel J, Srivastava A, et al. Multiple effects of chromate on the photosynthetic appara-tus of Spirodela polyrhiza, as probed by OJIP chlorophyll afluorescence measurements[J]. Environmental Pollution, 2001, 115(1): 49-64. |
| [32] |
Tan W, Li QL, Luo Y, et al. Alleviative effects of exogenous CaCl2 on the inhibition of photosynthesis induced by heat stress in tobacco[J]. Scientia Agricultura Sinica, 2009, 42(11): 3871-3879. |
| [33] |
孙鲁龙, 宋伟, 耿庆伟, 等. 短期温度骤降对秋季葡萄叶片PSⅡ活性的影响[J]. 果树学报, 2017(1): 33-40. |
| [34] |
吴敏兰, 王果, 李荭荭, 等. 外源Hg胁迫对3种烟草品种叶绿素含量和光合效应的影响[J]. 生态毒理学报, 2016, 11(6): 282-290. |
| [35] |
郭文霞, 赵志江, 郑娇, 等. 不同土壤水分条件下油松幼苗光合作用的气孔和非气孔限制--试验和模拟结果[J]. 林业科学, 2017, 53(7): 18-36. |




