2. 江苏省有害生物入侵预防与控制重点实验室,南京 210007
2. Jiangsu Key Laboratory for Prevention and Management of Invasive Species, Nanjing 210007
土壤微生物群落丰富,各具有不同的生物学功能。植物根际促生菌(Plant growth promoting rhizobacteria,PGPR)生存于植物根际和根表[1],具有促进植物生长,拮抗病原微生物[2],提高植物抗性,修复土壤,维持土壤质量健康等功能[3-4]。如PGPR可在植物根际快速繁殖,固定大气中的氮素[5]、使植物充分利用土壤的养分,促进植物更好生长[6]。Liu等[7]从杨树根际筛选出一株荧光假单胞菌(Pseudomonads fluorescent)JW-JS1,可显著促进NL-895杨和美洲黑杨苗木的生长和营养元素含量的提高。宋芳旭等[8]发现根际细菌水拉恩氏菌(Rahnella aquatilis)JZ-GX1对杨树溃疡病菌金黄壳囊孢(Cytospora chrysosperma)的防效可达84%。部分芽孢杆菌属(Bacillus Cohn)还可提高植物对重金属的耐受性[9],Kuramshina等[10]发现用枯草芽孢杆菌(Bacillus subtilis)内生菌株处理Sinapis alba种子可提高植物对镉和镍毒性作用的抵抗力,并减少地上部分的伤害表现。
在自然条件下PGPR对植物的有益功能是多方面相互作用的结果,然而目前关于PGPR的研究大多侧重于某个或某些生物学功能,对PGPR综合性能的研究相对较少。本实验室前期从杨树根际分离出一株具有解有机磷和产ACC脱氨酶特性的细菌菌株JYZ-SD5,初步研究表明其对杨树具有一定的促生作用。但关于该菌株更多的生物学功能并不十分清楚,其分类地位也不明确。为深入探讨和弄清该菌的潜在特性和应用价值,本研究进一步对该林木根际细菌JYZ-SD5的促生抗逆性能进行检测,同时展开林木温室促生试验,并确定其分类地位,以期为评估该林木根际细菌JYZ-SD5在野外试验中的应用价值提供参考依据。
1 材料与方法 1.1 材料 1.1.1 供试菌株供试根际细菌:实验室前期从山东杨树根际分离出的细菌JYZ-SD5。供试林木病原菌:水杉赤枯病菌:细极链格孢(Alternaria tenuissima)、异角状拟盘多毛孢(Pestalotiopsis heterocornis);茶树纹叶枯病菌:山茶球座菌(Guignardia camelliae);茶树轮斑病菌:异色状拟盘多毛孢(Pestalotiopsis vesicolor);松枯梢病菌:松杉球壳孢(Sphaeropsis sapinea);杨树溃疡病菌:七叶树壳梭孢(Fusicoccus aesculi);银杏叶枯病菌:链格孢(Alternaria sp.)。所有菌株保存于南京林业大学森林病理学实验室。
1.1.2 植物材料2年生水杉盆栽实生苗,基质选用南京林业大学北大山林木根际表层土。
1.1.3 供试培养基牛肉膏蛋白胨(NA)培养基,蒙金娜培养基用于测定菌株溶解有机磷的能力[11],无氮培养基用于固氮能力定性测定[12],解钾能力检测培养基[13],纤维素刚果红培养基用于分解纤维素能力的测定[14]。蛋白质酶检测培养基[15],金氏培基B(King’S medium B,KB)用于菌株产IAA的测定[11]。
1.2 方法 1.2.1 根际细菌JYZ-SD5固氮、解磷、解钾性能测定(1)固氮特性检测:将供试菌株采用平板划线的方法接种在无氮培养基中,每个处理3次重复,置于28℃低温恒温培养箱(MIR-553,Japan),连续观察细菌的生长状况。(2)解有机磷特性检测:将供试菌株采用三点接菌的方法接种在解有机磷培养基中,每个处理重复3次,置于28℃培养箱中,连续观察菌落周围透明圈的有无。(3)解钾能力测定:将供试菌株采用液体培养的方法,接种到解钾检测液体培养基中,每个处理重复3次,置于28℃摇床培养,转速为200 r/min,培养数天后,用火焰分光光度计(FP6410,上海)检测细菌的解钾能力(解钾能力=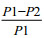
(1)定性检测:挑取单菌落接入金氏培基B中,恒温摇床(Multitron Standard,Switzerland)37℃培养24 h,用无菌枪头吸取1 mL菌液于无菌离心管中,加入4 mL Sackowcki’s显色剂之后迅速充分混合,室温下避光显色40 min,观察颜色变化。(2)定量检测:精确称取IAA10 mg,先用少量乙醇溶解,再用蒸馏水定容至100 mL(浓度为100 μg/mL),然后分别稀释成0、4、8、12、16、20、24 μg/mL,取各浓度1 mL,分别加入4 mL显色剂,40℃暗保温40 min,与OD535下测定OD值,绘制标准曲线。将培养的菌悬浮液和空白对照,离心10 min(10 000 r/min)后取上清液4 mL加入等量比色液,在黑暗中静置40 min,取出立即用HexIOS分光光度计(Lamnda365,Korea)测定OD535值,每个样品重复测3次,以加入比色液的空白对照调零,对比标准曲线计算该菌株分泌IAA量,连续测定7 d。
1.2.3 根际细菌JYZ-SD5拮抗林木病原菌活性测定(1)平板拮抗:供试病原真菌接种于PDA培25℃养基中,每皿接种一块,重复3次,用接种环沾取液体摇培24 h后的菌液,在菌落两侧对称划线,放入培养箱培养,连续观测记录菌株的抑菌效果。(2)胞外代谢产物拮抗活性:获取供试菌发酵液,发酵液移入灭菌50 mL离心管中,10 000 r/mim,4℃离心10 min,取上清液,过细菌滤膜,得无菌胞外代谢产物。将无菌胞外代谢产物按0.5%的比例加入PDA培养基中,摇匀倒平板。将林木病原菌接种于平板中,重复3次,置于25℃培养箱中培养,观察该菌抑菌效果(抑菌率=(对照组菌落直径-处理组菌落直径)/对照组菌落直径×100%)。
1.2.4 根际细菌JYZ-SD5产纤维素酶、蛋白酶测定(1)纤维素酶检测:将供试菌株采用三点接菌的方法接种在纤维素酶检测培养基中,每个处理重复3次,置于28℃培养箱中,连续观察菌落周围透明圈的有无。(2)蛋白酶检测:将供试菌株采用三点接菌的方法接种在蛋白酶检测培养基中,每个处理重复3次,置于28℃培养箱中,连续观察菌落周围透明圈的有无。
1.2.5 根际细菌JYZ-SD5的重金属耐受性测定(1)配制NA培养基,分别添加KMnO4、NiCl2.6H2O、K2Cr2O7、CuSO4.5H2O。使Mn7+、Ni2+、Cr6+、Cu2+浓度梯度为5、10、15、20、30、40、50、80、100、200、300、400 mg/L(以纯Mn7+、Ni2+、Cr6+、Cu2+计),对照为纯培养基。将菌株接种于上述培养基中,放入培养箱中,24 h后进行观察。(2)不同重金属浓度胁迫下菌株JYZ-SD5生长曲线的测定:将菌株JYZ-SD5接种到不同重金属浓度的液体NB培养基中,用微生物全自动生长曲线分析仪(Bioscreen C,Finland),每隔2 h测定不同盐胁迫下的OD600值,并以时间为横坐标,OD600值为纵坐标绘制菌株JYZ-SD5的生长曲线。
1.2.6 根际细菌JYZ-SD5对水杉促生试验用接种环挑取单菌落于含有50 mL NA液体培养基的100 mL三角瓶中,28℃、200 r/min振荡培养24 h。获得细菌发酵液,将上述发酵液稀释5倍,施用到2年生水杉盆栽苗中,每株施用50 mL稀释液(菌体量5×108 CFU/mL),对照组接种等量摇培24 h后的NA培养基。施菌后实生苗置于室外,在施菌后20 d、40 d后采用手持叶绿素仪(SPAD-502 plus,Japan KONICA MINOLTA制造公司)测定处理组和对照组相对叶绿素含量并测其苗高和地径。
1.2.7 根际细菌JYZ-SD5的鉴定(1)菌体形态、特征观察及生理生化指标测定:参照《伯杰细菌鉴定手册》和《常见细菌系统鉴定手册》对菌株JYZ-SD5进行生理生化测定,描述菌落形态、特性。(2)16S rDNA基因序列分析及系统进化树:以提取的细菌总DNA为模板,用细菌16S rDNA的一对通用引物(上游引物27f(5'-AGAGTTTGATCCTGGCTCAG-3'),下游引物1492r(5'-TACGGCTACCTTGTTACGACTT-3')对细菌基因组DNA进行扩增。PCR反应体系:mix10 µL,上下游引物各1 µL,DNA模板1 µL,ddH2O 7 µL。PCR反应条件:94℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸1 min,33个循环;72℃延伸10 min。将获得的PCR产物于1%的琼脂糖凝胶中电泳,EB染色,紫外灯下拍照。有条带则将获得的PCR产物送南京金斯瑞生物技术公司纯化测序。所测得的16S rRNA与Ez Taxon和Gen Bank中的序列进行基因序列比对,用MEGA 8.0构建系统发育树。
1.2.8 数据处理所测数据采用Excel 2013软件绘图,用prism cracked软件进行数据统计分析。
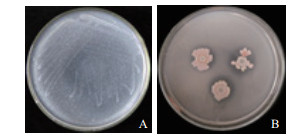
2 结果 2.1 根际细菌JYZ-SD5菌株的固氮、解磷和解钾特性测定表明,根际细菌JYZ-SD5菌株在固氮培养基上可以生长(图 1-A),在解有机磷培养基上生长出现透明圈(图 1-B),说明该菌具有固氮、解有机磷的能力;同时在解钾能力检测中,发现对照组中钾含量为7.9 µg/mL,处理组中钾含量为11 µg/mL,比对照提高了2.1 µg/mL,菌株JYZ-SD5的解钾能力为39%(表 1)。
|
| 图 1 根际细菌JYZ-SD5菌株固氮(A)和解有机磷特性(B)检测 |
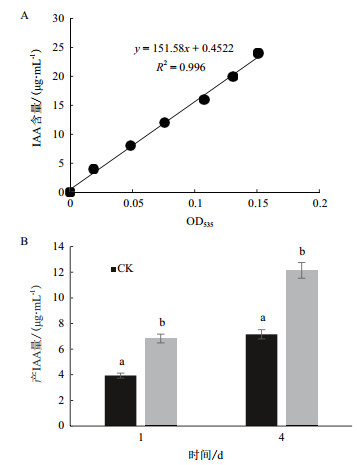
采用Salkowski比色法测定表明,在含有色氨酸培养液的比色反应中其颜色为淡红色,说明菌株JYZ-SD5具有一定产IAA的能力。采用标准IAA制作标准曲线定量分析,得出菌株JYZ-SD5培养1 d后在不含色氨酸的培养液中分泌的IAA浓度为3.938 5 μg/mL;在含L-色氨酸的培养液中IAA浓度达到7.152 0 μg/mL,且菌株JYZ-SD5在培养4 d后产IAA量达到最高。在不含色氨酸的培养液中分泌的IAA浓度最高为6.818 6 μg/mL;在含L-色氨酸的培养液中IAA浓度最高为12.199 6 μg/mL(图 2)。
|
| 图 2 根际细菌JYZ-SD5的IAA定量检测 A:IAA标准曲线;B:不同处理菌株JYZ-SD5产IAA量。图中不同小写字母表示处理间差异达显著水平(P < 0.05),下同 |
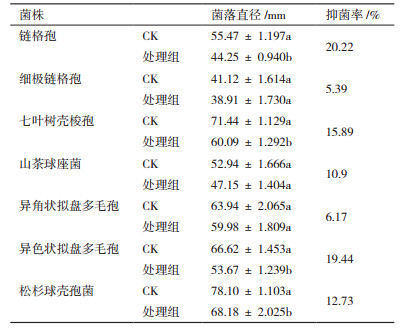
测定表明,该菌株胞外代谢产物对链格孢、七叶树壳梭孢、异色状拟盘多毛孢的抑菌效果较明显,其中对银杏叶枯病菌链格孢抑菌效果最大,抑菌率为20.22%(表 2)。菌株JYZ-SD5与供试林木病原真菌的平板对峙结果表明,该菌株对茶树轮斑病菌异色状拟盘多毛孢,链格孢,茶树云纹叶枯病菌山茶球座菌,水杉赤枯病菌细极链格孢的抑制效果较为明显(图 3)。

|
| 图 3 根际细菌JYZ-SD5与林木病原真菌拮抗效果 A:链格孢;B:细极链格孢;C:山茶球座菌;D:异色状拟盘多毛孢。其中,A1-D1为CK;A2-D2为接菌划线处理 |
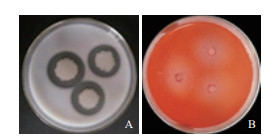
菌株JYZ-SD5在蛋白酶检测培养基、纤维素酶检测培养基上出现明显透明圈(图 4),表明该菌含有蛋白酶和纤维素水解酶,具有一定的水解蛋白质和分解纤维素的能力。
|
| 图 4 根际细菌JYZ-SD5蛋白酶(A)和纤维素酶(B)检测 |
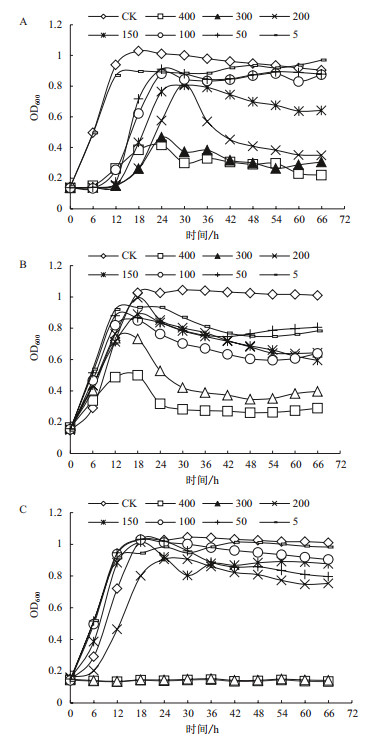
该菌在Mn7+、Gr6+存在的供试浓度下均可以生长,耐受浓度最高均可达到400 mg/L,在Ni2+浓度为0-200 mg/L可以较好的生长,在Cu2+浓度为5 mg/L及以上时该菌无法生长。在Gr6+、Ni2+浓度不超过200 mg/L时,该菌与在正常生长条件下时相比无明显差异;在Mn7+存在的情况下,该菌达到稳定期的时间明显推迟,说明Mn7+的存在会抑制该菌的繁殖速度,且当Mn7+浓度在200-300 mg/L时,该菌前30 h生长较好,30 h以后菌体量突然减少,说明在200-300 mg/L浓度下,该菌的耐受性减弱,培养后期会出现大量菌体死亡的现象。综合来看,重金属浓度在0-200 mg/L之间时,该菌对重金属胁迫耐受能力为Ni2+ > Gr6+ > Mn7+ > Cu2+;当重金属浓度高于200 mg/L时,只能在Mn7+、Gr6+存在的情况下缓慢生长(表 3,图 5)。
|
| 图 5 根际细菌JYZ-SD5在不同重金属胁迫下的生长曲线(重金属单位(mg/L)) A:Mn;B:Cr;C:Ni |
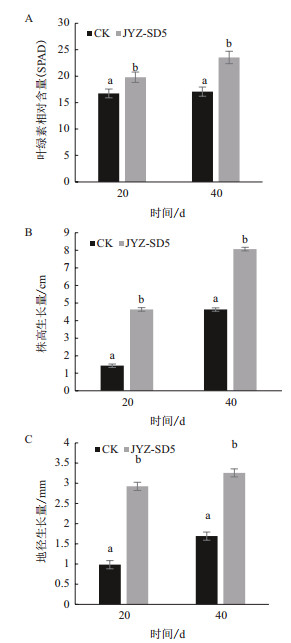
施菌处理后,水杉实生苗的苗高和地径相对于对照组均有明显提高。施菌20 d后苗高和地径净增长量均提高了200%左右;施菌40 d后,水杉叶绿素相对含量相对于对照增加了37.8%,苗高和地径的净增长量分别提高了74%和88%,施菌处理和对照处理间存在显著性差异。说明接种根际细菌JYZ-SD5菌株对水杉的生长有显著的促进作用(图 6)。
|
| 图 6 根际细菌JYZ-SD5菌株对水杉的促生作用 A:叶绿素相对含量;B:株高生长量;C:地径生长量 |
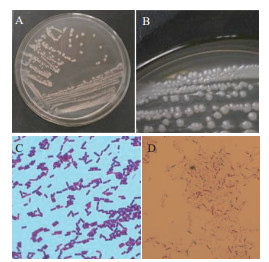
菌株JYZ-SD5在NA培养基上菌落为近圆形,边缘不整齐,乳白色,菌落中间无凸起,湿润、有光泽(图 7-A、7-B)。菌体短杆状,无鞭毛,革兰氏阳性菌,在芽孢染色观察中可看到着绿色的芽孢,说明产芽孢(图 7-C)。
|
| 图 7 根际细菌JYZ-SD5在NA平板上培养24 h后的菌落形态(A、B)及革兰氏染色(C)、芽孢染色(D)结果 |
菌株JYZ-SD5在VP实验、甲基红实验、吲哚实验、硝酸还原实验中结果呈阳性,可以水解淀粉、明胶。接触酶和氧化酶实验结果为阳性,在糖、醇发酵实验中,葡萄糖产酸检验结果为阳性,苯丙氨酸脱氨酶、木糖、甘露醇检验结果呈阴性(表 4),结果与拟蕈状芽孢杆菌(Bacillus paramycoides)的特征基本相符。
菌株JYZ-SD5的16S rDNA扩增产物,用1%琼脂糖凝胶进行电泳检测结果,在1 500 bp附近有一条明亮的PCR目的条带,且无其他非特异性条带。表明16S rDNA扩增获得的目的DNA片段可用于测序。经测序获得菌株JYZ-SD5的16S rDNA基因有1 420个碱基(GenBank登录号:MH894221)。
通过将菌株JYZ-SD5与Ez Taxon和GenBank中的序列进行基因序列比对,并将同源性最高、且已定名的模式菌的序列信息,通过MEGA8.0软件构建系统发育树(图 8),菌株JYZ-SD5与拟蕈状芽孢杆菌NH24A2模式菌株聚在一起,相似性达99%。根据系统发育树相似性分析,结合形态、生理生化特征比对,初步鉴定菌株JYZ-SD5为拟蕈状芽孢杆菌。
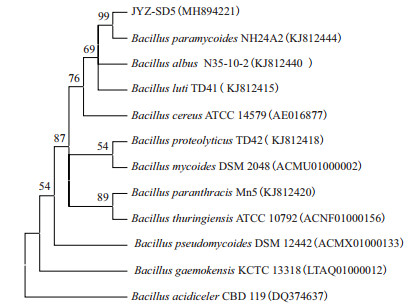
|
| 图 8 基于16S rRNA基因序列构建的JYZ-SD5菌株系统发育树 |
植物根际细菌一般通过提高植物对根际养分吸收、产生植物激素类物质等促进植物生长[16-17]。从研究结果看,林木根际细菌JYZ-SD5具有固氮、解有机磷和解钾的能力,具有较高的产IAA能力,不加色氨酸前体下产IAA量为6.818 6 μg/mL。Yasmi[18]等发现具有固氮、解磷和产IAA能力的两种细菌Exiguobacterium sp.和Stenotrophomonas sp.对卡琪花蒂玛(Labisia Pumila)有促生作用。本研究通过盆栽试验发现,林木根际细菌JYZ-SD5对水杉有很好的促生作用,能明显提高水杉的株高和地径,施菌40 d后,相对于对照组苗高和地径的净增长量分别提高了74%和88%。说明林木根际细菌JYZ-SD5存在某种促进植物生长的机制。结合其固氮、解磷、解钾,产IAA的能力分析,推测该根际细菌对水杉的促生机制可能是通过提高植物对土壤氮、磷、钾养分的吸收,同时产生一定的促生物质来实现。
研究证实,部分重金属耐受性较高的根际细菌,在重金属污染地区可修复被污染的土壤,提高植物在污染地区生长状况[19];如Krishnendu等[20]发现Enterobacter aerogenes K6菌株对Cd2+、Pb2+和As3+的耐受性高,并且在镉胁迫下施用该菌,水稻幼苗生长显著增强。本研究发现,根际细菌JYZ-SD5菌株具有良好的耐重金属的能力,对Mn7+、Gr6+的耐受性最高均可达400 mg/L,对重金属Ni2+的耐受最高也可达200 mg/L。并且林木根际细菌JYZ-SD5菌株可以产纤维素酶和蛋白酶,而蛋白酶和纤维素酶能够降解真菌细胞壁中的蛋白质和纤维素,破坏病菌菌丝,使病菌生长受到抑制[21];同时本实验也证明该根际细菌JYZ-SD5对链格孢的抑菌率可达20.22%,对其他林木病原菌也具有一定的抑菌效果。由此推测JYZ-SD5菌株在重金属污染地区及林木病害防治方面具有较好的应用价值。
林木根际细菌JYZ-SD5经鉴定为拟蕈状芽孢杆菌,属芽孢杆菌属。拟蕈状芽孢杆菌是Liu等[22]2017年通过多相分类学方法,依据表型和16S rRNA基因序列分析数据,认为其属于蜡状芽孢杆菌中的低dDDH和ANI值菌株,而重新被划分出的一个新种Bacillus paramycoides sp. nov. type strain NH24A2T,该新种的模式菌株来自海洋。而本研究中将来自林木根际的菌株JYZ-SD5鉴定为拟蕈状芽孢杆菌,这是该菌分离自陆地生态系统的首次报道。研究结果表明拟蕈状芽孢杆菌JYZ-SD具有较好的促生抗逆特性,具有作为一种新型的微生物菌株资源开发应用的潜力。
4 结论本研究通过对菌株JYZ-SD5生物学特性进行检测,得到该菌具有固氮、解磷、解钾、产IAA能力,对林木生长具有明显促进作用,对某些林木病原真菌具有一定的拮抗效果,对Ni2+、Gr6+、Mn7+等重金属耐受性较高,并通过形态观察、生理生化特性分析、16S rDNA序列分析将菌株JYZ-SD5鉴定为拟蕈状芽孢杆菌。
| [1] |
Ambardar S, Vakhlu J. Plant growth promoting bacteria from Crocus sativus rhizosphere[J]. World Journal of Microbiology & Biotechnology, 2013, 29(12): 2271-2279. |
| [2] |
Sabaté DC, Brandan CP, Petroselli G, et al. Decrease in the incidence of charcoal root rot in common bean(Phaseolus vulgaris L.)by Bacillus amyloliquefaciens, B14, a strain with PGPR properties[J]. Biological Control, 2017, 113: 1-8. DOI:10.1016/j.biocontrol.2017.06.008 |
| [3] |
Mayak S, Tirosh T, Glick BR. Plant growth-promoting bacteria confer resistance in tomato plants to salt stress[J]. Plant Physiology & Biochemistry, 2004, 42(6): 565-572. |
| [4] |
Dinesh R, Srinivasan V, Hamza S, et al. Isolation and characteriza-tion of potential Zn solubilizing bacteria from soil and its effects on soil Zn release rates, soil available Zn and plant Zn content[J]. Geoderma, 2018, 321: 173-186. DOI:10.1016/j.geoderma.2018.02.013 |
| [5] |
Islam MR, Sultana T, Joe MM, et al. Nitrogen-fixing bacteria with multiple plant growth-promoting activities enhance growth of tomato and red pepper[J]. Journal of Basic Microbiology, 2013, 53(12): 1004-1015. DOI:10.1002/jobm.v53.12 |
| [6] |
Li Y, Liu X, Hao T, et al. Colonization and maize growth promotion induced by phosphate solubilizing bacterial isolates[J]. International Journal of Molecular Sciences, 2017, 18(7): 1253. DOI:10.3390/ijms18071253 |
| [7] |
Liu H, Wu X, Ren J, et al. Phosphate-dissolving characteristics and growth promoting effect of Pseudomonads fluorescent JW-JSI on poplar seedlings[J]. Scientia Silvae Sinicae, 2013, 49(9): 112-118. |
| [8] |
宋芳旭, 吴小芹, 赵群. 水拉恩氏菌JZ-GX1对杨树溃疡病菌的拮抗作用[J]. 南京林业大学学报:自然科学版, 2017, 41(4): 42-48. |
| [9] |
Sengupta K, Maiti TK, Saha P. Degradation of 4-nitrophenol in presence of heavy metals by a halotolerant Bacillus sp. strain BUPNP2, having plant growth promoting traits[J]. Symbiosis, 2015, 65(3): 157-163. DOI:10.1007/s13199-015-0327-1 |
| [10] |
Kuramshina ZM, Smirnova YV, Khairullin RM. Cadmium and nickel toxicity for Sinapis alba, plants inoculated with endophytic strains of Bacillus subtilis[J]. Russian Journal of Plant Physiology, 2018, 65(2): 269-277. |
| [11] |
宋金秋, 刘淑娇, 崔丽红, 等. 根际细菌溶磷、产IAA及其抑菌作用的研究[J]. 基因组学与应用生物学, 2017(11): 4722-4728. |
| [12] |
Xu J, Kloepper JW, Huang P, et al. Isolation and characterization of N2-fixing bacteria from giant reed and switchgrass for plant growth promotion and nutrient uptake[J]. Journal of Basic Microbiology, 2018, 58: 459-471. DOI:10.1002/jobm.v58.5 |
| [13] |
韩晓阳, 周波, 董玉惠, 等. 山东茶园土壤高活性解钾细菌的筛选鉴定及肥效研究[J]. 茶叶科学, 2018, 38(1): 78-86. DOI:10.3969/j.issn.1000-369X.2018.01.008 |
| [14] |
李进, 钟志军, 苏怀益, 等. 大熊猫肠道芽孢杆菌的分离鉴定及部分生物学特性[J]. 微生物学通报, 2016, 43(2): 351-359. |
| [15] |
李伟, 龚劲松, 李恒, 等. 一株产蛋白酶不动杆菌的分离与酶学性质[J]. 食品与生物技术学报, 2017, 36(1): 8-14. DOI:10.3969/j.issn.1673-1689.2017.01.002 |
| [16] |
Melo AL, Soccol VT, Soccol CR. Bacillus thuringiensis: mechanism of action, resistance, and new applications: a review[J]. Critical Reviews in Biotechnology, 2016, 36(2): 317. DOI:10.3109/07388551.2014.960793 |
| [17] |
Pérezflores P, Valenciacantero E, Altamiranohernández J, et al. Bacillus methylotrophicus M4-96 isolated from maize(Zea mays)rhizoplane increases growth and auxin content in Arabidopsis thaliana via emission of volatiles[J]. Protoplasma, 2017, 1-13. |
| [18] |
Yasmi A, Radziah O, Hawa ZE, et al. Characterisation of plant growth-promoting bacteria from Kacip Fatimah(Labisia pumila)under natural tropical forest[J]. Universiti Putra Malaysia Press, 2016, 39(4): 557-575. |
| [19] |
Kuffner M, Puschenreiter M, Wieshammer G, et al. Rhizosphere bacteria affect growth and metal uptake of heavy metal accumulating willows[J]. Plant & Soil, 2008, 304(1/2): 35-44. |
| [20] |
Krishnendu P, Soumik M, Anumita S, Tushar KM. Alleviation of phytotoxic effects of cadmium on rice seedlings by cadmium resistant PGPR strain Enterobacter aerogenes MCC 3092[J]. Journal of Hazardous Materials, 2018, 351: 317-329. DOI:10.1016/j.jhazmat.2018.03.009 |
| [21] |
Elshafie HS, Ippolito C, Rocco R, et al. In vitro antifungal activity of Burkholderia gladiolipv. agaricicola against some phytopathogenic fungi[J]. International Journal of Molecular Sciences, 2012, 13(12): 16291-16302. DOI:10.3390/ijms131216291 |
| [22] |
Liu Y, Du J, Lai Q, et al. Proposal of nine novel species of the Bacillus cereus group[J]. International Journal of Systematic & Evolutionary Microbiology, 2017, 67(8): 2499. |