2. 哈尔滨工业大学环境学院,哈尔滨 150001
2. Harbin Institute of Technology, Harbin 150000
土壤盐碱化是影响农业生产的重要环境因素之一。盐碱土壤中无机盐含量丰富,有机质含量低,不适宜施用无机肥;而且由于盐离子的存在,会限制植物对氮、磷、钾等营养元素的吸收,这进一步造成盐碱土壤中植物可利用营养元素的缺失[1]。花生(Arachis hypogaea L.)是重要的油料和经济作物,主要生长在干旱和半干旱地区[2]。花生属于中度耐盐的植物,盐分胁迫对花生生长发育的各个方面都会产生不利影响[3]。因而,提高盐碱地花生营养元素的获得,进而提高花生的耐盐碱性,增加盐碱地花生产量是很有必要的。
根际促生菌(PGPR)是一类生存于植物根际土壤,同时兼具固氮、溶磷和分泌生长素的能力,能够提高植物抗逆性,促进植物生长的功能菌群[4]。此外,根际促生菌能够作为微生物肥料,提高土壤肥力,改善土壤生态环境[5-6]。根际促生菌与植物根系的相互作用是一个复杂的动态过程,受土壤类型和植物根系分泌物等多种因素影响[7]。Arora等[8]研究发现,分离自盐碱土壤中的PGPR,具有较强的定值能力及盐碱耐受性,能够促进盐碱环境条件下植物的生长。近年来,盐碱地中多种植物根际促生菌的分离与应用相继被报道[9-10]。目前,不同土壤环境中的花生根际促生菌得到了分离。如姜瑛等[11]从灰潮土中的花生根际中鉴定出具有固氮解磷功能的促生菌。刘晔等[12]从砂质潮土中的根际中筛选出具有固氮、解磷、解钾的促生菌,并成功促进了花生在砂质潮土中的生长。但是,关于盐碱地花生根际多功能固氮菌鲜有报道。
盐碱地的特殊理化性质导致非土著功能菌的定值能力、盐碱耐受能力及功能活性下降。因此分离自盐碱地花生根际的促生菌能够最大化发挥其促进盐碱条件下花生的生长作用。本实验首次选取黄河三角洲沿海地区花生根际土壤为研究对象,筛选鉴定出具有固氮、溶磷及分泌IAA能力的功能菌株,并对其盐碱耐受性能进行了测定。该结果丰富了微生物肥料生产的菌种库,对通过微生物改良盐碱地,提高花生产量具有重要意义。
1 材料与方法 1.1 材料 1.1.1 土壤样品土壤样品采自山东省东营市黄河三角洲区域的盐碱地花生根际(北纬37°05'-37°40',东经118°03'-118°38'),定10个取样点,每个取样点间隔1 m,刮去土壤表层的根茬残体等,用灭菌土钻采集0-20 cm的土样,混匀,放入无菌密封袋内,带回实验室后4℃,保存备用。
1.1.2 培养基阿须贝固氮菌培养基(Ashby):KH2PO4 0.2 g,MgSO4·7H2O 0.2 g,NaCl 0.2 g,CaCO3 5.0 g,甘露醇10 g,CaSO4·2H2O 0.1 g,蒸馏水1 000 mL,pH值7.0-7.5。
无机磷培养基(TPM):葡萄糖10 g,(NH4)2SO4 0.5 g,NaCl 0.3 g,KCl 0.3 g,MgSO4·7H2O 0.3 g,FeSO4·7H2O 0.03 g,MnSO4·H2O 0.03 g,Ca3(PO4)2 5.0 g,定容至1 000 mL,pH值7.0-7.5。分别以FePO4和ALPO3代替Ca3(PO4)2不溶性P源。
有机磷培养基(YM):以0.5 g的卵磷脂代替无机磷培养基中的Ca3(PO4)2。
牛肉膏蛋白胨培养基(LB):牛肉膏10 g,蛋白胨10 g,NaCl 5 g,定容至1 000 mL,pH值7.0-7.5。
无氮培养基:蔗糖10 g,NaCl 0.12 g,K2HPO4·3H2O 0.5 g,CaCO3 1 g,MgSO4·7H2O 0.2 g,蒸馏水定容至1 000 mL,pH值7.0-7.2。
DF培养基:葡萄糖2.0 g,葡萄糖酸钠2.0 g,柠檬酸2.0 g,KH2PO4 4.0 g,Na2HPO4 6.0 g,MgSO4·7H2O 0.2 g,(NH4)2SO4 2.0 g,组分一、组分二溶液各0.1 mL,蒸馏水定容至1 000 mL,pH值7.0-7.2;其中组分一:H3BO3 10 mg,MnSO4·H2O 11.19 mg,ZnSO4·7H2O 124.6 mg,CuSO4·5H2O 78.22 mg,10 mg,灭菌蒸馏水100 mL;组分二:FeSO4·7H2O 100 mg溶于10 mL灭菌蒸馏水中。
ADF培养基:ACC溶于灭菌蒸馏水,0.22 um滤膜过滤除菌,然后加到不含(NH4)2SO4的DF培养基内,使其终浓度为3.0 mmol/L。
1.2 方法 1.2.1 菌株的分离纯化采用Ashby培养基进行固氮菌的分离,称取5 g土样,加入装有45 mL的无菌水的三角瓶中震荡30 min,取1 mL上清液,加入到装有9 mL无菌水的试管中,逐级稀释至10-6浓度。取10-3-10-5的浓度梯度0.1 mL涂布于Ashby平板培养基上,30℃倒置培养3 d直至出现单菌落,然后进行分离纯化,直至得到纯菌落。将所得纯菌落接种于LB斜面培养基,4℃保存备用。
1.2.2 16S rDNA的扩增与测序将固氮菌接种于LB液体培养基中,震荡培养(28℃,180 r/min)培养24 h,按照细菌DNA提取试剂盒步骤,提取固氮菌的DNA,利用细菌通用引物16s-F27(5'-AGAGTTTGATCCTGGCTCAG-3')和16s-R1387(5'-GGGCGGWGTGTACAAGGC-3')为引物,进行PCR扩增,产物胶回收后,上海生工测序,将测序结果提交NCBI进行同源序列的比对。
1.2.3 固氮酶活性测定利用气相色谱结合乙炔还原法测定固氮酶活性。将待测菌株接种于Ashby培养基中培养48 h,取1 mL接种于的含10 mL Ashby液体培养基的60 mL磨口小口瓶中,再培养24 h,然后抽出5 mL气体,再注入5 mL乙炔气体,继续培养24 h,上机检测。
1.2.4 1-氨基-环丙烷-1-羧酸(ACC)脱氨酶将保存在-80℃的固氮菌株活化,按1%(V/V)的比例将活化后的菌液接种于无氮培养基中,28℃条件下过夜培养,离心(1 200 r/min,10 min),收集菌体,用5 mL的DF培养基洗涤菌体2次,将菌体重悬于5 mL的ADF培养基中,28℃条件下过夜培养,离心(1 200 r/min,10 min),收集菌体。0.1 mol/L的Tris-HCl(pH 7.6)缓冲液洗冲洗菌体2次,再次将菌体重悬于600 μL的0.1 mol/L的Tris-HCl(pH 8.5)缓冲液,加入30 μL的甲苯。取200 μL提取液与20 μL的0.5 mol/L的ACC溶液混合,30℃条件下孵育15 min,然后加300 μL的0.2%的2,4-二硝基苯肼,30℃条件下孵育30 min,最后,加入2 mL的2 mol/L NaOH溶液,利用紫外分光光度计测吸光率(OD=540 nm)。以牛血清蛋白为标准,以每分钟形成1 μmol α-酮丁酸盐为一个酶活单位。
1.2.5 解磷特性的测定挑取保存在LB斜面的固氮菌株,接种于LB液体培养基中,28℃培养24 h。调节菌悬液浓度至1×108 CFU/mL,按1%(V/V)的比例将待测菌株分别接种于含有不同P源无机磷培养基(TPM)和有机磷培养基(YM)的三角瓶中,振荡培养(28℃,180 r/min)3 d,每株菌设3次重复,以不接菌作为空白对照。采用钼锑抗比色法测定发酵液中可溶性磷含量(OD=600 nm)。pH计测定培养基pH值的变化[13]。
1.2.6 分泌IAA量测定将待测菌株接种于含有200 μg/mL色氨酸的LB培养基中,在28℃条件下180 r/min,培养3 d。离心(1 200 r/min,10 min),得到上清液,取5 mL的上清液加入到10 mL的试管中,然后加入等体积的salkowski比色液(0.5 mol/L的氯化铁10 mL加入到35%的高氯酸中,总体积500 mL)避光静止30 min显色,测其分光光度,以空白组作为对照(OD=530 nm)。
1.2.7 耐盐碱水平测定分别配制含不同NaCl浓度(0、0.5、1、1.2和1.5 mol/L)和不同起始pH值(7、8、9和10)的LB液体培养基中,各浓度设3次重复。将供试菌株接种到LB液体培养基中,30℃,过夜培养,调节菌悬液浓度为1× 108 CFU/mL,制成接种液,按1%的接种量(100 mL培养基接种1 mL接种液),分别转接至含不同NaCl浓度及不同pH值的LB液体培养基中,振荡培养(28℃,180 r/min)培养3 d,紫外分光光度计下测定其OD值(OD=600 nm),以OD值的大小表示其在各水平下的生长繁殖情况。
2 结果 2.1 菌株筛选鉴定对土壤样品稀释后进行涂布实验,初步得到菌株58株,利用乙炔还原法测定所分离的固氮菌株的固氮酶活,其中具有固氮能力的共22株,其固氮酶活性在125.82-346.32 nmol C2H4/(h·mL)(表 1),以16s-F27和16s-R1387为引物对菌株扩增及16S rDNA正向测序,得到的序列通过BLAST与GenBank数据库中序列进行比对,结果如图 1所示。这些菌株属于4个菌属,其中,13株菌株属于Stenotrophomonas spp.,占总数的59%,为优势菌群;6株菌株属于Enterobacter spp.,2株菌株属于Pseudomonas sp.,1株属于Aeromonas sp.。
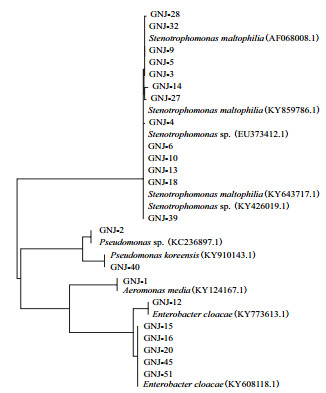
|
| 图 1 基于16S DNA基因序列构建固氮菌进化树 |
利用比色法对分离得到的22株菌株分泌IAA特性进行测定,培养基各菌株的显色反应与分泌IAA的量成正相关,即颜色反应越明显,其产生IAA的量越大。结果(表 1)显示,10株可以分泌IAA,分泌量在1.36-17.80 μg/mL,占供试菌株的54%。CNJ-1的分泌量最小,其分泌量为1.36 μg/mL;浓度大于10 μg/mL的菌株只有2株,分别是GNJ-2(12.90 μg/mL)和GNJ-32(10.23 μg/mL)。
2.3 产ACC脱氨酶特性ACC脱氨酶活性测定结果(图 2)显示,所有菌株均具有产ACC脱氨酶的能力,其产量为0.12-1.26 U/mg。其中,ACC脱氨酶活性最大的菌株为GNJ27(1.26 U/mg),其次为GNJ32(1.12 U/mg),这两株菌均属于Stenotrophomonas spp.。ACC脱氨酶活性最小的为Aeromonas sp. GNJ1,其产量为0.12 U/mg。

|
| 图 2 菌株ACC脱氨酶活性测定 |
液体培养测定菌株的溶磷性,结果如图 3所示。所筛选的菌株均具有溶解磷酸三钙的能力,其溶磷量1.45-53.58 mg/L之间。其中,编号GNJ-4,GNJ-13,GNJ-14,GNJ-16,GNJ-18,GNJ-20,GNJ-27,GNJ-32,GNJ-51溶磷酸三钙的能力相对较高,培养基内可溶性磷含量都在10 mg/L以上,而其他的菌株溶磷量大多在1-10 mg/L左右,相对较少。而且随着培养基可溶性磷含量的增加,培养基的pH有所下降,其下降范围由初始的7下降到3.14。以磷酸铁为不溶性P源时,培养基内可溶性磷含量为1.45-8.27 mg/L。其中编号GNJ-4,GNJ-16,GNJ-20,GNJ-27,GNJ-28,GNJ-40的能力较高,溶磷含量在5 mg/L以上,而其余菌株大多在2-4 mg/L左右波动。当以磷酸铝为不溶性磷源时,培养基内可溶性磷含量1.1-22.82 mg/L,其中编号GNJ-2,GNJ-27,GNJ-51的溶磷能力相对较高,其余菌株大多在6 mg/L左右。所有培养基的pH均随着培养基内可溶性磷含量增加而下降。这说明,固氮菌在溶磷的过程中其可以释放某些酸性物质,进而降低培养基的pH。
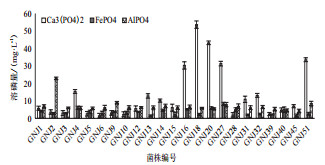
|
| 图 3 固氮菌株溶解难溶性磷 |
选取10株具有固氮、溶磷及分泌IAA特性的多功能菌株进行耐盐碱实验。结果(图 4)表明,不同菌种的盐耐受能力不同。大部分固氮菌株随着NaCl浓度的增加,菌体生长受到抑制,生物量下降;其中固GNJ-27和GNJ-40最适生长NaCl浓度为0.5 mol/L;GNJ-2,GNJ-15,GNJ-40在1.5 mol/L NaCl条件下仍可生存,其耐盐性最强。所有菌株的耐受pH值范围为7-9(图 5)。其中GNJ-1,GNJ-20,GNJ-27的最适生长pH值为7;GNJ-2,GNJ-5,GNJ-13,GNJ-14,GNJ-32的最适生长pH值为8;GNJ-15和GNJ-40的最适适生长pH值为9。
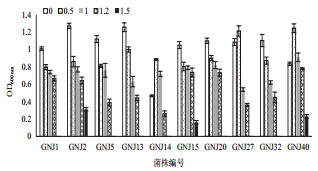
|
| 图 4 固氮菌株的NaCl耐受性 |
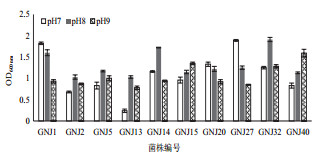
|
| 图 5 固氮菌株的pH耐受性 |
盐碱地植物根系分布着很多耐盐碱根际促生菌,这些菌株能够增植物的耐碱性,促进植物生长。目前,盐碱地中多种植物根际促生菌已成功筛选出来[9-10]。本实验利用Ashby培养基首次从盐碱地花生根际分离具有固氮能力的土著菌株,筛选出具有固氮能力的菌株22株,分属Aeromonas spp.,Pseudomonas spp.,Enterobacter spp.,和Stenotropho-monas spp.,4个种群。Stenotrophomonas spp.占总数的54%,为优势种群。这4个种群在黄瓜、小麦、水稻中均有相关报道,可以缓解盐胁迫损伤[14-15]。
氮是植物生长所必需的大量营养元素之一,微生物能够固定大气中的氮气,为植物提供氮素营养,进而促进植物生长。王超群等[16]从大豆根际分离的4株固氮菌,最大固氮酶活为263. 40 nmol C2H4 /(h·mL),最小固氮酶活为183.09 nmol C2H4 /(h·mL)。本实验分离得到菌株的固氮酶活性最高为346.32 nmol C2H4 /(h·mL),最低为125.82 nmol C2H4 /(h·mL)。可见,本实验所分离的促生菌株具有较高的固氮酶活性。有研究表明,固氮菌不但可以固定空气中的氮气,同时一些固氮菌还兼具产ACC脱氨酶,溶磷及分泌IAA的特性[17]。
ACC脱氨酶是许多植物根际促生细菌共有的一个特征性酶,在植物抵抗高温、高盐、寒冷及病害等逆境胁迫中发挥中重要作用。乙烯是植物生长发育的代谢产物,盐碱条件下,植物体内的乙烯水平会显著上升,进而影响植物生长。ACC脱氨酶是一种抑制乙烯生物合成的胞内酶,具有分泌ACC脱氨酶活性的微生物接种在植物根际时,能够降低植物由于盐胁迫产生的过量乙烯浓度,促进植物生长。许芳芳等[18]研究表明接种具有ACC脱氨酶活性的肠杆菌(Enterobacter sp.),显著提高了盐胁迫下小麦的生长性状,叶绿素含量19%,生物量提高54%,根长增加了46%。ACC脱氨酶活性是评价菌株是否可被制作成微生物肥料的指标之一。本实验所筛选的固氮菌株均具有ACC脱氨酶活性。赵龙飞等[19]研究表明具有固氮酶活性的肠杆菌属(Enterobacter)、寡养单胞菌属(Stenotrophomonas),同时具有产ACC脱氨酶的活性。
本实验所筛选的促生菌株中,所有菌株均具有溶磷性能,其中GNJ-18的最大溶磷量为53.58 mg/L。这与Sharma等[20]分离自花生根部的PGPR研究结果基本一致。而在分泌IAA特性方面,不同菌株的差异较大。郑娜等[21]从盐碱土壤中分离4株菌(Pseudomonas protegens、Achromobacter sp.、Variovorax sp.和P. protegens),其中3株具有分泌IAA的能力,产量最高达到160.55 µg/mL,但最低的只有0.10 µg/mL。本实验中,有45%的促生菌株具有分泌IAA的能力,浓度为1.36-12.9 μg/ml。Liu等[22]分离自菊芋根际的耐盐碱固氮菌中仅有一株具有产IAA能力,且分泌量仅为1.1 μg/ml,接种该菌株成功的促进了菊芋生长。IAA不但可以促进细胞生长,增加细胞体积和重量,直接促进植物生长。而且,通过接种分泌IAA的菌株,能够增加植物根表面积和长度,从而使植物能够获得更多营养物质[23]。这表明分离的促生菌具有应用于盐碱土壤中增加可利用营养元素含量的潜力。
本实验探究多功能菌株在不同NaCl及pH下的生长情况,发现所有菌株对NaCl具有较好的适应性,其中GNJ-2,GNJ-20和GNJ-27在NaCl浓度为1.5 mol/L条件下能够生长,远高于孙建光等[24]筛选自玉米固氮菌株的NaCl耐受性。牛艳芳等[25]筛选自非盐碱土壤中的固氮菌株的最适生长pH值均集中在6-8。而本实验所筛选的固氮菌株的最适生长pH值范围为7-9。这说明,分离自盐碱地植物根际的微生物对盐碱环境耐受性较好。薛婷婷等[26]对黄河三角洲盐碱地固氮菌的pH耐受性研究也证实了这一观点。因此,本研究所筛选的促生菌能够更好的适应盐碱环境,在制备盐碱地微生物菌肥方面具有较大的应用潜力。
4 结论根际促生菌能够通过固氮、产ACC脱氨酶,溶磷及分泌IAA等机制缓解植物盐胁迫损伤,改良盐碱土壤。本实验以黄河三角洲盐碱地花生根际土壤为研究对象,经固氮酶活的测定及16S rDNA鉴定,筛选得到22株具有固氮能力的菌株。所有菌株均具有产ACC脱氨酶及溶解难溶性无机磷源活性,有10株固氮菌株可以分泌IAA。这10株菌株具有良好的盐碱耐受性,在盐碱地微生物菌肥方面具有较大的开发潜力。
| [1] |
Ghollarata M, Raiesi F. The adverse effects of soil salinization on the growth of Trifolium alexandrinum L. and associated microbial and biochemical properties in a soil from Iran[J]. Soil Biology & Biochemistry, 2007, 39: 1699-1702. |
| [2] |
Arafa RAM, Elrahmany TA, Elghany BFA, et al. Role of some effective microorganisms in improving soil properties and productivity of peanut under North Sinai conditions[J]. Research Journal of Agriculture & Biological Sciences, 2010, 6(3): 228-246. |
| [3] |
张智猛, 慈敦伟, 张冠初, 等. 山东地区盐碱土花生种子际土壤微生物群落结构的研究[J]. 微生物学报, 2017, 57(4): 582-596. |
| [4] |
康贻军, 程洁, 梅丽娟, 等. 植物根际促生菌作用机制研究进展[J]. 应用生态学报, 2010, 21(1): 232-238. |
| [5] |
Ahemad M, Kibret M. Mechanisms and applications of plant growth promoting rhizobacteria: Current perspective[J]. Journal of King Abdulaziz University Science, 2014, 26(1): 1-20. |
| [6] |
毛晓洁, 王新民, 赵英, 等. 多功能固氮菌筛选及其在土壤生态修复中的应用[J]. 生物技术通报, 2017, 33(10): 148-155. |
| [7] |
马莹, 骆永明, 滕应, 等. 根际促生菌及其在污染土壤植物修复中的应用[J]. 土壤学报, 2013, 50(5): 1021-1031. |
| [8] |
Arora NK, Tewari S, Singh S, et al. PGPR for protection of plant health under saline conditions[M]// Bacteria in Agrobiology: Stress Management. Springer Berlin Heidelberg, 2012: 239-258.
|
| [9] |
姚拓, 龙瑞军, 王刚, 等. 兰州地区盐碱地小麦根际联合固氮菌分离及部分特性研究[J]. 土壤学报, 2004, 41(3): 444-448. DOI:10.3321/j.issn:0564-3929.2004.03.018 |
| [10] |
刘佳莉, 方芳, 史煦涵, 等. 2株盐碱地燕麦根际促生菌的筛选及其促生作用研究[J]. 草业学报, 2013, 22(2): 132-139. |
| [11] |
姜瑛, 吴越, 王国文, 等. 一株固氮解磷菌的筛选鉴定及其对花生的促生作用研究[J]. 土壤, 2015, 47(4): 698-703. |
| [12] |
刘晔, 刘晓丹, 张林利, 等. 花生根际多功能高效促生菌的筛选鉴定及其效应研究[J]. 生物技术通报, 2017, 33(10): 125-134. |
| [13] |
Murphy J, Riley JP. A modified single solution method for the determination of phosphate in natural waters[J]. Anal Chim Acta, 2962, 27: 31-36. |
| [14] |
Dilfuza E, Zulfiya K, Kakhramon D, et al. Bacteria able to control foot and root rot and to promote growth of cucumber in salinated soils[J]. Biology & Fertility of Soils, 2011, 47(2): 197-205. |
| [15] |
Shrivastava P, Kumar R. Soil salinity: A serious environmental issue and plant growth promoting bacteria as one of the tools for its alleviation[J]. Saudi Journal of Biological Sciences, 2015, 22(2): 123-131. DOI:10.1016/j.sjbs.2014.12.001 |
| [16] |
王超群, 刘帅, 王晓璐, 等. 大豆根际高效自生固氮菌分离鉴定与特性研究[J]. 大豆科学, 2015, 34(5): 850-854. |
| [17] |
胡春锦, 林丽, 史国英, 等. 广西甘蔗根际高效联合固氮菌的筛选及鉴定[J]. 生态学报, 2012, 32(15): 4745-4752. |
| [18] |
许芳芳, 袁立敏, 邵玉芳, 等. 肠杆菌FYP1101对盐胁迫下小麦幼苗的促生效应[J]. 微生物学通报, 2018, 45(1): 102-110. |
| [19] |
赵龙飞, 徐亚军, 常佳丽, 等. 具ACC脱氨酶活性大豆根瘤内生菌的筛选、抗性及促生作用[J]. 微生物学报, 2016, 56(6): 1009-1021. |
| [20] |
Sharma S, Kulkarni J, Jha B. Halotolerant rhizobacteria promote growth and enhance salinity tolerance in peanut[J]. Frontiers in Microbiology, 2016, 7: 01600. DOI:10.3389/fmicb.2016.01600 |
| [21] |
郑娜, 柯林峰, 杨景艳, 等. 来源于污染土壤的植物根际促生细菌对番茄幼苗的促生与盐耐受机制[J]. 应用与环境生物学报, 2018, 24(1): 47-52. |
| [22] |
Liu X, Li X, Li Y, et al. Plant growth promotion properties of bacterial strains isolated from the rhizosphere of the Jerusalem artichoke(Helianthus tuberosus L.)adapted to salt-alkaline soils and their effect on wheat growth[J]. Canadian Journal of Microbiology, 2017, 63(3): 228-237. DOI:10.1139/cjm-2016-0511 |
| [23] |
张东艳, 刘晔, 吴越, 等. 花生根际产IAA菌的筛选鉴定及其效应研究[J]. 中国油料作物学报, 2016, 38(1): 104-110. DOI:10.7505/j.issn.1007-9084.2016.01.016 |
| [24] |
孙建光, 张燕春, 徐晶, 等. 玉米根际高效固氮菌Sphingomonas sp. GD542的分离鉴定及接种效果初步研究[J]. 中国生态农业学报, 2010, 18(1): 89-93. |
| [25] |
牛艳芳, 闫伟, 陈立红. 阿尔山白桦根际土壤固氮菌多样性及特性[J]. 东北林业大学学报, 2017, 45(5): 101-105. DOI:10.3969/j.issn.1000-5382.2017.05.019 |
| [26] |
薛婷婷, 陆洪省, 程建光. 黄河三角洲盐碱地固氮细菌的分离鉴定和生长特性研究[J]. 山东化工, 2017, 46(18): 45-47. DOI:10.3969/j.issn.1008-021X.2017.18.017 |





