军团菌病是一种细菌性疾病,主要表现为自限性非肺炎性庞蒂亚克热(Pontiac fever)和军团菌病症状,其特征是严重的呼吸道症状,包括具有高度致命性的肺炎。感染的病原菌为军团菌,主要是嗜肺军团菌,约占90%以上[1-2]。军团菌可在25-45℃的温水中生长,广泛存在于人工、自然水环境以及各种人工供水设施中,在具有复杂水管系统的建筑物中较为常见,如淋浴头、供水管道、水龙头、浴缸和空调装置等,其主要原因在于这些管道的供水水流缓慢,甚至停滞[3]。
人们常在吸入经军团菌污染的水雾后感染,尤其是老年人、免疫功能缺陷或低下的患者、吸烟者和慢性呼吸道疾病患者[4]。最好的预防方法是将水温调节至20℃以下或者60℃以上,输水管道中的水温保持在55℃以上[3, 5]。为了防止烫伤,可在水源使用点应安装温度调节装置。其他的预防措施还包括合理建设供水系统以尽可能地减少水流停滞、使用特殊材料防止微生物生长等[5]。
军团菌病在全球范围均有发生,尚有大量未报到的病例[2]。最近,瑞士制定了军团菌在公共浴室和淋浴水中的微生物标准(FSVO 2017)来预防军团菌病。国际标准化组织也制定了相关的国际标准方法(ISO 11731),以检测水样是否符合微生物标准,该方法采用选择性琼脂平板培养后检测病原体并计数活细胞数(ISO 2008)。Kirschner等[6]的研究表明这种方法耗时,检测时间常大于10 d,同时由于技术限制或其他原因,部分军团菌可能具有活性但无法通过培养证实,即“活的非可培养状态”(Viable but not culturable status,VBNC),而容易出现假阴性结果[6-8]。在一定条件下,这部分军团菌能够恢复毒力和感染宿主的能力[9]。目前,以分子为基础的快速检测方法得到迅速发展,但应用该方法检测微生物时,不论是否具有活性的微生物均能被检测出来,从而导致假阳性结果的产生。采用DNA插层剂的方法可以区分病原微生物是否具有活性,但是同样存在缺点,如生物膜的存在会干扰检测结果[9]、试剂对检测物的浓度依赖性细胞毒性作用[10]。
一种检测活嗜肺军团菌的分子检测方法能够有效地解决这一问题,该方法基于PCR检测16S rRNA前体中特异性的靶点,这种靶点仅存在于活的嗜肺军团菌中,有望成为ISO方法的另一可选方案。前体rRNA在微生物rRNA总量中占据了很大的一部分,由于其具有较高的稳定性,比mRNA更容易检测和处理[11]。前体rRNA是由生长中的细菌合成的,在rRNA成熟过程中其头端和尾端的序列将随后被删除[11-12]。当微生物生长停滞时,其前体rRNA的合成停止,但继续成熟,从而导致前体rRNA大量流失,因此,前体rRNA的存在可作为判断微生物细胞活性的分子指标[11, 13-14]。
由于水为军团菌提供的营养物质有限,细胞群很少处于对数生长期,水中前体rRNA含量处于低水平[7]。将饥饿的军团菌转移至新鲜的培养基中可刺激其生长,导致rRNA的合成大量增加,随后再用核酸提取和逆转录实时定量PCR方法(Quantitative reverse transcription PCR,RT-qPCR)检测16S rRNA前体,可以极大地提高检测效能。本研究分别应用预刺激RT-qPCR法和ISO法对嗜肺军团菌、非嗜肺军团菌以及非军团菌进行检测,验证两种方法的特异性和灵敏度。随后分别应用这两种方法检测公共场所水环境中嗜肺军团菌水平及污染情况,比较两者结果的一致性,从而探究该预刺激方法在公共场所水环境中快速检测中的应用效果。
1 材料与方法 1.1 材料 1.1.1 病原菌株嗜肺军团菌(ATCC 33152、ATCC 33153)、约旦军团菌(ATCC 33623)、长滩军团菌(ATCC 33462)、普通大肠杆菌(ATCC 25922)、铜绿假单胞菌(ATCC 27853)、肠炎沙门氏菌(ATCC 13076)、金黄色葡萄球菌(ATCC 25923)均由美国模式培养物集存库(American type culture collection,ATCC)提供。
1.1.2 仪器与试剂E.Z.N.A. Total RNA Kit试剂盒(美国Omega公司); One Step PrimeScript RT-PCR Kit试剂盒(日本TaKaRa公司); 荧光定量PCR仪(美国Roche公司); 5720R台式冷冻离心机(德国Eppendorf公司); 全自动细胞计数仪TC10(美国Bio-Rad公司)。
1.2 方法 1.2.1 引物及探针的设计与合成嗜肺军团菌16S rRNA的上、下游引物序列分别为:5'-CGAGAGCT-AGTGCCGGAAT-3',5'-CCAAGTTGTCCCCCTCTTC-3';嗜肺军团菌16S rRNA的探针序列为:5'-FAM-TAGACAGATGGCGAGTGGCGAACG-BHQ1-3',扩增长度177 bp。上述引物及探针均由上海闪晶分子生物科技有限公司合成。采用核苷酸BLAST工具(https:/blst.ncbi.nlm.nih.gov)进行计算机模拟分析序列同源性检索,结果表明引物和探针对嗜肺军团菌具有高度特异性。
1.2.2 菌株的培养军团菌菌株在含L-半胱氨酸的BCYE琼脂平板上培养,非军团菌在5%羊血琼脂平板上培养,挑选单个的菌落制备成含菌量为105 CFU/μL的细菌混悬液供实验使用。
1.2.3 实验菌株的预处理与模板制备将实验菌株分为预刺激组(Pre-stimulated Group,PSG)和普通组(Ordinary group,OG)两组,分别进行预刺激处理和普通处理。取普通组细胞混悬液1-1.5 mL EP管中离心,16 000 r/min,4℃,5 min,弃上清液留沉淀。预刺激组细胞混悬液取1 mL置于50 mL离心管内,加入9 mL已预热的含L-半胱氨酸的BCYE培养基,37℃孵育一段时间后离心,丢弃9 mL上清液。剩余物转移至1.5 mL EP管中再离心16 000 r/min,4℃,5 min,弃上清液留沉淀。采用E.Z.N.A. Total RNA Kit试剂盒制备RNA模板,待测的RNA样品提取后立即进行分析,随后置于-70℃冰箱中。
1.2.4 逆转录实时定量PCR检测反应体系(25 μL)为2×One Step RT-PCR Buffer Ⅲ 10 μL、TaKaRa Ex Taq HS(5 U/μL)0.4 μL、PrimeScript RT Enzyme Mix Ⅱ 0.4 μL、PCR Forward Primer(10 μmol/L)1 μL、PCR Reverse Primer(10 μmol/L)1 μL、Probe 0.5 μL、待测样品5 μL、DEPC水补足至25 μL。PCR扩增条件为:50℃逆转录30 min; 95℃预变性15 min; 95℃变性15 s,60℃退火延伸60 s,40个循环。RT-qPCR检测的结果判定以Ct值≤35且扩增曲线呈S型为阳性。
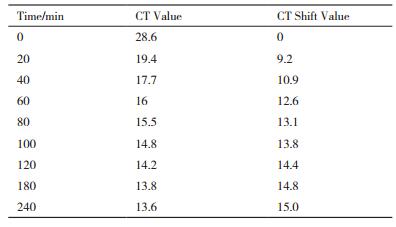
1.2.5 预刺激时间的选择嗜肺军团菌先进行饥饿预处理:取标准嗜肺军团菌1 mL置于50 mL离心管内,加入9 mL已预热的DEPC水,恒温37℃孵育24 h,从而抑制16S rRNA前体的合成及分泌。将人工饥饿处理后的嗜肺军团菌分为9组,分别进行普通处理(1组)及预刺激处理(8组),预刺激组分别于刺激后20、40、60、80、100、120、180及250 min进行收集实验样品,普通组即为预刺激后0 min。提取实验样本RNA,进行RT-qPCR。CT转化值是指预刺激组与普通组的CT值(CT Value)的差值。
1.2.6 特异性分析提取包括嗜肺军团菌(ATCC 33152、ATCC 33153)、约旦军团菌(ATCC 33623)、长滩军团菌(ATCC 33462)、普通大肠杆菌(ATCC 25922)、铜绿假单胞菌(ATCC 27853)、肠炎沙门氏菌(ATCC 13076)、金黄色葡萄球菌(ATCC 25923)在内8株实验菌株的RNA,采用预刺激RT-qPCR法检测的16S rRNA前体的表达,对比ISO法检测的结果,分析两种方法检测水样中嗜肺军团菌的特异性。
1.2.7 灵敏度分析将饥饿处理后的标准军团菌株混悬液按照106、105、104、103、102、101 Cell/L的浓度进行稀释,分别采用预刺激法RT-qPCR方法和ISO法检测嗜肺军团菌的表达,分析两种方法检测水样中嗜肺军团菌的灵敏度,结果用最低检测浓度(Limit of detection,LOD)表示。
1.2.8 外环境水样检测自2017年6月-2017年8月于湖南省湘潭市选择宾馆、饭馆、超市、医院等公共场所,采集场所自来水、淋浴水、空调冷却水等水样本。采集自来水和淋浴水前应先用酒精棉球擦拭出水口,并放水1-2 min后采样。冷却水取自集水池液面下20 cm处。公共水环境的水样分别进行预刺激RT-qPCR法及ISO标准法进行检测。
1.2.9 统计学方法采用SPSS 21.0对实验数据进行录入及分析,计数资料组间比较采用卡方检验分析,P < 0.05被认为差异具有统计学差异。
2 结果 2.1 预刺激时间的选择不同预刺激时间(0、20、40、60、80、100、120、180和240 min)处理嗜肺军团菌后,RT-qPCR结果显示随着预刺激时间延长,CT值逐渐减少,而相对应的CT转换值逐渐增加,分别为9.2、10.9、12.6、13.1、13.8、14.4、14.8、15.0个循环(表 1)。当预刺激时间 > 3 h时,CT转换值的增加明显变缓(图 1)。

|
| 图 1 不同预刺激时间处理嗜肺军团菌CT值变化 |
采用荧光定量PCR检测2株嗜肺军团菌、2株非嗜肺军团菌、4株非军团菌株的16S rRNA前体的表达,结果(表 1)表明预刺激RT-qPCR法和ISO法检测嗜肺军团菌的特异性均为100%。2株嗜肺军团菌的16S rRNA前体的编码序列检测为阳性,而2株非嗜肺军团菌、4株非军团菌的16S rRNA前体的编码序列检测为阴性,结果与ISO标准法完全一致。
2.3 灵敏度检测将饥饿处理后的标准嗜肺军团菌株混悬液按照106、105、104、103、102、101 Cell/L的浓度进行稀释,采用预刺激RT-qPCR法、ISO标准法进行检测。结果表明,预刺激法在浓度为106、105、104、103、102 Cell/L的嗜肺军团菌混悬液检测呈阳性,而在101 Cell/L的嗜肺军团菌混悬液检测呈阴性,因此预刺激RT-qPCR法的LOD为102 Cell/L; ISO标准法在浓度为106、105、104 Cell/L的嗜肺军团菌混悬液检测呈阳性,而在103、102、101 Cell/L的嗜肺军团菌混悬液检测呈阴性,因此ISO标准法的LOD为104 Cell/L(表 3)。
调查湖南省湘潭市地区的宾馆12家、饭馆10家、超市3家、医院2家等公共场所的自来水、淋浴水以及空调冷却水,共计69份水样品。预刺激RT-qPCR法及ISO标准法的总阳性率分别为43.5%(30/69)和40.6%(28/69)。
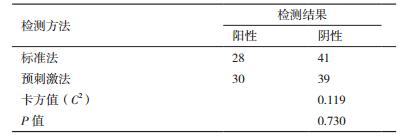
将预刺激RT-qPCR法与ISO标准法进行对比,预刺激RT-qPCR法与ISO标准法的一致率为94%,其中27份水样检测呈阳性,38份水样呈阴性; 两种检测方法中约有6%的水样出现差异性表达,其中3份水样检测结果预刺激RT-qPCR法呈阳性而ISO标准法检测呈阴性,1份水样检测结果预刺激RT-qPCR法呈阴性而ISO标准法检测呈阳性(表 4)。
每份水样均进行预刺激RT-qPCR法及ISO标准法检测,检测结果详见表 5。两组数据统计学分析发现,预刺激RT-qPCR法及ISO标准法分别检测水环境中嗜肺军团菌的表达,差异无明显统计学意义(C2=0.119,P=0.730)。
嗜肺军团菌是一种革兰染色阴性的机会致病菌,广泛存在于公共场所水环境中,如空调冷却水、供水系统、淋浴水、喷泉水。嗜肺军团菌可经气溶胶吸入引起以发热及肺部感染为主要症状的军团菌病。因此,水环境中嗜肺军团菌的快速检测及预警对控制人群中军团菌病的发生具有重要意义[15]。目前常用的嗜肺军团菌的检测方法包括分离培养法、酶联免疫吸附法、免疫荧光法和荧光定量PCR法等[16]。其中PCR技术具有快速定量检测的优势,因而得到了迅速发展,但是其缺陷在于无法区分活菌及死菌,限制了其实际应用。本研究首次提出预刺激RT-qPCR法检测水样中的活嗜肺军团菌,与金标准ISO法进行对比,探究新检测方法在实际应用中的可行性。
预刺激RT-qPCR法通过诱导16S rRNA的合成增加,并采用RT-qPCR技术定量分析嗜肺军团菌的16S rRNA的表达水平,从而可定量检测出活嗜肺军团菌。最佳预刺激时间的选择是该方法应首要解决的问题,本研究通过分析不同预刺激时间处理嗜肺军团菌后的CT值变化来确定最佳预刺激时间。最佳预刺激时间的选择应尽可能的接近最大效应时间,而小于军团菌的倍增时间。结果表明,预刺激时间设置为3 h是很合理的。饥饿处理后的嗜肺军团菌在预刺激1 h后即出现了明显的CT值改变。Warren等[17]的研究表明嗜肺军团菌的倍增时间约为6 h甚至更多。当预刺激时间超过3 h时,CT值增长明显缓慢[18-19]。因此,最佳预刺激时间设置为3 h,此时嗜肺军团菌16S rRNA的合成既接近于最大效应值,又远小于军团菌的倍增时间6 h。
预刺激RT-qPCR法和ISO标准法的特异性分析表明,两种方法特异性完全一致,均为100%;而在灵敏度检测中,预刺激法的LOD为102 Cell/L,ISO标准法的LOD为104 Cell/L。因此,预刺激RT-qPCR法检测具有高特异性和高灵敏度的特点。传统经典的军团菌检测方法,即ISO标准法,是军团菌检测的“金标准”,据部分学者报道[20]其特异性高达100%,但Boss等[21]研究表明部分细菌经ISO法检测为假定的嗜肺军团菌,而通过基质辅助激光解析电离飞行时间质谱分析(MALDI-TOF MS)证实为不动杆菌。需要指出的是,虽然本研究的特异性也为100%,但是仅进行了2株嗜肺军团菌、2株非嗜肺军团菌、4株非军团菌株的检测,受检菌株少可能是的两种方法特异性如此之高的部分原因。但是,部分欧洲的研究表明被报道的病例中绝大多数(约70%)的感染是由SG1型嗜肺军团菌引起,约有20%-30%是由SGs2-15型嗜肺军团菌引起[22]。本研究选用的2株嗜肺军团菌均为属于SG1型嗜肺军团菌,具有普适性,因此对实际检测中仍具有一定的指导意义。
公共场所水环境的检测结果表明,预刺激RT-qPCR法与ISO标准法的结果基本一致,一致率为94%,两者差异无明显统计学意义。预刺激RT-qPCR法是在荧光定量PCR(Quantitative real-time PCR,qPCR)的基础上改进而来的,而qPCR是除了细菌培养外唯一一种编入ISO技术规范的嗜肺军团菌检测标准,Omiccio Li等[23]对34株军团菌、16株非军团菌进行检测,认为在军团菌检测中,qPCR完全能够取代分离培养法,而不仅仅只是其替代选项。Bonetta等[24]的研究也表明qPCR对外环境水样中的军团菌检测,其阳性率远高于传统的分离培养法,能够更加真实地反映出外环境中军团菌的污染情况。近年来,随着卫生行政部门对军团菌越来越重视,医院、宾馆等公共场所的空调水系统等被大量使用消毒剂用于消灭和去除军团菌。环境中的压力和氧化还原条件等变化导致水样中军团菌向生物膜及原虫体内迁移,亦或者成为“活的非可培养状态”,这种状态下的军团菌无法被传统的细菌分离培养法检测出来。Greenhalgh等[25]的研究也证实了VBNC军团菌的存在可能导致假阴性结果的产生。
此外,预刺激RT-qPCR法还具有快速检测的特点。在收集水样后的8 h即可获得检测结果,而ISO法至少需要花费1周的时间。当疾病疫情爆发流行时,快速检测出水样中的潜在感染源就显得尤为重要。相较于传统的核酸技术而言,预刺激RT-qPCR法还可区分活细胞和死细胞,该方法的理论基础在于Cangelosi等[12]的研究发现16S rRNA前体在合成后其头部及尾部的序列立即被删除,因此利用16S rRNA可检测出细胞是否具有活性。本研究探究了预刺激RT-qPCR法与ISO的在实验室条件下及实际应用的差异,对该方法实际推广有一定指导意义,同时也存在一定的局限,如本研究中实验菌株较少可能影响到两种方法的评估,实验设备及技术要求较高导致难以在基层推广。
4 结论预刺激RT-qPCR法是一种快速有效的检测活嗜肺军团菌的方法,诊断灵敏度及特异性高,是ISO标准法潜在的替代方案。特别是在需要快速取得检测结果时,该方法可作为首选方案。
| [1] |
Dominguez A, Alvarez J, Sabria M, et al. Factors influencing the case-fatality rate of Legionnaires' disease[J]. Int J Tuberc Lung Dis, 2009, 13(3): 407-412. |
| [2] |
Parr A, Whitney EA, Berkelman RL. Legionellosis on the rise:A review of guidelines for prevention in the united states[J]. J Public Health Manag Pract, 2015, 21(5): E17-26. DOI:10.1097/PHH.0000000000000123 |
| [3] |
Rhoads WJ, Ji P, Pruden A, et al. Water heater temperature set point and water use patterns influence Legionella pneumophila and associated microorganisms at the tap[J]. Microbiome, 2015, 3: 67. DOI:10.1186/s40168-015-0134-1 |
| [4] |
Lanternier F, Ader F, Pilmis B, et al. Legionnaire's disease in compromised hosts[J]. Infectious Disease Clinics of North America, 2017, 31(1): 123-135. |
| [5] |
Bedard E, Fey S, Charron D, et al. Temperature diagnostic to identify high risk areas and optimize Legionella pneumophila surveillance in hot water distribution systems[J]. Water Research, 2015, 71: 244-256. DOI:10.1016/j.watres.2015.01.006 |
| [6] |
Kirschner AKT. Determination of viable legionellae in engineered water systems:Do we find what we are looking for?[J]. Water Research, 2016, 93: 276-288. DOI:10.1016/j.watres.2016.02.016 |
| [7] |
Al-Bana BH, Haddad MT, Garduno RA. Stationary phase and mature infectious forms of Legionella pneumophila produce distinct viable but non-culturable cells[J]. Environmental Microbiology, 2014, 16(2): 382-395. DOI:10.1111/1462-2920.12219 |
| [8] |
Li L, Mendis N, Trigui H, et al. Transcriptomic changes of Legionella pneumophila in water[J]. BMC Genomics, 2015, 16: 637. DOI:10.1186/s12864-015-1869-6 |
| [9] |
Ducret A, Chabalier M, Dukan S. Characterization and resuscitation of 'non-culturable' cells of Legionella pneumophila[J]. BMC Microbiology, 2014, 14: 3. DOI:10.1186/1471-2180-14-3 |
| [10] |
Yanez MA, Nocker A, Soria-Soria E, et al. Quantification of viable Legionella pneumophila cells using propidium monoazide combined with quantitative PCR[J]. Journal of microbiological methods, 2011, 85(2): 124-30. DOI:10.1016/j.mimet.2011.02.004 |
| [11] |
Cangelosi GA, Weigel KM, Lefthand-Begay C, et al. Molecular detection of viable bacterial pathogens in water by ratiometric pre-rRNA analysis[J]. Appl environ Microbiol, 2010, 76(3): 960-2. DOI:10.1128/AEM.01810-09 |
| [12] |
Cangelosi GA, Brabant WH. Depletion of pre-16S rRNA in starved Escherichia coli cells[J]. J Bacteriol, 1997, 179(14): 4457-4463. DOI:10.1128/jb.179.14.4457-4463.1997 |
| [13] |
Stroot PG, Oerther DB. Elevated precursor 16S rRNA levels suggest the presence of growth inhibitors in wastewater[J]. Water Science and Technology, 2003, 47(11): 241-250. DOI:10.2166/wst.2003.0611 |
| [14] |
Lu T, Stroot PG, Oerther DB. Reverse transcription of 16S rRNA to monitor ribosome-synthesizing bacterial populations in the environment[J]. Appl environ Microbiol, 2009, 75(13): 4589-4598. DOI:10.1128/AEM.02970-08 |
| [15] |
Warren JD, Xiong W, Bunker AM, et al. Septin 9 methylated DNA is a sensitive and specific blood test for colorectal cancer[J]. BMC Medicine, 2011, 9: 133. DOI:10.1186/1741-7015-9-133 |
| [16] |
张宝莹, 刘凡, 陈逊, 等. 应用两种PCR法快速检测公共场所水环境中嗜肺军团菌[J]. 中国卫生检验杂志, 2014, 24(14): 1984-1986, 1990. |
| [17] |
Warren WJ, Miller RD. Growth of Legionnaires disease bacterium(Legionella pneumophila)in chemically defined medium[J]. J Clin Microbiol, 1979, 10(1): 50-55. |
| [18] |
Mauchline WS, James BW, Fitzgeorge RB, et al. Growth temperature reversibly modulates the virulence of Legionella pneumophila[J]. Infection and Immunity, 1994, 62(7): 2995-2997. |
| [19] |
Mampel J, Spirig T, Weber SS, et al. Planktonic replication is essential for biofilm formation by Legionella pneumophila in a complex medium under static and dynamic flow conditions[J]. Appl environ Microbiol, 2006, 72(4): 2885-2895. DOI:10.1128/AEM.72.4.2885-2895.2006 |
| [20] |
莫自耀, 秦建强, 赵红波, 等. 应用单一和双重荧光定量PCR法快速检测军团菌[J]. 中华生物医学工程杂志, 2011, 1: 61-65. DOI:10.3760/cma.j.issn.1674-1927.2011.01.014 |
| [21] |
Boss R, Baumgartner A, Kroos S, et al. Rapid detection of viable Legionella pneumophila in tap water by a qPCR and RT-PCR-based method[J]. J Appl Microbiol, 2018, 125(4): 1216-1225. DOI:10.1111/jam.2018.125.issue-4 |
| [22] |
Beaute J, Zucs P, De Jong B, et al. Legionnaires disease in Europe, 2009-2010[J]. Euro Surveillance, 2013, 18(10): 20417. |
| [23] |
Omiccioli E, Schiavano GF, Ceppetelli V, et al. Validation according to ISO/TS 12869:2012 of a molecular method for the isolation and quantification of Legionella spp. in water[J]. Molecular and Cellular Probes, 2015, 29(2): 86-91. DOI:10.1016/j.mcp.2014.12.004 |
| [24] |
Bonetta S, Bonetta S, Ferretti E, et al. Evaluation of Legionella pneumophila contamination in Italian hotel water systems by quantitative real-time PCR and culture methods[J]. J Appl Microbiol, 2010, 108(5): 1576-1583. DOI:10.1111/jam.2010.108.issue-5 |
| [25] |
Greenhalgh T. How to read a paper. Papers that report diagnostic or screening tests[J]. BMJ, 1997, 315(7107): 540-543. DOI:10.1136/bmj.315.7107.540 |