2. 华中农业大学农业动物遗传育种与繁殖教育部重点实验室,武汉 430070;
3. 农业农村部农业转基因生物安全评价(食用)重点实验室,北京 100083;
4. 农业农村部科技发展中心,北京 100122
2. Key Laboratory of Agricultural Animal Genetics, Breeding and Reproduction of the Ministry of education, Huazhong Agricultural University, Wuhan 430070;
3. Key Laboratory of Safety Assessment of Genetically Modified Organism(Food Safety), the Ministry of Agriculture and Rural Affairs of P.R. China, Beijing 100083;
4. Department Center for Science and Technology, the Ministry of Agriculture and Rural Affairs of P. R.China, Beijing 100122
目前待检物质种类繁多,样品复杂[1-2],针对不同待检物质的定量检测方法不一[3]。各种传统定量检测方法可以准确测定目标检测物的含量[4-5],但无法对不同种类的待检物质进行统一的检测,而功能核酸的出现与其相关技术的发展可有效的解决这一问题。功能核酸作为一类具有特定空间构象、执行特异生物功能的天然或者人工核酸序列,可以将各种待检物质统一转化为核酸信号再结合功能核酸相关检测方法进行检测。另外,还具有易于修饰、价格低廉、稳定性高、特异性强等优势。功能核酸检测技术分为靶标识别、信号转换输出两部分。信号输出的方式包括比色信号、荧光信号、电化学信号、化学发光信号、热信号和动力学信号等。
其中,荧光传感具有灵敏度高、特异性强以及可进行实时原位检测的优势,而功能核酸免标记型荧光传感技术是荧光传感中重要的一部分,该技术与非功能核酸普通荧光传感技术以及标记型荧光传感技术相比都具有诸多优势。其与非功能核酸普通荧光传感技术相比,功能核酸起到了十分重要的作用,同时,为该种技术带来诸多优势。主要体现在3个方面。一是可将多种靶物质统一转为较为稳定的核酸信号,使现有的荧光检测的可检靶物质种类增多,扩大检测范围; 二是由于功能核酸本身可扩增的性质,可以在定量检测中加入信号扩增,使得检测灵敏度以及检测效率大大增强; 三是根据不同荧光物质的特性,与不同荧光物质结合,使体系产生荧光信号的变化。另外,与标记型荧光传感技术相比,其具有免去标记过程的优势,具体来看,该技术中的荧光物质可以在检测中免去荧光标记时荧光、猝灭基团的筛选和标记过程的繁琐和成本,同时,由于其自身的特性,可以保证与核酸的特异或非特异性结合后产生荧光信号变化。这也进一步扩展荧光检测的检测范围,同时更扩大和增强了其检测灵敏度与检测效率[6-7],该技术也逐渐被广泛应用于食品安全、环境污染、疾病诊断相关多种靶标物质的检测[8]。
不同荧光物质与功能核酸形成荧光信号机制复杂,种类繁多。因此,本文首先针对几种重要荧光物质的特点以及其与多种功能核酸的分子识别、作用方式以及荧光发光机制进行详细的介绍,并据此将功能核酸荧光免标记型定量统一化检测技术分为富G功能核酸序列介导的荧光定量检测技术,单链功能核酸序列介导的荧光定量检测技术,双链功能核酸序列介导的荧光定量检测技术,适配体功能核酸序列介导的荧光定量检测技术。接着从这几个角度对功能核酸荧光免标记型定量统一化检测技术与其实际应用进行了分类介绍与评价对比,最后讨论了该技术在多种风险因子分析中的研究意义以及存在的问题,并为其未来的发展方向与应用前景作出展望。
1 功能核酸荧光免标记型定量统一化检测技术概述及其分类功能核酸荧光免标记型定量统一化检测技术的检测基础技术是荧光定量检测技术,这是一种以紫外或可见光作为激发光源,照射处于基态的分子,使其吸收能量,跃迁至激发态,进而由于激发态不稳定,激发态物质分子返回基态过程会散失部分能量,这部分能量转化为光能,这种光被称为荧光,即可用与检测的荧光信号[9-10]。荧光定量检测技术广义上是由识别部分、转化部分以及荧光输出部分构成,其检测原理是待检测物被识别部分与转化部分特异性识别、结合、相互作用并转化为可引起荧光物质敏感的信号[11],进而导致其光物理性质发生变化,主要包括荧光的增强、淬灭和光谱位移等。
通常,在荧光免标记型功能核酸介导的荧光定量检测系统的构建过程中,需要根据反应过程中产生的不同结构的功能核酸选择不同种类的荧光物质,这类荧光物质可以分为与G-四连体功能核酸结合的NMM,TPM类荧光物质、与单链功能核酸结合的SYBR Gold、SYBR Green Ⅱ类荧光物质、与双链功能核酸结合的SYBR Green Ⅰ、YOYO、TOTO类荧光物质,与适配体功能核酸结合的Malachite Green类荧光物质。这些荧光物质在生物传感过程中作为荧光探针起到可与不同结构的核酸进行识别的作用以及体系荧光信号报告等功能,再根据其荧光发光特点可以将荧光免标记型功能核酸介导的荧光生物传感技术分为富G功能核酸序列介导的荧光定量检测技术,单链功能核酸序列介导的荧光定量检测技术,双链功能核酸序列介导的荧光定量检测技术,适配体功能核酸序列介导的荧光定量检测技术等。
2 免标记荧光定量检测技术重要发光机制及其与核酸结合的典型应用 2.1 聚集诱导发光基于聚集诱导发光(Aggregation-Induced Emis-sion,AIE)的荧光分子是一类含螺旋结构的分子,具有游离状态不发荧光,聚集状态或固态发较强荧光的性质[12]。具体发光机理是当这类分子以单体游离态被激发光激发后,被激发电子不以辐射跃迁的形式,而以分子内振动旋转形式回到基态,无法释放多余能量,不产生荧光; 而当该类分子聚集时,被激发的电子无法通过分子内振动旋转释放能量回到基态,而是通过辐射方式释放多余能量,产生荧光。AIE分子由于其独特的发光体系已经成为了一种强有力的分析工具,它可以很巧妙的结合分子溶解性,应用于设计高灵敏度和高选择性的生物荧光探针和生物化学传感器的设计,与传统的荧光探针相比,AIE探针具有更优越的抗漂白能力和更高的可靠性等的特点[13]。另外,该类核酸探针不需要标记淬灭基团或者辅助基团,一条简单的免标记核酸探针便可高效地完成对目标物的检测,极大地简化了传统核酸探针的结构,降低探针的设计、合成成本及操作难度。
Zhuang和Lou等[14]设计了一种基于AIE效应的免标记核酸探针,用于检测单细胞体系和病人组织样本中端粒酶活性。无端粒酶时,端粒酶引物带有负电荷与带有正电荷的AIE分子通过静电作用力,形成复合物,此时AIE分子以分散态存在,荧光较弱; 有端粒酶时,端粒酶引物以重复片段扩增,扩增后产物可与大量AIE分子结合,形成复合物,使得AIE分子聚集,荧光信号增强。通过监测AIE分子荧光信号的变化,实现对单细胞体系和病人组织样本中的端粒酶活性检测(图 1-A)。
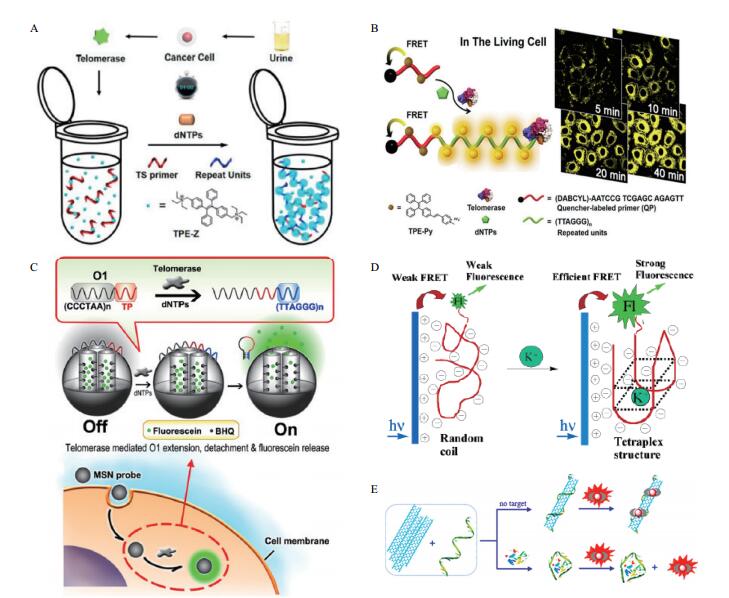
|
| 图 1 聚集诱导发光(A)荧光共振能量转移(B)静电力作用介导(C)水溶性共轭聚合物介导(D)时间分辨荧光(E)机理图 |
荧光共振能量转移原理(Fluorescence resonance energy transfer,FRET)是一种应用较为普遍的荧光发光机制,在FRET体系中含有能量供体与能量受体两个荧光基团,供体被激发光所激发后可以向受体转移能量,激发受体发出荧光[15],荧光共振能量转移机理对供体和受体的激发和发射光谱、两者间的距离和排列方式皆有一定要求[16]。
基于此原理,Zhuang等[17]利用游离的AIE荧光分子与猝灭基团之间的FRET作用,设计了检测端粒酶活性的荧光传感器。无端粒酶时,引物无法扩增,带有正电荷的AIE分子与核酸分子通过静电作用力结合,形成稳定的复合物,此时AIE分子聚集状态弱,且AIE分子与淬灭基团非常临近,AIE分子的荧光被淬灭; 有端粒酶时,引物以重复片段扩增[18],扩增片段会继续与AIE分子通过静电作用力结合,形成稳定的复合物,此时AIE分子以聚集状态存在,且远离淬灭基团,此时AIE分子发射荧光,通过监测AIE分子荧光信号变化,实现在单细胞体系中检测端粒酶活性(图 1-B)。在单细胞成像时,该研究方法大大降低了背景荧光信号干扰,增加了检测方法的可靠性。同时,该课题组[19]在端粒酶引物标记淬灭基团可降低背景荧光信号干扰的基础上,还利用最大发射波长为蓝光波段的AIE分子和红光波段的AIE分子彼此之间可产生FRET现象,实现在单细胞体系中检测端粒酶活性,大大拓宽检测范围。
2.3 静电力作用在该种机制下的荧光传感体系中,荧光物质分子与目标分子之间存在静电作用力,在这种静电作用力的介导下,靶物质信号变化可以引起荧光分子数量,状态,强弱的改变,达到检测目的。Qian等[20]以多孔硅纳米粒子(MSN)为载体,在MSN孔道内共价固定荧光淬灭剂BHQ并且填充荧光素,另外,通过静电吸附在其表面包裹含有端粒酶底物片段的DNA链,可将荧光素封堵在孔道内。在端粒酶的作用下,端粒酶引物扩增,导致探针扩增产物的两端杂交形成环状结构而脱离MSN表面,从而打开孔道,释放荧光素,此时荧光素远离淬灭剂BHQ,因此发射荧光。通过检测荧光信号变化,实现在细胞内端粒酶活性的检测(图 1-C)。
2.4 水溶性共轭聚合物发光共轭聚合物是一种由多个重复发光单元通过彼此间的共轭作用而形成的一类具有特殊光电性质的高分子化合物。共轭聚合物具有独特电子结构,每个发光单元之间通过电子离域与电子耦合使其具有分子线效应.具体来讲,当具有强光捕获能力的共轭聚合物受激发后,产生的激子可以沿着π电子骨架快速传递至能量受体,从而将环境中的微小波动转换为共轭聚合物荧光信号的变化,进而实现对被检测物的高灵敏检测[21-22]。另外,通过对其结构的精准调控,可以获得具有不同性能的功能性分子。其中,通过改变其主链结构,可以获得具有不同吸收和发射波长的荧光探针; 通过对侧链结构修饰以水溶性基团成为水溶性共轭聚合物和/或修饰选择性识别分子实现与特定靶标间的静电作用或者特异性结合,进而实现选择性识别的目的.
He等[23]将单链DNA作为识别载体,用水溶性共轭聚合物P1(图 1-D)实现在水溶液中对钾离子检测,该策略中还利用荧光共振能量转移(FRET)原理以及钾离子能够诱导单链DNA形成G-quadmplex结构的特点,当含有荧光基团标记的DNA溶液中不存在钾离子时,单链DNA呈无规则螺旋构象,空间电荷密度低。当向溶液中加入钾离子时,单链DNA会折叠呈G-quadruplex构象,此时空间电荷密度大大增加。因此,可通过静电相互作用缩短聚合物与核酸链之间的距离,使聚合物与核酸上标记的荧光团之间能够发生有效的荧光共振能量转移,从而实现对钾离子高选择性的识别,其他离子如Na、Li及NH4+等对检测基本没有干扰。
2.5 时间分辨荧光时间分辨荧光是一种特殊的荧光现象,也是一种基于分子吸收光能后以光辐射形式去活化的过程。其基本原理是Frank-Condon规则,分子中处于单线态基态电子能级S0的电子吸收一定波长的光子后,被激发至单线态激发态电子能级中的某一振动能级(一般是S1态),这一过程约10-15 s; 在经历短暂的振动弛豫(Vibration relaxation)过程后(约10-12-10-10 s)会有大量电子在S1态的最低振动能态积累。时间分辨荧光则是在最后将能量转移到镧系元素复合物的中心离子,通过其4f-4f能量跃迁而发出特定的荧光。再利用光学仪器检测荧光发射的强度随时间的变化,即可得到体系的荧光寿命信息。
一种基于镧系元素铕复合物与碳纳米管的的新型无标的时间分辨荧光传感器被设计用于溶解酶的检测。在该缓冲体系中,长为42个碱基的适配体核酸单链呈游离状态,单壁碳纳米管则呈现聚集的状态,当其与核酸适配体单链结合时被分散,通过π-π堆积相互作用,结合Eu3/BHHT复合物并猝灭其荧光; 当溶菌酶存在时,由于其核酸适配体与它的较高的亲和力和选择性,两者结合,无法在与单壁碳纳米管结合,Eu3/BHHT复合物被释放,荧光恢复。在最优的条件下,该传感器的检测限可以达到0.9 nmol/L,比普通适配体传感器检测限低60倍[24](图 1-E)。
3 功能核酸荧光免标记型定量统一化检测技术与其实际应用 3.1 富G功能核酸序列介导的荧光免标记型定量统一化检测技术G-四链体结合型荧光定量检测技术是一类选用可与G-四链体核酸结构结合的核酸荧光染料的免标记型功能核酸荧光定量检测技术。利用其进行检测时,随着目标物的加入,核酸发生G-四链体结构化或去结构化的改变,影响核酸染料与核酸结合,从而引起荧光信号发生变化。该类核酸荧光染料通常是核酸嵌入型染料或纳米簇等,主要包括三苯甲烷类染料(TPM)[25]、N-甲基卟啉二丙酸IX(NMM)[26]、styryl quinolinium(SQ)[27]、PPIX[28]等。目前将荧光染料与G-四链体相结合的荧光定量检测技术已被广泛应用。
Guo[29]和Lu等[30]设计了两种基于G-四链体能够极大提高TPM染料和SQ染料荧光强度的分别用于检测银离子与半胱氨酸的功能核酸荧光传感器。其检测机理是自由态的TPM染料和SQ染料发出极其微弱的荧光而结合G-四链体后荧光强度大大增强,但是,当加入银离子后,由于鸟嘌呤的作用,将会破坏G-四链体与荧光染料的配合物结构,从而导致荧光下降; 而半胱氨酸(Cys)能与银离子作用,因而加入Cys时,银离子被Cys从富G寡核苷酸链置换出来,G-四链体重新形成,TPM或SQ染料荧光强度恢复,通过这种银离子与半胱氨酸的交替加入实现对G-四链体的破坏与荧光强度的改变,进而达到双重检测的目的(图 2-A)。Guo等设计了一条32个碱基一条24个碱基的核酸单链探针,加完样品后需要将体系混合30 min后进行激发波长为605 nm,发射波长为680 nm的荧光检测,实验中银离子检测的线性范围为0.5-13 nmol/L,检测限可达到80 nmol/L。Lu等设计的核酸序列长度为28个碱基序列,与SQ染料呈现较好的荧光增强效果。
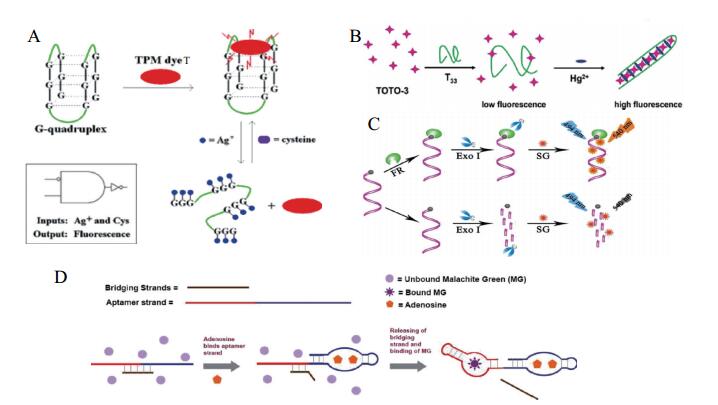
|
| 图 2 免标记型功能核酸介导的荧光定量检测技术原理图 |
另外,部分G-四链体功能核酸的形成需要金属离子的诱导,金属离子诱导G-四链体功能核酸结合型荧光定量检测技术主要分为两类,一类借助金属离子诱导核酸单链形成G-四链体,进而与核酸荧光染料结合引起荧光信号增强或金属离子与核酸染料竞争结合G-四链体,破坏原染料与G-四链体结合状态,引起荧光信号减弱的免标记型功能核酸荧光定量检测技术。该类荧光传感器较为巧妙的应用于金属离子检测,其中G-四链体也是金属离子的特异性配体。该类核酸荧光染料主要包括硫磺素T[31](Thioflavin T),噻唑橙(TO)等。
TO单体时荧光强度较低,可与锌离子诱导G-四链体配合物结合,荧光增强。利用该种染料可设计另一类金属离子诱导G4结合型荧光定量检测技术,即借助金属离子诱导核酸单链形成G-四链体,进而与核酸荧光染料结合引起荧光信号增强的荧光传感器。2015年,Guo[32]和他的团队设计了一种针对锌离子检测的免标记荧光定量检测技术,其检测限可达0.71 μmol/L,在0-30 μmol/L,呈线性相关。该传感器设计时,噻唑橙作为荧光探针,这段探针是一段含有20左右个碱基的核酸序列,检测环境为10 mmol/L Tris-HCl缓冲液(pH 7.5),室温检测,TO可与锌离子诱导形成的G-四链体进行结合,而氧化石墨烯则用于减弱噻唑橙/功能核酸检测系统的荧光背景。当锌离子不存在时,单链适配体被氧化石墨烯所吸附,体系呈低荧光状态; 然而当锌离子存在时,锌离子诱导核酸单链形成G-四链体,并使其与氧化石墨烯分离,TO进而与锌离子诱导形成的G-四链体结合,荧光强度显著增强。
3.2 单链功能核酸序列介导的荧光免标记型定量统一化检测技术单链核酸荧光染料结合型荧光定量检测技术是一类基于可与单链核酸结合的荧光染料的免标记型功能核酸荧光定量检测技术。其基本原理是当核酸分子构型为非单链构型时,荧光染料成游离状态,荧光较弱; 反之,变为单链结构时,荧光染料分子与单链核酸结合,荧光强度大大增强。可用于特异性的检测可与单链核酸的形成有关的目标靶物质。该类核酸荧光染料通常是核酸嵌入型染料,主要包括SYBR Gold[33]、SYBR Green Ⅱ[34]等。
SYBR Gold、SYBR Green Ⅱ属于1995年由Molecular probes公司推出的SYBR系列荧光染料。SYBR系列荧光染料本质是一种非对称花菁类化合物,与核酸具有极高亲和力,同时具有高灵敏度的特性,自推出后在国内外实验中被受推崇并已很大程度的商业化。SYBR Gold、SYBR Green Ⅱ主要在核酸检测中作为核酸凝胶染色试剂,用于RNA或DNA单链的染色,SYBR Green Ⅱ其在紫外激发光激发下发出亮绿色,SYBR Gold发出显眼的亮金黄色。其单体在水溶液中的荧光强度很弱,但是当与单链核苷酸相互作用时,可观察到明显增强的荧光信号。具有高灵敏性、信噪比高、使用方便、成本低等优点。
Xu等[35]报道了一种针对叶酸受体蛋白的荧光传感器,该传感器基于叶酸受体蛋白对核酸链的保护作用和SYBR Gold可结合单链的特点进行设计,设计了一条含有27个碱基的3'末端标记叶酸的单链DNA,检测条件为50 μL,20 mmol/L Tris-HCl,3 mmol/L MgCl2,50 mmol/L NaCl(pH 7.5),加入Exo Ⅰ酶后作用25 min,室温。没有目标待测物时,Exo Ⅰ会将核酸单链切割,SG染料不与单个碱基结合,荧光强度较弱; 当目标蛋白加入时,与叶酸结合,叶酸蛋白与叶酸的结合物可保护核酸单链不被ExoⅠ所切割,保持单链状态,进而结合荧光染料,使体系荧光信号增强,检测限可以达到30 pmol/L,荧光激发波长为494 nm,发射波长为500-600 nm(图 2-C)。
3.3 双链功能核酸序列介导的荧光免标记型定量统一化检测技术双链结合型荧光定量检测技术是一类基于可与双链核酸结合的荧光染料的免标记型功能核酸荧光定量检测技术。其基本原理是当核酸分子构型为非双链构型时,荧光染料成游离状态,荧光较弱; 反之,变为双链结构时,荧光染料分子与核酸结合,荧光程度增强,用于特异性的检测可与双链核酸的形成与稳定有关的目标靶物质。该类核酸荧光染料通常是核酸嵌入型染料,主要包括SYBR Green Ⅰ[36-37]、YOYO[38]、TOTO等。
TOTO-3样是一种游离态荧光较弱,而结合双链核酸后荧光显著增强的核酸嵌入型荧光染料。结合信号放大与荧光传感理论,该种荧光染料较为广泛的应用于双链核酸相关的靶标物质检测中。Chiang等[39]设计了一种汞离子免标记功能核酸荧光检测技术,基于富含T碱基(33个碱基)核酸单链/TOTO-3荧光探针,检测环境为5 mmol/L Tris-HCl(pH 7.4),当无汞离子存在时由于富T探针序列单链游离状态,TOTO-3呈现很微弱荧光; 当向体系加入汞离子后,T- Hg2+-T错配诱导富T探针序列分子内折叠形成双链,此时,TOTO-3与双链探针结合,荧光强度显著增加(大于265倍)。该方法可在15 min内完成检测,灵敏度0.6 ppb,并且荧光强度与汞离子浓度在一定范围内呈线性相关。因此,可以在一定程度上实现离子浓度监控,荧光激发波长为620 nm,发射波长为660 nm(图 2-B)。
3.4 适配体功能核酸序列介导的荧光免标记型定量统一化检测技术适配体荧光染料结合型荧光定量检测技术是一类基于可与特定序列结合的荧光染料的免标记型功能核酸荧光定量检测技术。其基本原理是当核酸分子为普通序列时,荧光染料成游离状态,荧光较弱; 而当核酸链序列是核酸染料的适体序列时,荧光染料分子将与单链核酸结合,荧光强度大大增强,可用于特异性的检测与特定序列的产生有关的目标靶物质。该类核酸荧光染料主要包括Malachite Green、Mango等。
Xu等[40]设计了一种针对腺苷检测的无标记的荧光传感器,它利用Malachite Green与特定的DNA序列结合,产生强烈的荧光信号的原理,首先设计了一条包含有腺苷的DNA适体序列(蓝色部分)和Malachite Green的RNA适体序列(红色部分)的“适体链”,两段适配体序列的碱基数都为27个,另一条是被称“桥接链”的含有对“适体链”中腺苷和Malachite Green二者的互补序列DNA链(棕色部分),桥连链由11-16个不等的碱基组成,该检测体系为22 mmol/L Tris缓冲液(5.56 mmol/L NaCl,155.6 mmol/L KCl,5.56 MgCl2)。“桥接链”的作用是:没有腺苷存在时,在室温的缓冲液中,适体和桥接链形成稳定的络合物,以防止Malachite Green适体链与Malachite Green结合产生强烈的荧光信号。此时,被保留在溶液中的游离Malachite Green几乎没有荧光信号。当腺苷的存在时,适体链与腺苷结合,留下的适体链与桥接链之间碱基互补的数量减少,此时在室温下是不太稳定,从而导致释放出桥接链。最后,Malachite Green与其适体链相结合,荧光信号明显增强(图 2-D),该检测中荧光激发波长为615 nm,发射波长为650 nm。
4 总结与展望功能核酸荧光免标记型定量统一化检测技术由于高灵敏度、高选择性、高响应速度等优点获得迅猛发展,在化学、生命科学和环境科学等多方面具有重要的科学意义。但是就目前的研究来说仍存在一些不足,如目前的功能核酸免标型荧光传感相关研究主要集中在一些常见物质的检测,一些传感策略只能实现在特定环境中对待特定测物检测等,没有做到完全的筛查和普及; 部分荧光传感系统的背景荧光较高,干扰检测结果。另外,现在研究的生物传感器有诸多停留在实验理论阶段,真正的商业化还需要进一步完善性能。因此,不断探索更多、更新的型荧光物质与功能核酸的作用方式,提出新的传感思路是将传感检测的特异性与灵敏度提高的有力方式,同时也是传感技术发展的重要趋势。同时还应在诸多方面进行改进与提高,如针对更多更广的风险因子开发更多的功能核酸荧光免标记型定量统一化检测技术,不断拓展检测范围; 在功能核酸荧光免标记型定量统一化检测技术涉及的分子识别方式、核酸扩增技术以及荧光信号输出机制方面进行不断的探索和优化,降低检测系统的背景干扰,优化性能。另外,开发高灵敏、高特异性、重复性好、便携式的实时定量原位检测的生物传感器以及设计多种风险因子可同时检测的高通量功能核酸荧光免标记型定量统一化检测技术也是其另一个重要的发展趋势。
| [1] |
Wan Z, Xu Z, Wang J. Flow injection on-line solid phase extraction for ultra-trace lead screening with hydride generation atomic fluorescence spectrometry[J]. Analyst, 2006, 131(1): 141-147. DOI:10.1039/B511829H |
| [2] |
Schmittmann O, Schulze Lammers P. A true-color sensor and suitable evaluation algorithm for plant recognition[J]. Sensors, 2017, 17(8): 1823. DOI:10.3390/s17081823 |
| [3] |
Fresenius W. One hundred and forty years"Fresenius' Journal of Analytical Chemistry"[J]. Fresenius' Journal of Analytical Chemistry, 2001, 371(8): 1041-1042. DOI:10.1007/s00216-001-1108-7 |
| [4] |
Cocherie A, Robert M. Direct measurement of lead isotope ratios in low concentration environmental samples by MC-ICP-MS and multi-ion counting[J]. Chemical Geology, 2007, 243(1): 90-104. |
| [5] |
Golge O, Hepsag F, Kabak B. Determination of aflatoxins in walnut sujuk and Turkish delight by HPLC-FLD method[J]. Food Control, 2016, 59: 731-736. DOI:10.1016/j.foodcont.2015.06.035 |
| [6] |
Alsaafin A, Mckeague M. Functional nucleic acids as in vivo metabolite and ion biosensors[J]. Biosens Bioelectron, 2017, 94: 94-106. DOI:10.1016/j.bios.2017.02.030 |
| [7] |
Du Y, Dong S. Nucleic Acid Biosensors:Recent Advances and Perspectives[J]. Analytical Chemistry, 2017, 89(1): 189-215. DOI:10.1021/acs.analchem.6b04190 |
| [8] |
Liu J, Cao Z, Lu Y. Functional nucleic acid sensors[J]. Chemical Reviews, 2009, 109(5): 1948-1998. DOI:10.1021/cr030183i |
| [9] |
Zhang H, Zhang H, Aldalbahi A, et al. Fluorescent biosensors enabled by graphene and graphene oxide[J]. Biosensors and Bioelectronics, 2017, 89: 96-106. DOI:10.1016/j.bios.2016.07.030 |
| [10] |
Asnaashari M, Kenari RE, Farahmandfar R, et al. Fluorescence quenching biosensor for acrylamide detection in food products based on double-stranded DNA and gold nanoparticles[J]. Sensors & Actuators B Chemical, 2018, 265: 339-345. |
| [11] |
Prodi L, Bolletta F, Montalti M, et al. Luminescent chemosensors for transition metal ions[J]. Coordination Chemistry Reviews, 2000, 205(1): 59-83. DOI:10.1016/S0010-8545(00)00242-3 |
| [12] |
Wang X, Song P, Lu P, et al. Aggregation-induced emission luminogen-embedded silica nanoparticles containing DNA aptamers for targeted cell imaging[J]. Acs Applied Materials & Interfaces, 2016, 8(1): 609. |
| [13] |
Tyagi A, Chu KL, Abidi IH, et al. Single-probe multistate detection of DNA via aggregation-induced emission on a graphene oxide platform[J]. Acta Biomaterialia, 2016, 50(334): 334-343. |
| [14] |
Zhuang Y, Zhang M, Chen B, et al. Quencher group induced high specificity detection of telomerase in clear and bloody urines by AIEgens[J]. Analytical Chemistry, 2015, 87(18): 9487-9493. DOI:10.1021/acs.analchem.5b02699 |
| [15] |
Selvin PR. Fluorescence resonance energy transfer[J]. Current Opinion in Biotechnology, 1995, 6(1): 103-110. DOI:10.1016/0958-1669(95)80016-6 |
| [16] |
Nakayama H, Arakaki A, Maruyama K, et al. Single-nucleotide polymorphism analysis using fluorescence resonance energy transfer between DNA-labeling fluorophore, fluorescein isothiocyanate, and DNA intercalator, POPO-3, on bacterial magnetic particles[J]. Biotechnology & Bioengineering, 2003, 84(1): 96-102. |
| [17] |
Zhuang Y, Huang F, Xu Q, et al. Facile, fast-responsive, and photo-stable imaging of telomerase activity in living cells with a fluores-cence turn-on manner[J]. Analytical Chemistry, 2016, 88(6): 3289-3294. DOI:10.1021/acs.analchem.5b04756 |
| [18] |
Zhang X, Lou X, Xia F. Advances in the detection of telomerase activity using isothermal amplification[J]. Theranostics, 2017, 7(7): 1847-1862. DOI:10.7150/thno.18930 |
| [19] |
Zhuang Y, Shang C, Lou X, et al. Construction of AIEgens-based bioprobe with two fluorescent signals for enhanced monitor of extracellular and intracellular telomerase activity[J]. Analytical Chemistry, 2017, 89(3): 2073. DOI:10.1021/acs.analchem.6b04696 |
| [20] |
Ruocan Q, Lin D, Huangxian J. Switchable fluorescent imaging of intracellular telomerase activity using telomerase-responsive mesoporous silica nanoparticle[J]. Journal of the American Chemical Society, 2013, 135(36): 13282-13285. DOI:10.1021/ja406532e |
| [21] |
Swager TM. The molecular wire approach to sensory signal amplification[J]. Accounts of Chemical Research, 1998, 31(5): 201-207. DOI:10.1021/ar9600502 |
| [22] |
Thomas SW, Joly GD, Swager TM. Chemical sensors based on amplifying fluorescent conjugated polymers[J]. Chemical reviews, 2007, 107(4): 1339-1386. DOI:10.1021/cr0501339 |
| [23] |
He F, Tang Y, Wang S, et al. Fluorescent amplifying recognition for DNA G-quadruplex folding with a cationic conjugated polymer:a platform for homogeneous potassium detection[J]. Journal of the American Chemical Society, 2005, 127(35): 12343-12346. DOI:10.1021/ja051507i |
| [24] |
Ouyang X, Yu R, Jin J, et al. New strategy for label-free and time-resolved luminescent assay of protein:conjugate Eu3+ complex and aptamer-wrapped carbon nanotubes[J]. Analytical Chemistry, 2011, 83(3): 782-789. DOI:10.1021/ac103087z |
| [25] |
Chu JF, Chang TC, Li HW. Single-molecule TPM studies on the conversion of human telomeric DNA[J]. Biophysical Journal, 2010, 98(8): 1608-1616. DOI:10.1016/j.bpj.2009.12.4328 |
| [26] |
Xu S, Zhang Y, Luo X, et al. Fluorescent G-quadruplex-NMM DNA probe for the detection of silver nanoparticles in aqueous media[J]. Analytical Methods, 2015, 7(5): 1672-1675. DOI:10.1039/C4AY03062A |
| [27] |
Wang Q, Liu C, Chang J, et al. Novel water soluble styrylquinoli-nium boronic acid as a ratiometric reagent for the rapid detection of hypochlorite ion[J]. Dyes & Pigments, 2013, 99(3): 733-739. |
| [28] |
Andreas Leunig MD, Betz CS, Mehlmann M, et al. Detection of squamous cell carcinoma of the oral cavity by imaging 5-aminolev-ulinic acid-Induced protoporphyrin Ⅸ fluorescence[J]. Laryn-goscope, 2000, 110(1): 78-83. |
| [29] |
Guo JH, Kong DM, Shen HX. Design of a fluorescent DNA IMPLICATION logic gate and detection of Ag+ and cysteine with triphenylmethane dye/G-quadruplex complexes[J]. Biosensors and bioelectronics, 2010, 26(2): 327-332. DOI:10.1016/j.bios.2010.08.020 |
| [30] |
Lu YJ, Ma N, Li Y, et al. Styryl quinolinium/G-quadruplex complex for dual-channel fluorescent sensing of Ag+ and cysteine[J]. Sensors and Actuators B:Chemical, 2012, 173: 295-299. DOI:10.1016/j.snb.2012.07.007 |
| [31] |
Chen J, Lin J, Zhang X, et al. Label-free fluorescent biosensor based on the target recycling and Thioflavin T-induced quadruplex formation for short DNA species of c-erbB-2 detection[J]. Anal Chim Acta, 2014, 817(817): 42-47. |
| [32] |
Guo Y, Sun Y, Shen X, et al. Quantification of Zn(Ⅱ)using a label-free sensor based on graphene oxide and G-quadruplex[J]. Analytical Methods, 2015, 7(22): 9615-9618. DOI:10.1039/C5AY01840D |
| [33] |
Oba S, Hatakeyama M, Handa H, et al. Development of polymer latex particles for selective cleavage of mismatched DNA and their application for DNA diagnosis[J]. Bioconjugate Chemistry, 2005, 16(3): 551-558. DOI:10.1021/bc049728l |
| [34] |
Berdalet E, Roldán C, Olivar MP. Quantifying RNA and DNA in planktonic organisms with SYBR Green Ⅱ and nucleases:Part B. Quantification in natural samples[J]. Scientia Marina, 2005, 69(1): 17-30. DOI:10.3989/scimar.2005.69n1 |
| [35] |
Xu Y, Jiang B, Xie J, et al. Terminal protection of small molecule-linked ssDNA for label-free and sensitive fluorescent detection of folate receptor[J]. Talanta, 2014, 128: 237-241. DOI:10.1016/j.talanta.2014.05.009 |
| [36] |
De MD, Croci L, Delibato E, et al. Evaluation of DNA extraction methods for use in combination with SYBR green Ⅰ real-time PCR to detect Salmonella enterica serotype enteritidis in poultry[J]. Applied & Environmental Microbiology, 2003, 69(6): 3456-3461. |
| [37] |
Karlsen F, Steen HB, Nesland JM. SYBR Green Ⅰ DNA staining increases the detection sensitivity of viruses by polymerase chain reaction[J]. Journal of Virological Methods, 1995, 55(1): 153-156. DOI:10.1016/0166-0934(95)00053-W |
| [38] |
Figeys D, Arriaga E, Renborg A, et al. Use of the fluorescent inter-calating dyes POPO-3, YOYO-3 and YOYO-1 for ultrasensitive detection of double-stranded DNA separated by capillary electroph-oresis with hydroxypropylmethyl cellulose and non-cross-linked polyacrylamide[J]. J Chromatogr A, 1994, 669(1-2): 205-216. DOI:10.1016/0021-9673(94)80349-8 |
| [39] |
Chiang CK, Huang CC, Liu CW, et al. Oligonucleotide-based fluorescence probe for sensitive and selective detection of mercury(Ⅱ)in aqueous solution[J]. Anal Chem, 2008, 80(10): 3716-3721. DOI:10.1021/ac800142k |
| [40] |
Xu W, Lu Y. Label-free fluorescent aptamer sensor based on regulation of malachite green fluorescence[J]. Anal Chem, 2009, 82(2): 574-578. |




