2. 中国农业大学食品科学与营养工程学院,北京 100083
2. College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083
随着工业化和城市化的快速发展,空气、水、土壤和食物中重金属的含量,尤其是毒性很大的铅离子的含量越来越高,它能够随着空气、水和食物通过呼吸系统和消化系统进入到人体当中[1]。铅离子是许多酶类的辅助因子,对人体健康也十分重要[2],然而,当血铅浓度高于0.48 nmol/L就可能对身体产生危害[3]。因为铅离子难以被人体利用,随着多余的铅离子在体内富集,体内越来越高的铅浓度将对人体健康产生极为不利的影响,如高血压、神经紊乱和肌肉麻痹等,随之神经、生殖和消化等系统均会出现不良症状[4]。正处于生长发育关键期的儿童更容易受到铅离子的毒害,即使更低水平的血铅浓度都能够延缓儿童的智力发育[5]。铅离子污染对环境和人体健康危害都是十分巨大的[6],为此世界卫生组织(WHO)还设定了铅离子的准则值为0.01 mg/L[7],但世界上还有很多地区仍难以达到铅离子的安全浓度范围[8]。我国对于饮用水含Pb2+的规定是0.05 mg/L。铅离子检测的传统方法主要有原子吸收光谱法(AAS)[9],原子发射光谱法(AES)[10],电感耦合等离子体光谱法(ICP-MS)[11],X-ray射线荧光光谱法(R-FS)[12]及离子色谱法(IC)[13]。尽管这些方法准确度和精度高,但它们需要特定的实验室、复杂昂贵的设备、耗时的前处理和专业技术人员的操作,从而很大程度地限制了其应用,尤其是现场检测、即时检测和快速检测[14]。
20世纪60年代发展起来的电化学法,在检测重金属铅离子上具有成本低、选择性好、灵敏度高、操作方便等优势,能实现现场在线检测[15],并且可以检测复杂样品中铅离子的含量[16]。电化学传感器常用的工作电极有碳基电极、汞基电极、金电极、铋电极等。因汞电极具有毒性并污染环境,已禁止使用。金和铂等金属电极因成本较高,耐腐蚀性较差且易于与待测金属形成金属间化合物导致电极的电化学反应动力学和电子导电性能变差[17],使其应用受到很大的限制。而碳基电极具有电化学窗口宽、易于修饰和机械硬度高等优点,已逐步成为电化学法检测铅离子最常用的基底电极。但是裸碳基电极表面易被污染,检测的灵敏度和准确度都会有不同程度地降低。因此,限制了裸碳基电极检测铅离子的实际应用。对电极表面进行修饰,不仅可以增加铅离子氧化反应的电信号,而且可以拓宽检测的线性范围及检出限。目前,已报道的碳基电极修饰材料有金属、金属氧化物、碳纳米材料和二氧化硅等无机纳米材料,有机小分子和聚合物等有机材料,以及脱氧核酶和G-四联体等功能核酸物质。本文对以碳基电极为工作电极的电化学传感器的研究进展进行了综述,并对以后的发展方向和应用前景作出展望。
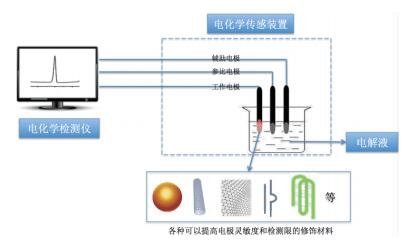
1 铅离子检测的电化学法检测铅离子的电化学法主要是依据其电化学的性质,通过测量溶液中电信号(如电阻、电导、电位和电流等)的改变来确定参与化学反应的铅离子含量而建立起来的一类分析方法。电化学法检测铅离子的原理如图 1所示,整个传感器包括两个部分,分别是电化学传感装置和电信号输出装置。电化学传感装置由工作电极(WE)、参比电极(RE)和辅助电极(CE)组成。工作电极是电化学反应发生的场所,也是电化学研究的主要对象。工作电极的材料构成,其表面积、表面状态以及形态等对电化学反应的影响极大,是整个电化学检测的关键因素。因此,选择合适的工作电极对电化学检测具有重要意义。可以通过对工作电极的表面进行不同种类的材料修饰,以实现高选择性和高灵敏度地检测痕量铅离子。
|
| 图 1 碳基电极电化学传感器示意图 |
电化学检测铅离子主要包括以下两个过程,第一步是铅离子富集的过程,Pb2+在负电势的法拉第作用(Faraday’s reaction)下被还原为Pb0或者与适配体结合形成Pb0的复合物,并聚集在工作电极的表面,通过阳极溶出伏安法(Anodic stripping voltammetric,ASV)或其他电化学检测方法检测到相关的电信号; 第二步是铅离子溶出的过程,在去掉电极电势后,Pb0再氧化成为Pb2+,得到一个高的溶出电流峰[18],溶出过程形成的峰电流与Pb2+浓度成正比,且信号呈峰形,便于测量。该方法将有效地预富集步骤与先进的电化学测量两个过程有机地结合在一起,从而实现Pb2+的灵敏检测且优势明显,能够实现在线识别和高灵敏度地检测铅离子,逐渐成为一种重要的Pb2+检测方法。
目前,常用的电化学方法有电位分析法、电导分析法、安培分析法以及伏安法。其中,伏安法是检测铅离子的最常用的电化学方法。伏安法包括循环伏安法(CV),方波伏安法(SWV)、线性扫描伏安法(LSV)和差分脉冲伏安法(DPV)。SWV和DPV通过增加法拉第电流和非法拉第电流的比率,克服了毛细管噪音,增加了伏安流量的灵敏度,因此可以检测到更低的铅离子浓度,且适于不同的电极材料和电解液,所以在实际检测中,它们是更佳的选择。
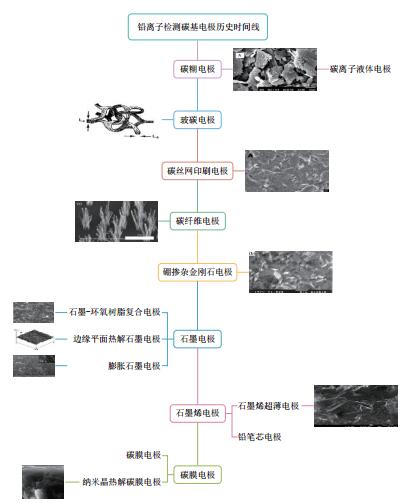
2 碳基电极研究进展在检测铅离子的电化学传感器中,基底电极的材料是至关重要的,只有选用合适的电极材料才能达到想要的检测灵敏度和可重复性。事实上,电极材料的几何结构和表面特性,决定了电极的反应和溶出过程的效率。对于一个绿色可持续及高效检测痕量铅离子的电化学传感器来说,理想的基底电极应该具有以下特征:非毒性、便宜、易操作、电位窗口大、背景电流和阻抗低、可重复使用、稳定性高以及良好的检测性能。碳基材料符合以上要求,以sp2杂化碳为主体的石墨、玻碳、碳粉、碳纤维和sp3为主体的金刚石等各种碳材料是电化学研究中最为常用的基础电极材料[19],它们制作的电极具有较高的化学惰性、导电性好、背景电流小、电化学窗口宽等优点。
检测铅离子的碳基电极研究进展如图 2所示。自20世纪50、60年代发明了碳糊电极(CPE)[20]和玻碳电极(GCE)[21]以来,以碳基为基础电极进行铅离子的检测受到广大电分析化学工作的青睐,先后出现了碳丝网印刷电极[22]、碳纤维电极[23]、碳离子液体电极[24]、硼掺杂金刚石电极[25]、石墨电极[26-28]、石墨烯电极[29-30]和碳膜电极[31-32]等。然而,碳丝网电极含有的有机溶剂会导致石墨缺陷,并且电极的重现性较差,灵敏度不高; 碳纤维、石墨、石墨烯和碳膜等电极却因为表面易吸附电化学中间体和产物而被污染,需经常对电极进行抛光处理; 硼掺杂金刚石电极存在着电催化活性低,表面再造等问题,对一些多种电化学活性物质共存体系进行检测时,选择性和灵敏性均较差。
CPE是利用具有导电性的石墨粉与疏水性的黏合剂混合制成的糊状物,然后将其涂在电极棒上或填充在电极管中而制成的一类电极,碳离子液体电极则是用导电的离子液体替换疏水性的黏合剂而制备的新型碳糊电极。这类电极可以根据使用者的需求制成,且电位窗口宽,表面易于更新,使用寿命长及成本低廉。GCE具有无毒、导电性强、可重复使用、表面易于修饰以及较高的稳定性等优点。从文献数量分析,CPE和GCE是目前检测铅离子电化学传感器中最常见的、使用最广泛的碳基电极。
3 基于碳基电极电化学传感器的研究进展为提高碳基电极检测铅离子的分析性能和机械稳定性,减少表面活性物质吸附在电极表面导致电极钝化,需要对电极表面进行修饰(CME)。从无机、有机和功能核酸等修饰电极的材料着手,总结分析了现阶段铅离子电化学传感器的研究进展。
3.1 无机纳米材料修饰的电化学传感器无机纳米材料中的金属、金属氧化物、碳纳米材料和二氧化硅等由于具有化学稳定性、热稳定性、高的表面反应活性、催化效率、大的比表面积及很强的吸附能力等优点[35],常作为碳基电极的修饰材料,用于构建电化学传感器。
3.1.1 金属纳米材料金、银、铋、汞等金属纳米材料具有独特的光电学和催化性能,常用于对碳基电极进行修饰。自19世纪20年代初Heyrovsky发现极谱法检测重金属以来,汞修饰的电极起到关键的作用[36],但汞元素对环境产生污染,已经被很多国家和地区限制使用。因此,环境友好型的、绿色低毒的电极修饰材料在电分析化学领域中受到更广泛的关注,如金[37]、银[38]、铋[39]等金属,它们具有化学惰性、高导电性以及生物适配性等性质,在制成纳米材料后,利用率得到了巨大的提高。
自2000年Wang和他的团队[39]首次发现了铋膜具有与汞膜类似的效果以来,因其毒性低、环境友好、灵敏度高、易于修饰、线性范围宽、可实现阳极溶出伏安法测定痕量铅离子,业已替代传统的汞电极。Zhou等[40]采用恒电流电解法成功地在玻碳电极表面修饰了多孔结构的树状铋膜,以方波溶出伏安法(SWSV)检测Pb2+的线性范围为5-50 μg/L。
3.1.2 金属氧化物纳米材料金属氧化物纳米粒子具有较强的电子转移反应动力以及较大的比表面积,它们在电极表面有更多的吸附位点能够吸附更多的被测铅离子,它们还具有优良的纳米形态学、生物相容性、高的催化性及无毒等优点,因此,它们常用于检测铅离子的电极修饰。这类金属氧化物主要有Fe3O4[41]、TiO2[42]、MgO[43]与Cu2O[44]等。此外,双金属氧化物由于具有协同作用,良好的富集与溶出金属离子的能力,受到越来越多的关注。Li等[45]用铈-锆氧化物标记的纳米微球对玻碳电极进行修饰,并对铅离子进行检测,最低检出限达到0.006 μmol/L,线性范围为0.02-0.5 μmol/L。该电极对Hg(Ⅱ),Cd(Ⅱ),Cu(Ⅱ)和Zn(Ⅱ)的抗干扰能力比较强,重现性和稳定性均较高。
3.1.3 碳纳米材料碳纳米材料,如碳纳米粒子,碳纳米管(CNTs)、富勒烯和石墨烯(GR)等,具有化学惰性,表面不易被氧化,氢超电位高,背景电流小,且导电性能好,价格便宜,这使得它们成为检测重金属铅离子的理想修饰材料。
3.1.3.1 碳量子点碳量子点(CQD)是一类粒径小于10 nm的,由分散的准球形颗粒组成,是一种新型的发光材料[46],由于其具有可调节发光特性、光稳定性、良好的溶解性、生物相容性、易被官能化等特点而受到广泛关注。CQD表面有大量的含氧基团[47],能够与铅离子结合,而其荧光性质则可用于构建铅离子检测传感器。然而,CQD的电化学性能与光致发光性能相比,由于其导电性低、层叠结构多,因此需要与碳纳米管、氧化石墨烯等结合形成复合修饰材料。Li等[48]构建了氮掺杂碳量子点氧化石墨烯(NCQD-GO)阳极溶出伏安法测定铅离子的新型电化学传感器,铅离子检测的线性范围为20.72-10360 μg/L,最低检测限为1.17 μg/L。
3.1.3.2 碳纳米颗粒碳纳米颗粒(CNPs)的粒径大于10 nm,由非晶态和纳米晶核组成,具有广泛的、有吸引力的生物学特性,如低毒性、良好的生物相容性,高电导率以及比表面积大等,这使得CNPs可用于铅离子的检测。Simpson等[49]用CNPs修饰玻碳电极并用于铅离子的检测,检测限为0.3 ppm,线性范围为0.5-5 ppm。
3.1.3.3 碳纳米管自1991年Iijima[50]偶然发现碳纳米管(CNTs)以来,碳纳米管成为电化学中最常用的修饰材料之一。CNTs虽然化学组成简单并以原子结合形态呈现,却可以展现出复杂多变的结构及相关的物理、化学性能,不但耐热、耐腐蚀及导电性好,而且还具有小尺寸、表面效应和空间量子隧道效应、良好的电学特性和大的比表面积等。此外,铅离子检测的选择性和灵敏度可以通过CNTs的功能化得到加强。Afkhami等[33]用新合成的席夫碱与多壁碳纳米管修饰碳糊电极,最低检测限为0.25 ng/L,线性范围为1.0-1 100 ng/L。多壁碳纳米管提高了电极检测的灵敏度和稳定性,席夫碱能够提高电极检测的选择性和灵敏度。因此,CNTs在构建铅离子检测电化学传感器中具有广阔的应用前景。
3.1.3.4 石墨烯石墨烯由碳原子以sp2杂化连接的单原子层构成,具有热导率高、机械性能强、韧性好、表面积大和电子传输性能优异等特点[51],已被广泛用于重金属铅离子的检测[52]。为了进一步提高石墨烯的选择性和灵敏度,可对其进行强酸或氧化剂进行处理,引入羧酸和羟基基团并进一步共价连接其他功能分子或能够识别铅离子的基团,如石墨烯-金属纳米复合修饰材料[53]、石墨烯-金属氧化物复合修饰材料[54]、石墨烯-聚合物复合修饰材料[55]和石墨烯-生物分子复合修饰材料[56]。
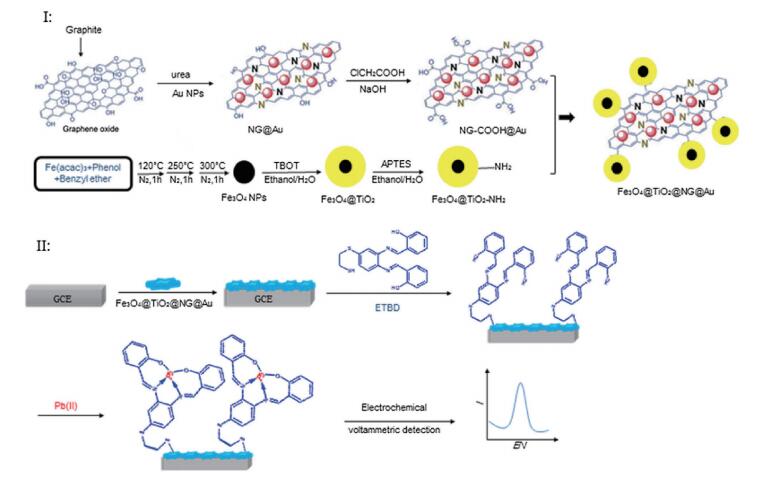
Liu等[54]采用自组装的方式构建了以氮掺杂的石墨烯为基底的Fe3O4@TiO2@NG@Au@ETBD纳米复合修饰材料,其修饰的GCE检测Pb2+的线性范围为4×10-13-2×10-8 mol/L,检出限为7.5×10-13 mol/L,如图 3所示。Fe3O4@TiO2提升了电子迁移率、化学稳定性以及Pb2+的吸附能力; 氮掺杂的石墨烯作为基底材料提供了Fe3O4@TiO2和金纳米颗粒的结合位点,并增强电信号; 金纳米颗粒可以通过金硫键连接无机的纳米材料和有机化合物(ETBD),ETBD能够与大量的Pb2+结合形成[Pb(Ⅱ)-ETBD]n+,从而实现Pb2+的特异性检测。
|
| 图 3 Ⅰ:Fe3O4@TiO2@NG@Au纳米复合材料的构建过程;Ⅱ:采用Fe3O4@TiO2@NG@Au纳米复合材料修饰的GCE对Pb(Ⅱ)进行检测示意图 |
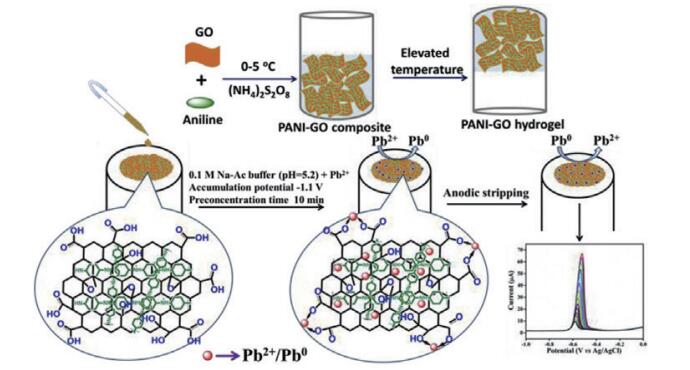
Muralikrishna等[55]构建了氧化石墨烯与聚苯胺水凝胶修饰GCE检测铅离子的电化学传感器,以方波阳极溶出伏安法检测Pb2+的线性范围为0.2-250 nmol/L和250-3 500 nmol/L,该传感器重现性和可再生性较好,检测结果可以达到原子吸收光谱法的水平(图 4)。Xue等[56]在结合了血红素的石墨烯片上修饰了花状的MnO2和珠状金纳米颗粒官能团,并融入了特异性检测Pb2+的单链DNA,作为电活性探针与电催化剂实现了检测Pb2+的电信号放大。该传感器检出限为0.1 pmol/L-200 nmol/L,最低检出限为0.034 pmol/L,灵敏性和特异性均较高(图 5)。
|
| 图 4 聚苯胺与氧化石墨烯水凝胶化合物的合成及其修饰的GCE检测Pb2+示意图 |
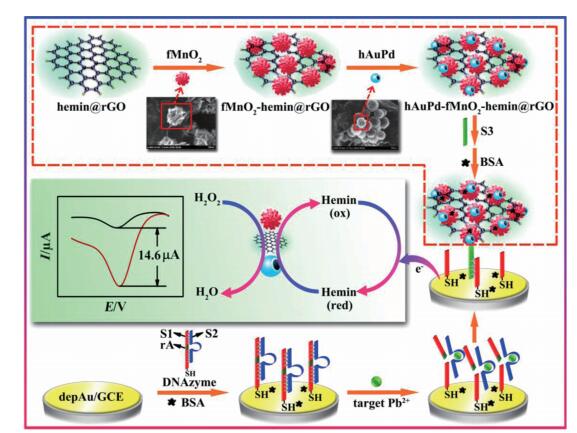
|
| 图 5 检测Pb2+的电化学传感器的制作及信号放大策略 |
介孔类材料是孔道介于2-50 nm一种多孔材料,分为硅基和非硅基两大类。硅基介孔材料有MCM系列、SBA系列和MSU系列等。非硅基介孔材料主要包括介孔氧化铝等过渡金属氧化物和介孔碳等非氧化物。介孔类修饰材料由于孔道结构有序、孔径分布窄、孔径大小可调、比表面积高、热稳定性好,且表面含有大量吸附能力强的羟基,备受研究者的关注。
目前,采用介孔硅和介孔碳两种材料检测铅离子,如Yantasee等[57]用磷酸乙酰胺功能化介孔氧化硅修饰丝网印刷电极以方波伏安法检测Pb2+,富集5 min之后,检测限为0.91 ppb,并且该修饰电极的重现性很好。Yin等[58]采用介孔碳和全氟磺酸复合物修饰玻碳电极,铅离子的最低检测限为0.13 μg/L,线性范围为5-70 μg/L。
3.2 基于有机材料的电化学传感器 3.2.1 有机小分子有机分子对重金属离子的特异识别能力被用于电化学传感器的制备[59],其氨基能与铅离子形成金属螯合物,从而起到检测的作用[60]。Fatima等[61]采用1,8-二氨基萘与铋的复合材料修饰碳糊电极,构建了铅离子电化学传感器,检测范围为0.5-50 μg/L,最低检测限为0.3 μg/L。
3.2.2 有机聚合物有机聚合物,特别是导电聚合物和螯合聚合物,通过聚合单体或修饰聚合物于电极表面,与重金属铅离子进行强的配位,已被用于制备灵敏度和选择性更高的铅离子电化学传感器。常用的导电性聚合物包括聚苯胺(PANI)、聚吡咯(PPy)、聚苯乙烯(PS)和硫醇(PDMcT)等。
Dai等[62]以氧化聚合的方式合成了PPy与氧化石墨烯纳米复合材料,植酸(PA)在静电引力的作用下对该纳米复合材料进行功能化修饰,复合物PA/PPy/GO修饰的玻碳电极具有高的导电性和灵敏度,铅离子检测的线性范围为5-150 μg/L。Promphet等[63]采用制备好的石墨烯/聚苯胺/聚苯乙烯多孔纳米纤维复合材料对丝网印刷碳电极进行修饰,该传感器检测铅离子的线性范围为10-500 μg/L,最低检测限为3.3 μg/L。
3.3 基于功能核酸的电化学传感器20世纪90年代初发展起来的基于指数富集配体系统进化技术得到的各种可与目标物高亲和力、高特异性结合的DNA或RNA序列被称为功能性核酸(FNAs)。它们与传统的核酸碱基相比,具有更广泛的识别能力、催化活性及较高的化学和热稳定性及良好的结构变异性,为构建功能核酸电化学传感器提供了新的识别元件。
3.3.1 基于脱氧核酶修饰的Pb2+电化学传感器脱氧核酶(DNAzyme)是利用体外筛选的组合生物学技术获得的,对特定的底物产生具有类似于蛋白酶催化活性的小分子单链DNA片段。DNAzyme具有稳定性和高催化活性、合成简单、费用较低、易于修饰等优点,尤其是对铅离子具有高度的识别特异性的DNAzyme,其活性与铅离子浓度密切相关,因此可以用其制备检测铅离子的电化学传感器[64-69]。
如8-17型DNAzyme(图 6),是由两条单链DNA组成,其中一条单链称作底物DNA链,包含一个切割位点; 另一条为核酸酶链,由催化中心区域和两侧的底物识别结构域构成。催化中心区域,由一个茎-环结构和一段单链区域构成,含有至少两对为G-C碱基对,环部序列含有3个碱基,其碱基序列不能发生任何变化。在铅离子存在下,催化水解8-17型DNAzyme底物DNA链上的RNA底物磷酸二酯键,从而在核糖核酸碱基(rA)处发生断裂,因此,可应用于Pb2+的分析检测[64]。
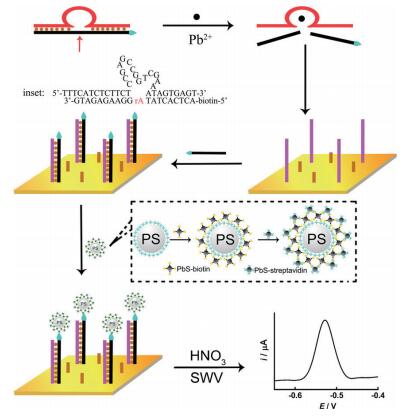
|
| 图 6 8-17型DNAzyme的结构及其检测Pb2+的原理 |
此外,将纳米材料与DNAzyme结合起来用于电极的复合修饰材料可以放大检测铅离子的信号。Xue等[56]将制备的S3-hAuPd-fMnO2-hemin@rGO复合材料对玻碳电极进行修饰,该传感器检测铅离子的范围为0.1 pmol/L-200 nmol/L,最低检出限低至0.034 pmol/L。
3.3.2 基于G-四联体修饰的Pb2+电化学传感器Pb2+可诱导富鸟嘌呤(G)的DNA构象转变成稳定的G-四联体(G4)结构[70],G4的基本单元是由四个鸟嘌呤在一正方形平面内以氢健环形连接而成,每一个G碱基既为氢健的受体也为配体,是一个动态的四链结构。由于Pb2+的半径小,进入G4两个平面中央后,使两个平面之间的垂直距离更小,使得G4结构更加紧凑、更加稳定,这一特性使其成为一种特定的识别铅离子的功能核酸[71]。
此外,当铅离子存在时,双链DNA将会解开为单链DNA,一条链形成G4,Zhu等[72]运用这一原理,在双链DNA上加入亚甲基蓝(MB),当加入铅离子时,双链DNA解开为单链,并形成G4结构,MB从电极表面释放出来,引起电信号减弱,从而实现铅离子的检测,线性范围为5.0×10-11-1.0×10-14 mol/L,检出限为4.3×10-15 mol/L(图 7)。
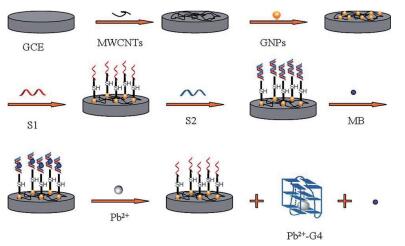
|
| 图 7 铅离子检测DNA传感器的组装与检测 |
随着工业化和城市化进程的不断提高,污染物尤其是重金属铅离子不断地被排放到环境中,对人类健康的影响也越来越显著。因此,为了克服铅离子对环境的毒性影响,需要对其进行痕量水平的监测。相比于传统的原子吸收光谱法,基于碳基电极的电化学传感器因能简单、快速、灵敏地对重金属铅离子进行检测而越来越得到研究者的重视。
在过去60余年中,该类型传感器在以下两个方面进行了大量的研究,一方面是基底电极碳材料的发展,出现了碳糊、玻碳、碳纤维、硼掺杂金刚石、石墨、石墨烯和碳膜等碳基电极,未来也会有更多的碳基电极被发明,然而它们由于表面易被污染,检测的灵敏度和准确度都会随着使用次数的增加而有不同程度地降低的不足; 另一方面是为了克服裸碳基电极的缺点、增加铅离子氧化反应的电信号及拓宽检测线性范围及降低检出限而进行的电极表面修饰研究,目前,已报道的碳基电极修饰材料有金属、金属氧化物、碳纳米材料和二氧化硅等无机纳米材料,有机小分子和聚合物等有机材料,以及脱氧核酶和G-四联体等功能核酸物质。而近年来兴起的功能核酸电化学传感器,更是极大地提高了铅离子的检出限达到飞摩尔级,而且特异性、灵敏度和响应速度都非常高,因此受到了更大的关注。
虽然基于碳基电极的电化学传感器具有很多优点,但仍然存在一些缺点和不足,主要表现在:(1)当前的研究大多集中在不同水体类型的铅离子检测,而检测土壤、植物等更复杂体系中铅离子的研究较少,可能是由于这些体系中铅离子的溶出更加困难,且干扰因素太多; (2)这些传感器检测的线性范围较窄,意味着样品仍需进行合适的前处理,因此,很大程度上限制了它们在现场即时检测; (3)当前研究的传感器仍以实验室理论研究为主,能实际应用的成熟化产品仍较少。因此,基于碳基电极的电化学传感器在很多方面仍需改进和提高,如寻找新的碳材料,提高基底电极的重现性和抗干扰能力; 寻找新的功能核酸,提高修饰电极检测铅离子的灵敏度; 通过不断提高碳纳米管、氧化石墨烯、量子点等纳米材料及有机材料的功能,扩大铅离子检测的线性范围等。
未来随着材料学、分子生物学等诸多细分领域的发展,更加简便、易携带、稳定性和重复性好,能进行实时定量原位检测的碳基电极的电化学传感器将会被发明,并用于环境和食品安全等领域的监测。
| [1] |
Markovac J, Goldstein GW. Picomolar concentrations of lead stimulate brain protein kinase C[J]. Nature, 1988, 334(6177): 71-73. DOI:10.1038/334071a0 |
| [2] |
Bagchi D, Bagchi M, Stohs SJ, et al. Free radicals and grape seed proanthocyanidin extract:importance in human health and disease prevention[J]. Toxicology, 2000, 148(2): 187-197. |
| [3] |
United States Environmental Protection Agency. Reducing health risks worldwide: Report No EPA-160-K-98-001. Washington D. C. 1998.
|
| [4] |
Kayhanian M. Trend and concentrations of legacy lead(Pb)in highway runoff[J]. Environmental Pollution, 2012, 160(1): 169-177. |
| [5] |
Huang PC, Su PH, Chen HY, et al. Childhood blood lead levels and intellectual development after ban of leaded gasoline in Taiwan:a 9-year prospective study[J]. Environment International, 2012, 40(2): 88-96. |
| [6] |
Nigg JT, Knottnerus GM, Martel MM, et al. Low blood lead levels associated with clinically diagnosed attention-deficit/hyperactivity disorder and mediated by weak cognitive control[J]. Biological Psychiatry, 2008, 63(3): 325-331. DOI:10.1016/j.biopsych.2007.07.013 |
| [7] |
Griffiths C, Klemick H, Massey M, et al. US environmental protection agency valuation of surface water quality improvements[J]. Review of Environmental Economics & Policy, 2012, 6(1): 130-146. |
| [8] |
Saidur MR, Aziz AR, Basirun WJ. Recent advances in DNA-based electrochemical biosensors for heavy metal ion detection:A review[J]. Biosens Bioelectron, 2017, 90: 125-139. DOI:10.1016/j.bios.2016.11.039 |
| [9] |
Yang L, Saavedra SS. Chemical sensing using sol-gel derived planar waveguides and indicator phases[J]. Analytical Chemistry, 1995, 67(8): 1307-1314. DOI:10.1021/ac00104a002 |
| [10] |
Ewing GW. Analytical Instrumentation Handbook[M]. 2rd ed. New York: Marcel Dekker, 1997.
|
| [11] |
Liu HW, Jiang SJ, Liu SH. Determination of cadmium, mercury and lead in seawater by electrothermal vaporization isotope dilution inductively coupled plasma mass spectrometry[J]. Spectrochimica Acta B, 1999, 54(9): 1367-1375. DOI:10.1016/S0584-8547(99)00081-6 |
| [12] |
Rebôcho J, Carvalho ML, Marques AF, et al. Lead post-mortem intake in human bones of ancient populations by(109)Cd-based X-ray fluorescence and EDXRF[J]. Talanta, 2006, 70(5): 957-961. DOI:10.1016/j.talanta.2006.05.062 |
| [13] |
Zeng W, Chen Y, Cui H, et al. Single-column method of ion chromatography for the determination of common cations and some transition metals[J]. J Chromatogr A, 2006, 1118(1): 68-72. DOI:10.1016/j.chroma.2006.01.065 |
| [14] |
Jamali MR, Assadi Y, Shemirani F, et al. Synthesis of salicylaldehyde-modified mesoporous silica and its application as a new sorbent for separation, preconcentration and determination of uranium by inductively coupled plasma atomic emission spectrometry[J]. Anal Chim Acta, 2006, 579(1): 68-73. |
| [15] |
Drummond TG, Hill MG, Barton JK. Electrochemical DNA sensors[J]. Nature Biotechnology, 2003, 21(10): 1192-1199. DOI:10.1038/nbt873 |
| [16] |
Ronkainen NJ, H Brian H, Heineman WR. Electrochemical biosensors[J]. Chem Soc Rev, 2010, 39(5): 1747-1763. DOI:10.1039/b714449k |
| [17] |
Kyrisoglou C, Economou A, Efstathiou CE. Bismuth-coated iridium microwire electrode for the determination of trace metals by anodic stripping voltammetry[J]. Electroanalysis, 2012, 24(9): 1825-1832. DOI:10.1002/elan.v24.9 |
| [18] |
Lu Y, Liang X, Niyungekoa C, et al. A review of the identification and detection of heavy metal ions in the environment by voltammetry[J]. Talanta, 2017, 178: 324-338. |
| [19] |
Bowler R, Davies TJ, And MEH, et al. Electrochemical cell for surface analysis[J]. Analytical Chemistry, 2005, 77(6): 1916-1919. DOI:10.1021/ac048443z |
| [20] |
Marcoux LS, Prater KB, Prater BG, et al. A nonaqueous carbon paste electrode[J]. Anal Chem, 2002, 37(11): 1446-1447. |
| [21] |
Zittel HE, Miller FJ, Chem A. A glassy-carbon electrode for voltammetry[J]. Analytical Chemistry, 1965, 37(2): 200-203. DOI:10.1021/ac60221a006 |
| [22] |
Wang Z, Wang H, Zhang Z, et al. Electrochemical determination of lead and cadmium in rice by adisposable bismuth/electrochemically reduced graphene/ionic liquid composite modified screen-printed electrode[J]. Sensors & Actuators B, 2014, 199: 7-14. |
| [23] |
Robinson JE, Heineman WR, Sagle LB, et al. Carbon nanofiber electrode array for the detection of lead[J]. Electrochemistry Communications, 2016, 73: 89-93. DOI:10.1016/j.elecom.2016.11.002 |
| [24] |
Liu HJ, Qu LN, Hu S, et al. Sensitive and simple electrochemical detection of lead(Ⅱ)with carbon ionic liquid electrode[J]. Journal of the Chinese Chemical Society, 2010, 57(6): 1367-1373. DOI:10.1002/jccs.v57.6 |
| [25] |
Yano T. Electrochemical behavior of highly conductive boron-doped diamond electrodes for oxygen reduction in acid solution[J]. J Electrochem Soc, 1999, 146(3): 1081-1087. DOI:10.1149/1.1391724 |
| [26] |
Roohollah TK, Craig EB, Ji X, et al. Electroanalytical determination of cadmium(Ⅱ)and lead(Ⅱ)using an in-situ bismuth film modified edge plane pyrolytic graphite electrode[J]. Analytical Sciences, 2007, 23: 283-289. DOI:10.2116/analsci.23.283 |
| [27] |
Castañeda MT, Pérez B, Pumera M, et al. Sensitive stripping voltammetry of heavy metals by using a composite sensor based on a built-in bismuth precursor[J]. Analyst, 2005, 130(6): 971-976. DOI:10.1039/b502486m |
| [28] |
Potlako JM, Azeez OI, Nonhlangabezo M, et al. Electrochemical co-detection of As(Ⅲ), Hg(Ⅱ)and Pb(Ⅱ)on a bismuth modified exfoliated graphite electrode[J]. Talanta, 2016, 153: 99-106. DOI:10.1016/j.talanta.2016.03.003 |
| [29] |
Wang Z, Liu E. Graphene ultrathin film electrode for detection of lead ions in acetate buffer solution[J]. Talanta, 2013, 103(2): 47-55. |
| [30] |
Demetriades D, Economou A, Voulgaropoulos A. A study of pencil-lead bismuth-film electrodes for the determination of trace metals by anodic stripping voltammetry[J]. Anal Chim Acta, 2004, 519(2): 167-172. DOI:10.1016/j.aca.2004.05.008 |
| [31] |
Pauliukaitė R. Characterization and application of bismuth-film modified carbon film electrodes[J]. Electroanalysis, 2005, 17(15-16): 1354-1359. DOI:10.1002/(ISSN)1521-4109 |
| [32] |
Hadi M, Rouhollahi A, Yousefi M. Application of nanocrystalline graphite-like pyrolytic carbon film electrode for voltammetric sensing of lead[J]. Journal of Applied Electrochemistry, 2011, 42(3): 179-187. |
| [33] |
Afkhami A, Ghaedi H, Madrakian T, et al. Highly sensitive simultaneous electrochemical determination of trace amounts of Pb(Ⅱ)and Cd(Ⅱ)using a carbon paste electrode modified with multi-walled carbon nanotubes and a newly synthesized Schiff base[J]. Electrochimica Acta, 2013, 89: 377-386. DOI:10.1016/j.electacta.2012.11.050 |
| [34] |
McCreery RL, Bard AJ. Eletroanalytical Chemistry[M]. New York: Marcel Dekker, 1991.
|
| [35] |
Kaushika A, Khan R, Solanki PR, et al. Iron oxide nanoparticles-chitosan composite based glucose biosensor[J]. Biosens Bioelectron, 2012, 24(4): 676-683. |
| [36] |
Zuman P. Stripping Analysis:Principles, instrumentation and applications[J]. Microchem J, 1986, 33(1): 135-136. DOI:10.1016/0026-265X(86)90094-9 |
| [37] |
Zhu L, Xu L, Huang B, et al. Simultaneous determination of Cd(Ⅱ)and Pb(Ⅱ)using square wave anodic stripping voltammetry at a gold nanoparticle-graphene-cysteine composite modified bismuth film electrode[J]. Electrochimica Acta, 2014, 115(3): 471-477. |
| [38] |
Kaur B, Srivastava R, Satpati B. Ultratrace detection of toxic heavy metal ions found in water bodies using hydroxyapatite supported nanocrystalline ZSM-5 modified electrodes[J]. New Journal of Chemistry, 2015, 39(7): 5137-5149. DOI:10.1039/C4NJ02369B |
| [39] |
Wang J, Lu J, Hocevar SB, et al. Bismuth-coated carbon electrodes for anodic stripping voltammetry[J]. Analytical Chemistry, 2000, 72(14): 3218-3222. DOI:10.1021/ac000108x |
| [40] |
Zhou H, Hou H, Dai L, et al. Preparation of dendritic bismuth film electrodes and their application for detection of trace Pb(Ⅱ)and Cd(Ⅱ)[J]. Chinese Journal of Chemical Engineering, 2016, 24(3): 410-414. DOI:10.1016/j.cjche.2015.08.012 |
| [41] |
Yantasee W, Hongsirikarn K, Warner CL, et al. Direct detection of Pb in urine and Cd, Pb, Cu, and Ag in natural waters using electrochemical sensors immobilized with DMSA functionalized magnetic nanoparticles[J]. Analyst, 2008, 133(3): 348-355. |
| [42] |
Liu MC, Zhao GH, Tang YT, et al. A simple, stable and picomole level lead sensor fabricated on DNA-based carbon hybridized TiO2 nanotube arrays[J]. Environmental Science & Technology, 2010, 44(11): 4241-4246. |
| [43] |
Wei Y, Gao C, Meng FL. SnO2/Reduced graphene oxide nanocomposite for the simultaneous electrochemical detection of cadmium(Ⅱ), lead(Ⅱ), copper(Ⅱ), and mercury(Ⅱ):An interesting favorable mutual interference[J]. The Journal of Physical Chemistry C, 2012, 116(1): 1034-1041. |
| [44] |
Liu ZG, Sun YF, Chen WK, et al. Facet-dependent stripping behavior of Cu2O microcrystals toward lead Ions:A rational design for the determination of lead ions[J]. Small, 2015, 11(21): 2493-2498. DOI:10.1002/smll.v11.21 |
| [45] |
Li PH, Li YX, Chen SH, et al. Sensitive and interference-free electrochemical determination of Pb(Ⅱ)in wastewater using porous Ce-Zr oxide nanospheres[J]. Sensors & Actuators B, 2018, 257: 1009-1020. |
| [46] |
Xu X, Ray R, Gu Y, et al. Electrophoretic analysis and purification of fluorescent single-walled carbon nanotube fragments[J]. Journal of the American Chemical Society, 2004, 126(40): 12736-12737. DOI:10.1021/ja040082h |
| [47] |
Wang J, Zhang W, Yue X, et al. One-pot synthesis of multifunctional magnetic ferrite-MoS2-carbondot nanohybrid adsorbent for efficient Pb(Ⅱ)removal[J]. Journal of Materials Chemistry A, 2016, 4(10): 3893-3900. DOI:10.1039/C6TA00269B |
| [48] |
Li L, Liu D, Shi A, et al. Simultaneous stripping determination of cadmium and lead ionsbased on the N-doped carbon quantum dots-graphene oxide hybrid[J]. Sensors & Actuators B, 2018, 255: 1762-1770. |
| [49] |
Simpson A, Pandey RR, Charles CC, et al. Fabrication characterization and potential applications of carbon nanoparticles in the detection of heavy metal ions in aqueous media[J]. Carbon, 2018, 127: 122-130. DOI:10.1016/j.carbon.2017.10.086 |
| [50] |
Iijima S. Helical microtubules of graphitic carbon[J]. Nature, 1991, 354(6348): 56-58. DOI:10.1038/354056a0 |
| [51] |
Novoselov KS, Geim AK, Morozov SV, et al. Two-dimensional gas of massless Dirac fermions in grapheme[J]. Nature, 2005, 438(7065): 197-200. DOI:10.1038/nature04233 |
| [52] |
Priya T, Dhanalakshmi N, Thennarasu S, et al. A novel voltammetric sensor for the simultaneous detection of Cd2+ and Pb2+ using graphene oxide/κ-carrageenan/L-cysteine nanocomposite[J]. Carbohydrate Polymers, 2018, 182: 199-206. DOI:10.1016/j.carbpol.2017.11.017 |
| [53] |
Ping J, Wang Y, Wu J, et al. Development of an electrochemically reduced graphene oxide modified disposable bismuth film electrode and its application for stripping analysis of heavy metals in milk[J]. Food Chemistry, 2014, 151(4): 65-71. |
| [54] |
Liu FM, Zhang Y, Yin W, et al. A high-selectivity electrochemical sensor for ultra-trace lead(Ⅱ)detection based on a nanocomposite consisting of nitrogen-doped graphene/gold nanoparticles functionalized with ETBD and Fe3O4@TiO2 core-shell nanoparticles[J]. Sensors & Actuators B, 2016, 242: 889-896. |
| [55] |
Muralikrishna S, Nagaraju DH, Balakrishna RG, et al. Hydrogels of polyaniline with graphene oxide for highly sensitive electrochemical determination of lead ions[J]. Anal Chim Acta, 2017, 990: 67-77. DOI:10.1016/j.aca.2017.09.008 |
| [56] |
Xue S, Jing P, Xu W. Hemin on graphene nanosheets functionalized with flower-like MnO2 and hollow AuPd for the electrochemical sensing lead ion based on the specific DNAzyme[J]. Biosens Bioelectron, 2016, 86: 958-965. DOI:10.1016/j.bios.2016.07.111 |
| [57] |
Yantasee W, Deibler LA, Fryxell GE, et al. Screen-printed electrodes modified with functionalized mesoporous silica for voltammetric analysis of toxic metal ions[J]. Electrochemistry Communications, 2005, 7(11): 1170-1176. DOI:10.1016/j.elecom.2005.08.018 |
| [58] |
Yuan Y, Zhao G, Liu G. A sensitive electrochemical sensor using a mesoporous carbon and nafion composite for the simultaneous detection of cadmium and lead[J]. International Journal of Electrochemical Science, 2017, 12: 5378-5391. |
| [59] |
Oztekin Y, Ramanaviciene A, Ramanavicius A. Electrochemical copper(Ⅱ)sensor based on self-assembled 4-amino-6-hydroxy-2-mercaptopyrimidine monohydrate[J]. Sensors & Actuators B:Chemical, 2011, 155(2): 612-617. |
| [60] |
Wu Y, Li NB, Luo HQ. Simultaneous measurement of Pb, Cd and Zn using differential pulse anodic stripping voltammetry at a bismuth/poly(p-aminobenzene sulfonic acid)film electrode[J]. Sensors & Actuators B, 2008, 133(2): 677-681. |
| [61] |
Fatima ES, Ouarzane A, Rhazi ME. Electrochemical detection of lead(Ⅱ)at bismuth/Poly(1, 8-diaminonaphthalene)modified carbon paste electrode[J]. Arabian Journal of Chemistry, 2017, 10: 596-603. DOI:10.1016/j.arabjc.2015.08.021 |
| [62] |
Dai H, Wang N, Wang D, et al. An electrochemical sensor based on phytic acid functionalized polypyrrole/graphene oxide nanocomposites for simultaneous determination of Cd(Ⅱ)and Pb(Ⅱ)[J]. Chemical Engineering Journal, 2016, 299: 150-155. DOI:10.1016/j.cej.2016.04.083 |
| [63] |
Promphet N, Rattanarat P, Rangkupan R, et al. An electrochemical sensor based on graphene/polyaniline/polystyrene nanoporous fibers modified electrode for simultaneous determination of lead and cadmium[J]. Sensors & Actuators B, 2015, 207: 526-534. |
| [64] |
Zhang H, Jiang B, Xiang Y, et al. DNAzyme-based highly sensitive electronic detection of lead via quantum dot-assembled amplification labels[J]. Biosens Bioelectron, 2011, 28(1): 135-138. DOI:10.1016/j.bios.2011.07.009 |
| [65] |
Tang S, Wei L, Fang G, et al. A novel electrochemical sensor for lead ion based on cascade DNA and quantum dots amplification[J]. Electrochimica Acta, 2014, 134(21): 1-7. |
| [66] |
Zeng G, Zhu Y, Zhang Y, et al. Electrochemical DNA sensing strategy based on strengthening electronic conduction and a signal amplifier carrier of nanoAu/MCN composited nanomaterials for sensitive lead detection[J]. Environmental Science Nano, 2016, 3(6): 1504-1509. DOI:10.1039/C6EN00323K |
| [67] |
Zhou Y, Lin T, Zeng G, et al. Label free detection of lead using impedimetric sensor based on ordered mesoporous carbon-gold nanoparticles and DNAzyme catalytic beacons[J]. Talanta, 2016, 146: 641-647. DOI:10.1016/j.talanta.2015.06.063 |
| [68] |
Zhang C, Lai C, Zeng G, et al. Nanoporous Au-based chronocoulometric aptasensor for amplified detection of Pb2+ using DNAzyme modified with Au nanoparticles[J]. Biosens Bioelectron, 2016, 81: 61-67. DOI:10.1016/j.bios.2016.02.053 |
| [69] |
Tang S, Tong P, Li H, et al. Ultrasensitive electrochemical detection of Pb2+ based on rolling circle amplification and quantum dots tagging[J]. Biosens Bioelectron, 2013, 42(12): 608-611. |
| [70] |
Li Y, Liu XR, Ning XH, et al. An ionic liquid supported CeO2 nanoparticles-carbon nanotubes composite-enhanced electrochemical DNA-based sensor for the detection of Pb2+[J]. Journal of Pharmaceutical Analysis, 2011, 1(4): 258-263. DOI:10.1016/j.jpha.2011.09.001 |
| [71] |
Li Y, Wang C, Zhu Y, et al. Fully integrated graphene electronic biosensor for label-free detection of lead(Ⅱ)ion based on G-quadruplex structure-switching[J]. Biosens Bioelectron, 2017, 89(2): 758-763. |
| [72] |
Zhu Y, Zeng G, Zhang Y, et al. Highly sensitive electrochemical sensor using a MWCNTs/GNPs-modified electrode for lead(Ⅱ)detection based on Pb2+-induced G-rich DNA conformation[J]. Analyst, 2014, 139(19): 5014-5020. DOI:10.1039/C4AN00874J |