2. 湖南省中药饮片标准化及功能工程技术研究中心,长沙 410208
2. Hunan Traditional Chinese Medicine Piece Standardization and Function Technology Research Center, Changsha 410208
花是植物六大器官之一,除作观赏外,很多还具药用价值和食用价值。其中,以花类药材为例,《中药大辞典》中,就有160多种花类植物可以入药[1],常用临床花类中药近50种。但因有些花类药材如金银花、山银花、槐花、三七花等存在花期短、易凋谢或仅以花蕾或初开的花入药等缺陷,易导致资源浪费。研究如何获得长花期、高品质花卉植物对提高其观赏价值、利用价值、调整产业结构,增加农民收入有重要意义。
大量研究表明,植物激素乙烯在植物开花和衰老过程中起关键作用。近年来,国内外围绕乙烯在花发育和衰老过程中的动态变化及其调节效应进行研究,取得较大进展,其中很多关键基因被分离鉴定[2-4]。目前,在分子水平上,关于延长植物花期、调控花发育的研究主要集中于乙烯生物合成和乙烯信号转导途径两大方面,可有选择地阻断乙烯生物合成和信号转导某一环节来延迟花的衰老[5]。本文主要对近年来乙烯生物合成及信号转导途径中介导花衰老进程的相关基因克隆及调控相关研究进行综述。
1 花衰老进程中乙烯相关功能开花是植物重要生理过程。花衰老是研究植物衰老及其调控过程的理想系统[6-8],表现为花瓣萎蔫或脱落、花色改变、花径变小等特征,涉及一系列生理代谢过程,是基因表达、蛋白质合成及内外因素综合调控的结果[9]。内源激素中,与花衰老相关的主要是乙烯(Ethylene)和脱落酸(ABA)[10-12],因绝大多数双子叶植物花瓣衰老对乙烯敏感[13],且国内外围绕乙烯在花发育和衰老过程中相关机制已取得较多研究,故目前关于延缓切花衰老和调控花发育的研究主要集中于乙烯方面。
乙烯为结构最简单的小分子烯烃,以气体形式存在于自然界,为调控植物生长发育、导致植物衰老的重要内源激素,存在于植物整个生命周期,在种子萌发、植物开花、器官衰老与脱落、果实成熟、性别分化以及对生物胁迫和非生物胁迫等生理过程中均起重要作用,被誉为“果蔬成熟激素”[3, 14]。一般来说,植物体内乙烯含量很低,在未成熟组织中合成微少,仅在成熟衰老组织及受胁迫组织等特定阶段或特定条件中大量产生。在高等植物中,乙烯生成主要分为2个系统[15]:系统Ⅰ乙烯具自抑制机制,调控植物正常生长、发育和应对胁迫反应等,仅少量乙烯生成; 系统Ⅱ具自催化机制,用于跃变期乙烯大量生产,促花凋亡和果实成熟。花衰老过程与乙烯息息相关,乙烯在花中合成及转导途径与果实相同(图 1)[16]。因此,研究乙烯生物合成途径和调节机理,对调控内源乙烯、认识植物成熟过程,调节花发育与衰老有重大意义。
2 乙烯生物合成途径及其花衰老相关基因研究 2.1 乙烯生物合成途径1964年,Lieberman等[17-18]首次提出并证实乙烯生物合成途径中真正前体为蛋氨酸(即甲硫氨酸); 其后,Adams等[19]发现1-氨基环丙烷-1-羧酸(1-aminocyclopropane-1-carboxylic acid,ACC)为乙烯生物合成直接前体。目前,根据前人研究成果[11, 20-22],乙烯生物合成线性模型可归纳为:蛋氨酸/甲硫氨酸(Methionine,Met)→S-腺苷蛋氨酸(S-adenosylmethionine,SAM)→ACC→乙烯(图 2)。此途径中,主要包括3个酶反应:(1)S-腺苷甲硫氨酸合成酶(S-adenosy-L-methionine synthetase,SAMS)催化ATP的腺苷基团与Met生成SAM; (2)1-氨基环丙烷-1-羧酸合酶(1-aminocyclopropane-1-carboxylic acid synthase,ACS)催化SAM裂解为甲硫腺苷(5'-methylthioadenosine,MTA)和ACC; (3)1-氨基环丙烷-1-羧酸氧化酶(1-aminocyclopropane-1-carboxylic acid oxidase,ACO)催化前体ACC最终合成乙烯。其中,ACC为重要的中间产物,ACC合酶(ACS)和ACC氧化酶(ACO)为关键酶[4, 23]。
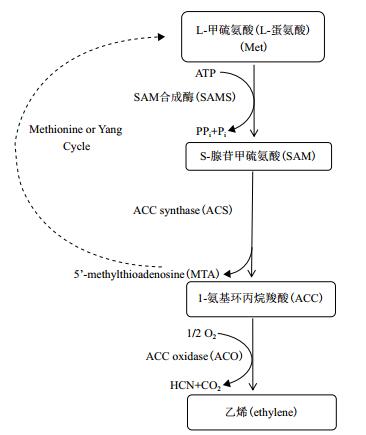
|
| 图 2 植物乙烯合成通路示意图 |
SAMS为重要代谢酶类,为多基因家族基因编码蛋白,在植物中,参与多种生理作用,在进化上具高保守性[20]。研究发现,SAMS作为乙烯生物合成途径中第1个酶,其催化产物SAM为植物体内乙烯前体,其含量在一定程度上影响ACC合成; 但一般认为SAMS在乙烯合成中不是限速酶。除乙烯合成,SAMS还充当细胞甲基化供体,参与多胺、甜菜碱、麦根酸等多种生物合成过程,并与植物响应逆境胁迫相关[24-26]。
在基因水平上,SAMS主要在动物和微生物上开展研究,在植物中研究相对较迟,且花中相关报道极少。目前,除拟南芥[27-28]、水稻[29]等模式植物,已从香石竹[30]、玉簪花[20]、石蒜[31]、茶[32]、高山离子芥[33]等植物中克隆到SAMS基因。经研究,Kim等[26]从白菜中分离出SAMS基因,构建SAMS过表达和RNAi载体转基因烟草,结果发现,RNAi植株中ACS表达下降,过表达植株中ACS表达水平小幅上升,表明SAMS在转录水平上一定程度地调控乙烯合成。催花研究中,刘建新等[14]从擎天凤梨开花植株单克隆获得擎天凤梨SAMS基因,探究SAMS基因在开花期表达模式和乙烯释放量的关系,发现所得SAMs1在不同组织中表达模式与乙烯释放量明显一致,推测其在乙烯生物合成、苞片呈色以及催花研究中发挥重要作用。此外,大丽花花瓣中DpSAMS表达量随大丽花花瓣的开放与衰老,呈逐渐上升趋势,且对外源乙烯敏感,推测DpSAMS为大丽花衰老相关[9]。综上所述,SAMS与乙烯生物合成一定程度上相关,可能影响花发育衰老进程。
在乙烯合成过程中,虽一般不认为SAMS是限速酶,但SAMS在一定程度上也能影响乙烯生物合成途径,继而影响植物生长发育,深入研究SAMS基因对调控花发育衰老有一定意义。
2.2.2 ACS及其调控花衰老的研究ACS为多基因家族,其家族成员间蛋白和序列存在一定保守性和差异性,保守性主要表现于N端,差异性主要表现于C端,某些同源基因因差异较大致其生化特性和功能不同[34-35];ACS是乙烯生物合成的重要限速酶,其酶活性是ACC和乙烯调控植物生长发育的基础,直接关系到植物体内乙烯含量[35],可通过在转录及翻译水平上调控ACS,从而影响乙烯含量延缓植株衰老。但一般情况下,ACS转录水平很低,其蛋白极不稳定,导致胞质中ACS蛋白浓度低,且ACS半衰期短、易水解,故该酶特性研究进展较缓[36-37]。
目前,已从不同植物中分离得到ACS基因,并验证其与植物发育衰老密切相关。果实成熟研究中,研究者已对番茄[38-40]、西葫芦[41]等植物的ACS基因进行克隆,并利用基因工程手段在植株中导入ACS反义RNA或RNAi基因,从而使果实过熟迟滞,或通过提高果实中ACS基因表达量而促进植株生长发育,以上研究证明ACS参与调控乙烯生成,作为乙烯生物合成关键酶调控植株发育和衰老。在花衰老研究中,Ma等[42]从月季花瓣中克隆得到3个ACS基因(RhACS1-RhACS3),发现ACS基因成员间表达存在时间上的接替过程,其中RhACS1和RhACS2主要在花朵衰老时表达,RhACS3在花朵开放期间表达,进入衰老后减弱,表明RhACS1、RhACS2表达与衰老相伴,RhACS3与开放相关; 对“云香”水仙中NtACS1进行表达分析,发现NtACS1在花瓣及副冠中表达随花衰老均呈逐渐下降趋势,且表达峰值都在花苞期,推测NtACS1可能在乙烯生物合成途径系统1发挥作用,与“云香”水仙花发育初期乙烯生物合成有关[43-44];研究者通过比较文心兰中OnACS2的表达与乙烯释放速率的关系发现,文心兰花朵各部位的乙烯释放速率和OnACS2表达量都呈先上升再下降趋势,且乙烯释放速率上升出现在OnACS2表达上升时或之后,推测OnACS2的表达积累影响了花中乙稀释放[45]。因此,以上研究均表明:ACS基因编码的蛋白可能在乙烯生物合成途径中发挥重要的催化作用,ACS基因的表达积累可能促使花中乙烯释放,从而促使花开放或加速花衰老。
此外,ACS基因家族的表达不仅受到转录水平调节,其翻译水平的调节,尤其是ACS蛋白的磷酸化修饰和泛素化降解,对于植物乙烯生物合成也是至关重要的[46-47]。研究者可通过去磷酸化和ACS泛素化蛋白酶体降解等手段,降低ACS稳定性和活性,继而抑制植物体内乙烯合成,近年来已陆续开展在转录后水平调控ACS影响乙烯合成的相关研究[47-51]。但目前通过在翻译水平上调控ACS来影响植株乙烯合成的研究主要在模式植物拟南芥等幼苗、根等部位进行,对于植物花器官等研究尚少。
因此,可通过在转录水平和翻译水平上修饰和控制ACS基因,影响植物体内乙烯生成,继而调控植物发育衰老进程。目前,在转录水平调控ACS来延长花期已在不同植物上得到应用,如利用基因工程调控ACS基因来延长蝴蝶兰[52-53]、洋桔梗[54]、菠萝花[55]等花卉寿命。研究者可进一步将通过在翻译水平上负调控ACS从而减少乙烯合成的研究推广至花类植物。
2.2.3 ACO及其调控花衰老研究ACO为多基因家族,表达具时空特异性,因其需抗坏血酸和氧气为共底物,且需Fe2+和CO2为辅因子,故称其ACC氧化酶[56]。在乙烯生物合成中,最初认为仅ACS酶活性为控制合成的关键步骤,ACO仅作辅助。但研究表明,ACO活性也是控制乙烯合成的重要因素。ACO直接氧化ACC成乙烯,为乙烯生物合成最终反应,但目前来说,对离体条件下ACO的研究进展仍较为缓慢[57]。
近年来,已先后从月季[42]、芍药[58]、香石竹[59]、文心兰[60]等花卉植物中分离得到ACO基因全长或片段,并验证其与植物生长发育密切相关,调控植株衰老进程。据研究,番茄基因组中已克隆得到6个ACO基因(LeACO1-LeACO6)[61-62],番茄中ACO各成员在果实发育与衰老中表达模式具显著差异,除LeACO2在果实中没有明显的转录产物积累,其他ACO家族基因均在果实整个发育阶段乙烯生物合成途径中发挥一定作用,其中对LeACO1-LeACO3研究较多,ACO1、ACO3转录本在花、叶片及果实衰老过程中有所积累,ACO1在果实成熟衰老起主要作用,在花发育过程中,ACO1-ACO3转录水平均受到花期调控[63-64]。除果实,在花卉中也有类似报道,玉簪花HpACO随花期变化表达逐渐增强,在盛花期达到最高,在衰花期有所下降,表明HpACO可能参与调控玉簪开花和衰老进程[20]。对文心兰进行研究,结果显示,文心兰花中各部位OnACO2表达水平与乙烯释放速率均随花衰老对应急剧升高,且OnACO2表达量上升在乙烯释放上升之前,推测OnACO2可能为文心兰花衰老相关功能基因,其表达量升高可能为乙烯产生的前提条件[60]。孙申申等[44, 65-66]以“云香”水仙花瓣为材料,分离得到NtACO1和NtACOY2,2个基因在花瓣和副冠中的表达量随花发育和衰老均呈整体上升趋势,分别构建NtACO1和NtACOY2过表达转基因烟草,与野生型相比,2种转基因烟草营养生长期缩短,开花提前,花期缩短,表明NtACO1及NtACOY2均为乙烯生物合成的可能功能基因,参与调控“云香”水仙的花发育与衰老进程。以上研究均证明ACO基因可参与调控乙烯生物合成,继而影响植物花期。
开展ACO基因相关研究将有助于为调控乙烯生物合成从而获得花期延长的优良育种提供研究参考。目前,通过调控ACO基因实现抗衰老转基因植物育种已有一定研究基础,调控ACO基因以获得花期延长的石斛兰[67]、石竹[68]、康乃馨[69]等转基因花卉培育已有报道。
3 乙烯信号转导途径及其花衰老相关基因的研究 3.1 乙烯信号转导途径乙烯生物合成为乙烯作用的上游部分,乙烯信号转导则为下游,其研究起步较晚,进展较快,乙烯的生物学效应被认为是通过乙烯信号转导途径得以实现的[70-71]。目前,乙烯信号转导在模式植物拟南芥中已建立相关线性模型,即乙烯→乙烯受体ETR家族→CTR家族→EIN2→EIN3/EIL→ERF→乙烯反应相关基因表达(图 3)。
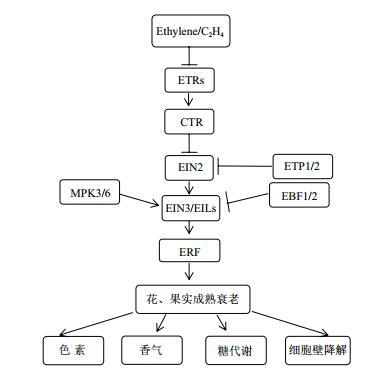
|
| 图 3 乙烯信号转导途径 |
研究发现,乙烯信号转导途径中,上游的乙烯受体(Ethylene receptor,ETR)与CTR1(Constitutive triple response 1)为负调控元件,而下游EIN2(Ethylene insensitive 2)、EIN3/EIL(Ethylene insensitive 3/ EIN3-like)和乙烯响应因子(Ethylene response factor,ERF)中ERF1则为乙烯信号转导的正调控器[5]。
3.1.1 ETRERSs等编码的ETR在内质网膜上感知乙烯信号,是乙烯信号转导途径的第一级元件,起负调控作用。在模式植物拟南芥中,共发现5个ETR蛋白,由一个多基因家族编码,可分为ETR1亚族(ETR1、ERS1)和ETR2亚族(ETR2、ERS2和EIN4),其中ETR1对乙烯信号转导影响最大。乙烯敏感性与乙烯受体有关,主要表现在:当受体增多,乙烯敏感性降低,与受体的负调控模式一致; 其次,乙烯受体家族具非冗余性,每个受体在乙烯信号中除具普遍作用还具自身独特的功能[72-73]。且研究表明,ETR基因任意一个发生功能获得性突变均影响受体与乙烯的结合能力,而导致乙烯不敏感表型,进一步证实乙烯受体对乙烯反应起负调控作用[74-76]。此外,研究者发现,乙烯受体基因在调控信号转导时,还特别受铜离子和RTE1(Reversion to ethylene sensitivity 1)蛋白的影响。乙烯与受体结合需要亚铜离子(Cu+)作为辅助,铜转运体RAN1(Responsive to antagonist 1)蛋白被发现负责转运铜离子并维持其浓度梯度,对维持乙烯受体正常构象、活性及生物发生发挥重要作用[77];而RTE1蛋白被认为是ETR1受体功能的正调节因子,其专一性地与ETR1发生互作,通过ETR1的氨基端(残基1-349)抑制乙烯信号传递[78-79]。
3.1.2 CTR1CTR1为乙烯信号转导途径中鉴定出的第一个基因,N端可与内质网上的乙烯受体相结合,C端具类似哺乳动物Raf的丝氨酸/苏氨酸蛋白激酶的结构[80-81],体外磷酸化试验表明其具丝氨酸/苏氨酸蛋白激酶活性,活性特征与Raf1一定程度类似,是乙烯信号转导中心组分[5, 81]。可与乙烯受体协同影响植物乙烯敏感性,当缺乏乙烯时,乙烯受体处于激活状态与CTR1结合,活性状态下的CTR1能使EIN2磷酸化,磷酸化的EIN2蛋白停留在内质网上,致乙烯信号传递中断,协同抑制下游乙烯信号; 反之,当乙烯浓度高时,受体结合乙烯,失去活性,CTR1不能被激活,EIN2不磷酸化,其羧基端片段转移入核,激活下游的乙烯信号转导途径,促乙烯信号向下传递[81-84]。除EIN2途径,还有研究认为CTR1可绕过EIN2而通过MAPK激酶级联反应直接影响EIN3,进而调控乙烯信号转导途径[71, 85]。此外,CTR基因的表达可能不完全受内源乙烯的调控,还受其他未知因子调控。
3.1.3 EIN2EIN2为乙烯应答途径中关键正调控因子,与下游的EIN3/EILs协同正调控乙烯反应,半衰期短,为定位于内质网膜的跨膜蛋白[81, 86-87]。研究表明,EIN2可能充当双功能信号转导器,N端负责接受上游乙烯信号,并参与乙烯的暗形态反应; C端(EIN2-CEND)则负责激活下游乙烯将信号向下转导[80, 87-88],且EIN2-CEND可被F-box蛋白EIN2 Targting Protein 1/2(ETP1/2)识别,并经由蛋白酶体依赖的泛素化降解途径降解[81, 86]。迄今为止,关于EIN2的生化功能及调控乙烯信号转导的分子机制仍不十分清楚,但已知EIN2是目前唯一的单基因功能缺失突变导致拟南芥乙烯完全不敏感的基因[88-89],表明EIN2在乙烯信号转导通路中占据核心地位; 且近年来关于解析EIN2的生化功能方面已有突破性进展,Li等[90]揭示EIN2是介导下游组分EBF1/2(EIN3-binding F-box protein 1/2)mRNA 3'UTR翻译抑制的必要组分,其通过介导EBF1/2,从而调控乙烯信号转导的分子机制,并解析了一种涉及EIN2、EIN5及EBF1/2非编码区共同组成的乙烯信号转导新机制。除乙烯信号通路,其他信号途径中也筛选到EIN2突变体,表明EIN2可能在其他信号途径中也起作用,或为多种信号途径交叉点。
3.1.4 EIN3及EILsEIN3及5个EILs(EIL1-EIL5)为正调控因子,由植物特异的转录因子基因家族编码[70]。其中EIL1与EIN3相似度最高,有研究发现,植株中EIN3或EIL1过表达则表现出组成型乙烯表型,EIN3或EIL1单基因功能缺失,突变体表现乙烯部分不敏感,EIN3/EIL1双突变体表现出完全乙烯不敏感,因此,EIN3/EIL1在乙烯信号通路中发挥重要作用,EIN3家族成员间存在功能冗余,其他EILs成员(EIL2-EIL5)可能在特定组织或发育阶段对乙烯反应作用较小[75, 91-92]。EIN3/EILs可与ERF等启动子区内含EIN3结合位点(EIN3-binding site,EBS),也称初级乙烯应答元件(Primary ethylene response element,PERE)上的特定DNA序列结合,继而诱导ERF表达,进行乙烯信号传导[93]。除受EIN2调控,EIN3/EIL1蛋白的积累和稳定性还受到其上游的F-box蛋白EBF1/EBF2泛素化降解,EBF1/EBF2通过介导EIN3等转录因子而间接对乙烯信号进行负调控[94]。此外,EIN3/EIL1也是与其他信号通路进行交叉对话的重要节点[89]。
3.1.5 ERF乙烯反应元件结合蛋白(Ethylene-resp-onsive element binding protein,ERF也称EREBP),为乙烯信号转导途径中最下游元件,属AP2/ERF转录因子超家族,具1个AP2/ERF结构域[95],为植物特有转录因子,在植物体内分布广泛,基因家族庞大,研究表明,每种植物有100种以上ERF转录因子,于植物生长发育、激素信号转导及各种胁迫过程中起重要作用[95-98]。根据与不同顺式作用元件的结合,ERF家族可分为2个主要亚家族:即ERF和CBF/DREB亚家族。ERF亚家族可结合GCC-box(序列AGCCGCC)调控植物抗病相关基因及其他信号途径的基因表达; CBF/DREB亚家族可结合脱水响应元件DRE盒(TACCGACAT)或CRT元件(A/GCCGAC)调控植物对非生物胁迫的响应性等[70, 80, 95-96]。近年来,关于ERF在调控植物发育代谢及激素信号转导等方面相关研究已广泛开展,但ERF类转录因子家族成员众多,功能存在冗余,组学分析难以明确单个家族成员的具体功能[99]。尽管越来越多的研究表明,ERF蛋白在植物成熟过程中起重要作用,但ERF蛋白在植物成熟研究中相关乙烯生物合成的转录调控机制仍不完全清楚,信息尚少[100],且其真正参与乙烯信号调控的可能较少。目前,已知ERF1为EIN3/EILs的直接作用目标,其超表达突变体表现部分组成性乙烯反应,为正转录调控因子[93, 101]。
3.2 乙烯信号转导途径中介导花衰老相关基因的研究近年来,已广泛开展乙烯信号转导相关基因介导花发育与衰老进程的相关研究,研究证明,乙烯信号转导基因可影响花卉植物发育衰老进程,以下列举部分研究成果。研究发现,不同植物乙烯受体ETR基因家族成员在花发育与衰老过程中表达情况有所不同:腊梅乙烯受体基因CpETR-1-CpETR-3转录水平与腊梅花开放衰老进程关联紧密,经qRT-PCR,发现CpETR-1与CpETR-2表达量随腊梅花期变迭有一致变化规律,CpETR-3的表达在花开放前期变化不明显,但三者在衰老期增幅均达显著水平,且三者表达均受乙烯作用抑制剂1-MCP和外源乙烯影响,表明乙烯受体基因参与调控蜡梅花朵开放衰老进程[102];田晓岩等[103]克隆了文心兰乙烯受体基因OnERS1,结合切花衰老进程乙烯释放量和OnERS1时空特异性表达,推测OnERS1为花衰老功能基因,并负调控乙烯反应。Chen等[104]克隆了文心兰OgEIL1和OgEIL2,并进行表达分析,结果表明,OgEIL1和OgEIL2的表达均与乙烯相关,两者均参与调控文心兰花的衰老,OgEIL1的功能与拟南芥EIN3相同,并推测OgEIL1对外源乙烯更敏感,而OgEIL2对内源乙烯敏感。ERF类转录因子在调控乙烯响应前景也越来越受到关注,在观赏植物方面,Liu等[105]对矮牵牛中13个ERF基因进行分析,发现其第Ⅶ组ERF基因与花瓣和雌蕊乙烯产量增加有很强关联,可能与矮牵牛花衰老相关。吴凡等从“洛阳红”牡丹切花中分离3个ERF基因(PsERF1-PsERF3),并分别检测其乙烯敏感型“洛阳红”和乙烯不敏感型“雪映桃花”牡丹中不同花发育时期中表达情况,其中PsERF1在两品种花瓣中表达量显著高于其他花器官,其表达量在“洛阳红”切花发育过程中逐渐增加,而在“雪映桃花”切花中逐渐降低,推测其为牡丹切花乙烯信号转导途径关键基因,而PsERF2和PsERF3则可能同时参与多种信号途径,其中,PsERF2可能参与乙烯与ABA信号途径的互作[99]。此外,乙烯参与调控植物性别分化,当内源乙烯积累一定量便可持续调控雄花向雌花转化,印度南瓜性别分化过程中,EIN3-like在乙烯生成过程中起关键正调控作用,促乙烯产生,而CpETR1、CTR-like、CpCTR1和CpCTR2在雄花中负调控乙烯信号传导[106]。
通过研究发现,很多花对乙烯敏感,而不同植物乙烯信号转导组分在花发育及衰老过程中具不同转录调节特性,可根据乙烯信号转导标准模式,通过调节乙烯信号转导基因表达得到多条途径延缓花衰老,并调控花对乙烯的敏感性。
4 乙烯生物合成及信号转导途径中其他相关酶的研究乙烯反应是一个复杂的植物生理学过程,与很多其他通路相互影响耦连,除乙烯标准路径中关键酶,还有其他酶可通过影响乙烯上下游反应从而调控乙烯。有研究者发现:拟南芥中CIPKL可参与乙烯生物合成,AtCIPKL蛋白对ACC和乙烯利敏感性反应具差异,AtCIPKL过表达植株乙烯含量明显降低,推测AtCIPKL作为负调控参与乙烯生物合成中ACC转化为乙烯过程,通过影响AtACO2活性从而改变乙烯的含量[107];某些花发育相关基因也与植株的衰老有关,如Chen等[108-110]认为FOREVER YOUNG FLOWER(FYF)可能抑制花器官衰老与脱落:其通过参与乙烯反应,有效抑制乙烯反应下游基因的表达,且研究表明,转FYF的植株对乙烯不敏感,花衰老显著延迟,通过研究拟南芥中FYF与乙烯响应DNA结合因子(Ethylene response DNA-binding factors,EDFs)的关系,发现EDF1/EDF2/EDF3/EDF4异位表达将激活衰老相关基因并促进花衰老/脱落,而FYF通过激活一个ERF基因(FUF1),负调控乙烯响应中下游基因EDF1/EDF2/EDF3/EDF4,从而调节花衰老/脱落; bHLH转录因子也可能影响乙烯反应,Jing等[111]研究表明,bHLH转录因子基因PhFBH4在矮牵牛花衰老其间显著上调,通过调控乙烯生物合成途径而影响植物生长发育,沉默或过表达矮牵牛中PhFBH4可降低或增加ACS1和ACO1的转录本丰度,从而影响乙烯产量,其中ACS1是PhFBH4蛋白的直接靶点。此外,还有ARGOS[112]、PIF3[113-114]、PIF5[115]等基因也可通过影响乙烯途径相关酶从而作用于乙烯反应。
5 小结与展望近年来,国内外对于乙烯生物合成及信号转导通路的认识已取得长足进步,但对于信号通路的精细调节机制以及整个乙烯反应与植物其他信号途径之间的交叉反应还需更为深入的研究。此外,围绕乙烯在开花和衰老相关研究虽已有一定基础,但利用基因工程手段从根本上调控乙烯生成,获得花期延长的转基因植物还未大规模研究。目前,大多数仍处于乙烯反应相关基因克隆阶段。成功案例主要是某些应用广的观赏花卉,对于可药用及食用花类等研究尚少。
调控植物乙烯合成和传导进程对调控花开放和衰老进程的快慢具有十分重要的研究意义,且利用基因转导技术延长花期是花类育种的有效手段。目前,在分子水平上,通过调控乙烯反应从而获得长花期植物主要有以下途径:(1)采用分子生物学方法沉默或抑制乙烯生物合成有关酶基因的表达,减少合成乙烯的前体,降低花瓣对乙烯的敏感性,如导入SAM水解酶、导入反义或正义的ACS或ACO、导入ACC脱氨酶基因等。(2)通过基因工程阻断乙烯信号转导途径,沉默或抑制信号转导相关功能基因或导入其突变基因等,从而改变植物组织对乙烯的响应。
除一些观赏切花,许多药用及食用花类如金银花、山银花、三七花、黄花菜、槐花等也存在花期短,易凋谢,花蕾入用等缺陷。将调控乙烯反应从而延缓花衰老的研究应用于其他经济价值高、应用广的药用及食用花类等很有前景。对已报道的短花期药材或作物,研究者们亦可利用生物手段,对目的植株乙烯生物合成及信号转导途径相关基因进行克隆和遗传操作,从基因水平上延缓衰老,获得长花期、高品质的优良转基因育种,从而提高其经济价值和利用价值,对增加农民收入和调整产业结构有重大意义。
| [1] |
江苏新医学院. 中药大辞典[M]. 上海: 上海科学技术出版社, 2002.
|
| [2] |
Lin ZF, Zhong S, Grierson D. Recent advances in ethylene research[J]. Journal of Experimental Botany, 2009, 60(12): 3311-3336. DOI:10.1093/jxb/erp204 |
| [3] |
张丽艳, 严翔, 方贻文, 等. 果蔬成熟乙烯生物合成与调控研究进展[J]. 现代园艺, 2014(11): 12-15. |
| [4] |
刘进平. 乙烯生物合成关键酶基因研究进展[J]. 热带农业科学, 2013, 33(1): 51-57. DOI:10.3969/j.issn.1009-2196.2013.01.012 |
| [5] |
余义勋, 刘娟旭, 刘玲. 花衰老相关的乙烯信号转导基因研究进展[J]. 生物技术通讯, 2008, 19(3): 472-474. DOI:10.3969/j.issn.1009-0002.2008.03.044 |
| [6] |
Rogers HJ. From models to ornamentals:how is flower senescence regulated?[J]. Plant Molecular Biology, 2013, 82(6): 563-574. DOI:10.1007/s11103-012-9968-0 |
| [7] |
Tripathi SK, Tuteja N. Integrated signaling in flower senescence[J]. Plant Signaling & Behavior, 2007, 2(6): 437-445. |
| [8] |
van Doorn WG, Woltering EJ. Physiology and molecular biology of petal senescence[J]. Journal of Experimental Botany, 2008, 59(3): 453-480. DOI:10.1093/jxb/erm356 |
| [9] |
陈驰.大丽花花瓣衰老相关基因结构与表达特征的研究[D].苏州: 苏州大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10285-1015406348.htm
|
| [10] |
Ronen M, Mayak S. Interrelationship between abscisic acid and ethylene in the control of senescence processes in carnation flowers[J]. Journal of Experimental Botany, 1981, 32(129): 759-765. |
| [11] |
Yand SF, Hoffman NE. Ethylene biosynthesis and its regulation in higher plants[J]. Annu Rev Plant Physiol, 1984, 35(1): 155-189. DOI:10.1146/annurev.pp.35.060184.001103 |
| [12] |
魏文辉, 王力军, 覃瑞, 等. 牡丹切花衰老过程中内源激素水平变化的研究[J]. 湖北民族学院学报:自然科学版, 2000, 18(4): 1-6. |
| [13] |
田晓岩, 刘进平.生长调节物质对花瓣衰老的调控作用[C]//中国观赏园艺研究进展论文集.青岛: 中国园艺办公观赏园艺专业委员会, 2014: 454-461.
|
| [14] |
刘建新, 丁华侨, 郁永明, 等. 擎天凤梨SAMs基因的分离及开花期的表达分析[J]. 核农学报, 2017, 31(4): 671-679. |
| [15] |
Mcmurchie EJ, Mcglasson WB, Eaks IL. Treatment of fruit with propylene gives information about the biogenesis of ethylene[J]. Nature, 1972, 237(5352): 235-236. DOI:10.1038/237235a0 |
| [16] |
黄凤兰, 解立波, 李国瑞, 等. 乙烯信号转导与合成基因在延长花期中的应用[J]. 内蒙古民族大学学报:自然科学版, 2009, 24(2): 176-179. DOI:10.3969/j.issn.1671-0185.2009.02.018 |
| [17] |
Lieberman M, Mapson LW. Genesis and Biogenesis of Ethylene[J]. Nature, 1964, 204(4956): 343-345. DOI:10.1038/204343a0 |
| [18] |
Lieberman M, Kunishi A, Mapson LW, et al. Stimulation of ethylene production in apple tissue slices by methionine[J]. Plant Physiology, 1966, 41(3): 376-382. DOI:10.1104/pp.41.3.376 |
| [19] |
Adams DO, Yang SF. Ethylene biosynthesis:Identification of 1-aminocyclopropane-1-carboxylic acid as an intermediate in the conversion of methionine to ethylene[J]. Proc Natl Acad Sci USA, 1979, 76(1): 170-174. DOI:10.1073/pnas.76.1.170 |
| [20] |
朱晓仙.玉簪花中3个乙烯生物合成相关基因的克隆及其表达分析[D].金华: 浙江师范大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10345-1012486514.htm
|
| [21] |
Larsen PB. Mechanisms of ethylene biosynthesis and response in plants[J]. Essays in Biochemistry, 2015, 58: 61-70. DOI:10.1042/bse0580061 |
| [22] |
Bakshi A, Shemansky JM, Chang C, et al. History of research on the plant hormone ethylene[J]. Journal of Plant Growth Regulation, 2015, 34(4): 809-827. DOI:10.1007/s00344-015-9522-9 |
| [23] |
Liu CY, Lü RH, Li J, et al. Characterization and expression profiles of MaACS and MaACO genes from mulberry(Morus alba L.)[J]. Journal of Zhejiang University Science B, 2014, 15(7): 611-623. DOI:10.1631/jzus.B1300320 |
| [24] |
周琦, 郑幸果, 何辉煌, 等. 植物S-腺苷甲硫氨酸合成酶的新功能展望[J]. 生命的化学, 2017, 37(4): 521-527. |
| [25] |
吴秋红, 张自德, 王峰. 红树植物杯萼海桑Sams基因的克隆与生物信息学分析[J]. 广西植物, 2013, 33(6): 846-851. |
| [26] |
Kim SB, Yu JG, Lee GH, et al. Characterization of Brassica rapa S-adenosyl-L-methionine synthetase gene including its roles in biosynthesis pathway[J]. Horticulture Environment & Biotechnology, 2012, 53(1): 57-65. |
| [27] |
Peleman J, Saito K, Cottyn B, et al. Structure and expression analyses of the S -adenosylmethionine synthetase gene family in Arabidopsis thaliana[J]. Gene, 1989, 84(2): 359-369. DOI:10.1016/0378-1119(89)90510-6 |
| [28] |
Peleman J, Boerjan W, Engler G, et al. Strong cellular preference in the expression of a housekeeping gene of Arabidopsis thaliana encoding s-adenosylmethionine synthetase[J]. The Plant Cell, 1989, 1: 81-93. DOI:10.1105/tpc.1.1.81 |
| [29] |
Breusegem FV, Dekeyser R, Gielen J, et al. Characterization of a S-adenosylmethionine synthetase gene in rice[J]. Plant Physiology, 1994, 105: 1463-1464. DOI:10.1104/pp.105.4.1463 |
| [30] |
Larsen PB, Woodson WR. Cloning and nucleotide sequence of a S-adenosylmethionine synthetase cdna from carnation[J]. Plant Physiology, 1991, 96(3): 997-999. DOI:10.1104/pp.96.3.997 |
| [31] |
Li XD, Xia B, Wang R, et al. Molecular cloning and characteriza-tion of S-adenosylmethionine synthetase gene from Lycoris radiata[J]. Molecular Biology Reports, 2013, 40(2): 1255-1263. DOI:10.1007/s11033-012-2168-9 |
| [32] |
冯艳飞, 梁月荣. 茶树S-腺苷甲硫氨酸合成酶基因的克隆和序列分析[J]. 茶叶科学, 2001, 21(1): 21-25. |
| [33] |
Ding C, Chen T, Yang Y, et al. Molecular cloning and characteriza-tion of an S-adenosylmethionine synthetase gene from Chorispora bungeana[J]. Gene, 2015, 572(2): 205-213. DOI:10.1016/j.gene.2015.07.062 |
| [34] |
Yamagami T, Tsuchisaka A, Yamada K, et al. Biochemical diversity among the 1-amino-cyclopropane-1-carboxylate synthase isozymes encoded by the Arabidopsis gene family[J]. Journal of Biological Chemistry, 2003, 278(49): 49102-49112. DOI:10.1074/jbc.M308297200 |
| [35] |
吕淑芳, 江静. 拟南芥乙烯合成酶acs基因家族研究进展[J]. 生物技术通报, 2014, 30(11): 7-13. |
| [36] |
骆兴菊.植物激素脱落酸通过诱导乙烯的生物合成抑制拟南芥主根生长[D].北京: 中国农业大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10019-1014221235.htm
|
| [37] |
魏云潇, 叶兴乾. 果蔬采后成熟衰老酶与保护酶类系统的研究进展[J]. 食品工业科技, 2009, 30(12): 427-431. |
| [38] |
Gupta A, Pal RK, Rajam MV. Delayed ripening and improved fruit processing quality in tomato by rnai-mediated silencing of three homologs of 1-aminopropane-1-carboxylate synthase gene[J]. Journal of Plant Physiology, 2013, 170(11): 987-995. DOI:10.1016/j.jplph.2013.02.003 |
| [39] |
Oeller PW, Lu MW, Taylor LP, et al. Reversible inhibition of tomato fruit senescence by antisense RNA[J]. Science, 1991, 254(5030): 437-439. DOI:10.1126/science.1925603 |
| [40] |
白云凤, 张爱萍, 闫建俊, 等. 靶向番茄slACS2基因crispr-cas9 sgRNA的设计和分析[J]. 生物信息学, 2017, 15(1): 7-15. DOI:10.3969/j.issn.1672-5565.2017.01.201609002 |
| [41] |
Martínez C, Manzano S, Megías Z, et al. Molecular and functional characterization of cpacs27a, gene reveals its involvement in monoecy instability and other associated traits in squash(Cucurbita pepo L.)[J]. Planta, 2014, 239(6): 1201-1215. DOI:10.1007/s00425-014-2043-0 |
| [42] |
Ma N, Cai L, Lu WJ, et al. Exogenous ethylene influences flower opening of cut roses(Rosa hybrida)by regulating the genes encoding ethylene biosynthesis enzymes[J]. Science in China, 2005, 48(5): 434-444. DOI:10.1360/062004-37 |
| [43] |
孙申申, 温秀萍, 杨菲颖, 等. '云香'水仙ACC合成酶基因NtACS1的克隆及遗传转化[J]. 西北植物学报, 2017, 37(2): 250-257. |
| [44] |
孙申申. '云香'水仙ACS基因和ACO基因的克隆分析及遗传转化[D].福州: 福建农林大学, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10389-1018180010.htm
|
| [45] |
Shi LS, Liu JP. Molecular cloning and expression analysis of an 1-aminocyclopropane-1-carboxylate synthase gene from Oncidium gower ramsey[J]. Biochemical & Biophysical Research Communications, 2016, 469: 203-209. |
| [46] |
熊莉.拟南芥ACS7基因转录后调控机制的研究[D].天津: 南开大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10055-1015566369.htm
|
| [47] |
Ludwików A, Ciesla A, Kasprowicz-Maluskl A, et al. Arabidopsis protein phosphatase 2C ABI1 interacts with type Ⅰ ACC synthases and is involved in the regulation of ozone-induced ethylene biosynthesis[J]. Molecular Plant, 2014, 7(6): 960-976. DOI:10.1093/mp/ssu025 |
| [48] |
Christians MJ, Gingerich DJ, Hansen M, et al. The BTB ubiquitin ligases ETO1, EOL1 and EOL2 act collectively to regulate ethylene biosynthesis in Arabidopsis by controlling type-2 ACC synthase levels[J]. The Plant Journal, 2009, 57(2): 332-345. DOI:10.1111/tpj.2009.57.issue-2 |
| [49] |
Skottke KR, Yoon GM, Kieber JJ, et al. Protein phosphatase 2A controls ethylene biosynthesis by differentially regulating the turnover of ACC synthase isoforms[J]. PLoS Genetics, 2011, 7(4): 1-13. |
| [50] |
Prasad ME, Schofield A, Lyzenga W, et al. Arabidopsis RING E3 ligase XBAT32 regulates lateral root production through its role in ethylene biosynthesis[J]. Plant Physiology, 2010, 153(11): 1587-1596. |
| [51] |
Lyzenga WJ, Booth JK, Stone SL. The Arabidopsis RING-type E3 ligase XBAT32 mediates the proteasomal degradation of the ethylene biosynthetic enzyme, 1-aminocyclopropane-1-carboxylate synthase 7[J]. The Plant Journal, 2012, 71: 23-34. DOI:10.1111/tpj.2012.71.issue-1 |
| [52] |
牛苏燕.蝴蝶兰ACC合成酶(ACS)反义基因植物表达载体的构建及遗传转化[D].郑州: 河南农业大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10466-1013137624.htm
|
| [53] |
王宇腾, 崔波, 蒋素华, 等. 蝴蝶兰acc氧化酶和acc合成酶融合反义表达载体的构建[J]. 河南农业科学, 2011, 40(6): 115-117, 121. DOI:10.3969/j.issn.1004-3268.2011.06.032 |
| [54] |
孙晶.利用RNA干扰技术抑制洋桔梗ACC合酶基因表达的研究[D].南京: 南京师范大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10319-1015505833.htm
|
| [55] |
Trusov Y, Botella JR. Silencing of the acc synthase gene acacs2 causes delayed flowering in pineapple[Ananas comosus(L.)merr. ][J]. Journal of Experimental Botany, 2006, 57(14): 3953-3960. DOI:10.1093/jxb/erl167 |
| [56] |
孙梦婷, 范晓蕾, 郭荣波, 等. 生物乙烯研究进展[J]. 生物技术通报, 2016, 32(2): 38-45. |
| [57] |
姚雪, 侯和胜. 高等植物aco基因研究进展[J]. 安徽农学通报, 2013, 19(1/2): 16-17. |
| [58] |
Zhao DQ, Tao J, Zhou CH, et al. Expression, cloning and characterization of acc synthase and acc oxidase genes in Paeonia lactiflora[J]. International Journal of Agriculture & Biology, 2014, 16(4): 777-782. |
| [59] |
Tanase K, Otsu S, Satoh S, et al. Expression levels of ethylene biosynthetic genes and senescence-related genes in carnation(Dianthus caryophyllus L.)with ultra-long-life flowers[J]. Scientia Horticulturae, 2015, 183: 31-38. DOI:10.1016/j.scienta.2014.11.025 |
| [60] |
田晓岩, 石乐松, 潘英文, 等. 文心兰OnACO2基因的克隆及表达分析[J]. 分子植物育种, 2015, 13(7): 1602-1610. |
| [61] |
李栀恩.番茄ACC氧化酶家族基因的表达研究及其在果实乙烯合成过程中的功能分析[D].重庆: 重庆大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10611-1012048725.htm
|
| [62] |
Jafari Z, Haddad R, Hosseini R, et al. Cloning, identification and expression analysis of acc oxidase gene involved in ethylene production pathway[J]. Molecular Biology Reports, 2013, 40(2). |
| [63] |
Blume B, Grierson D. Expression of acc oxidase promoter-gus fusions in tomato and nicotiana plumbaginifolia regulated by developmental and environmental stimuli[J]. Plant Journal, 1997, 12(4): 731-746. DOI:10.1046/j.1365-313X.1997.12040731.x |
| [64] |
Barry CS, Blume B, Bouzayen M, et al. Differential expression of the 1-aminocyclopropane-1-carboxylate oxidase gene family of tomato[J]. Plant Journal, 1996, 9(4): 525-535. DOI:10.1046/j.1365-313X.1996.09040525.x |
| [65] |
孙申申, 温秀萍, 杨菲颖, 等. '云香'水仙ACC氧化酶基因克隆及遗传转化[J]. 园艺学报, 2017, 44(7): 1388-1396. |
| [66] |
孙申申, 温秀萍, 陈晓静. '云香'水仙ACC氧化酶基因的克隆表达分析及其遗传转化与鉴定[J]. 西北植物学报, 2017, 37(9): 1685-1692. |
| [67] |
Sornchai P, Koto R, Burns P, et al. Genetic transformation of dendrobium 'Sonia Earsakul' with antisense Carica papaya ACO1 gene[J]. Modern Applied Science, 2015, 9(12): 125-133. DOI:10.5539/mas.v9n12p125 |
| [68] |
吴晓庆, 谭华山, 张静静, 等. 根瘤农杆菌介导ACO基因转化延长石竹花期的研究[J]. 华中农业大学学报, 2015, 34(6): 21-26. |
| [69] |
张树珍, 汤火龙, 杨本鹏, 等. 康乃馨ACC氧化酶反义基因遗传转化康乃馨的研究[J]. 园艺学报, 2003, 30(6): 699-702. DOI:10.3321/j.issn:0513-353X.2003.06.014 |
| [70] |
徐倩, 殷学仁, 陈昆松. 基于乙烯受体下游转录因子的果实品质调控机制研究进展[J]. 园艺学报, 2014, 41(9): 1913-1923. |
| [71] |
殷学仁, 张波, 李鲜, 等. 乙烯信号转导与果实成熟衰老的研究进展[J]. 园艺学报, 2009, 36(1): 133-140. DOI:10.3321/j.issn:0513-353X.2009.01.022 |
| [72] |
Wen CK. Ethylene in plants[M]. Berlin, Germany: Springer Netherlands, 2015.
|
| [73] |
Shakeel SN, Wang X, Binder BM, et al. Mechanisms of signal transduction by ethylene:overlapping and non-overlapping signalling roles in a receptor family[J]. AoB Plants, 2013, 5: 1-16. |
| [74] |
Hua J, Meyerowitz EM. Ethylene responses are negatively regulated by a receptor gene family in Arabidopsis thaliana[J]. Cell, 1998, 94(2): 261-271. DOI:10.1016/S0092-8674(00)81425-7 |
| [75] |
Alonso JM, Stepanova AN, Solano R, et al. Five components of the ethylene-response pathway identified in a screen for weak ethylene-insensitive mutants in Arabidopsis[J]. Proc Natl Acad Sci USA, 2003, 100(5): 2992-2997. DOI:10.1073/pnas.0438070100 |
| [76] |
Sakai H, Hua J, Chen QG, et al. Etr2 is an etr1-like gene involved in ethylene signaling in Arabidopsis[J]. Proc Natl Acad Sci USA, 1998, 95(10): 5812-5817. DOI:10.1073/pnas.95.10.5812 |
| [77] |
Binder BM, Rodríguez FI, Bleecker AB. The copper transporter ran1 is essential for biogenesis of ethylene receptors in Arabidopsis[J]. Journal of Biological Chemistry, 2010, 285(48): 37263-37270. DOI:10.1074/jbc.M110.170027 |
| [78] |
Resnick JS, Rivarola M, Chang C. Involvement of RTE1 in conformational changes promoting ETR1 ethylene receptor signaling in Arabidopsis[J]. Plant Journal, 2010, 56(3): 423-431. |
| [79] |
刘茜, 谢芳, 邱莉萍, 等. 乙烯受体差异性协作与raf-like蛋白ctr1负调控的乙烯信号转导[J]. 中国科学:生命科学, 2013, 43(12): 1054-1064. |
| [80] |
张弢, 董春海. 乙烯信号转导及其在植物逆境响应中的作用[J]. 生物技术通报, 2016, 32(10): 11-17. |
| [81] |
Ju C, Yoon GM, Shemansky JM, et al. Ctr1 phosphorylates the central regulator EIN2 to control ethylene hormone signaling from the er membrane to the nucleus in Arabidopsis[J]. Proc Natl Acad Sci USA, 2012, 109(47): 19486-19491. DOI:10.1073/pnas.1214848109 |
| [82] |
Qiao H, Shen ZX, Huang SC, et al. Processing and subcellular trafficking of ER-tethered EIN2 control response to ethylene gas[J]. Science, 2012, 338(6105): 390-393. DOI:10.1126/science.1225974 |
| [83] |
Kieber JJ, Rothenberg M, Roman G, et al. Ctr1, a negative regulator of the ethylene response pathway in Arabidopsis, encodes a member of the raf family of protein kinases[J]. Cell, 1993, 72(3): 427-441. DOI:10.1016/0092-8674(93)90119-B |
| [84] |
Bisson MM, Groth G. New insight in ethylene signaling:autokinase activity of etr1 modulates the interaction of receptors and ein2[J]. Molecular Plant, 2010, 3(5): 882-889. DOI:10.1093/mp/ssq036 |
| [85] |
Yoo SD, Cho YH, Tena G, et al. Dual control of nuclear ein3 by bifurcate mapk cascades in c2h4 signalling[J]. Nature, 2008, 451(7180): 789-795. DOI:10.1038/nature06543 |
| [86] |
Qiao H, Chang KN, Yazaki J, et al. Interplay between ethylene, ETP1/ETP2 F-box proteins, and degradation of EIN2 triggers ethylene responses in Arabidopsis[J]. Genes & Development, 2009, 23(4): 512-521. |
| [87] |
张存立, 郭红卫. 乙烯信号转导通路研究[J]. 自然杂志, 2012, 34(4): 219-228. |
| [88] |
Alonso JM, Hirayama T, Roman G, et al. EIN2, a Bifunctional transducer of ethylene and stress responses in Arabidopsis[J]. Science, 1999, 284(5423): 2148-2152. DOI:10.1126/science.284.5423.2148 |
| [89] |
李文阳, 马梦迪, 郭红卫. 植物激素乙烯作用机制的最新进展[J]. 中国科学:生命科学, 2013, 43(10): 854-863. |
| [90] |
Li W, Ma M, Feng Y, et al. Ein2-directed translational regulation of ethylene signaling in Arabidopsis[J]. Cell, 2015, 163(3): 670-683. DOI:10.1016/j.cell.2015.09.037 |
| [91] |
Chao Q, Rothenberg M, Solano R, et al. Activation of the ethylene gas response pathway in Arabidopsis by the nuclear protein ethylene-insensitive3 and related proteins[J]. Cell, 1997, 89(7): 1133-1144. DOI:10.1016/S0092-8674(00)80300-1 |
| [92] |
王彦杰, 张超, 王晓庆, 等. 高等植物EIN3/EILs转录因子研究进展[J]. 生物技术通报, 2012(3): 1-8. |
| [93] |
Solano R, Stepanova A, Chao Q, et al. Nuclear events in ethylene signaling:a transcriptional cascade mediated by ethylene-insensitive3 and ethylene-response-factor1[J]. Genes & Development, 1998, 12(23): 3703-3714. |
| [94] |
An FY, Zhao Q, Ji Y, et al. Ethylene-induced stabilization of ethylene insensitive3 and ein3-like1 is mediated by proteasomal degradation of ein3 binding f-box 1 and 2 that requires ein2 in Arabidopsis[J]. The Plant Cell, 2010, 22(7): 2384-2401. DOI:10.1105/tpc.110.076588 |
| [95] |
高浩, 竺锡武. ERF转录因子研究进展[J]. 现代农业科技, 2017(8): 130-131, 134. DOI:10.3969/j.issn.1007-5739.2017.08.083 |
| [96] |
刘建光, 王永强, 张寒霜, 等. ERF转录因子在植物抗逆境胁迫的研究进展[J]. 华北农学报, 2013, 28(增刊1): 214-218. |
| [97] |
Bolt S, Zuther E, Zintl S, et al. ERF105 is a transcription factor gene of Arabidopsis thaliana required for freezing tolerance and cold acclimation[J]. Plant Cell & Environment, 2017, 40(1): 108-120. |
| [98] |
任昂彦, 孔英珍. 普通烟草ERF转录因子亚家族成员鉴定及表达模式分析[J]. 中国烟草科学, 2017, 38(1): 15-22. |
| [99] |
吴凡, 张超, 郭加, 等. 牡丹切花ERF转录因子基因的分离与表达分析[J]. 园艺学报, 2016, 43(1): 109-120. |
| [100] |
Xiao YY, Chen JY, Kuang JF, et al. Banana ethylene response factors are involved in fruit ripening through their interactions with ethylene biosynthesis genes[J]. Journal of Experimental Botany, 2013, 64(8): 2499-2510. DOI:10.1093/jxb/ert108 |
| [101] |
Klee HJ. Ethylene signal transduction[J]. Plant Physiology, 2004, 135(2): 660-667. DOI:10.1104/pp.104.040998 |
| [102] |
罗江会, 马婧, 刘道凤, 等. 乙烯对蜡梅切花开放衰老及乙烯受体基因表达的影响[J]. 植物生理学报, 2015, 51(2): 253-258. |
| [103] |
田晓岩, 杨翠萍, 胡进, 等. 文心兰OnERS1全长基因克隆及表达分析[J]. 分子植物育种, 2017, 15(4): 1265-1272. |
| [104] |
Chen SY, Tsai HC, Raghu R, et al. Cdna cloning and functional characterization of ethylene insensitive 3 orthologs from oncidium gower ramsey involved in flower cutting and pollinia cap dislodgement[J]. Plant Physiol Biochem, 2011, 49(10): 1209-1219. DOI:10.1016/j.plaphy.2011.05.005 |
| [105] |
Liu J, Li J, Wang H, et al. Identification and expression analysis of erf transcription factor genes in petunia during flower senescence and in response to hormone treatments[J]. Journal of Experimental Botany, 2011, 62(2): 825-840. DOI:10.1093/jxb/erq324 |
| [106] |
杨晓霞.乙烯在印度南瓜(Cucurbita maxima)花发育中的作用机制研究[D].哈尔滨: 东北农业大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10224-1015396980.htm
|
| [107] |
刘春森.拟南芥AtCIPKL在乙烯合成中的功能分析[D].武汉: 华中师范大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10511-1015443808.htm
|
| [108] |
Chen WH, Li PF, Chen MK, et al. Forever young flower negatively regulates ethylene response dna-binding factors by activating an ethylene-responsive factor to control Arabidopsis floral organ senescence and abscission[J]. Plant Physiology, 2015, 168(4): 1666-1683. DOI:10.1104/pp.15.00433 |
| [109] |
Chen MK, Hsu WH, Lee PF, et al. The mads box gene, forever young flower, acts as a repressor controlling floral organ senescence and abscission in Arabidopsis[J]. The Plant Journal, 2011, 68(1): 168-185. DOI:10.1111/j.1365-313X.2011.04677.x |
| [110] |
Chen MK, Lee PF, Yang CH. Delay of flower senescence and abscission in Arabidopsis transformed with an forever young flower homolog from Oncidium orchid[J]. Plant Signaling & Behavior, 2011, 6(11): 1841-1843. |
| [111] |
Jing Y, Chang XX, Kasuga T, et al. A basic helix-loop-helix transcription factor, PhFBH4, regulates flower senescence by modulating ethylene biosynthesis pathway in petunia[J]. Horticulture Research, 2015, 2(15059): 1-9. |
| [112] |
Shi J, Habben JE, Archibald RL, et al. Overexpression of argos genes modifies plant sensitivity to ethylene, leading to improved drought tolerance in both Arabidopsis and maize[J]. Plant Physiology, 2015, 169(1): 266-282. |
| [113] |
Leivar P, Monte E. Pifs:systems integrators in plant development[J]. The Plant Cell, 2014, 26(1): 56-78. |
| [114] |
Zhong SW, Shi H, Xue C, et al. A molecular framework of light-controlled phytohormone action in Arabidopsis[J]. Current Biology, 2012, 22(16): 1530-1535. DOI:10.1016/j.cub.2012.06.039 |
| [115] |
Khanna R, Shen Y, Marion CM, et al. The basic helix-loop-helix transcription factor pif5 acts on ethylene biosynthesis and phytochrome signaling by distinct mechanisms[J]. The Plant Cell, 2007, 19(12): 3915-3929. DOI:10.1105/tpc.107.051508 |





