2. 西南民族大学 青藏高原动物遗传资源保存与利用教育部重点实验室,成都 610041;
3. 西藏自治区农牧科学院 省部共建青稞和牦牛种质资源与遗传改良国家重点实验室,拉萨 850009
2. Key Laboratory of Qinghai-Tibetan Plateau Animal Genetic Resource Reservation and Utilization, Ministry of Education, Southwest Minzu University, Chengdu 610041;
3. State Key Laboratory of Barley and Yak Germplasm Resources and Genetic Improvement, Tibet Academy of Agricultural and Animal Husbandry Sciences, Lhasa 850009
青藏高原作为世界上海拔最高,面积最大的高原,具有高寒、低氧、干燥及紫外线强等特点。牦牛(Bos grunniens)作为青藏高原所特有的一种大型哺乳类动物,为高原牧民提供奶、肉、皮、毛和役力等生产生活资料,是研究高寒耐缺氧的重要经济动物。目前,全世界有牦牛1 400余万头,其中95%的牦牛分布于我国,是世界上拥有牦牛数量和品种(类群)最多的国家[1-4]。
缺氧上调蛋白1(Hypoxia up regulated 1,HYOU1,又名ORP150)属于热休克蛋白70家族,存在于内质网(Endoplasmic reticulum,ER)中,作为分子伴侣的一个重要组成部分,在蛋白折叠、组装、分泌和跨膜运输等过程中具有重要功能。HYOU1基因首次在低氧环境下的大鼠星形胶质细胞中被发现,位于小鼠11号染色体长臂上[5-8]。该基因转录翻译起始位点有3个可替换的mRNA片段,能产生缺少N末端的信号肽。研究者还发现在其5'UTR中存在顺式作用元件,与应激反应有关;在缺氧状态下,该蛋白在内质网中大量累积,影响蛋白质的折叠与分泌。蛋白质合成紊乱影响细胞正常生理活动,甚至导致细胞功能障碍及凋亡,表明该基因在缺氧条件下,对细胞功能维持具有重要作用[9]。
HYOU1作为一种内质网分子伴侣,当细胞受外界环境(低氧、缺血和高温等)胁迫时,会起到保护细胞及维持细胞活力的作用[10-11]。Liu等[12]研究发现HSP70能维持PC12细胞中的Ca2+,从而防止细胞凋亡并减少缺氧对心肌细胞的损伤。Wei等[13]通过研究发现EMF预处理缺氧心肌细胞后,HSP70表达量显著提升,使得细胞内的Ca2+水平保持稳定,从而对缺氧细胞起到保护作用。Montesi等[14]对骨细胞进行低氧处理72 h后发现,与常氧组相比,低氧组HYOU1 mRNA的表达水平显著提升,而蛋白水平无显著差异,表明在缺氧条件下,HYOU1对细胞正常功能的维持具有重要作用。Krętowski等[15]对表皮纤维细胞进行研究时发现,HYOU1仅在表皮纤维细胞缺氧时才会被诱导表达,表明该蛋白可能在低氧胁迫细胞的保护反应中起重要调控作用。
目前关于HYOU1基因在牦牛上的研究较少,本研究在克隆HYOU1基因CDS区的基础上,利用软件预测分析其蛋白质组成及结构等特点,并结合荧光定量PCR技术,探究其在黄牛和牦牛不同组织中的表达谱,旨在为牦牛研究HYOU1的功能提供基础数据。
1 材料与方法 1.1 材料各取3头4.5周岁、健康、生长状态良好的牦牛(西藏自治区类乌齐县)及三江黄牛(四川省汶川县三江镇),屠宰后立即采集其肌肉、大脑、心脏、肺脏、乳腺及肝脏组织,DEPC溶液冲洗后迅速置于液氮中保存备用。
1.2 方法 1.2.1 总RNA提取及cDNA第一链的合成利用Trizol Reagent提取各组织中的总RNA,并利用电泳及岛津Biospec-Nano微量分光光度计检测RNA的质量及浓度。按照反转录试剂盒PrimeScriptTMRT-PCR Kit的操作步骤,以各组织提取的RNA为模板,合成cDNA第一链。置-20℃冰箱备用。
1.2.2 引物设计与合成根据黄牛HYOU1基因(XM_005897129.2)序列,利用Primer Premier 5.0软件设计PCR特异性引物(表 1)并由英潍捷基(上海)生物技术有限公司合成。
通过生物信息学预测分析HYOU1基因编码蛋白的特性及功能(表 2)。
利用Primer Premier 5.0软件设计HYOU1基因及内参基因GADPH(XM_01-4482068)的特异性荧光定量引物:HYOU1-F(5'-G-AAGACACGAAGCCCATCCC-3')和HYOU1-R(5'-A-GTTCGCTTCTGTCCTGTCG-3');GAPDH-F(5'-CCA-CGAGAAGTATAACAACACC-3')和GAPDH-R(5'-G-TCATAAGTCCCTCCACGAT-3')。荧光定量反应体系(10 μL):ddH2O 3.2 μL,上下引物各0.4 μL,模板DNA 1 μL,SYBR premix Dimer Eraser(2×)5 μL,每个反应3个平行对照。采用T检验法比较HYOU1基因在牦牛及黄牛不同组织中的表达情况,并采用2-ΔΔCT法[16],计算各自的相对表达量及标准差,研究不同组织间的差异表达情况(P < 0.05)。
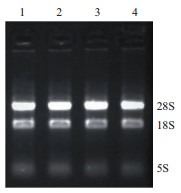
2 结果 2.1 总RNA提取通过Trizol法提取各个组织中的总RNA,并利用1%琼脂糖凝胶电泳检测,结果显示,提取的RNA无降解,条带清晰(图 1)。岛津Biospec-Nano微量分光光度计检测RNA的OD260/OD280均在1.9-2.0之间,说明提取的RNA纯度高,可满足后续实验需求。
|
| 图 1 牦牛组织总RNA琼脂糖凝胶电泳图 |
利用TaKaRa反转录试剂盒将检测合格的RNA反转录成cDNA,再进行RT-PCR扩增,扩增产物经1%的琼脂糖凝胶电泳检测,均出现较亮条带,与预期扩增大小一致(图 2)。

|
| 图 2 牦牛HYOU1基因PCR扩增产物电泳图 A:牦牛HYOU1-1引物PCR产物电泳结果;B:牦牛HYOU1-2引物PCR产物电泳结果 |
测序发现成功扩增HYOU1基因的CDS区。利用DNAstar软件分析发现,HYOU1基因CDS区长度为3 006 bp,其中A、G、C和T含量分别为25.0%、31.1%、26.7%和17.1%,其中A+T含量42.1%,G+C的平均含量57.9%,存在一定碱基偏好性。
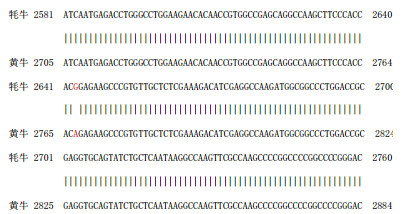
2.2 牦牛HYOU1基因序列分析西藏牦牛HYOU1测序结果与黄牛序列进行比对,两者序列相似性为99.9%。其中第2 643位碱基发生1个碱基突变(ACG→ACA),而氨基酸序列并没有发生改变,因此该核苷酸位点突变为同义突变(图 3)。
|
| 图 3 牦牛与黄牛HYOU1基因序列比对结果 |
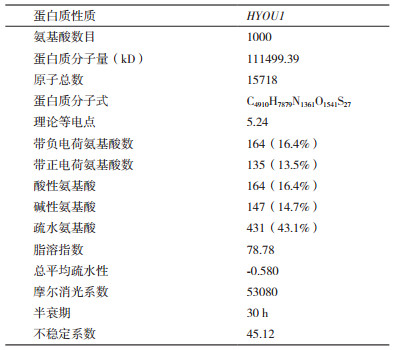
首先利用Expasy中的Translate工具将核苷酸序列转换成氨基酸序列,发现HYOU1基因共编码1000个氨基酸,共包括20种氨基酸,其中谷氨酸Glu(11.30%)、亮氨酸Leu(9.90%)、丙氨酸Ala(9.50%)含量较高,组氨酸His(1.20%)、色氨酸Trp(0.50%)、半胱氨酸Cys(0.40%)含量较低(图 4),再用Expasy中的Protparam工具预测HYOU1氨基酸序列的理化性质,结果见表 3。

|
| 图 4 HYOU1氨基酸组成 |
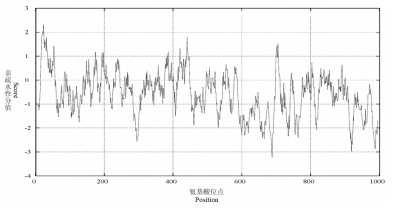
通过Expasy中的Protscale工具分析该蛋白质亲疏水性,发现该氨基酸序列的第28号位的亮氨酸疏水性最强,其峰值为1.829;第989、990号位的脯氨酸、苏氨酸亲水性最强,其峰值均为-2.519。分析表明该蛋白质存在3个高分值(Scare > 1.0)峰,分别位于19-33、376-381和422-435区域,而8个低分值(Scare < -1.5)峰值位于278-289、585-614、642-682、717-721、748-756、899-920、9450、969-981区域(图 5)。该蛋白质的总平均亲水性为-0.580,属于亲水性蛋白。
|
| 图 5 牦牛HYOU1蛋白的疏水性/亲水性预测 正值表示疏水,负值表示亲水;窗口大小为n=9 |
运用PSORT Prediction对牦牛HYOU1蛋白亚细胞定位预测分析,结果表明其分布于内质网(33.3%)、高尔基体(33.3%)、线粒体(22.2%)以及细胞质(11.1%),内质网及高尔基体中分布较多(表 4)。并进一步利用Euk-mPLoc 2.0对HYOU1蛋白质进行亚细胞定位预测和分析,结果显示其位于内质网中,最终认定其分布在内质网中。
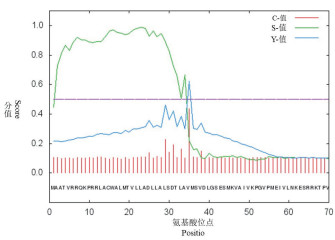
信号肽通常位于分泌蛋白的N端,由3个部分组成:带正电的N端、中间主要功能区以中性氨基酸为主、带负电的小分子氨基酸组成的C端,为信号肽序列切割位点。运用SignalP 4.1在线工具对牦牛HYOU1蛋白质进行信号肽预测分析结果表明,C最高值为0.436,出现在第35位点缬氨酸(V)上,Y值的最高峰也出现在35位点缬氨酸(V)上,为0.622,S-max为0.989,由于高于阈值0.5,说明其有信号肽且其长度约在34个氨基酸长度,并通过S-mean(0.866)和D值(0.754)能初步判断其为分泌蛋白(图 6)。
|
| 图 6 牦牛HYOU1编码蛋白信号肽分析 |
利用TMHMM在线软件对蛋白跨膜结构进行预测分析(图 7),结果表明HYOU1蛋白质中存在一个跨膜螺旋(TMhelix)区,位于第13-35氨基酸位点。

|
| 图 7 牦牛HYOU1蛋白跨膜结构域分析 |
利用KinasePhos对HYOU1氨基酸序列进行磷酸化位点预测(图 8),共发现磷酸化位点66个,其中丝氨酸(S)、苏氨酸(T)和络氨酸(Y)分别为33个、29个及4个。

|
| 图 8 牦牛HYOU1蛋白的磷酸化位点分析 |
使用SMART在线软件对HYOU1蛋白质进行功能结构域预测(图 9),结果表明该氨基酸序列共包含6个低复杂区域和1个跨膜区(第13-35氨基酸位点)结构,并未发现特殊结构域。

|
| 图 9 牦牛HYOU1结构域预测 |
利用Expasy中的Sopma工具对HYOU1蛋白质的二级结构进行预测(图 10),结果发现,二级结构中占比最大的是α-螺旋(46.71%)、其次是随机卷曲(37.92%)和延伸连(10.78%),最少的是β-转角(4.59%)。

|
| 图 10 牦牛HYOU1蛋白二级结构预测 |
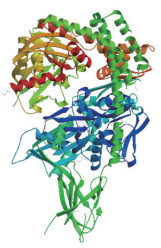
通过Phyre2对HYOU1氨基酸序列进行同源建模,得到三级结构模型,HYOU1蛋白质(62%的序列)已被建模,可信度为100%。其中与数据库中已知蛋白质结构的比对中相似度最高的是hsp70,与目标克隆基因一致。三级结构中主要依旧以无规则卷曲、α-螺旋、延伸链和β-转角构成(图 11),与二级结构预测结果基本一致。
|
| 图 11 牦牛HYOU1蛋白三级结构预测 |
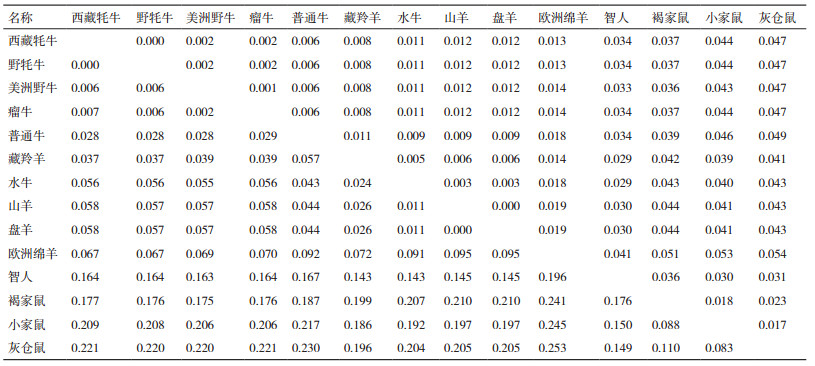
利用MEGA-X软件将西藏牦牛与野牦牛、美洲野牛、水牛、普通牛、瘤牛、山羊、欧洲绵羊、盘羊、藏羚羊、智人、小家鼠、褐家鼠及灰仓鼠,构建系统进化树(图 12)并用Kimura-Two-Parameter模型计算其遗传距离(表 5)。结果发现克隆所得牦牛该基因序列与野牦牛遗传距离最近,符合实际情况。其中与褐家鼠、小家鼠及灰仓鼠的遗传距离最远。该14种动物的总平均值为0.1156325462。系统进化树分析结果与遗传距离分析结果一致。

|
| 图 12 不同哺乳动物HYOU1基因系统进化树 |
利用RT-PCR的方法研究HYOU1基因在牦牛及黄牛六个组织器官中mRNA表达水平,结果表明,HYOU1基因在牦牛及黄牛的六个组织部位广泛表达,并且在牦牛和黄牛的六个组织部位中的表达趋势均表现为肝脏 > 乳腺 > 肺脏 > 大脑 > 心脏 > 肌肉(图 13);且黄牛HYOU1的表达量均显著高于牦牛表达量(P < 0.05)(图 14)。

|
| 图 13 HYOU1基因分别在黄牛及牦牛6组织部位不同表达情况图 A:黄牛6个组织间差异表达情况;B:牦牛6个组织间差异表达情况 |

|
| 图 14 牦牛和黄牛HYOU1基因的mRNA组织表达分析 均为黄牛与牦牛表达量的比较 |
汪琦等[9]对牦牛HYOU1基因多态性研究中发现该基因存在两个SNPs位点,推测rs19683位点的突变对牦牛的高原适应性具有较大影响,但其未进一步对该基因编码的氨基酸序列进行近一步研究。目前暂未发现HYOU1基因在牦牛不同组织中的表达谱及功能研究。
本试验成功克隆西藏齐牦牛HYOU1基因CDS区序列,全长3 006 bp,其中A、G、C和T含量分别为25.0%、31.1%、26.7%和17.1%,G+C含量明显高于A+T含量,存在一定碱基偏好性。HYOU1基因共编码1 000个氨基酸,通过对西藏牦牛HYOU1基因序列分析比较发现,仅存在一个1个碱基突变位点,且该位点突变为同义突变,氨基酸序列未发生变换。
通过对HYOU1基因编码氨基酸序列的理化性质预测,发现HYOU1基因共编码1 000个氨基酸,相对分子质量为111 499.39,分子式为C4910H7879N1361O1541S27,理论等电点为5.24,一般而言,酸性氨基酸的pI值为2.8-3.2,中性氨基酸的pI值区间为4.8-6.3,碱基氨基酸pI为7.6-11.0,因此推测其为中性蛋白。不稳定系数45.12,大于40,说明蛋白质结构不稳定;该蛋白的平均亲水系数为负值(-0.580)且脂溶指数为78.78,为亲水性脂溶蛋白[17]。牦牛HYOU1蛋白信号肽预测分析可初步判定其为分泌蛋白;蛋白跨膜结构预测发现HYOU1蛋白存在一个跨膜螺旋位于13-35号位的氨基酸序列,与结构域预测结果在13-35个氨基酸的位置中出现跨膜区域结果一致。亚细胞定位中发现其主要分布在内质网上。二、三级结构分析表明α-螺旋在二级结构中占有最大比重,在三级结构中α-螺旋、随机卷曲和延伸链占有量最大。
遗传距离分析表明西藏牦牛与野牦牛的遗传距离最近,其次为美洲野牛及其他的牛亚科,之后是羊亚科,最远的是鼠科。结合遗传进化树发现西藏牦牛在牛亚属中先与野牦牛聚类后再与美洲野牛汇聚,在之后与普通牛及瘤牛聚集,最后才与水牛汇聚在一起。该结果与宋大伟在牦牛Y染色体上TSPY、DBY基因及线粒体D-loop区的序列研究结果表明,牦牛首先与野牦牛聚类后与美洲野牛聚类后再与普通牛和瘤牛等组成的分支相聚类的说法基本一致[18]。进化树汇聚方式与动物分类的观点相一致,首先与牛亚科聚集在一块,之后才会与同属于牛科的羊亚科及羚羊属聚集在一块,之后是智人,最后才与鼠科聚集在一块,说明HYOU1基因在不同的物种内都较保守。
组织表达谱分析表明,HYOU1基因在牦牛和黄牛6个组织中广泛表达,牦牛与黄牛中组织表达量由高到低的排序依次为肝脏、乳腺、肺脏、大脑、心脏和肌肉,其中肝脏的表达量显著高于HYOU1基因在其他组织部位的表达,可能与肝脏作为一个以代谢为主的器官,在体内具有去氧化,储存肝糖、分泌蛋白质合成等重要作用有关。这与赵成玉等人通过肝细胞低氧处理后发现,低氧诱导因子(Hypoxia-inducible factors,HIFs)等对肝糖原的调控,影响了整体血液中的血糖浓度从而适应低氧的环境。因此肝脏作为糖代谢及低氧适应性研究中极为重要的一个部位,其表达量可能要高于其他组织器官[19-21]。同一组织部位两两比较后发现,黄牛HYOU1基因表达量均显著高于牦牛的表达量(P < 0.05),其中黄牛肝脏的表达量为牦牛肝脏表达量的4.4倍,这可能与牦牛高原适应有关[22],但是具体机制有待更深一步的研究。
4 结论本研究成功克隆了HYOU1基因的CDS区,通过信息学分析发现HYOU1主要分布于内质网中,同时在HYOU1蛋白上既有信号肽又有跨膜区,是一个分泌性的跨膜蛋白。组织表达谱分析发现HYOU1基因在牦牛各组织部位的表达量均低于黄牛各个组织部位的表达量。
| [1] |
Qiu Q, Zhang G, Ma T, et al. The yak genome and adaptation to life at high altitude[J]. Nature Genetics, 2012, 44(8): 946-949. DOI:10.1038/ng.2343 |
| [2] |
Wang Z, Yonezawa T, Liu B, et al. Domestication Relaxed selective constraints on the yak mitochondrial genome[J]. Molecular Biology & Evolution, 2011, 28(5): 1553-1556. |
| [3] |
钟金城. 牦牛遗传与育种[M]. 成都: 四川科学技术出版社, 1996.
|
| [4] |
国家畜禽遗传资源委员会. 中国畜禽遗传资源志:牛志[M]. 北京: 中国农业出版社, 2011.
|
| [5] |
董传豪, 饶开晴, 徐亚欧, 等. 高原动物的低氧适应性研究进展[J]. 黑龙江畜牧兽医, 2015(17): 57-60. |
| [6] |
Ikeda J, Kaneda S, Kuwabara K, et al. Cloning and expression of cDNA encoding the human 150 kDa oxygen-regulated protein, ORP150[J]. Biochemical & Biophysical Research Communications, 1997, 230(1): 94-99. |
| [7] |
Kuwabara K, Matsumoto M, Ikeda J, et al. Purification and characterization of a novel stress protein, the 150-kDa oxygen-regulated protein(ORP150), from cultured rat astrocytes and its expression in ischemic mouse brain[J]. Journal of Biological Chemistry, 1996, 25(9): 5025-5032. |
| [8] |
Jung TW, Lee KT, Lee MW, et al. SIRT1 attenuates palmitate-induced endoplasmic reticulum stress and insulin resistance in HepG2 cells via induction of oxygen-regulated protein 150[J]. Biochemical & Biophysical Research Communications, 2012, 422(2): 229-232. |
| [9] |
汪琦.牦牛四个低氧适应基因的遗传多态性研究[D].成都: 西南民族大学, 2017.
|
| [10] |
Tamatani M, Matsuyama T, Yamaguchi A, et al. ORP150 protects against hypoxia/ischemia-induced neuronal death.[J]. Nature Medicine, 2001, 7(3): 317-323. DOI:10.1038/85463 |
| [11] |
Ozawa K, Kuwabara K, Tamatani M, et al. 150-kDa oxygen-regulated protein(ORP150)suppresses hypoxia-induced apoptotic cell death[J]. Journal of Biological Chemistry, 1999, 274(10): 6397-6404. DOI:10.1074/jbc.274.10.6397 |
| [12] |
Liu Y, Wang XC, Hu D, et al. Heat shock protein 70 protects PC12 cells against ischemia-hypoxia/reoxygenation by maintaining intracellular Ca2+homeostasis[J]. Neural Regeneration Research, 2016, 11(7): 1134-1140. DOI:10.4103/1673-5374.187051 |
| [13] |
Wei J, Tong J, Yu L, et al. EMF protects cardiomyocytes against hypoxia-induced injury via heat shock protein 70 activation[J]. Chemico-Biological Interactions, 2016, 25(3): 8-17. |
| [14] |
Montesi M, Jähn K, Bonewald L, et al. Hypoxia mediates osteocyte ORP150 expression and cell death in vitro[J]. Molecular Medicine Reports, 2016, 14(5): 4248-4254. DOI:10.3892/mmr.2016.5790 |
| [15] |
Krętowski R, Borzym-Kluczyk M, Cechowska-Pasko M. Hypoxia enhances the senescence effect of bortezomib-the proteasome inhibitor-on human skin fibroblasts[J]. Biomed Research International, 2014, 2014: 196249. |
| [16] |
Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [17] |
景炅婕, 张静, 贾夏丽, 等. 绵羊及相关物种去乙酰化酶1的理化性质和蛋白结构预测[J]. 山西农业大学学报:自然科学版, 2015, 35(2): 124-132. |
| [18] |
宋大伟.牦牛的起源与系统发育分析[D].南京: 南京农业大学, 2008.
|
| [19] |
赵成玉, 圈启芳, 何熠伟, 等.慢性持续性低氧对大鼠肝脏和胰腺GLUT2 mRNA表达的影响[J/OL].中华临床医师杂志, 2015(22): 4148-4152.
|
| [20] |
龚俊艳, 赵成玉. 持续性低氧对糖代谢的调节机制的研究进展[J]. 中国全科医学, 2018, 21(12): 1497-1503. DOI:10.3969/j.issn.1007-9572.2018.00.094 |
| [21] |
龚俊艳, 赵成玉. 持续性低氧大鼠肝脏HIF-2α信号通路变化及对血糖的影响[J]. 中国高原医学与生物学杂志, 2018, 39(2): 89-94. |
| [22] |
韩树鑫, 苟潇, 杨舒黎. 动物低氧适应的生理与分子机制[J]. 中国畜牧兽医, 2010, 37(9): 29-34. |