L-苏氨酸(L-Threonine)被认为是动物体内第二或第三限制性氨基酸, 是人体和动物的必需氨基酸。已被广泛应用于食品、饲料及医药行业[1-2]。目前, 国内外生产L-苏氨酸的主流方法是微生物直接发酵法[3-4]。其中, 大肠杆菌(Escherichia coli)工程菌是目前生产中最为常用的宿主菌株[5]。但是由于其安全性不高, 并且随着代谢的进行, 生产过程中会逐渐积累一些毒素, 故在医药行业中不能使用大肠杆菌生产苏氨酸。相对来说, 无致病性的安全菌株谷氨酸棒状杆菌同样作为氨基酸的传统生产菌株, 其优势就展现出来了。随着谷氨酸棒杆菌模式菌株ATCC 13032测序的完成, 氨基酸合成途径及代谢调控机理逐渐清晰, 以及谷氨酸棒杆菌遗传操作体系的建立和完善, 谷氨酸棒杆菌正成为氨基酸代谢工程改造的基盘菌株[6]。
L-苏氨酸的生物合成是以TCA循环中间代谢物草酰乙酸为前体。底物葡萄糖代谢经过糖酵解途径、磷酸戊糖途径、TCA循环及C3-C4回补途径等中心代谢途径, 由草酰乙酸经天冬氨酸转氨酶催化生成L-天冬氨酸, 即进入L-苏氨酸合成途径。L-天冬氨酸经天冬氨酸激酶(AK, 编码基因lysC)和天冬氨酸半醛脱氢酶(ASD, 编码基因asdA)两步酶催化反应后, 再经过高丝氨酸脱氢酶生成L-高丝氨酸, 经高丝氨酸激酶生成L-磷酰-高丝氨酸, 最后经苏氨酸合酶形成L-苏氨酸[7]。AK由LysC基因编码, 同时受L-苏氨酸、L-赖氨酸、L-甲硫氨酸的协同反馈抑制。天冬氨酸激酶(AK, 编码基因lysC)是合成L-苏氨酸中的关键酶之一, 控制天冬氨酸族合成途径总碳流量。因此, 通过对一些经传统育种方法选育得到的L-苏氨酸生产菌进行组学研究分析, 发现AK和ASD是该合成途径上影响L-苏氨酸产量的关键酶之一[8]。
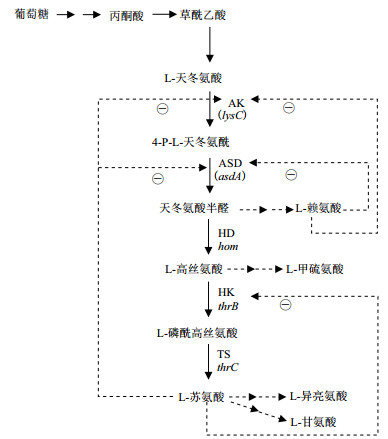
|
| 图 1 L-苏氨酸的生物合成途径 虚线加箭头表示反馈抑制,⊖表示抑制;横线加点虚线表示杂酸方向;大写字母表示酶,斜体字母表示编码该酶的基因 |
Dong等[9]将谷棒杆菌的lysC基因第279位突变点A突变为T解除了L-赖氨酸和L-苏氨酸反馈抑制的能力。其表达lysC基因并且串联表达hom基因和thrB基因使部分碳流量从L-赖氨酸(50%)转移至L-苏氨酸, 使谷氨酸棒杆菌L-苏氨酸产量达到4.85 g/L。徐德雨等[10]发现在高产菌的天冬氨酸激酶AK中存在G359D突变, 验证突变后可阻断赖氨酸引起的别构效应, 从而有效解除赖氨酸与苏氨酸的协同抑制。通过体外天冬氨酸激酶野生型和G359D突变体酶活检测, 其突变体在10 mmol/L赖氨酸和苏氨酸同时存在时酶活达到76.94%±1.61%, 而野生型酶活仅4.38%±1.28%。由此可见, AK酶定点突变可解除L-苏氨酸、L-赖氨酸的协同抑制, 提高酶活, 从而使碳流量更多的流向产L-苏氨酸方向, 达到提高L-苏氨酸产量目的。
本文以选育获得的一株甲硫氨酸和异亮氨酸缺陷(Met-/Ile-)及α-氨基-β-羟基戊酸抗性(AHVr)的谷氨酸棒状杆菌T11(Corynebacterium glutamicum T11)为出发菌株, 通过基因克隆和序列分析, 在已有突变的基础上, 采用PCR介导的方式对lysC基因进行定点突变, 构建L-苏氨酸高效抗反馈抑制的关键酶基因lysCr-asdA串联表达组件转化出发菌株T11, 筛选获得过量积累L-苏氨酸工程菌株, 进行摇瓶和30 L全自动发酵罐分析工程菌的产酸能力、细胞生长及杂酸的积累情况, 为进一步的L-苏氨酸的代谢工程改造奠定基础。
1 材料与方法 1.1 材料 1.1.1 菌株和质粒谷氨酸棒状杆菌T11(C. glutamicum T11)本实验室选育并保藏; 大肠杆菌JM109感受态细胞, 购自于全式金; 穿梭表达载体pZ8-1由中国科学院微生物所李寅研究员赠送。
1.1.2 试剂和仪器限制性内切酶、T4 DNA连接酶、DNA Marker、PrimeStar DNA聚合酶和PCR试剂:TaKaRa宝生物公司产品; 引物合成、sanPreP柱式胶回收DNA试剂盒、质粒小量提取试剂盒:生工生物工程(上海)股份有限公司产品; 点突变试剂盒Fast Mutagenesis System:北京全式金生物技术有限公司; 酵母粉和胰蛋白胨:Bio Basic Inc公司产品; 其余试剂均为国产或进口分析纯。
PCR仪:ABI产品; 电泳仪:DYY-6C北京六一仪器厂; 紫外分光光度计:UV-282PCS, 尤尼柯(上海)仪器有限公司; 电转仪:Eppendorf 2510, 艾本德中国有限公司; 高效液相色谱:岛津公司; 30L发酵罐:镇江东方生物工程设备有限公司。
1.1.3 培养基LB培养基(g/L):胰蛋白胨10, 酵母提取物5, NaCl 10, 若为固体培养基, 则额外添加2.0%(w/v)的琼脂粉。
LBG培养基:LB培养基添加0.5%(w/v)的葡萄糖, 若为固体培养基, 则额外添加2.0%(w/v)的琼脂粉。
上述培养基的pH均调至7.0±0.1大肠杆菌用LB培养基; C. glutamicum用LBG培养基, 其中用于C. glutamicum和E. coli的筛选标记卡那霉素使用的终浓度分别为25 μg/mL和50 μg/mL。
种子培养基各组成质量分数分别为:葡萄糖2.5%, 豆粕提取粉2.0%, 尿素0.125%, 玉米浆2.0%, KH2PO4 0.1%, MgSO4 0.05%, FeSO4·7H2O 0.05%, VB1 100 μg/L, VH 150 μg/L, 20%的氨水调pH 6.9±0.1。
发酵培养基组成质量分数分别为:葡萄糖8%, 豆粕提取粉2.0%, (NH4)2SO4 3.5%, 玉米浆2.0%, KH2PO4 0.1%, MgSO4 0.1%, FeSO4·7H2O 0.05%, CaCO3 3.0%, VB1 100 mg/L, VH 150 mg/L, 20%的氨水调pH 6.9±0.1。
1.2 方法 1.2.1 lysC-asdA串联基因簇的克隆根据C. gluta-micum T11菌株的16S rDNA的序列比对结果, 以谷氨酸棒状杆菌ATCC13869基因组序列为模板, 设计lysC-asdA串联基因簇的上下游引物CA-F、CA-R。
CA-F:5′-CGGAATTCCG GTGGCCCTGGTCGT-ACAGAAATATGGC-3′; CA-R:5′-CGGGATCCCG TTACTTAACCAGCAGCTCAGCG-3′。其中引物CA-F带有EcoRⅠ酶切位点和保护碱基, CA-R带有BamHⅠ酶切位点和保护碱基(下划线序列)。
以C. glutamicum T11菌株基因组为模板进行PCR扩增。反应体系为50 μL:10×Ex buffer 5 μL, 引物CA-F、CA-R各2 μL, 基因组DNA模板0.5 μL, dNTP 2.5 μL, Ex Taq酶1 μL, ddH2O补足至50 μL。反应条件为:95℃预变性5 min; 95℃ 40 s, 57℃ 40 s, 72℃ 2.5 min, 35个循环; 72℃延伸5 min。PCR产物1%的琼脂糖凝胶检测, 胶回收试剂盒纯化回收, 备用。
1.2.2 pZ8-1-lysC-asdA重组载体的构建采用限制性内切酶EcoRⅠ和BamHⅠ分别对串联基因片段lysC-asdA和穿梭表达质粒pZ8-1进行双酶切处理, 分别回收目的片段, 然后用T4 DNA ligase进行连接, 连接体系参考TaKaRa ligase kit说明书。连接反应结束后, 转化E. coli JM109感受态细胞, 转化液涂布含50 μg/mL卡那霉素的LB平板, 37℃倒置培养过夜。从平板上挑选单克隆, 采用验证引物(F:5′-TTCTGGCAAATATTCTGAAATGAGC-3′和R:5′-TTCGCAACGTTCAAATCCGC-3′)进行菌落PCR验证, 并挑取阳性克隆进行37℃过夜培养, 提取质粒, 并对质粒进行酶切和测序验证。
1.2.3 PCR介导的lysC基因的定点突变为了将lysC基因的第279位密码子定点突变, 以阳性克隆质粒pZ8-1-lysC-asdA为模板, 使用携带突变位点的引物Cr-A-F和Cr-A-R, 参考Fast Mutagenesis System说明书, 进行PCR介导的定点突变, 扩增, 挑取抗性平板克隆进行酶切验证, 并将阳性克隆送交上海生工进行测序验证。
lysC基因PCR介导的定点突变引物设计如下:Cr-A-F:5′-CCGATAAGCCAGGCGAGACTGCGAAGGTTTTCCG-3′; Cr-A-R:5′-CAGCCTCGCCTGGCTTATCGGAAATACCCAGAACGG-3′
其中加粗的碱基为引入的突变碱基。提取质粒并进行测序验证, 构建的表达载体命名为pZ8-1-lysCr-asdA, 具体的构建原理如图 2所示。
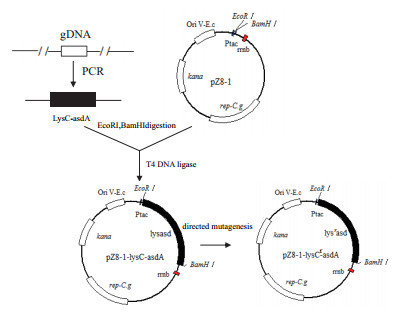
|
| 图 2 重组表达质粒pZ8-1-lysCr-asdA构建示意图 |
将获得的阳性pZ8-1-lysCr-asdA重组质粒电转导入谷氨酸棒状杆菌T11感受态细胞中[11]。谷氨酸棒状杆菌T11感受态细胞按文献制备[12], 抗性平板筛选及菌落PCR验证, 构建含有表达质粒pZ8-1-lysCr-asdA的工程菌株。
1.2.4.2 筛选从抗性平板中挑取菌落大的阳性克隆, 直接接种至每孔含有1 mL发酵培养基的96微孔板初筛, 30℃, 220 r/min培养48 h, 检测发酵液中L-苏氨酸含量, 并对初筛L-苏氨酸积累较多的菌株进行摇瓶发酵复筛和遗传稳定性验证。遗传稳定性分析为每24 h斜面传代一次, 传代5代, 每隔一代进行摇瓶发酵, 检测工程菌株的L-苏氨酸产量。最后选取L-苏氨酸产量较高且遗传稳定的工程菌株进行进一步的发酵分析。
1.2.5 L-苏氨酸工程菌株的摇瓶发酵分析所获得的工程菌T11/pZ8-1-lysCr-asdA经摇瓶发酵后分析其L-苏氨酸含量、菌体生物量以及其他氨基酸的生成情况。摇瓶发酵采用一级发酵, 培养条件为:30℃, 220 r/min发酵60 h, 同时以出发菌株T11为对照菌株。氨基酸的含量采用高效液相色谱系统(HPLC)自动柱前衍生化法测定。色谱柱为Venusil-AA柱。采用流动相组成为水相(1 L):7.6 g无水乙酸钠, 925 mL高纯水, 冰醋酸调pH至6.5;有机相(1 L):80%乙腈。色谱条件:柱温40℃, 流量1.0 mL/min, SPD-M20A检测器。
1.2.6 L-苏氨酸工程菌株的30 L罐补料分批发酵根据摇瓶发酵特性, 结合已有的发酵工艺, 采用二级发酵的方式对L-苏氨酸工程菌株T11/pZ8-1-lysCr-asdA进行补料分批发酵, 考察高密度发酵情形下的L-苏氨酸产率、葡萄糖的利用率及细胞生长情况, 综合评价菌株的发酵潜力。
摇瓶种子培养:挑一环新鲜斜面上的菌体接种至装有30 mL LBG培养基的250 mL三角瓶中, 30℃, 220 r/min振荡培养12 h至对数生长中后期, ΔOD562nm约为0.2×100。
种子罐培养:按0.33%的接种量, 将摇瓶种子液转接至含有3 L种子培养基的5 L种子罐中, 初始搅拌300 r/min, 培养温度30℃, 种子罐周期8 h, 移种ΔOD562nm约为0.30×100。
补料发酵培养:30 L发酵罐初始装液量为15 L, 移种量20%, 初始葡萄糖浓度约125 g/L, 发酵溶氧维持在25%-35%, 初始搅拌转速300 r/min, 发酵温度30℃, 流加25%的氨水以控制pH在6.9-7.0, 发酵期间每隔2 h取样检测菌体生物量及残糖, 根据耗糖速率确定补料量; 当残糖降至5.0 g/L以下时连续流加700 g/L的葡萄糖, 维持残糖浓度在5.0-10 g/L, 发酵结束前4 h, 停止流加葡萄糖, 当残糖基本耗尽时, 发酵结束, 整个发酵周期约60 h。
2 结果 2.1 lysC-asdA串联基因的克隆以谷氨酸棒状杆菌生产菌T11基因组为模板, 引物CA-F、CA-R为引物对扩增出一段约2 300 bp条带, 并对目的产物进行胶回收(图 3), 其与相似基因组ATCC13869的lysC-asdA的理论大小(2 324 bp)基本一致。

|
| 图 3 lysC-asdA基因PCR扩增及回收 M:200 bp Ladder DNA marker;1:PCR产物片段;2:PCR产物胶回收片段 |
转化经酶切的质粒与目的基因, 长出单菌落后随机挑取9个单克隆, 用验证引物直接进行菌落PCR验证, 随机挑取的8个单克隆均为阳性克隆(图 4-A), 筛选菌落PCR阳性的单克隆进行质粒抽提和单切和双切验证, 确认质粒pZ8-1中插入大小约为2 400 bp的目的片段(图 4-B)。另外, 测序结果显示插入的基因片段确为目标片段, 确认pZ8-1-lysC-asdA构建成功。
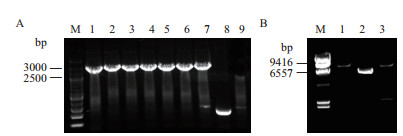
|
| 图 4 重组表达质粒pZ8-1-lysC-asdA的分子验证 A.重组表达质粒pZ8-1-lysC-asdA的菌落PCR验证;B. pZ8-1-lysC-asdA质粒的酶切验证;(A:M:200 bp Ladder DNA marke;1-7:重组表达质粒pZ8-1-lysC-asdA菌落PCR验证;8:pZ8-1空质粒对照;9:T11出发菌株对照;B:M:λ-Hind Ⅲ digest DNA marker;1:pZ8-1-lysC-asdA质粒经BamH Ⅰ单酶切;2:pZ8-1质粒经BamH Ⅰ单酶切;3:pZ8-1-lysC-asdA质粒经EcoR Ⅰ和BamH Ⅰ双酶切) |
值得注意的是, 克隆的lysC-asdA基因较亲缘关系最近(相似性为99%)的ATCC13869存在显著差异, 其lysC基因的ORF区域有多达8个碱基的突变, 其中6个为无义突变, 但该突变在理论上都与密码子识别相关, 另外两个碱基的突变都导致了氨基酸的突变; asdA基因也有4个碱基的突变, 但都是无义突变, 这4个碱基的突变都同样涉及到密码子优化的问题。这极有可能和出发菌株T11本身经历过多轮次的诱变选育有关。pZ8-1-lysC-asdA质粒载体经EcoRⅠ和BamHⅠ酶切后, 出现7 000 bp和2 400 bp的两条带, 与预期结果一致。
为进一步提高lysC基因的抗反馈抑制的能力, 采用PCR介导的方式对lysC基因进行另一关键位点的定点突变。获得的阳性克隆中提取质粒并进行测序分析, 结果显示, 突变后的lysCr-asdA基因与突变前的基因差异在第279位密码子由GCT突变成ACT, 所编码的氨基酸由丙氨酸变为苏氨酸, 与定点突变设计目标一致, 表明表达载体pZ8-1-lysCr-asdA构建成功。
2.3 工程菌株获得及其筛选将获得的含有抗反馈抑制突变的串联表达质粒pZ8-1-lysCr-asdA电转化至L-苏氨酸菌株C. glutamicum T11感受态细胞, 采用含卡那霉素抗性平板进行筛选, 随机挑取单菌落, 验证引物F和R组成的引物对其进行菌落PCR鉴定, 结果显示在约2 800 bp的特异条带, 与理论预测大小一致, 说明外源质粒导入宿主菌株, 成功获得含有表达载体的工程菌。
挑选了300个单克隆进行96孔板初筛, 并从中获得10株生长速度较快且L-苏氨酸含量较高的菌株进行摇瓶复筛和遗传稳定性验证。结果显示, 选取的10株相对高产的菌株中, 几株菌株传至第二代遗传稳定性逐渐降低, 在斜面传至第三代时, 产酸明显下降, 再继续传代, L-苏氨酸产量下降最高达到14.4%。相对而言, 其中一株菌株L-苏氨酸产量最高, 而且稳定性维持在较高水平, 具备进行进一步发酵验证和分析的潜力, 将该工程菌株菌株命名为T11/pZ8-1-lysCr-asdA。
2.4 工程菌株T11/pZ8-1-lysCr-asdA摇瓶发酵产L-苏氨酸能力分析为了分析工程菌株T11/pZ8-1-lysCr-asdA发酵合成L-苏氨酸的能力, 将其与菌株T11/pZ8-1和T11/pZ8-1-lysC-asdA及出发菌株T11在相同条件下进行摇瓶发酵培养, 考察L-苏氨酸浓度、主要杂酸情况及菌株生物量(OD562nm), 结果见表 1。
从L-苏氨酸的生物合成和生物量来说, 菌株T11/pZ8-1-lysCr-asdA的L-苏氨酸的浓度和细胞密度都最高, T11/pZ8-1-lysC-asdA次之, 这说明串联基因簇的表达对于L-苏氨酸的合成与积累作用显著, 而且通过调控其他氨基酸的生物合成, 一定程度上对细胞的生长代谢带来了益处; 转入空载体pZ8-1/T11菌株无论是细胞密度还是L-苏氨酸浓度都是最低的, 这可能与空载体在宿主细胞内消耗了一定的能量, 从而影响细胞繁殖和氨基酸的代谢合成有关。
另外, 从主要杂酸的生物合成情况来看, 出发菌T11与对照菌株T11/pZ8-1的赖氨酸、丙氨酸、和甘氨酸含量接近, 而含有串联基因簇的工程菌株, 其丙氨酸含量显著降低, 但赖氨酸和甘氨酸含量有所提高, 说明lysC-asdA的串联表达加速了前体物丙酮酸的转化, 有效地将碳流量引入了合成苏氨酸的合成途径, 显著提高天冬氨酸族合成代谢流, 但这其中碳流向不仅包括苏氨酸的生物合成, 还有一部分流向了赖氨酸的生物合成, 而甘氨酸作为苏氨酸的降解途径之一, 其生物合成的增加意味着更多的苏氨酸在细胞内被降解。
相比较T11/pZ8-1-lysC-asdA与T11/pZ8-1-lysCr-asdA菌株, lysC基因的突变对于L-苏氨酸的生物合成有积极意义, 其进一步提高了lysC基因编码产物抗反馈抑制的能力, 增强了L-苏氨酸生物合成代谢流。而对于提高L-苏氨酸产量, lysCr-asdA的定点突变和串联表达较lysC-asdA串联表达具有更显著的作用。
2.5 工程菌株T11/pZ8-1-lysCr-asdA 30L罐的补料分批发酵为进一步分析T11/pZ8-1-lysCr-asdA工程菌株的代谢情况, 以出发菌株T11为对照, 在30 L全自动发酵罐中进行补料分批发酵, 考察菌株的发酵生产性能。发酵过程代谢曲线见图 5, 工程菌株T11/pZ8-1-lysCr-asdA L-苏氨酸发酵产量达65.5 g/L, 糖酸转化率达39.5%, 较出发菌株分别提高29.5%和33.9%。
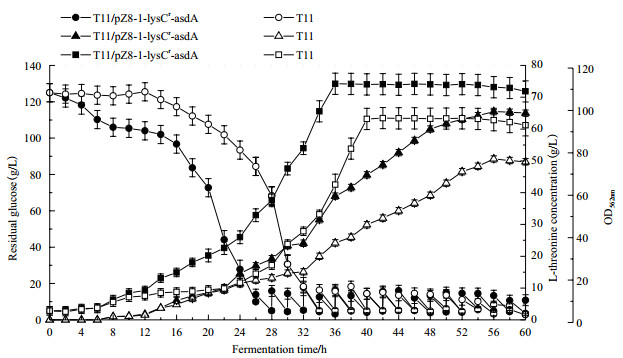
|
| 图 5 T11/pZ8-1-lysCr-asdA工程菌株在30 L罐中的补料分批发酵 |
发酵0-16 h, 菌株处于适应期, 细胞密度均增长较慢, 但细胞的耗糖速率有差别, 工程菌株T11/pZ8-1-lysCr-asdA的耗糖速率明显要大, 说明其细胞更为活跃, 代谢更为旺盛; 发酵16 h之后, 细胞均进入对数生长期, 菌株T11/pZ8-1-lysCr-asdA在发酵24 h开始流加补糖, 36 h时达到最大菌浓, 其最大菌浓时OD562nm为112.6, 补糖时间和达到最大菌浓时间均较对照菌株提前6 h, 最大菌浓也较对照菌株T11高16.8%;发酵36 h后, L-苏氨酸的积累速率明显加快, 两者均在发酵56 h时达到最大的产酸率, 随着发酵的进行, L-苏氨酸的积累和生物量在56 h和60 h之间降低, 因此, 发酵在60 h终止。
3 讨论AK是整个天冬氨酸族氨基酸合成途径上的第一个关键酶, 由lysC基因编码, 控制合成天冬氨酸族氨基酸的碳流量。ASD是继AK后另一个关键限速酶, 这两个基因的转录皆受L-赖氨酸、L-苏氨酸反馈阻遏调控。故对于构建天冬氨酸族氨基酸如L-赖氨酸、L-甲硫氨酸、L-苏氨酸、L-异亮氨酸高产菌株具有重要意义。Kalinowski等[13-14]发现lysC基因与asdA基因是同一基因簇的相邻基因, 其中lysC基因编码蛋白由两个亚基α和β相互重叠组成, 而当β亚基中的一个碱基发生改变时, 整个AK蛋白表现抗反馈特性。本研究以一株Met-、Ile-和苏氨酸结构类似物抗性的苏氨酸产生菌为出发菌株, 在获得已鉴定突变的基础上, 进一步对lysC基因的第279位密码子进行定点突变, 核苷酸由GCT突变为ACT, 所编码的氨基酸由丙氨酸突变苏氨酸, 氨基酸由疏水性变为亲水性, 这可能进一步改变AK的分子构象, 可能Ala279位点具有稳定配体Lys与AK结合的作用, 从而加强了Lys对AK的反馈抑制。故将该位点改变打破了其与Lys间的非共价键作用, 从而解除赖氨酸对天冬氨酸激酶的反馈抑制, 削弱L-苏氨酸和L-赖氨酸对AK酶抑制能力, 同时提升了磷酸-天冬氨酸对AK的亲和能力, 从而增强L-苏氨酸代谢流。这一点, 与工程菌株的苏氨酸生物合成和积累的情况一致, lysC的突变有效的提高了苏氨酸合成的碳流量, 使L-苏氨酸产量提高。
加速限速反应作为菌株选育的常用策略, 除了解除终产物的反馈抑制手段之外, 关键酶基因的高效表达则更能从关键酶的表达量上实现限速反应的加速进程。Ishida等[15]通过构建重组质粒pDR34, 在乳糖发酵短杆菌同时串联表达了hom、thrB和thrC基因, 发酵72 h使得L-苏氨酸产量从17.9 g/L达到24.8 g/L。Dong等[16]将谷氨酸棒杆菌ATCC 13869敲除ddh基因和lysE基因使苏氨酸产量提高28%, 赖氨酸的量降低95%, 同时串联表达lysC、hom和thrB基因进行72 h摇瓶发酵验证苏氨酸含量达到7.27 g/L。本研究以强启动子tac作为起始元件, 在已有菌株特性的基础上, 串联表达抗反馈抑制的关键酶基因, 极大的提高了苏氨酸产量。但在甲硫氨酸和异亮氨酸合成受阻的基础上, 苏氨酸的另一支路——赖氨酸的合成同样得到了增强, 不仅如此, 作为苏氨酸的分解代谢产物之一的甘氨酸的含量也有所增加, 其实这些都和关键酶基因表达之后的代谢流增强有关。这也提示我们在关注苏氨酸积累的同时, 需要进一步系统的考虑其他的支路代谢和氨基酸转运体系, 比如阻断苏氨酸竞争代谢支路, 即抑制或敲除赖氨酸的表达; 降低苏氨酸胞外降解途径, 即敲除合成甘氨酸相关酶基因, 运用代谢流分析的原理与方法对苏氨酸代谢途径进行全面分析, 为我们进一步的改造明确方向。
与摇瓶发酵不同, 30 L罐通过流加补料的方式保持细胞的生长和代谢性能, 其目标产物的产量往往会得到大幅度的增长。值得注意的是, 本研究中工程菌株T11/pZ8-1-lysCr-asdA相较出发菌株T11来说, 其较出发菌株糖耗时间提前, 菌株生长速度加快, 最终体现为菌株发酵产酸时间提前, 展现了更好的高密度发酵的适应性, 较出发菌株其生长速率更快, 原因可能一是改造后菌株的前体物丙酮酸转化成生长抑制物如乳酸、乙酸量降低, 从而减少了细胞生长的伤害, 相对的加速其转化成草酰乙酸方向, 从而使碳流量更多的合成苏氨酸的方向。二是lysCr-asdA基因与含强启动子的pZ8-1载体串联表达不仅使菌株的AK和ASD酶高效表达, 也使碳流量方向途径中其他的酶活得到促进, 从而代谢速率加快, 而且在流加补糖的过程中保持较高的L-苏氨酸的比合成速率, 这说明外源基因的表达不仅直接促进了苏氨酸的合成, 对于细胞生长和其他所需氨基酸的代谢调控也要一定的影响。
4 结论本研究以一株Met-、Ile-和AHV抗性的苏氨酸产生菌T11为出发菌株, 在获得已鉴定突变的基础上, 进一步对lysC基因的第279位密码子进行定点突变同时串联基因簇lysCr-asdA。成功构建pZ8-1-lysCr-asdA表达组件, 串联表达抗反馈抑制的关键酶基因, 转入出发菌株T11并通过96孔板高通量初筛和摇瓶复筛得到一株高产L-苏氨酸且遗传稳定工程菌T11/pZ8-1-lysCr-asdA。发酵结果显示其L-苏氨酸产量显著提高, L-赖氨酸、L-甘氨酸含量均比出发菌株提高, 而丙氨酸的含量下降, 表明lysC的定点突变及lysC、asdA基因的串联表达对谷氨酸棒杆菌L-苏氨酸的代谢流有明显影响。
| [1] |
Debabov VG. The threonine story[J]. Advances in Biochemical Engineering/biotechnology, 2003, 79(1): 113. |
| [2] |
刘元涛, 刘树海. L-苏氨酸性质、应用、生产及市场现状[J]. 发酵科技通讯, 2010, 39(3): 52-54. DOI:10.3969/j.issn.1674-2214.2010.03.021 |
| [3] |
张春. L-苏氨酸生产菌的选育及其发酵条件的优化[D].沈阳: 吉林农业大学, 2011.
|
| [4] |
Becker J, Wittmann C. Bio-based production of chemicals, materials and fuels Corynebacterium glutamicum as versatile cell factory[J]. Current Opinion in Biotechnology, 2012, 23(4): 631-40. DOI:10.1016/j.copbio.2011.11.012 |
| [5] |
Debabov VG, Kozlov JI, Khurges EM, et al. Bacterial strain of Escherichia coli BKⅡM B-3996 as the producer of L-threonine: US, US 7138266 B2[P]. 2006.
|
| [6] |
吕扬勇, 伍展红, 郑穗平. 谷氨酸棒杆菌metX、dapA基因敲除对苏氨酸合成的影响[J]. 生物技术通报, 2011(1): 158-164. |
| [7] |
董迅衍, 王小元. 微生物生产L-苏氨酸的代谢工程研究进展[J]. 食品与生物技术学报, 2016, 35(12): 1233-1240. DOI:10.3969/j.issn.1673-1689.2016.12.001 |
| [8] |
董迅衍, 徐大庆, 李烨, 等. 乳糖发酵短杆菌lysC突变对L-赖氨酸积累的影响[J]. 食品与生物技术学报, 2011, 30(4): 592-596. |
| [9] |
Dong X, Zhao Y, Zhao J, et al. Characterization of aspartate kinase and homoserine dehydrogenase from Corynebacterium glutamicum IWJ001 and systematic investigation of L-isoleucine biosynthesis[J]. J Ind Microbiol Biot, 2016, 43(6): 873-885. |
| [10] |
徐德雨, 郑小梅, 赵晶, 等. 谷氨酸棒杆菌天冬氨酸激酶G359D突变解除赖氨酸与苏氨酸协同抑制的研究[J]. 生物技术通报, 2017, 33(11): 143-152. |
| [11] |
Xu D, Tan Y, Huan X, et al. Construction of a novel shuttle vector for use in Brevibacterium flavum, an industrial amino acid producer[J]. Journal of Microbiological Methods, 2010, 80(1): 86. DOI:10.1016/j.mimet.2009.11.003 |
| [12] |
萨姆布鲁克J, 拉塞尔DW.分子克隆实验指南[M].第3版.黄培堂, 译.北京: 科学出版社, 2008.
|
| [13] |
Kalinowski J, Bachmann B, Thierbach G, et al. Aspartokinase genes lysC alpha and lysC beta overlap and are adjacent to the aspartate beta-semialdehyde dehydrogenase gene asd in Corynebacterium glutamicum[J]. Molecular & General Genetics Mgg, 1990, 224(3): 317-324. |
| [14] |
Kalinowski J, Cremer J, Bachmann B, et al. Genetic and biochemical analysis of the aspartokinase from Corynebacterium glutamicum[J]. Mol Microbiol, 2006, 5(5): 1197-1204. |
| [15] |
Ishida M, Kawashima H, Sato K, et al. Factors improving L-threonine production by a three L-threonine biosynthetic genes-amplified recombinant strain of Brevibacterium lactofermentum[J]. Journal of the Agricultural Chemical Society of Japan, 1994, 58(4): 768-770. |
| [16] |
Dong X, Yue Z, Hu J, et al. Attenuating l -lysine production by deletion of ddh, and lysE, and their effect on l -threonine and l -isoleucine production in Corynebacterium glutamicum[J]. Enzyme & Microbial Technology, 2016(93-94): 70-78. |





