植物生长调节剂是人们根据植物激素的结构、功能或作用原理通过化学合成或从生物中提取得到的一大类物质[1]。在农业生产上主要有提高产量、改善品质、增强抗逆性以及延长储藏期和水果保鲜等作用。目前国内登记的植物生长调节剂品种有40多种, 产品多达960个(中国农药信息网, 2017年12月)。植物生长调节剂的合理使用在农业生产中发挥了重要的作用。徐长宝[2]在进行柿种子发芽实验时使用500 mg/L的赤霉素溶液处理种子, 其发芽率提高了34.7%, 发芽势提高了27.8%, 发芽期也提前了8 d; 宋文[3]将葡萄砧木的基部放在适当的NAA溶液中浸泡后进行嫁接, 使其成活率提高了10%-20%。然而Mao等[4]在植物生长调节剂的毒性实验中已经证明2, 4-D、NAA和BNOA等有机化合物具有一定毒性, 这些化学物质长期积累在食物和环境中可能会造成急性或慢性中毒。据农业部统计全国每年植物生长调节剂使用量约3 000 t, 其中在水果生产中使用广泛, 且用量较大[5]。但目前市场上绝大多数植物生长调节剂是化学合成的, 生物源的仅占2%-3%[6], 因此生物源植物生长调节剂的开发对绿色、安全的生态农业的发展十分重要。
链霉菌属是一类重要的生防菌[7], 其次级代谢不仅能产生各种抗生素, 而且能够产生植物激素类物质如生长素、赤霉素等[8], 有研究报道大多数细菌在次级代谢过程中都能产生如生长素、赤霉素、嗜铁素等物质来促进植物的生长[9]。本实验中的玫瑰黄链霉菌NKZ-259(Streptomyces roseoflavus strain NKZ-259)是由实验室前期分离获得, 研究发现该菌株次级代谢能产生吲哚乙酸(Indole-3-acetic acid, IAA), 其发酵液对辣椒、番茄和小麦等的生长具有明显的促进作用[10]。IAA属于植物生长素类物质, 是植物生长过程中分泌的调节植物生长的信号物质, 能够促进细胞生长、种子发芽和作物生根等[11]。尤桂春等[12]以500 mg/L的IAA溶液处理柠檬枝条, 扦插50 d后其生根率达到90.8%, 与对照相比增加了33.9%;王非等[13]使用20 mg/L的IAA处理齿叶铁线莲种子使其发芽率达到了93.4%, 平均发芽时间缩短了3 d。Aminullah等[14]在研究IAA对大豆产量及品质的影响时发现:在大豆出苗后15 d施用10 mg/L的IAA, 豆子的产量比未喷施IAA增加了20%, 豆子的品质也达到最优水平, 此外IAA在诱导番茄单性结实、提高坐果率等方面也发挥了重要的作用。
目前关于玫瑰黄链霉菌的报道大多是农用抗生素的挖掘及其防病机制研究[15], 也有关于芽孢杆菌等细菌产生促生类物质如细胞分裂素、生长素的报道, 但大多是通过研制活菌制剂发挥微生物对作物生长的作用, 然而大田中活菌制剂的使用常易受活菌数及气候环境等的影响, 效果不稳定。微生物源植物生长调节剂是通过筛选某些在其次级代谢过程中能够产生促生类物质的微生物, 通过发酵技术、分离纯化技术等最终获得较为纯净的物质开发成制剂用于农业生产, 而目前对于微生物源植物生长调节剂开发的报道较为少见, 因此我们期望通过分离提取该菌株代谢产生的IAA来开发微生物源植物生长调节剂。微生物次级代谢产物成分复杂且含量极低, 因此开发微生物源的植物生长调节剂, 次级代谢产物的含量的提高是关键的一步。本研究将通过对菌株的发酵培养基进行优化, 进一步提高菌株次级代谢产生IAA的含量, 从而为后期IAA的分离纯化及制剂开发奠定基础。
1 材料与方法 1.1 材料 1.1.1 供试菌株玫瑰黄链霉菌NKZ-259(Streptomyces roseoflavus strain NKZ-259), 由中国农业科学院植物保护研究所农用抗生素组保存。
1.1.2 供试培养基菌种培养采用MS培养基, 配方参考葛蓓孛等[16]; 种子培养基配方参考侯晓平等[17]; 原始发酵培养基:葡萄糖10 g, 蛋白胨4 g, 酵母膏2 g, 硫酸镁0.5 g, 磷酸二氢钾2 g, 无菌水定容至1 L。
1.2 方法 1.2.1 菌株发酵液制备将保存的玫瑰黄链霉菌NKZ-259接种在MS培养基上于28℃、黑暗条件下培养7 d, 用无菌牙签划下1 cm2大小的菌块接种于种子培养基, 28℃, 200 r/min摇床震荡培养48 h。取1%种子液接种于发酵培养基, 28℃, 220 r/min摇床震荡培养96 h, 滤纸过滤后即得发酵液。
1.2.2 IAA的定性检测取1.2.1制备的发酵液按体积比1:1与salkowski比色液(50 mL 35%HCL+1 mL 0.5 mol/L)混合进行显色反应, 同时以50 g/mL IAA标准溶液做对照, 放置于25℃、黑暗条件下静置30 min, 观察颜色变化, 颜色变为粉红色表示有IAA产生[18-19]。
1.2.3 IAA的定量检测IAA标准曲线的制作参考吴翔等的方法[20]。取1.2.1制备的发酵液2 mL与等体积salkowski比色液混合, 以未接菌的发酵培养基与salkowski比色液等体积混合作为对照, 室温避光放置30 min, 测定其OD530。通过IAA标准曲线计算发酵液中IAA的浓度。
1.2.4 IAA发酵培养基的单因子试验IAA发酵培养基最适碳源的筛选:分别以2%葡萄糖、蔗糖、麦芽糖、乳糖、玉米粉和可溶性淀粉作为单一碳源代替础培养基中的碳源; 以2%葡萄糖作为速效碳源, 分别添加2%蔗糖、麦芽糖、乳糖、玉米粉和1%可溶性淀粉作为复合碳源, 摇床28℃、200 r/min发酵96 h后测定各发酵液中IAA浓度。
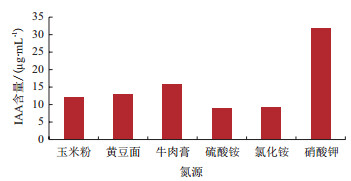
IAA发酵培养基最适氮源的筛选:由于原始培养基中有蛋白胨和酵母膏两种有机氮源, 缺少无机氮源, 因此分别以2%黄豆面、牛肉膏、玉米粉代替基础培养基中的蛋白胨, 再以0.4%的硫酸铵、氯化铵和硝酸钾代替基础培养基中的酵母膏作为无机氮源, 发酵条件及IAA测定方法同上。
IAA发酵培养基最适无机盐的筛选:在原始培养基中分别添加0.04%氯化钠、磷酸氢二钾、氯化镁和硫酸锌作为无机盐, 发酵条件及IAA的测定方法同上。
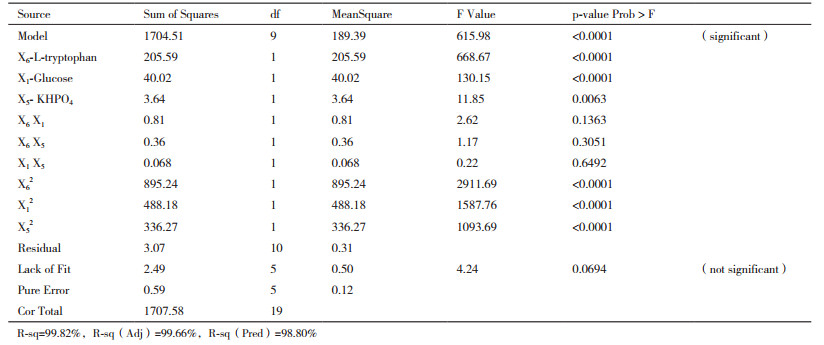
1.2.5 培养基优化试验设计Plackett-Burman法筛选显著影响因子使用Minitab 17软件, 选用n=6的Plackett-Burman法对单因子试验确定的6个成分设计12次试验进行考察, 以X1、X2、X3、X4、X5、X6分别代表葡萄糖、淀粉、蛋白胨、硝酸钾、磷酸氢二钾和L-色氨酸, 每个因素取高低两个水平, 分别以1和-1表示(表 1), 每组试验设计三组平行试验。
中心组合设计(Central composite design, CCD)优化关键影响因子对Plackett-Burman法设计筛选出的3个显著影响因子, 应用Design-expert 7.0.6软件设计3因素5水平, 20次的试验(表 2), 每组实验3次重复, 并进行响应面分析。
通过salkowski比色实验, 明确了玫瑰黄链霉菌NKZ-259次级代谢过程能够产生IAA, 以OD530为横坐标(x), IAA浓度为纵坐标(y)制作标准曲线, 得到线性回归方程y=38.971x+2.282 3, r=0.988 1, 在所测浓度范围内线性关系良好, 根据标准曲线得到基础发酵培养基中IAA的含量是11.64 g/mL。
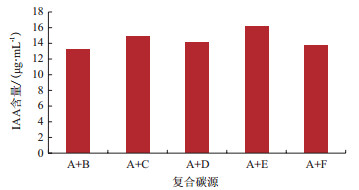
2.2 IAA发酵培养基的单因子试验试验分别以葡萄糖、蔗糖、麦芽糖、乳糖、玉米粉和可溶性淀粉作为单一碳源, 发现NKZ-259菌株对可溶性淀粉的利用率最高, 发酵产生IAA含量最高(图 1), 以可溶性淀粉和葡萄糖组成复合碳源时, 比单一碳源发酵产生的IAA含量更高(图 2), 因此选用葡萄糖和可溶性淀粉作为培养基中的最佳碳源; 氮源一般分为无机氮源和有机氮源, 选用黄豆面、牛肉膏、蛋白胨、酵母膏、玉米粉作为无机氮源, 硫酸铵、氯化铵和硝酸钾作为有机氮源进行试验, 发现当NKZ-259菌株以蛋白胨为有机氮源、硝酸钾为无机氮源时IAA的产量明显增高(图 3), 因此采用蛋白胨和硝酸钾作为培养基中的最适氮源; 无机盐也是微生物生长所不可缺少的成分, 分别选用氯化钠、磷酸氢二钾、氯化镁和硫酸锌进行试验发现:当加入磷酸氢二钾时, IAA的产量最高(图 4), 最终选择磷酸氢二钾作为发酵培养基中的最适无机盐。
|
| 图 1 不同单一碳源对发酵液中IAA含量的影响 |
|
| 图 2 不同复合碳源对发酵液中IAA含量的影响 图中A、B、C、D、E、F分别代表 2%葡萄糖、2%蔗糖、2%麦芽糖、2%乳糖、1%可溶性淀粉、2%玉米粉 |
|
| 图 3 不同氮源对发酵液中IAA含量的影响 |

|
| 图 4 不同无机盐对发酵液中IAA含量的影响 |
根据Plackett-Burman法设计六因素、两水平表并配制培养基进行试验, 每组试验做3次重复, 实验数据分析使用Mintab 17软件。以菌株发酵液中IAA的含量作为响应值, 建立一次回归方程:IAA含量=15.487+2.080X1-0.063X2-0.069X3+0.184X4+1.830 X5 +5.839X6。
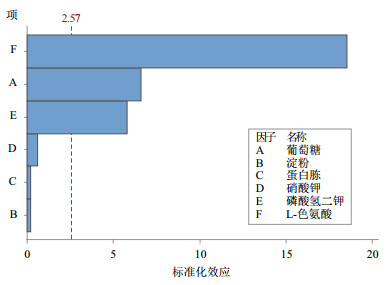
模型回归决定系数R=98.83%, 校正系数R(调整)=97.43%, 表明真实值与预测值相关性极高, 且回归模型P=0.000 < 0.05, 差异达到极显著水平, 因此, 该数学模型可用于评价本试验各因子对响应值影响的显著性[21]。表 4中L-色氨酸、葡萄糖和磷酸氢二钾(P < 0.05)均对预测响应值均达到显著水平(表 3-4、图 5), 且其对IAA含量均具有显著正效应, 因此选用上述三个因素继续优化得到最大响应值。
|
| 图 5 标准化效应Pareto图(响应为IAA含量,α<0.05) |
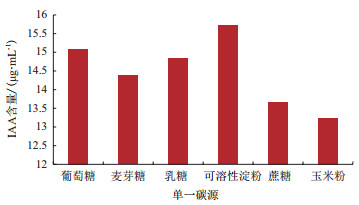
应用Design-expert7.0.6软件对Plackett-Burman筛选出的3个重要影响因子, 采用Central composite design设计3因素, 5水平(-1.682, -1, 0, 1, 1.682), 试验次数为20的试验(表 5)。
运用Design-Expert 7.0.0软件对20组试验数据进行回归分析, 得到拟合回归方程:IAA=45.47+3.88 X6+1.71 X1+0.52 X5-0.32 X6 X1-0.21 X6 X5+0.092 X1 X5-7.88 X62-5.82 X12-4.83 X52; 经方差分析该模型极显著(P < 0.0001), 模型回归决定系数R-sq=99.82%, R-sq(Adj)=99.66%, 说明模型与实际拟合良好; 模型失拟项P为0.0694>0.05, 表明模型失拟项不显著, 因此模型选择合适。表 6中一次项(L-色氨酸、葡萄糖、磷酸氢二钾)、二次项(X62、X12、X52)都极为显著, 三因子的交互项均不显著, 表明各因子对响应值的影响不是简单的线性关系, 而是二次关系[22]。由此表明该回归方程可以用来解释各因素和响应值之间的真实关系, 因此该模型可用来对菌株NKZ-259产IAA的发酵培养基成分进行分析预测。
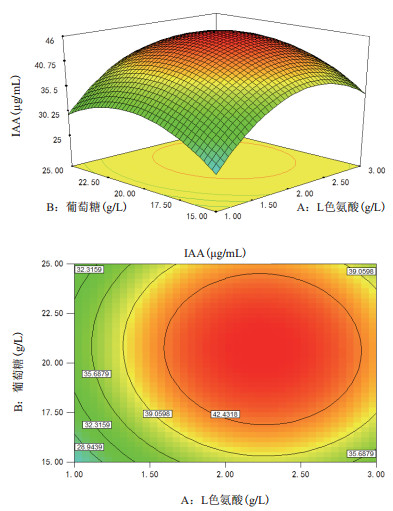
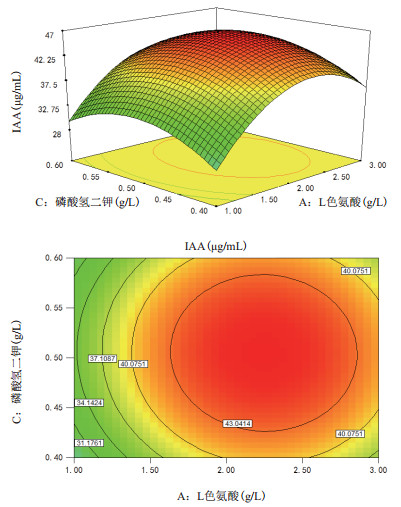
为了进一步了解这3个因素之间的交互作用, 通过Design-Expert 7.0.0软件绘制响应面图和等高线图, 等高线的形状可反映出两因素之间交互作用的大小, 椭圆形表示两因素的交互作用明显, 圆形表示两因素之间的交互作用不显著[23]。由图 6-8进一步看出:L-色氨酸、葡萄糖和磷酸氢二钾这三个因素, 两两之间交互作用均不明显。根据响应面模型预测的发酵培养基中主要成分含量为:L-色氨酸2.24 g/L, 葡萄糖20.7 g/L, 磷酸氢二钾0.5 g/L, 模型预测的IAA含量为46.060 7 μg/mL。
|
| 图 6 L-色氨酸和葡萄糖两因素的响应面图和等高线图 |
|
| 图 7 L-色氨酸和磷酸氢二钾两因素的响应面图和等高线图 |

|
| 图 8 葡萄糖和磷酸氢二钾两因素的响应面图和等高线图 |
利用微生物生产各种有用代谢物的一个重要方法就是微生物发酵, 因此发酵培养基的优化尤为重要[24]。响应面法(Response surface methodology, RSM)是近年来菌株培养基优化的最优方法之一, 它通过采用多元二次回归方程来拟合各因素与响应值间的函数关系, 并最终寻求最优的工艺参数[25]。与正交实验相比, 响应面法是通过建立曲面模型来检验各因素及其交互作用对响应值的影响, 可连续的对试验各个水平进行分析, 而且可显著减少实验次数、缩短试验周期, 目前已广泛应用于化学、生物工程、食品、医药等领域。Li等[26]运用响应面法对乳酸乳球菌ATCC 11454发酵产细菌素的培养基进行优化, 使该菌株发酵产生的细菌素产量增加了一倍; 韩兴[27]通过PB设计及响应面分析优化玫瑰黄链霉菌Men-myco-93-63发酵培养基使抗生素产量提高了1.63倍。
IAA作为一种信号分子通过调控植物细胞分裂、器官发育及相关基因的表达来调控植物的生长, 对植物的生长发育十分重要[28], 然而植物组织中产生激素类物质的含量十分有限。虽然目前已经能够通过化学方法合成并大量生产激素类物质如IAA等, 但化学合成的物质对环境和人类健康有着巨大的威胁。从微生物次级代谢物中分离提取的植物生长调节类物质来源于自然环境, 能显著降低环境中的农药残留及化学物质对人类健康带来的威胁, 因此微生物源植物生长调节剂的开发研究十分重要。目前已报道刘伟等[29]通过对地衣芽孢杆菌发酵培养条件的优化来提高细胞分裂素的产量, 并对其分离纯化条件进行了研究。本研究后期将在IAA含量提高的基础上对其进行分离纯化, 致力于以NKZ-259为出发菌株, 探索微生物源植物生长调节剂的生产工艺, 并最终开发出绿色、高效的微生物源植物生长调节剂。
4 结论本研究通过单因子试验明确了菌株NKZ-259发酵培养基中的最适碳源、氮源、无机盐; 应用Plackett-Burman法筛选出了培养基中对菌株发酵产生IAA的显著影响因子, 然后通过中心组合设计(Central composite design)对Plackett-Burman筛选出的三个影响因子进行优化并通过响应面法进行分析, 最终得到菌株发酵产生IAA的最优培养基为:L-色氨酸2.24 g/L, 葡萄糖20.7 g/L, 磷酸氢二钾0.5 g/L, 可溶性淀粉10 g/L, 蛋白胨3 g/L, 硝酸钾4.5 g/L。使用优化后的培养基进行发酵, 3次发酵产生IAA的含量分别为45.656 0、45.023 1和45.453 2 μg/mL, 平均值为45.377 4 μg/mL, 与原始发酵培养基相比菌株产生IAA的含量提高了3倍。
| [1] |
杨秀荣, 刘亦学, 刘水芳, 等. 植物生长调节剂及其研究与应用[J]. 天津农业科学, 2007(1): 23-25. DOI:10.3969/j.issn.1006-6500.2007.01.008 |
| [2] |
徐长宝, 任晓亮, 朱桂玲. 打破柿树种子休眠和促进发芽的方法[J]. 林业科技开发, 2009, 23(2): 109-112. DOI:10.3969/j.issn.1000-8101.2009.02.032 |
| [3] |
宋文, 肖景义, 赵莹, 等. 植物激素萘乙酸在果树生产中的应用[J]. 特种经济动植物, 2012, 15(12): 48-49. DOI:10.3969/j.issn.1001-4713.2012.12.027 |
| [4] |
Mao X, Tang L, Tan T, et al. Determination of plant growth regulators in pears by microwave-assisted extraction and liquid chromatography with electrospray ionization mass spectrometry[J]. Journal of Separation Science, 2014, 37(11): 1352-8. DOI:10.1002/jssc.v37.11 |
| [5] |
史晓梅, 金芬, 黄玉婷, 等. 水果中常用植物生长调节剂的研究进展[J]. 食品工业科技, 2012, 33(4): 417-422+426. |
| [6] |
张兴, 马志卿, 冯俊涛, 等. 植物源农药研究进展[J]. 中国生物防治学报, 2015, 31(5): 685-698. |
| [7] |
Goudjal Y, Zamoum M, Sabaou N, et al. Potential of endophytic Streptomyces spp. for biocontrol of Fusarium root rot disease and growth promotion of tomato seedlings[J]. Biocontrol Science & Technology, 2016, 26(12): 1691-1705. |
| [8] |
Narayana K J, Peddikotla P, Krishna P S J, et al. Indole-3-acetic acid production by Streptomyces albidoflavus[J]. Journal of Biological Research-Thessaloniki, 2009, 11: 49-55. |
| [9] |
Abd-Alla MH, El-Sayed ESA, Rasmey AHM. Indole-3-acetic acid(IAA)production by Streptomyces atrovirens isolated from rhizospheric soil in Egypt[J]. Journal of Biology & Earth Sciences, 2013(3): 182-193. |
| [10] |
Shi LM, Thin TN, Ge BB, et al. Antifungal and plant growth-promoting activities of Streptomyces roseoflavus strain NKZ-259[J]. Biological Control, 2018, 125: 57-64. DOI:10.1016/j.biocontrol.2018.06.012 |
| [11] |
Lin L, Xu X. Indole-3-acetic acid production by endophytic Streptomyces sp. En-1 isolated from medicinal plants[J]. Current Microbiology, 2013, 67(2): 209-217. |
| [12] |
尤桂春, 武竞超, 林文忠. IAA不同浓度处理对柠檬枝条扦插生根的影响[J]. 东南园艺, 2016, 4(1): 8-9. DOI:10.3969/j.issn.2095-5774.2016.01.003 |
| [13] |
王非, 王金侠, 李强, 等. GA_3和IAA处理对4种铁线莲种子萌发的影响[J]. 草业科学, 2014, 31(4): 672-676. |
| [14] |
Aminullah, Zada K, Jamal M, et al. Effect of indole acetic acid(IAA)on yield and yield contributing parameters of soybean[J]. Pakistan Journal of Biological Sciences, 2000, 3(5): 856-857. DOI:10.3923/pjbs.2000.856.857 |
| [15] |
郭敬华.玫瑰黄链霉菌Men-myco-93-63发酵液防治黄瓜白粉病的效果及作用机理初探[D].保定: 河北农业大学, 2007.
|
| [16] |
葛蓓孛, 王家旺, 刘彦彦, 等. 武夷菌素高产基因工程菌发酵培养基的优化[J]. 中国生物防治学报, 2016, 32(5): 642-649. |
| [17] |
张东艳, 刘晔, 吴越, 等. 花生根际产IAA菌的筛选鉴定及其效应研究[J]. 中国油料作物学报, 2016, 38(1): 104-110. DOI:10.7505/j.issn.1007-9084.2016.01.016 |
| [18] |
Glickmann E, Dessaux Y. A critical examination of the specificity of the salkowski reagent for indolic compounds produced by phytopathogenic bacteria[J]. Applied & Environmental Microbiology, 1995, 61(2): 793-6. |
| [19] |
吴翔, 甘炳成, 黄忠乾, 等. 一株产IAA菌株的筛选、鉴定及培养条件优化[J]. 四川农业大学学报, 2014, 32(4): 432-435+461. DOI:10.3969/j.issn.1000-2650.2014.04.013 |
| [20] |
王占一, 金美花, 王玉海, 等. Plackett-Burman和Central Composite Design试验设计法优化石榴皮中熊果酸的SFE-CO_2萃取工艺[J]. 中药材, 2015, 38(3): 610-614. |
| [21] |
宋浩, 纪兆林, 陈夕军, 等. 地衣芽孢杆菌W10菌株发酵培养基优化[J]. 扬州大学学报:农业与生命科学版, 2015, 36(1): 87-91. |
| [22] |
钟小廷.产细菌素蜡样芽孢杆菌的筛选、鉴定及培养基优化[D].成都: 西华大学, 2014.
|
| [23] |
刘志祥, 曾超珍. 响应面法在发酵培养基优化中的应用[J]. 北方园艺, 2009(2): 127-129. |
| [24] |
Wang L, Zhang M, Li Y, et al. Application of response surface methodology to optimize the production of antimicrobial metabolites by Micromonospora Y15[J]. Biotechnology & Biotechnological Equipment, 2017, 1-10. |
| [25] |
李莉, 张赛, 何强, 等. 响应面法在试验设计与优化中的应用[J]. 实验室研究与探索, 2015, 34(8): 41-45. DOI:10.3969/j.issn.1006-7167.2015.08.011 |
| [26] |
Li C, Bai J, Cai Z, et al. Optimization of a cultural medium for bacteriocin production by Lactococcus lactis using response surface methodology[J]. Journal of Biotechnology, 2002, 93(1): 27-34. |
| [27] |
韩兴, 刘亚南, 甄丹妹, 等. 玫瑰黄链霉菌Men-myco-93-63产抗生素发酵培养基的优化[J]. 江苏农业科学, 2017, 45(10): 100-103. |
| [28] |
Passari AK, Mishra VK, Gupta VK, et al. In vitro and in vivo plant growth promoting activities and DNA fingerprinting of antagonistic endophytic actinomycetes associates with medicinal plants[J]. PLoS One, 2015, 10(9): 1-18. |
| [29] |
刘伟.利用地衣芽孢杆菌发酵生产细胞分裂素[D].武汉: 华中农业大学, 2005.
|