我国是人口众多的农业大国, 也是农药和化肥污染极为严重的国家。化学农药的滥用不仅会对人类生态环境产生恶劣的影响, 还会导致病虫害抗性等问题。生物农药因其低残留、低毒、不易产生抗药性、选择性强等优点已成为世界各国的研究重点。开发新型生物农药, 减少和替代高毒高残化学农药成为发展绿色安全农产品的必要条件[1]。农用抗生素主要是指生物农药中的微生物源农药, 目前在杀虫和杀菌方面已取得显著的防治效果, 成为当今研究的热点[2]。放线菌因具有复杂的次级代谢系统, 能产生诸多结构新颖、生物活性显著的次级代谢产物, 成为重要的微生物农药资源而倍受关注。
经过多年的研究探索, 我国对于抗生素的筛选和发酵工艺等已有了很大程度的改善和提高, 先后研发了很多实用价值极高的杀菌农用抗生素和抗病毒农用抗生素[3], 并成功地商业化应用于生产当中。例如, 被用来杀虫的有阿维菌素、多杀菌素和南昌霉素; 被用来杀菌的有放线菌酮、春雷霉素、万隆霉素、多效霉素、井冈霉素、农抗120、多抗霉素、中生菌素及宁南霉素等; 被用来除草的有双丙氨膦等[4-7]。因此, 从放线菌及其次生代谢产物中筛选广谱、稳定及低毒的农用抗生素具有十分广阔的应用前景。
本实验室长期致力于农用抗生素的基础研究, 先后开发出多种具有杀虫和强杀菌功效的农用抗生素[8]。在新型农用抗生素的分离筛选过程中, 从土壤中筛选到一株黄麻链霉菌(Streptomyces corchorusii), 经离体生测发现其对西瓜枯萎病菌和水稻纹枯病菌具有极强抑制作用[9]。已有研究表明, 黄麻链霉菌菌株发酵液对水稻纹枯病菌具有较强的室内抑制毒力, 远高于井冈霉素对水稻纹枯病菌的室内抑制毒力[10-11], 但田间防治效果与井冈霉素相当。为此, 本实验进一步研究了该菌株发酵液对多种植物病原真菌的抗菌活性及发酵液中抗菌物质对热、紫外线以及pH值的稳定性, 以便为S. corchorusii AUH-1菌株的进一步开发利用提供理论基础, 并为该菌株发酵液中抗真菌组分的分离纯化、结构测定及加工储藏等提供理论参考。
1 材料与方法 1.1 材料 1.1.1 供试菌株黄麻链霉菌(Streptomyces corchorusii)AUH-1菌株:由本实验室自行分离筛选获得, 甘油冻存管保存。
供试植物病原真菌:水稻纹枯病菌(Rhizoctonia solani)、西瓜枯萎病菌(Fusarium oxysporum f.sp.niveum)、葡萄座腔病菌(Botryosphaeria dothidea)、棉花枯萎病菌(Fusarium oxysporum f.sp.vasinfectum)、烟草黑胫病菌(Phytophthora parasitica var.nicotian-ae)、棉花黄萎病菌(Verticillium dahliae)、辣椒疫病菌(Phytophthora capsici)、黄瓜枯萎病菌(Fusarium oxysporum f.sp.cucumerinum)均由本实验室保存。
1.1.2 培养基指示菌培养基:(1)PDA培养基:马铃薯200 g, 葡萄糖20 g, 琼脂15 g, 蒸馏水1 000 mL, pH值自然。(2)高氏一号培养基:可溶性淀粉20 g, NaCl 0.5 g, K2HPO4 0.5 g, MgSO4 0.5 g, FeSO4 0.01 g, 琼脂15 g, 蒸馏水1 000 mL, pH 7.2-7.4。
发酵培养基:蔗糖40 g, 玉米淀粉20 g, 玉米浆20 g, (NH4)2SO4 2 g, KH2PO4 1 g, MgSO4 1 g, MnSO4 0.01 g, ZnSO4 0.01 g, H2O 1000 mL, pH 7.2-7.4。所有培养基在121℃灭菌30 min备用。
1.2 方法 1.2.1 发酵粗提液的制备黄麻链霉菌AUH-1新鲜斜面用1×2 cm规格的接种铲挖菌块, 接入发酵培养基中(装液量:100 mL/500 mL三角瓶), 在28℃、180 r/min摇床培养5 d, 收集发酵液, 加入2倍体积工业酒精浸提48 h, 离心, 取上清液经减压浓缩至酒精蒸干, 浓缩液用0.22 mm无菌微孔滤膜过滤, 即为发酵粗提液, 存于4℃冰箱, 备用。
1.2.2 发酵粗提液抗真菌活性测定采用抑制菌丝生长速率法, 将各指示菌株接种至PDA平板上, 在28℃下培养7 d, 用直径为6 mm打孔器打取菌落边缘菌块作为接种物, 接种至含有发酵粗提液的PDA平板上, 以含等量无菌水的PDA平板为对照, 培养48 h后采用十字交叉法测定菌落大小, 按公式算出菌丝生长抑制率。

温度稳定性:取10 mL发酵粗提液放入50 mL离心管内, 分别置于60、70、80、90、100、115和121℃条件下处理30 min。以水稻纹枯病菌作为指示菌, 设无菌水为对照, 每处理重复3次。参照1.2.2方法测定其抑制率, 根据抑制率变化情况来确定其热稳定性。
紫外稳定性:吸取发酵粗提液5 mL至无菌培养皿中, 敞口放置在距15 W紫外灯30 cm处, 在此条件下分别处理5、10、20、30、40和50 min后将发酵液转移至1.5 mL离心管内。紫外稳定性的菌丝生长抑制率测定方法同上。
酸碱稳定性:取10 mL发酵粗提液至50 mL离心管中, 用1 mol/L的NaOH和1 mol/L的HCl调整发酵液pH值至1.0、3.0、5.0、7.0、9.0、11.0, 室温下静置过夜, 然后将发酵液pH值调回其原始pH 5.17。酸碱稳定性的菌丝生长抑制率测定方法同上。
1.2.4 数据分析采用Microsoft excel 2016进行数据整理, origin 9.0和DPS 7.05进行作图和差异显著性分析(P < 0.05)。
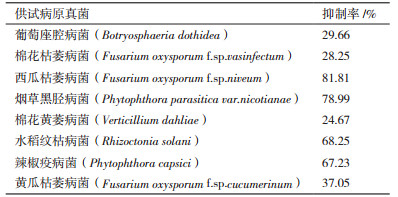
2 结果 2.1 发酵粗提液抗真菌活性用抑制菌丝生长速率法测试S.corchorusii AUH-1菌株发酵粗提物对供试植物病原真菌的抑制作用, 结果如表 1和图 1所示。S.corchorusii AUH-1菌株发酵粗提物对8种植物病原真菌都有不同程度的抑制作用, 其中对西瓜枯萎病菌、烟草黑胫病菌、水稻纹枯病菌以及辣椒疫病菌的抑制效率分别高达81%、78%、68%和67%以上, 对葡萄座腔病菌、棉花枯萎病菌、棉花黄萎病菌和黄瓜枯萎病菌的抑制效果较差, 但抑制率也达到24%以上。因此, 该菌具有广谱的抗真菌活性。
|
| 图 1 黄麻链霉菌AUH-1发酵粗提液对植物病原真菌的抑制效果 1,2:西瓜枯萎病菌对照和处理;3,4:烟草黑胫病菌对照和处理;5,6:水稻纹枯病菌对照和处理;7,8:葡萄座腔对照和处理;9,10:棉花黄萎病菌对照和处理;11,12:棉花枯萎病菌对照和处理;13,14:辣椒疫病菌对照和处理;15,16:黄瓜枯萎病菌对照和处理 |
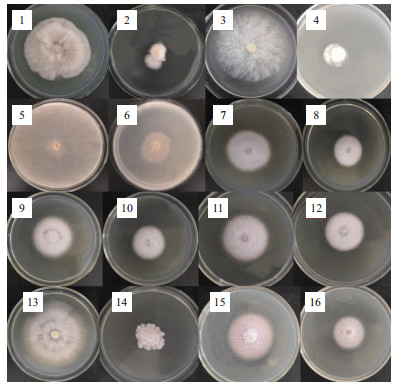
温度对黄麻链霉菌AUH-1发酵粗提液抑菌活性物质稳定性的影响如图 2所示。在60℃以上温度进行热处理, 均会降低发酵粗提液中抗真菌活性物质的抑菌活性。其中, 60-80℃热处理下的水稻纹枯病菌抑制率差异不显著, 抑菌率值保持在53.64%-57.47%之间。进一步提高热处理温度, 黄麻链霉菌AUH-1发酵粗提液的水稻纹枯病菌抑制率出现显著下降。值得注意的是, 即使经100℃以上热处理30 min, 黄麻链霉菌AUH-1发酵粗提液仍保持一定的抗真菌活性, 100、115和121℃三种温度下的水稻纹枯病菌抑制分别为23.04%、5.29%和3.6%。由此可见, 黄麻链霉菌AUH-1所产抗真菌活性物质具有较好的热稳定性。
|
| 图 2 黄麻链霉菌AUH-1抑菌活性物质热稳定性 |
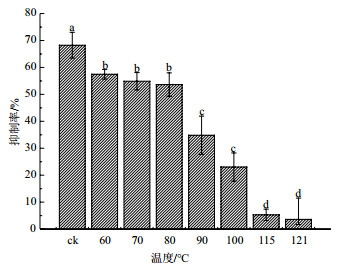
用15W紫外灯近距离照射黄麻链霉菌AUH-1发酵粗提液后, 抑菌活性变化情况如图 3所示。紫外照射对发酵粗提液中抗真菌活性物质抑菌活性的影响不大, 即使经紫外照射50 min后, 对水稻纹枯病菌的抑制率仍可达到51.31%。这说明, 黄麻链霉菌AUH-1如果作为农用抗生素进行大田施用, 能满足室外日照条件的影响。

|
| 图 3 黄麻链霉菌AUH-1抑菌活性物质紫外稳定性 |
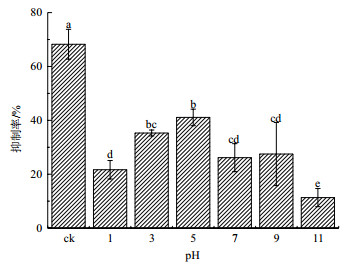
如图 4所示, 随pH值的升高, 黄麻链霉菌AUH-1发酵粗提液的抑菌活性呈先升高后降低的趋势。当pH值为5时, 水稻纹枯病菌的抑制率为41.08%, 随着pH值继续升高, 当pH值为11时, 水稻纹枯病菌的抑制率从41.08%降至11.33%。对比不同pH值下的水稻纹枯病菌抑制率发现, 碱处理更易造成黄麻链霉菌AUH-1发酵粗提液的失活。值得注意的是, 当发酵粗提液不经任何酸碱处理时, 水稻纹枯病菌的抑制率达到68.25%, 反而显著高于1、3、5、7、9、11的酸碱处理。由此可见, 黄麻链霉菌AUH-1所产抗真菌活性物质不耐受酸碱。
|
| 图 4 黄麻链霉菌AUH-1抑菌活性物质酸碱稳定性 |
农用抗生素作为一种由微生物产生的抗菌活性物质, 无论是施用到作物表面还是进入植物根际土壤, 均易受到室外光照、温度等外界条件的影响。目前, 关于农用抗生素酸碱、热、紫外等处理下的稳定性研究已有大量报道, 而且多种抗生素物质展现出了良好的稳定性。赵娟等[12]从极端沙漠环境分离筛选到一株高活性拮抗放线菌XJ93, 通过室内杀菌活性测定发现其具有较广谱的抗真菌活性, 发酵液在80℃及以下温度处理1 h仍保持较高的抑菌活性(63.51%-70.72%), 在pH为1和13条件下, 抑制率仍达到45%以上, 并且对可见光和紫外光具有较好的稳定性。
黄麻链霉菌(S.corchorusii)代谢产物的生物活性在近几年才被发现并开始研究。杨敬辉、陈宏州等[10, 13]发现其活性物质对草莓枯萎病菌及水稻纹枯病菌具有抑制效果。据吴翔等[14]报道, 其活性物质对纤维素也具有一定的降解能力。Adinarayana等[15]的研究表明, 其代谢所产抗生素拒霉素(Resistomycin)和特曲霉素D(Tetracenomycin D)对人体癌细胞具有一定的抗肿瘤活性。
本研究通过抑制菌丝生长速率法测定了S.corchorusii AUH-1的抗真菌活性, 实验结果表明, S.corchorusii AUH-1粗提液对8种植物病原真菌均具有不同程度的抑制作用, 具有广谱的抗真菌活性, 尤其是对西瓜枯萎病菌的抑制作用最为强烈, 抑制率达81.81%, 另外对烟草黑胫病菌、水稻纹枯病菌及辣椒疫病菌的抑制效率也高达65以上。由于供试的植物病菌真菌数量较少, 因此暂不能确定其粗提液对未测试的病原真菌有无抑菌活性, 且关于其抑菌机制还有待进一步研究。此外, 本实验只对病原真菌在室内条件下进行离体生测, 而对其在大田试验中的防效是否理想也需要进一步验证。
本研究以水稻纹枯病菌为指示菌, 对S. corch-orusii AUH-1粗提液活性物质稳定性进行测定。结果表明, 其所产抗真菌活性物质对酸碱敏感, 但是具有良好的热稳定性和紫外稳定性, 为该菌活性物质分离纯化及产品的加工与应用提供一定的理论依据。由此可见, 黄麻链霉菌AUH-1具有开发出生物农药的良好应用前景, 可满足室外日照、温度等外界环境条件的变化, 而保持较好的抗植物病原真菌效果。
4 结论以水稻纹枯病菌为指示菌, 探究了黄麻链霉菌AUH-1菌株发酵液的抗真菌活性, 以及温度、紫外线和pH等理化因素对其所产活性物质稳定性的影响, 结果发现其对8种植物病原真菌都有不同程度的抑制作用, 具有广谱的抗真菌活性, 且存在良好的热稳定性和紫外稳定性。
| [1] |
范万泽, 薛应钰, 张树武, 等. 拮抗放线菌ZZ-9菌株发酵液的抑菌谱及稳定性测定[J]. 西北农业学报, 2017, 26(3): 463-470. |
| [2] |
俞晗.致病杆菌Xenorhabdus bovienii SN84次生代谢产物对三种植物病原真菌抑菌作用的研究[D].沈阳: 沈阳农业大学, 2017.
|
| [3] |
毛良居, 毛赫. 链霉菌生物防治研究进展[J]. 安徽农业科学, 2017, 45(1): 145-147. DOI:10.3969/j.issn.0517-6611.2017.01.048 |
| [4] |
招衡, 张翼翾. 生物农药及其未来研究和应用[J]. 世界农药, 2010, 32(2): 16-24. DOI:10.3969/j.issn.1009-6485.2010.02.004 |
| [5] |
Deshpande BS, Ambedkar SS, Shewale JG. Biologically active secondary metabolites from Streptomyces[J]. Enzyme & Microbial Technology, 1988, 10(8): 455-473. |
| [6] |
王敬伟, 曾鑫年, 林壁润.农用放线菌代谢产物研究概况[C].中国植物保护学会2007年学术年会, 2007.
|
| [7] |
邱德文. 生物农药研究进展与未来展望[J]. 植物保护, 2013, 39(5): 81-89. DOI:10.3969/j.issn.0529-1542.2013.05.011 |
| [8] |
倪国荣, 涂晓嵘, 张智平, 等. 弗氏链霉菌S-221变种发酵液的抗菌活性及稳定性研究[J]. 中国酿造, 2009, 28(2): 37-39. DOI:10.3969/j.issn.0254-5071.2009.02.011 |
| [9] |
章帅文, 杨勇, 刘群, 等. 拮抗植物病原真菌Streptomyces corchorusii AUH-1的分离与鉴定[J]. 广东农业科学, 2018, 45(2): 103-108. |
| [10] |
杨敬辉, 吉沐祥, 文平兰, 等. 黄麻链霉菌NF0919菌株对水稻纹枯病的生防活性[J]. 江苏农业学报, 2012, 28(6): 1288-1293. |
| [11] |
杨敬辉, 吉沐祥, 陈宏州, 等. 黄麻链霉菌NF0919菌株发酵培养基的优化[J]. 江西农业学报, 2012, 24(10): 136-139. DOI:10.3969/j.issn.1001-8581.2012.10.042 |
| [12] |
赵娟, 贾卫国, 刘伟成, 等. 草莓灰霉病菌拮抗放线菌的筛选及活性测定[J]. 北方园艺, 2018, 42(4): 59-65. |
| [13] |
陈宏州, 庄义庆, 杨敬辉. 黄麻链霉菌NF0919菌株对草莓枯萎病的生防活性初探[J]. 江西农业学报, 2014, 26(11): 54-57. DOI:10.3969/j.issn.1001-8581.2014.11.014 |
| [14] |
吴翔, 甘炳成, 黄忠乾, 等. 2株降解纤维素放线菌的鉴定[J]. 西南农业学报, 2014, 27(1): 117-120. |
| [15] |
Adinarayana G, Venkateshan MR, Bapiraju VVSNK, et al. Cytoto-xic compounds from the marine actinobacterium Streptomyces corchorusii, AUBN 1/7 1[J]. Russian Journal of Bioorganic Chemistry, 2006, 32(3): 295-300. DOI:10.1134/S1068162006030125 |