石油(Petroleum)开采过程中造成的污染引起了全世界的关注[1]。近年来, 微生物提高石油采收率(Microbial enhanced oil recovery, MEOR)是目前采油行业研究的热门[2]。产表面活性剂的菌种所产生的表面活性剂能增大石油烃类化合物在水中的溶解度, 生物表面活性剂相比于化学表面活性剂, 有低毒、更易于生物降解和可在原地合成等诸多优点[3]。利用微生物自身产生的表面活性剂增强石油烃类物质降解效果, 已成为外源微生物采油技术(MEOR)的一个重要研究方向[4]。微生物代谢产生的酸、二氧化碳等气体能增强原油的流动能力, 或把重质组分分解为易流动的组分, 以达到降低原油黏度的目的, 并通过菌体自身生物特征和封堵作用提高原油采收率[5]。
现在微生物提高采收率的研究主要集中在细菌方面。自20世纪50年代起, 前苏联和东欧等一些国家就进行了微生物采油领域的研究; 到20世纪80年代, 美国及前苏联的微生物采油技术已在矿场实验中取得了相应成功。我国的微生物采油技术是从20世纪60年代开始, 到90年代在大庆、新疆、大港及胜利等地的油田进行实地矿场实验, 这项技术的应用已取得一定的成绩[6]。但目前对陕北地区微生物提高原油采收率的报道还是相对较少。
本研究从陕西省延安市安塞区某油田的附近的油污泥及含油废水中筛选出以原油为唯一碳源、能够产生提高原油采收率代谢产物的增油菌, 并对其生长条件和增油代谢产物如发酵液排油特性、产生物表面活性剂特性、表面张力、降油能力及降黏特性进行了测定, 旨在为后期的矿场试验和现场应用提供有效的指导, 确保矿场实验的成功。
1 材料与方法 1.1 材料 1.1.1 供试样品采自陕北某油田采油过程中所污染的土壤、含油废水和油污泥。0#柴油:延安某加油站。
1.1.2 供试培养基无机盐溶液(BMSM)(g/L):KH2PO4 10.0 g, NaNO3 2.0 g, (NH4)2SO4 1.0 g, MgSO4 0.3 g, Na2HPO4 4.0 g, NaCl 5.0 g, 自来水1 000 mL, 调节pH为7.0[7]。
富集培养液:在无机盐营养液中加入20 g/L原油。分离培养基:在富集培养液中加入10 g/L琼脂粉, 加热溶解。菌种纯化及保藏培养基:牛肉膏蛋白胨培养基。发酵培养基:在无机盐溶液中分别加入3.0 g/L牛肉膏、10.0 g/L蛋白胨和10.0 g/L红糖[8]。原油液体培养基:无机盐溶液中分别加入40 g/L原油和13.0 g/L玉米浆[9]。
1.1.3 供试菌株 1.2 方法 1.2.1 石油降解菌株的分离和纯化各取5 mL含油废水加入到100 mL富集培养液中, 取4 g油污泥加蒸馏水制成5 mL悬液, 加入到100 mL富集培养液中, 30℃、170 r/min摇床培养5 d, 再吸取5 mL培养液接种到新鲜的富集培养液中, 连续转接3次。将第3次摇床震荡培养所得的菌液按10倍的浓度梯度稀释后, 取0.1 mL均匀涂布到分离培养基上, 35℃恒温培养。等到平板上长出菌落后, 挑取直径较大而且使菌落背景清晰透明的单菌落, 采用平板划线法进行分离和纯化; 纯化后的菌株保藏于牛肉膏蛋白胨斜面中待用[13]。
1.2.2 供试菌株生长条件的测定生长条件的评价主要指标是温度、pH值、盐度等对微生物生长的影响[14]。室内研究方法是选取各指标的不同的参数值, 在特定的条件下培养一段时间后, 通过测定菌液的浓度, 来确定微生物最适的生长指标, 菌液的浓度直接影响微生物质量。本研究采用紫外分光光度计测定OD值的方法来确定菌液浓度。
1.2.2.1 石油降解菌株最适生长温度的测定将无机盐培养基的初始pH调至7.0, 分别接种一只斜面到100 mL灭菌的无机盐培养基中, 分别在25、28、31、34、37和40℃的恒温170 r/min的摇床上进行1 d的振荡培养, 于600 nm处测定OD值。
1.2.2.2 石油降解菌株最适pH的测定用HCl溶液或NaOH溶液将无机盐培养基的pH值调为5.0、6.0、7.0、8.0、9.0和10.0, 灭菌后将菌株分别接种于已调节好pH的无机盐培养液中, 35℃, 170 r/min摇床上恒温培养1 d, 于600 nm处测定OD值。
1.2.2.3 石油降解菌株最适盐浓度的测定配置NaCl浓度5 g/L、10 g/L、20 g/L、30 g/L、40 g/L和50 g/L的无机盐培养基中, 分别将菌株接种于已配置好盐浓度的无机盐培养基中, 35℃, 170 r/min摇床上恒温培养1 d, 于600 nm处测定OD值。
1.2.3 供试菌株发酵液排油活性的测定菌株的斜面保存的培养物活化后, 用灭菌竹签挑取分别接种到装有100 mL发酵培养基的250 mL的锥形瓶中, 30℃静置培养5 d, 每隔24 h晃动一次。取口径为12 mL的培养皿, 加无菌水近满, 在水面上加5 mL 0#已被刚果红染色的柴油, 待柴油在水面上自由扩散, 直到形成一层油膜, 在油膜的中心加2 mL发酵液, 红色的油膜被挤向四周形成一圆形排油圈, 用直尺测量排油圈的直径(D), 选用滴加未接菌的发酵液处理的油膜作为对照(CK)[15]。
1.2.4 生物表面活性物质的提取采用酸沉淀法粗提生物表面活性剂。取1.2.3所获取的发酵液各10 mL, 4 000 r/min离心5 min, 收集上清液, 用6 mol/L HCl溶液调节pH值至2-3, 放入冰箱, 在4℃的低温环境下过夜, 观察是否有白色沉淀产生, 若出现白色沉淀则表明发酵液中含有微生物代谢产生的脂肽或脂蛋白类表面活性成分; 若无白色沉淀产生, 则表明发酵液中含微生物代谢形成的糖脂类表面活性成分[16]。对冷藏后的发酵液进行离心(4 000 r/min, 离心5 min), 发酵液中有白色沉淀, 表明已获得了生物表面活性剂的粗提物。
1.2.5 发酵液pH的测定用已灭过菌的竹签挑取斜面保存的细菌培养物, 接种到装有100 mL发酵液培养基的250 mL锥形瓶中, 在30℃恒温环境下, 静置培养5 d, 每隔24 h晃动1次。在20℃的室温条件下, 用pH计测定发酵液的pH。
1.2.6 发酵液表面张力的测定用1.2.5节同样的方法培养细菌, 然后测定发酵液的表面张力。发酵液表面张力是采用环法JK99B全自动张力仪测定的[17]。
1.2.7 供试菌株对原油的降解试验 1.2.7.1 原油乳化分散效果及原油在瓶壁上的附着情况将已纯化的菌株活化后, 制成菌数约为1×108 CFU/mL菌悬液[18], 按5%的接种量接种到装有100 mL灭菌的原油液体培养基的锥形瓶中, 复合菌群接种各供试菌株按2.5%的接种量接种于100 mL灭菌的原油液体培养基的锥形瓶中。30℃恒温摇床振荡培养14 d, 将不接种的原油液体培养基作为空白对照(CK), 观察供试菌株乳化分散原油的效果及原油在瓶壁上的附着情况。
1.2.7.2 石油降解率的测定称取0.8 g脱脂棉置于三角漏斗中, 将供试菌株作用后的含有原油的发酵液用三角漏斗过滤。将三角漏斗内饱含石油的脱脂棉的水分沥干后放入原反应瓶中, 加40 mL石油醚浸泡, 等到反应瓶内脱脂棉上的原油溶解后, 将原油石油醚溶液用加有0.8 g脱脂棉的漏斗再次过滤, 然后用40 mL石油醚洗涤原反应瓶及含油脱脂棉并过滤, 收集融有原油的石油醚。定容至100 mL, 取1 mL样品液稀释至100 mL, 用紫外分光光度计测稀释样品的OD值。制作标准曲线, 计算原油的降解率。
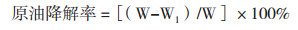
式中:W为初始原油质量(g), W1为样品残油的质量(g)。
原油标准曲线的绘制[19]:
(1) 配置标准油, 准确称取原油0.1 000 g, 加入少量石油醚溶解后定容至100 mL量瓶中, 摇匀, 配成100 mg/L的标准溶液。
(2) 分别移取0 mL、0.5 mL、1 mL、2 mL、3 mL和4 mL标准溶液于10 mL量瓶中, 用石油醚定容, 此标准系列的浓度分别是0 mg/L、5 mg/L、10 mg/L、20 mg/L、30 mg/L和40 mg/L。
(3) 先取中间浓度的标准液在紫外分光光度计的200-400 nm处进行光谱扫描, 找出最大吸收峰。
(4) 在最大吸收峰的波长256 nm下分别测定标准浓度的吸光度, 以浓度(mg/L)为横坐标, 吸光度为横坐标绘制浓度(mg/L)-吸光度标准曲线。
1.2.7.3 降黏率的测定采用与1.2.7.1同样的方法培养细菌, 再用黏度计测定经供试菌株作用后, 石油黏度的变化。
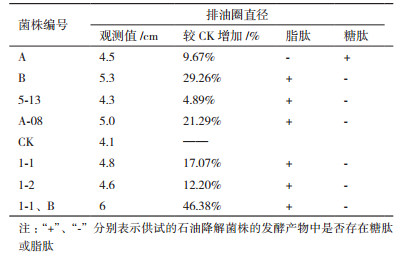
2 结果 2.1 石油降解菌株的分离、筛选从原油及含油废水中共分离纯化出10株细菌, 其中4株分离自油污泥, 6株分离自含油废水。为了筛选出降解、乳化效果好的增油菌株, 依据排油圈直径的大小(表 1), 从中选出菌株A、菌株B、菌株A-08、菌株5-13、菌株1-1和菌株1-2这6株作为供试菌株, 并对挑选出的6株供试菌株进行下一步的性能评价。
由图 1结果表明, 28-31℃之间菌液浓度最大, 当温度为28℃时, 菌株A、菌株1-1的菌液浓度最大; 当温度为31℃时, 菌株A-08、菌株1-2、菌株B、菌株5-13的菌液浓度最大。当温度超过这一温度范围时, 由于高温会影响微生物的生长状况, 导致微生物的活性下降甚至失活, 6株菌的菌液浓度明显降低。因此, 本实验将6株菌的最适生长温度定为30℃。

|
| 图 1 温度对供试菌株生长状况的影响 |
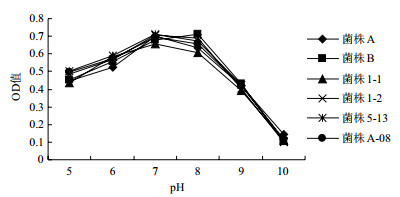
pH是影响微生物生长的重要环境条件, 大多数微生物的生长的pH都在6.0-8.0这个范围之内。图 2的结果显示, 随着pH的增加, 供试菌株的菌液浓度也明显增加, 不过当pH为7.0-8.0之间时, 菌液浓度最大。当pH值为8时, 菌株B的菌液浓度最大, 当pH值为7时, 其余5株菌的菌液浓度最大, 当pH值超过9.0以后, 由于pH值过大, 导致微生物部分功能减弱甚至失活, 菌液浓度急速降低。初步确定供试细菌的最适生长pH值条件为7.0-8.0。
|
| 图 2 pH对供试菌株生长状况的影响 |
图 3结果表明, 随着盐浓度的增加, 供试菌株的菌液浓度先增加后减少, 盐浓度(NaCl)的质量浓度为10 g/L左右, 各菌株的菌液浓度是最大的。当盐浓度超过10 g/L, 各菌株的菌液浓度呈降低趋势, 菌株A-08和菌株5-13最为明显, 原因是盐浓度改变了培养基的渗透压, 影响了菌体的新陈代谢和菌体的形态结构, 进而影响了供试菌株的各种性能。因此, 选择最适生长盐浓度为10 g/L。

|
| 图 3 盐浓度对供试菌株生长状况的影响 |
表 1结果表明, 6株菌及其复合菌群均具有一定的排油活性, 但供试菌株间存在一定的差异, 其中菌株B的排油圈直径是单株菌最大, 达到5.3 cm, 相较于对照增加了29.26%, 说明该供试菌株所产生的表面活性剂的排油活性最强, 剩余的5株菌的排油圈直径在4.3-5.1 cm。菌株1-1和菌株B的复合菌群的排油圈直径为6 cm, 相较于对照增加了46.34%, 其余的复合菌群的排油圈直径都比单一供试菌株的排油圈直径小。在供试菌株中, 有5株菌的发酵液出现白色沉淀, 表明这5株供试菌株所产生的表面活性物质的成分是脂肽类, 剩余的1株供试菌株发酵液中未发现白色沉淀, 表明该细菌所产生的表面活性物质成分为糖脂。
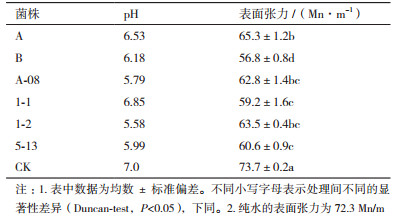
2.4 供试菌株发酵液的pH及其表面张力的测定微生物的新陈代谢过程中会有酸、气体等产物生成, 这些物质会降低原油的黏度。因此, 发酵液的pH也是对供试菌株降解性能的一种评价。表 2结果显示, 菌株1-2、5-13和A-08这3株菌的发酵液, 较CK有较明显的变化, pH明显减小, 菌株1-2的pH最小, 为5.58, 说明这3株菌在新陈代谢过程中产生了酸性物质。而菌株5-13、A、1-2的发酵液pH相较于CK的pH变化不大。菌株B、5-13、1-1发酵液的表面张力相较于CK明显大幅度下降, 菌株A-08的表面张力变化最大, 较CK下降了16.9 Mn/m, 说明菌株B、菌株5-13、菌株1-1在代谢过程中产生大量的表面活性物质。
图 4结果表明, 经恒温摇床发酵处理后, 相较于对照菌株1-2、A-08、A和A-08的复合菌群处理后, 原油在无机盐液体培养基中均匀分散, 且较为稳定, 原油对培养瓶瓶壁的附着性也大幅度减小, 只有轻微的黏壁。供试菌株对原油的乳化效果及原油对瓶壁的附着性的影响结果(表 3)表明, 菌株1-2、A-08、5-13、A和A-08的复合菌群与原油作用后, 原油被乳化成细小的圆型颗粒, 均匀分布于培养基中, 油水无界面, 几乎不黏壁; 菌株B与原油作用后, 原油被乳化成不规则颗粒状, 摇晃后可长时间均匀分布, 发酵液棕黑色, 但大量黏壁; 其余供试菌株及复合菌群大量黏壁, 呈片状或块状分布于水层上方, 油水分层明显。供试菌株的复合菌群降解效果相较于单株菌有好有差, 这是因为菌株之间存在协同作用和拮抗作用。

|
| 图 4 供试菌株及其复合菌群对原油附着性的影响 |
在最大吸收波长256 nm下分别测定标准溶液的吸光度A, 结果如图 5。

|
| 图 5 原油标准浓度曲线图 |
供试菌株作用后, 原油样品稀释液在最大吸收波长256 nm下的吸光度, 用石油醚为对照样品(CK)。结果(表 4)表明各供试菌株对原油的降解率在29.25%-60.00%, 其中的A、A-08混合菌的降解率最高, 达到了60.00%, 但是, 混合菌株A、B的降解效果与单菌株1-2和A-08比较, 有所下降。可见, 混菌的降解效果不一定比单菌株高。
表 5结果显示, 经恒温摇床发酵处理后, 相较于对照(CK), 经菌株1-2、菌株A-08、菌株5-13和菌株B处理后, 原油黏度明显降低。而经菌株1-1、菌株A处理后, 原油黏度变化不明显。由此可知, 菌株1-2、菌株A-08、菌株5-13和菌株B对原油黏度作用明显, 最高可达到49.02%。
石油降解菌株对原油的驱油、降油、降黏过程与供试菌株的生长条件、代谢过程中产生的代谢产物密切相关。本研究筛选出高效产生物表面活性剂的石油降解菌株A-08, 培养7 d后测定原油降解率为40.37%, 通过革兰氏染色后为阴性, 薄层层析法(TLC)确定产物为脂肽类物质。
黄曼曼等[20]以20#机油和真空泵油为唯一碳源, 筛选出机油高效降解菌, 采用紫外分光光度法和气相色谱质谱联用(GC-MS)研究菌株降解特性。从初筛的22株机油降解菌中筛选出4株机油高效降解菌株, 分别为JZ6、JZ18、JZ41和JZ50, 在含机油培养基中30℃培养7 d后, 机油降解率分别为42.62%、33.67%、33.36%和40.52%。而本研究在30℃条件下, 单株菌的降解率、降黏率最高可达50.75%和49.02%。
张娜等[21]分离到的菌株X-1为革兰氏阳性菌, 降解率为30.04%, 最佳生长条件为pH 7.0, 32℃, 盐度为2%, 将本实验所筛选菌株的特性与张娜等所筛选的X-1菌株特性进行比较后, 发现A-08对原油的降解率比X-1菌株对原油的降解率高出了20.71%, 最适温度比X-1菌株高了8℃, 耐盐度比X-1高了8%。该种菌具有耐高温和耐盐等优点, 使得其在将来的应用中具有广阔的前景。
本研究中对筛选出的供试菌株进行石油降解实验时, 除了对单一菌株的降油效果进行了测定, 还对它们的复合菌群的降油效果也进行了测定, 其中的A、A-08混合菌的降解率最高, 达到了60.00%, 充分验证了具有降油能力的单一菌种的降解效果主要受培养条件的影响; 而复合菌群在降解原油的过程中, 有的降解效率远高于单一菌株, 也有低于单一菌株的, 这是微生物之间存在协同、竞争拮抗作用, 此结果与前人的研究结果一致[7, 22]。本研究结果表明, 尽管单一供试菌株的降解率最高可达到50.75%, 但并未达到预期目标, 这可能是因为除了菌株的生长条件之外, 菌株的营养条件也影响菌株对原油的降解效果, 这还有待于今后进一步研究。
本研究采用了紫外法来测定原油的降解率, 除了紫外法, 研究者大都采用重量法和气相色谱法[23-24]。但不同的方法在测定降解率时都存在利弊, 因此可根据不同目的而进行选择。在进行残余烃的回收过程中采用了脱脂棉过滤、洗涤的方法, 经过比较, 此方法较便捷, 有利于提高筛选效率[25]。本研究还需对所筛选出的降油菌作进一步的鉴定和矿场实验或者是进行油藏环境的模拟实验。
4 结论从含油废水和油污泥中筛选出10株细菌。当温度为30℃、pH为7-8、盐浓度为10g/L时, 菌株的菌液浓度最大。在最适的生长条件下, 供试菌株对原油的降解作用效果最好。在30℃条件下, 单株菌的降解率、降黏率最高可达50.75%和49.02%。通过对复合菌群的降油效果的测定表明, 其中的A、A-08混合菌的降解率最高, 达到了60.00%。
| [1] |
汪先珍. 微生物采油技术[J]. 采油通讯, 2007, 3(42): 51-52. |
| [2] |
李茂毅.石油烃降解菌株的选育以及对石油中烃类物质降解的研究[D].西安: 西北大学, 2011.
|
| [3] |
Mulligan CN. Environmental applications for biosurfactants[J]. Environmental Pollution, 2005, 133(2): 183-198. |
| [4] |
Cameotra SS, Singh P. Bioremediation of oil sludge using crude biosurfactants[J]. International Biodeterioration and Biodegradation, 2008, 62(3): 274-280. DOI:10.1016/j.ibiod.2007.11.009 |
| [5] |
赵栋, 张洋, 王玲, 刘婷. 微生物采油技术综述[J]. 内江科技, 2013(6): 150. DOI:10.3969/j.issn.1006-1436.2013.06.108 |
| [6] |
张俊会, 王平, 薛泉宏, 等. 延长石油增油细菌的筛选及其降解特性的研究[J]. 西北农林大学学报:自然科学版, 2012, 40(10): 120-128. |
| [7] |
撕拉依力·托合提.复合微生物降解原油及其馏分研究[D].南京: 南京理工大学, 2009, 19(1): 21-23.
|
| [8] |
韩寒冰. 原油降解菌的筛选及其降解性能的研究[J]. 茂名学院学报, 2009, 19(1): 21-23. DOI:10.3969/j.issn.2095-2562.2009.01.007 |
| [9] |
刘涛, 宋智勇, 曹功泽, 等. 中一区Ng3区块微生物驱油物模实验研究[J]. 应用与环境生物学报, 2013, 19(2): 335-341. |
| [10] |
邓振山, 马琳, 张袭, 等. 一株产表面活性剂石油降解菌株筛选及其特性[J]. 环境工程学报, 2017, 11(5): 3295-3303. |
| [11] |
邓振山, 高飞, 刘玉珍, 等. 基于含蜡状芽孢杆菌的生物刺激-生物强化联合体系降解石油污染物[J]. 南华大学学报:自然科学版, 2018, 32(2): 19-25. |
| [12] |
邓振山, 张袭, 占鹏.玫瑰色微球菌A-04的红色素鉴定及稳定性分析[J].天然产物开发与研究, 2018. doi: http://kns.cnki.net/kcms/detail/51.1335.Q.20180703.0958.008.html. http://www.cnki.com.cn/Article/CJFDTotal-TRCW20180702005.htm
|
| [13] |
姚瑶, 刘兆普, 等. 胜利油田土壤中石油降解菌分离和鉴定及代谢产物的研究[J]. 南京农业大学学报, 2013, 36(1): 65-71. |
| [14] |
邓丽萍, 蒋新兴, 焦龙进. 微生物采油菌种性能评价的研究方法[J]. 内蒙古石油化工, 2012(12): 9-10. |
| [15] |
张俊会.几株真菌和细菌对原油理化性质的影响[D].杨凌: 西北农林科技大学, 2012.
|
| [16] |
左珊珊, 吴娟. 生物表面活性剂合成条件的优化及提取方法[J]. 环境工程学报, 2016(6): 3325-3329. |
| [17] |
Yin H, Qiang J, Jia Y, et al. Characteristics of biosurfactant prod-uced by Pseudomonas aeruginosa S6 isolated from oil-containing wastewater[J]. Process Biochemistry, 2009, 44(3): 302-308. DOI:10.1016/j.procbio.2008.11.003 |
| [18] |
吴涛, 谢文军, 依艳丽, 等. 耐盐石油烃降解菌的筛选鉴定及其特性研究[J]. 环境科学, 2012, 33(11): 3949-3955. |
| [19] |
吴玉新. 紫外分光光度计法测定污水中含油量的研究[J]. 环境保护, 1998. |
| [20] |
黄曼曼, 邓百万, 等. 机油高效降解菌的筛选鉴定及降解特性的初步研究[J]. 生物技术通报, 2018, 34(6): 155-163. |
| [21] |
张娜, 隆小华, 刘兆普, 等. 石油降解菌x-1产表面活性剂的研究[J]. 天然产物研究与开发, 2012, 24(3): 389-392. DOI:10.3969/j.issn.1001-6880.2012.03.026 |
| [22] |
单金玉, 贾莹, 刘健, 等. 两株假单胞菌对烃的作用及其协同效应[J]. 微生物学报, 2002, 29(4): 55-58. |
| [23] |
杨慧娟, 刘五星, 骆永明, 等. 气相色谱-质谱法分段测定土壤中的可取总石油烃[J]. 土壤, 2014, 46(1): 134-138. |
| [24] |
姜岩, 伍涛, 张贤明. 土壤中石油烃预处理及含量分析方法研究进展[J]. 土壤(Soils), 2015, 47(3): 461-465. |
| [25] |
张胜祥, 张玉辉, 许德军. 摇瓶发酵烃降解率测定方法的研究[J]. 郑州师范教育, 2013, 2(2): 43-45. |