2. 陕西理工大学 生物科学与工程学院, 汉中 723001
2. School of Biological Science & Engineering, Shaanxi University of Technology, Hanzhong 723001
随着工农业的发展, 尤其是矿山开采和重金属冶炼相关行业的快速发展, 重金属污染逐渐成为严重的生态问题[1], 已引起广泛关注[2-3]。我国重金属污染状况不容乐观[4], 尤其是矿山、尾矿库区等地土壤和水体的重金属污染更为严重, 再加之过度的开采, 导致矿区土地退化, 生物多样性锐减[5], 土地生产力丧失, 出现矿区石漠化等现象[6]。镉(Cd)作为土壤中主要的重金属污染物之一, 因移动性大、毒性高而受到广泛重视。据统计, 我国镉污染土壤面积已达20万km2, 并有进一步扩大的风险[7]。另外, 土壤中的镉极易被植物吸收, 通过食物链富集进而危害人体健康[8]。因此, 土壤的镉污染治理迫在眉睫。
微生物因其具有比表面积大、繁殖迅速、代谢能力旺盛、种类多、适应性强及成本低等优势, 在镉污染治理中的具有重要地位[9]。目前, 耐镉微生物的筛选已受到众多专家学者的关注。已分离筛选到的耐镉微生物主要为Pseudomonas sp.、Cupriavidus metallidurns、Bacillus cereus、Enterococcus faecalis、Sphingomonas sp.等[10]。Zhang等[8]分离到的Lactobacillus plantarum CCFM8610菌株耐镉能力极强, 可达1 000 mg/L, Cd2+吸附率可达31.34%。Limcharoensuk等[11]筛选到的P. aeruginosa B27可吸附16.89 mg/g的Cd2+, 应用潜力巨大。刘玉玲等[12]分离的耐镉细菌Delftia acidovorans B9能够促进污染土壤中的Cd从弱酸可溶态向可还原态和残渣态转化, 为Cd污染土壤微生物修复提供了理论依据。
阿耶波多氏芽孢杆菌(Bacillus aryabhattai), 简称阿氏芽孢杆菌, 分布广泛[13], 在动物肠道[14]、植物根际[15]、深海[16]、高原[17]均有发现, 抗逆性极强。其应用主要有两方面, 一是降解或合成某种大分子化合物等, 二是与植物共生或者促进植物生长等[18]。目前, 阿氏芽孢杆菌在植物促生和抗逆方面已有报道, 但对该菌作为内生细菌在Cd污染修复方面的报道相对较少。
本研究从秦岭铅锌尾矿区采集优势植物杠柳并从中分离出一株镉耐受性浓度为900 mg/L的内生细菌, 并进行分子生物学鉴定, 研究其生物学特性, 包括培养条件对菌株生长的影响, 菌株的Cd2+去除率、铅锌耐受性、促生能力以及对小麦幼苗抗镉能力的促进作用, 以期为该菌株在环境镉污染修复中的应用提供理论依据, 提高环境修复效率。
1 材料与方法 1.1 材料 1.1.1 采样地点供试的杠柳(Periploca sepium Bunge)于2017年3月采自陕西省汉中市略阳县(东经106°16′, 北纬33°34′)。剪取健康植株的根和茎, 用封口袋带回实验室, 24 h内进行内生细菌的分离。
1.1.2 试剂细菌基因DNA提取试剂盒购自上海生工生物技术有限公司, 其余试剂均为国产分析纯。
1.1.3 仪器EYELA N1000型旋转蒸发仪(上海爱郎仪器有限公司), SW-CJ-1D型单人超净工作台(上海苏净实业有限公司), YXQ-LS-50S型高压灭菌锅(上海博讯实业有限公司医疗设备厂), 超声波清洗器(昆山市超声仪器有限公司), UV2550型紫外分光光度计(日本岛津公司), A320原子吸收分光光度计(上海精密仪器有限公司)。
1.1.4 培养基牛肉膏蛋白胨固体培养基:牛肉膏3.0 g, 蛋白胨10.0 g, NaCl 5.0 g, 琼脂15.0 g, H2O 1 000 mL(液体培养基不加琼脂)。
无机磷培养基:葡萄糖10.0 g、(NH4)2SO4 0.5 g、NaCl 0.3 g、KCl 0.3 g、FeSO4·7H2O 0.03 g、MgSO4·7H2O 0.3 g、MnSO4·4H2O 0.03 g、Ca3(PO4)2 10.0 g、蒸馏水1 000 mL、琼脂20.0 g。
解钾细菌培养基:钾长石2.5 g, Na2HPO4 0.2 g, MgSO47H2O 0.2 g, NaCl 0.2 g, CaCO3 5.0 g, 葡萄糖10.0 g, CaSO47H2O 0.1 g。
1.2 方法 1.2.1 抗镉内生细菌的分离与鉴定将杠柳的根和茎依次用75%酒精(30 s)、0.1%升汞(8 min)、10%次氯酸钠溶液(1 min)消毒, 并用组织印迹法[19]进行消毒可靠性检验。将根和茎分别研磨后稀释3个梯度做3个重复, 分别涂布于Cd2+浓度为100 mg/L固体培养基上, 置于37℃恒温培养箱中暗培养72 h, 之后以100 mg/L为梯度进行浓度梯度筛选, 以最终筛选的出能在Cd2+浓度为900 mg/L的培养基上生长的一株内生细菌GR42作为实验材料。
1.2.2 菌株菌落及细胞形态在牛肉膏蛋白胨培养基上培养, 观察菌落的形态、边缘、颜色和透明度等, 采用革兰氏染色法观察菌体的形态和大小。
1.2.3 生理生化实验甲基红实验、V-P实验、柠檬酸盐实验、吲哚实验、H2S产生实验、石蕊牛乳实验、氧化酶实验、酶触实验、尿酶实验、糖发酵实验、硝酸盐还原实验、淀粉水解实验等参考《常见细菌系统鉴定手册》[20]。
1.2.4 抗镉内生细菌16S rDNA的序列分析利用细菌基因组DNA提取试剂盒提取菌株DNA, 采用细菌通用引物1492r(5′-GGTTACCTTGTTACGACTT-3′)和27F(5′-AGAGTTTGATCCTGGCTCAG-3′)对16S rDNA序列进行扩增。将分离得到的抗镉内生细菌菌株进行16S rDNA分子鉴定并将PCR产物送上海生工测序, 测序结果整理后提交NCBI, 申请并获得登录号, 利用Mega7.0构建系统发育树。
1.2.5 菌株的生长曲线取抗性菌株接种于50 mL液体牛肉膏蛋白胨培养基中, 置37℃下振荡(140 r/min)培养, 分别于0、4、8、12、24、36、48、60、72、84和96 h, 取样测定OD值, 并绘制生长曲线。
1.2.6 培养条件对菌株生长的影响 1.2.6.1 温度对菌株生长的影响取抗性菌株接种于50 mL液体牛肉膏蛋白胨培养基中, 分别置于23、28、33、和37℃下振荡(140 r/min)培养36 h, 取样测定OD值。
1.2.6.2 pH对菌株生长的影响取抗性菌株分别接种于50 mL初始pH为4.0、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0和10.0的牛肉膏蛋白胨培养基中振荡(140 r/min)培养36 h, 取样测定OD值。
1.2.6.3 装液量对菌株生长的影响取抗性菌株接种于250 mL三角瓶中装液量分别为25、50、100和150 mL的牛肉膏蛋白胨培养基中振荡(140 r/min))培养36 h, 取样测定OD值。
1.2.6.4 NaCl浓度对菌株生长的影响取抗性菌株接种于50 mL NaCl浓度分别为1、5、10、30和50 g/L的牛肉膏蛋白胨培养基中振荡(140 r/min)培养36 h, 取样测定OD值。
1.2.7 抗性菌株对Cd2+的去除率测定方法参考金忠民等[21], 用原子吸收分光光度法测定Cd2+浓度。取活化后菌悬液进行去除实验。初始实验条件设定为:恒温水平摇床转速为140 r/min, 接种量为2%, pH 7.0, 培养温度为37℃, 培养基初始Cd2+浓度分别为100、200、400、600和800 mg/L, 同时做空白对照。培养36 h后将培养液10 000 r/min离心10 min除去菌体, 取上清液过0.22 μm滤膜用于测定Cd2+浓度, 以不含菌但含100 mg/L Cd2+的培养基为对照, 去除率按下列公式计算:
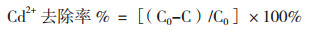
式中:C0为Cd2+的初始浓度(mg/L), C为Cd2+的残留浓度(mg/L)。
1.2.8 抗性菌株对铅锌的耐受性分别配制只含Pb2+浓度为400、800、1 200、1 600、2 000、2 400和3 000 mg/L的液体牛肉膏蛋白胨培养基和只含Zn2+浓度为400、800、1 200、1 600、2 000、2 400和3 000 mg/L的液体牛肉膏蛋白胨培养基, 分别向每瓶接种抗性菌株GR42, 置37℃下振荡(140 r/min)培养36 h后取样测定OD值。
1.2.9 菌株促生能力研究 1.2.9.1 IAA(吲哚-3-乙酸)活性测定方法参考姜云等[22]Salkowski比色法, 分别测定菌悬液OD600值和离心后上清液OD530值, 计算菌浓度OD600值为1时, 单位体积菌悬液中细菌分泌IAA的量。标准曲线采用分析纯的IAA梯度稀释后, 以IAA浓度为横坐标, 以OD530值为纵坐标绘制。根据标准曲线方程计算菌悬液中IAA的含量。
1.2.9.2 铁载体活性测定方法参考分光光度计法, 用铁载体活性单位(Siderophore units, SU)表示铁载体的产量, 根据公式计算菌株产铁载体的量:
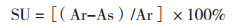
式中, Ar为空白参比值, As为处理参比值。
1.2.9.3 ACC(1-氨基环丙烷-1-羧酸)脱氨酶测定方法参考韩坤等[23]ACC脱氨酶活性的测定方法并作部分调整。用比活力(U/mg)即单位酶活除以总蛋白浓度表示ACC脱氨酶活性。
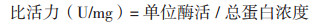
采用透明圈法[24]进行定性实验; 通过钼锑抗比色法及四苯硼酸钠法进行溶磷解钾定量实验, 具体操作步骤见参考文献[25-26]。
1.2.10 菌株对镉胁迫小麦幼苗的促生作用将菌株GR42接种于牛肉膏蛋白胨液体培养基中, 于恒温水平摇床转速140 r/min, 37℃条件下培养36 h后, 10 000 r/min, 离心5 min, 将菌体重悬于无菌水中备用。
将珍珠岩置于组培瓶中, 加入含Cd2+的Hoagland营养液, 使珍珠岩中的Cd2+终浓度为10 mg/kg, 灭菌后将消毒过的小麦种子置于组培瓶的砂床上, 每瓶10粒种子, 置3个重复, 恒温培养15 d, 分别在第5天和第10天加入10 mL不同的菌悬液, 以无菌水为空白。15 d后测其生理指标, 包括株高、根长、鲜重、干重、叶绿素和可溶性糖及可溶性蛋白。
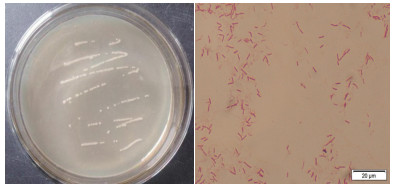
2 结果 2.1 菌株细胞形态观察及生理生化实验从陕西汉中矿区采集的杠柳中分离得到1株在Cd2+浓度为900 mg/L的培养基上生长的镉抗性内生细菌GR42, 该菌株在平板上的生长情况及革兰氏染色情况, 如图 1所示。革兰氏染色为紫色, 菌株GR42为革兰氏阳性菌。
|
| 图 1 菌株菌落形态 |
通过菌株的形态观察及生理生化实验结果可以看出, GR42的菌落形态为圆形、乳白色、边缘整齐且透明度差。该菌株为革兰氏阳性菌, 细胞形状为杆状, 长宽比3.8, 糖发酵实验、甲基红实验、柠檬酸盐实验、H2S产生实验、脲酶实验、氧化酶实验、触酶实验、淀粉水解实验均呈阳性。V-P实验、吲哚实验、硝酸盐还原实验均呈阴性。可分解石蕊牛乳产酸, 符合芽孢杆菌属菌株的生理生化特性。
2.2 菌株16S rDNA序列鉴定结果通过平板培养法筛选出1株在900 mg/L Cd2+浓度平板上生长的内生细菌GR42, 其序列大小在1 500 bp左右。将GR42菌株16SrDNA序列测序后, 进行序列分析和相似性比较, 并建立系统发育树以确定该菌的系统分类地位。结果(图 2)显示该菌株与Bacillus sp.中的Bacillus aryabhattai具有99%的相似性, 结合形态观察及生理生化实验结果, 鉴定此菌株为阿耶波多氏芽孢杆菌, 登录号为MF919465。
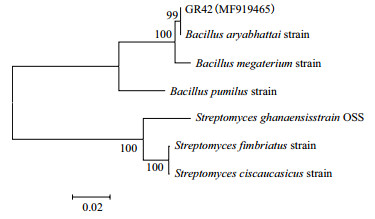
|
| 图 2 菌株GR42的系统发育树 |
细菌的生长曲线是描述细菌生长特性的重要指标, 对细菌的发酵有一定的指导意义。由图 3可见, 菌株GR42在接种0-8 h内处于延迟期; 在8-36 h内处于对数生长期; 36-48 h处于稳定期; 48 h之后, 菌株进入衰亡期。可见菌株的对数生长期较长, 稳定期较短, 这可能与菌株特异性和培养基成分有关。
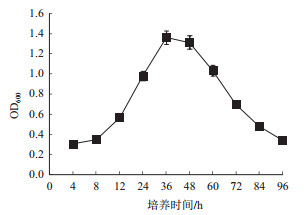
|
| 图 3 菌株生长曲线 |
温度是影响微生物新陈代谢的重要指标之一。由图 4可以看出, 该菌株最适宜的培养温度在28-33℃之间。在28℃之前随着温度的升高菌株的生长速率升高, 而超过33℃菌株的生长速率降低。
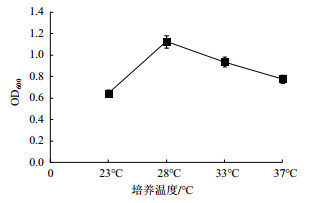
|
| 图 4 温度对菌株生长的影响 |
pH可以反应出菌株对于环境的适应能力, 不同的菌株对于pH的要求不尽相同。由图 5可以看出, 菌株GR42对pH的适应范围近似于以pH7.0为期望值的正态分布图, 其最适的pH在7.0左右, 在pH6.0-7.5范围内生长良好, 但不能在强酸或强碱的环境中生长。
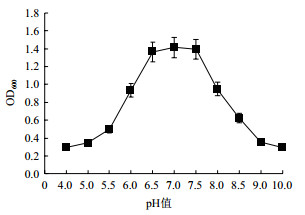
|
| 图 5 pH对菌株生长的影响 |
微生物在不同生长阶段对氧气需求量不同, 对发酵产量有直接影响, 因此研究溶氧量对于微生物发酵有重要意义。以250 mL三角瓶中不同装液量来考察溶氧量对菌株GR42发酵的影响。如图 6所示, 在140 r/min摇床转速下, 随着装液量从25 mL增加到150 mL, 菌体生物量表现出下降趋势, 说明菌体生长对溶氧的需求较大, 最适装液量为50 mL。
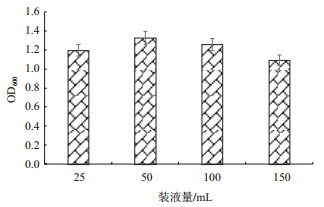
|
| 图 6 不同装液量对菌株生长的影响 |
在高盐环境之下, 由于Na+作用的细胞会失水皱缩, 影响生长, 因此培养基中的盐浓度对细菌的生长十分重要。不同微生物对渗透压的适应能力不尽相同, 由图 7可以看出, GR42菌株随着盐浓度的增大, 菌株的生长速率逐渐受到抑制。菌株GR42在盐浓度为1-5 g/L之间时均能生长, 有较强的抗盐胁迫能力, 其最适盐浓度在5-10 g/L之间, 当盐浓度达到50 g/L时对细菌的正常生长有一定的抑制作用。
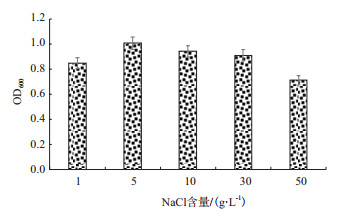
|
| 图 7 盐浓度对菌株生长的影响 |
菌株对重金属离子的去除率是衡量菌株修复能力的重要指标。利用原子吸收分光光度法测定溶液中剩余Cd2+的含量, 计算菌株GR42对不同浓度Cd2+的去除率, 去除效果见图 8。可见随着镉浓度的升高菌株对Cd2+的去除率逐渐降低, 去除率与菌株OD600值呈正相关关系。这是由于Cd2+对菌株的生长有毒害作用, 浓度越高毒害作用越大, 使得菌株单位时间内OD600值变小, 群体数量的减少导致去除率降低。
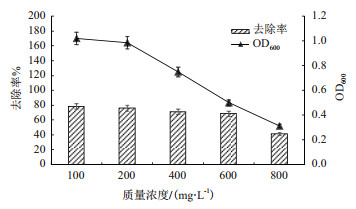
|
| 图 8 菌株GR42对不同浓度镉的去除率 |
镉抗性菌株GR42不仅对Cd2+具有较高抗性对铅锌也有较高抗性, 由图 9可以看出在铅锌耐受性实验中, GR42菌株对Pb2+的耐受性明显优于Zn2+; 随着Pb2+、Zn2+浓度的增加, 菌株的生长呈现先增加后降低的趋势, 这可能与一定浓度Pb2+、Zn2+的对菌株的生长有一定的促进作用有关。当Pb2+浓度为1 600 mg/L时, GR42生长最好, 而当Pb2+浓度大于1 600 mg/L时, 菌株的生长明显受到抑制, 2 000 mg/L时菌株不生长; 当Zn2+浓度为1 200 mg/L时, 菌株GR42生长最好, 当大于1 200 mg/L时, 菌株GR42的生长受到明显抑制。
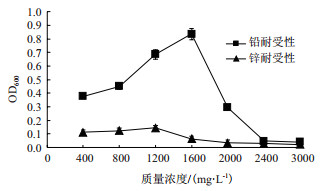
|
| 图 9 菌株铅锌耐受性 |
以SU作为定量指标, 值越大铁载体的产量越大。如表 1所示, 菌株GR42所测得SU值为76.74%。同时菌株GR42对Cd2+也有较高的去除率, 这说明铁载体在菌株抗镉性能方面有重要作用。ACC脱氨酶活性为0.627 U/mg。菌株GR42培养液中有效磷含量为85.43 mg/L, 溶磷量为13.801 mg/g, 有效钾含量为30.15 mg/L, 解钾量为8.868 mg/g。
镉对小麦幼苗有严重的毒害作用使得其生长发育受到抑制, 植株矮小, 叶片泛黄等, 由表 2可见, 与空白组相比添加菌株GR42处理的小麦幼苗的株高、根长、鲜重、干重和叶绿素含量都有显著增加, 可溶性糖和可溶性蛋白含量差异不显著, 这可能与菌株GR42吸附了部分游离态的镉, 使小麦根际周围Cd2+的浓度降低, 使得镉胁迫压力变小有关。同时该菌株还可以产生铁载体和ACC脱氨酶促进小麦幼苗的生长。可见, 菌株GR42可有效提高镉胁迫下小麦幼苗的生物量, 促进其生长。
植物内生菌(Endophyte)是生活史的部分或全部阶段生活于健康植物的各种组织和器官间隙内, 并与之建立和谐联合关系的各种不同微生物, 内生菌在与植物的协同进化过程中会获得宿主植物的部分遗传基因序列, 具有产生与宿主植物相同或相似代谢产物的能力[27], 部分内生菌可产生吲哚乙酸(Indole-3-acetic acid, IAA)、铁载体和1-氨基环丙烷-1-羧酸(1-aminocyclopropane-1-carboxylate, ACC)脱氨酶等促进植物的生长。在细菌的代谢过程中, 铁元素可作为激活剂和催化基团, 在酶的作用过程中起到非常重要的作用[28]。产ACC脱氨酶的细菌可以通过抑制植物体内乙烯合成的胞内聚合酶, 将乙烯合成前体ACC分解为α-丁酮酸和氨, 从而促进自身和宿主植物的生长[29]。磷、钾是植物生长所必需的营养元素, 不仅参与许多重要的生命代谢活动, 而且还是很多器官的组成成分, 对作物碳水化合物的运输、合成和分解起着重要作用。土壤中虽含有丰富的磷、钾元素, 但由于大部分磷、钾以难溶性盐或氧化物的形式存在于土壤中, 导致植物无法直接吸收利用[30], 溶磷解钾微生物可将矿物态磷钾转变为可以被植物吸收的有效磷、有效钾, 可为植物及其他微生物提供磷源磷, 在土壤磷、钾素循环中起着至关重要的作用[31]。经鉴定本研究从杠柳中分离筛选出的抗镉内生细菌为阿耶波多氏芽孢杆菌, 铁载体活性76.74%, ACC脱氨酶活性0.627 U/mg, 溶磷量为13.801 mg/g, 解钾量为8.868 mg/g。聂孝红等[32]从锑矿周边污染土壤中筛选出4株可产生IAA和铁载体的耐锑细菌, 可促进油菜在中低浓度锑污染下株高、根长和叶绿素含量的增加。王东升等[33]从龙葵根际土中筛选出的定铜绿假单胞菌T1和阴沟肠杆菌Y2可向胞外分泌有机酸活化土壤中难溶态的磷和镉元素, 促进龙葵对磷镉元素的吸收, 促进龙葵的生长。以上研究结果这与本研究结果相一致, 菌株GR42可有效提高镉胁迫下小麦幼苗的生物量, 促进其生长, 表明其既有重金属抗性, 又有促生能力。
菌株GR42的最适温度、pH、装液量和盐浓度分别为28℃、7.0、50 mL/250 mL和5-10 g/L。Cd2+浓度为800 mg/L时, 镉去除率可达41.1%, 可耐受2 000 mg/L Pb2+、1 200 mg/L Zn2+。汪婵娟等[34]从有色金属矿区植物根际土壤中分离出3株抗镉细菌分别为S. echinoides、Massilia flava和阿氏芽孢杆菌(Bacillus aryabhattai)对Cd2+的最低抑菌质量浓度分别为300、100和80 mg/L, 本研究从铅锌矿区植物中分离出的内生细菌GR42也是一株阿氏芽孢杆菌, 可在800 mg/L Cd2+水平生长, 具有更高的镉抗性。瞿佳等[35-36]分离出的粪产碱菌(Alcaligenes faecali)在Pb2+浓度为0.5和1.0 mmol/L时, 去除率分别为99.08%和97.24%, 不解糖假苍白杆菌对Zn2+的最大耐受浓度20 mmol/L, 在Zn2+浓度为2.0 mmol/L时吸附率高达55.25%。本研究分离的内生细菌GR42在Cd2+浓度为600 mg/L时, 去除率为68.5%, 同样有较高的镉抗性和铅锌抗性, 这可能与其较高的铁载体活性和过氧化氢酶活性有关, 表明该菌株在镉污染修复方面有潜在的应用价值。
阿氏芽孢杆菌作为21世纪初发现的一种分布广泛、功能多样、应用潜力巨大的新兴细菌, 近年国外研究大多倾向于大分子降解、产物合成及促进植物生长等。阿氏芽孢杆菌RS1[37]可产生植酸酶水解磷酸盐, 阿氏芽孢杆菌31SG[38]代谢产生的丙烯酰胺水解酶可以水解丙烯酰胺和丙烯酸钾复合物, 这与本研究的结果一致, 其具有溶磷解钾的能力, 可见阿氏芽孢杆菌在降解大分子化合物、保护环境方面应用潜力巨大; Aneesh等[39]从土壤中分离的阿氏芽孢杆菌PHB10代谢产生的聚羟基丁酸酯(Polyhydroxybutyrate, PHB)具有优良的物理属性, 为利用细菌生产PHB的应用提供了理论基础; 阿氏芽孢杆菌还能提高植物抗逆性, 缓解砷、铜、锌和亚硝酸盐对植物的毒害作用, 分泌植物激素等促生物质促进植物的生长[18]。Singh等[40]将阿氏芽孢杆菌NBRI014在浓度1 000 mg/L的砷酸盐培养基中培养后发现, 菌株能够吸收砷元素, 降低环境中砷的毒性。阿氏芽孢杆菌SRB02[41]可降低土壤中亚硝酸盐对大豆的毒害作用。Bhattacharyya等[42]发现阿氏芽孢杆菌AB211可溶解无机磷酸盐, 合成铁载体, 并产生吲哚乙酸等激素促进植物生长, 这与本实验中菌株可产生铁载体并促进小麦幼苗生长结果一致。可见, 本实验中分离的阿氏芽孢杆菌既有重金属抗性, 又有促生能力, 表明该菌株在植物促生和镉污染修复方面有潜在的应用价值。
本实验尚有不足, 仍需进行后续研究, 如未对菌株Cd2+去除特性进行研究, 未进行铅锌镉复合污染下菌株去除3种重金属的动力学实验, 未测定小麦幼苗中Cd2+含量, 未测定小麦收获后石英砂中残留Cd的形态和含量, 这一系列的问题都需要进行下一步实验来解决。
4 结论经鉴定抗镉内生细菌GR42为阿耶波多氏芽孢杆菌, 最适培养条件为温度28℃、pH7.0、装液量50 mL/250 mL和盐浓度在5-10 g/L之间。该菌株铅锌镉抗性和镉去除率均较高, 并有一定的促生能力, 对小麦幼苗的抗镉能力有显著促进作用。该菌株可在植物促生和Cd污染修复方面具有一定的应用价值。
| [1] |
刘菊梅, 栗利曼, 沈渭寿, 等. 黄河包头段灌区玉米重金属污染及人群健康风险评价[J]. 南方农业学报, 2015, 46(9): 1591-1595. DOI:10.3969/j:issn.2095-1191.2015.09.1591 |
| [2] |
俞华齐, 王娟, 姜忍忍, 等. 重金属铬单克隆抗体特异性ELISA免疫检测方法的建立[J]. 江苏农业学报, 2016, 32(2): 460-466. DOI:10.3969/j.issn.1000-4440.2016.02.034 |
| [3] |
Xiao X, Luo SL, Zeng GM, et al. Biosorption of cadmium by endophytic fungus(EF)Microsphaeropsis sp. LSE10 isolated from cadmium hyperaccumulator Solanum nigrum L.[J]. Bioresource Echnology, 2009, 101(6): 1668-1674. |
| [4] |
中华人民共和国环境保护部, 中华人民共和国国土资源部.全国土壤污染状况调查公报[N].中国国土资源报, 2014-04-18.
|
| [5] |
方瑛, 马任甜, 安韶山, 等. 黑岱沟露天煤矿排土场不同植被复垦土壤酶活性及理化性质研究[J]. 环境科学, 2016, 37(3): 1121-1127. |
| [6] |
王晓学, 李叙勇, 吴秀芹. 基于元胞自动机的喀斯特石漠化格局模拟研究[J]. 生态学报, 2012, 32(3): 907-914. |
| [7] |
Hsu SH, Wang SL, Huang JH, et al. Effects of rice straw ash amendment on Cd solubility and distribution in a contaminated paddy soil under submergence[J]. Paddy and Water Environment, 2015, 13(1): 135-143. DOI:10.1007/s10333-013-0415-x |
| [8] |
Zhang WL, Du Y, Zhai MM, et al. Cadmium exposure and its health effects:a 19-year follow-up study of a polluted area in China[J]. Science of The Total Environment, 2014, 470-471: 224-228. DOI:10.1016/j.scitotenv.2013.09.070 |
| [9] |
Mohamde YM, Ghazy MA, Sayed A, et al. Isolation and characteri-zation of a heavy metal-resistant, thermophilic esterase from a Red Sea Brine Pool[J]. Scientific Reports, 2013, 28(3): 3350-358. |
| [10] |
周赓, 邓成刚, 曹林友, 等. 一株耐镉细菌的筛选、鉴定与性质研究[J]. 化学与生物工程, 2016, 33(3): 43-47. DOI:10.3969/j.issn.1672-5425.2016.03.012 |
| [11] |
Limcharoensuk T, Sooksawat N, Sumarnrote A, et al. Bioaccumul-ation and biosorption of Cd2+ and Zn2+ by bacteria isolated from a zinc mine in Thailand[J]. Ecotoxicology & Environmental Safety, 2015, 122: 322-330. |
| [12] |
刘玉玲, 铁柏清, 李园星露, 等. 耐镉细菌的分离及其对土壤中镉的形态影响[J]. 农业环境科学学报, 2018, 37(2): 250-258. |
| [13] |
Paula RS, Patricia H, Brito MS, et al. Rethinking the niche of Upper-atmosphere bacteria:Draft genome sequences of Bacillus aryabhattai C765 and Bacillus aerophilus C772, isolated from rice fields[J]. Genome Announcements, 2015, 3(2): pii:e00094-15. |
| [14] |
Yadav KK, Bora A, Datta S, et al. Molecular characterization of midgut microbiota of Aedes albopictus and Aedes aegypti from arunachal pradesh, India[J]. Parasit Vecators, 2015, 8: 641. DOI:10.1186/s13071-015-1252-0 |
| [15] |
Karina IPP, Miguel AC, Bouch D. Screening beneficial rhizobac-teria from Spartina maritima for phytoremediation of metal polluted salt marshes:comparison of gram-positive and gram-negative strains[J]. Environmental Science and Pollution Research, 2016, 23(19): 19825-19837. DOI:10.1007/s11356-016-7184-1 |
| [16] |
Jian W, Chong R, Nan H, et al. Draft genome of bagasse-degrading bacteria Bacillus aryabhattai GZ03 from deep sea water[J]. Marine Genomics, 2015, 19(1): 13-14. |
| [17] |
Yan Y, Lei Z, Meng YY. The genome of Bacillus aryabhattai T61 reveals its adaptation to Tibetan Plateau environment[J]. Genes & Genomics, 2016, 38(3): 293-301. |
| [18] |
熊乙, 欧翔, 贾蓉, 等. 阿氏芽孢杆菌应用研究进展[J]. 生物技术, 2018, 28(3): 302-306. |
| [19] |
董晓辉, 孟春梅, 黎军英, 等. 单抗免疫斑点法和组织印迹法检测侵染蝴蝶兰的建兰花叶病毒[J]. 微生物学通报, 2009, 36(10): 1614-1617. |
| [20] |
东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 162-167.
|
| [21] |
金忠民, 郝宇, 刘丽杰, 等. 一株铅镉抗性菌株的分离鉴定及其生物学特性[J]. 环境工程学报, 2015, 9(7): 3551-3557. |
| [22] |
姜云, 田磊, 陈长卿, 等. 一株人参内生产吲哚乙酸细菌的筛选及鉴定[J]. 中国中药杂志, 2015, 40(2): 213-217. |
| [23] |
韩坤, 田曾元, 刘珂, 等. 具有ACC脱氨酶活性的海滨锦葵内生细菌对小麦耐盐性的影响[J]. 植物生理学报, 2015, 324(2): 212-220. |
| [24] |
王金昌, 郑国华, 傅筱冲. 一株解钾解磷菌株的筛选[J]. 江西科学, 2014, 32(1): 51-53, 103. DOI:10.3969/j.issn.1001-3679.2014.01.014 |
| [25] |
王誉瑶, 韦中, 徐阳春, 等. 溶磷菌株组合的溶磷效应及对玉米生长的影响[J]. 植物营养与肥料学报, 2017, 23(1): 262-268. |
| [26] |
詹寿发, 卢丹妮, 毛花英, 等. 2株溶磷、解钾与产IAA的内生真菌菌株的筛选、鉴定及促生作用研究[J]. 中国土壤与肥料, 2017(3): 142-151. |
| [27] |
刘军生, 解修超, 罗阳兰, 等. Aspergillus sp. EA-LJS80的分离及其发酵液提取物七叶皂苷C的生物活性[J]. 菌物学报, 2018, 37(1): 79-87. |
| [28] |
Miethke M, Marahiel MA. Siderophore-based iron acquisition and pathogen control[J]. Microbiology and Molecular Biology Reviews Mmbr, 2007, 71(3): 413-451. DOI:10.1128/MMBR.00012-07 |
| [29] |
Arshad M, Shaharoona B, Mahmood T. Inoculation with Pseudomonas spp. containing ACC deaminase partially eliminates the effects of drought stress on growth, yield, and ripening of Pea(Pisum sativum L.)[J]. Pedosphere, 2008, 18(5): 611-620. DOI:10.1016/S1002-0160(08)60055-7 |
| [30] |
杨慧, 范丙全, 等. 一株新的溶磷草生欧文氏菌的分离、鉴定及其溶磷效果的初步研究[J]. 微生物学报, 2008(1): 51-56. DOI:10.3321/j.issn:0001-6209.2008.01.010 |
| [31] |
谷艳. 氧化尾矿与白茅根际尾矿中可培养溶磷菌比较研究[J]. 土壤通报, 2018, 49(1): 119-125. |
| [32] |
聂孝红, 尹昊, 郭东矗, 等. 四株耐锑细菌的生物学特性及其对油菜在锑污染土壤中的促生作用[J]. 生态学杂志, 2017, 36(6): 1658-1666. |
| [33] |
王东升, 王立立, 李取生, 等. 产铁载体菌对龙葵修复土壤Cd污染的促进效应[J]. 环境工程学报, 2018(8): 2311-2319. |
| [34] |
汪婵娟, 熊治廷, 徐仲瑞, 等. 有色金属矿区植物根际耐镉菌的分离鉴定与镉吸附特性[J]. 生态与农村环境学报, 2018, 34(5): 448-455. |
| [35] |
瞿佳, 赵玲侠, 沈讷敏, 等. 抗锌细菌ZS2的分离鉴定及抗金属特性研究[J]. 生物技术通报, 2016, 32(12): 137-142. |
| [36] |
瞿佳, 赵玲侠, 孙晓宇, 等. 一株抗铅细菌的分离鉴定与抗铅性能研究[J]. 西北农业学报, 2016, 25(8): 1195-1200. |
| [37] |
Roy MP, Datta S, Ghosh S. A novel extracellular low-temperature active phytase from Bacillus aryabhattai RS1 with potential application in plant growth[J]. Biotechnol Prog, 2017, 3: 2-26. |
| [38] |
Oksinska MP, Magnucka EG, Lejcus K, et al. Biodegradation of the cross-linked copolymer of acrylamide and potassium acrylate by soil bacteria[J]. Environmen Sci Pollut Res, 2016, 23(6): 5969-5977. DOI:10.1007/s11356-016-6130-6 |
| [39] |
Aneesh BP, Kumar AJ, Thulasi K, et al. Evaluation of short-chain-length polyhydroxyalkanoate accumulation in Bacillus aryabhattai[J]. Brazilian J Microbiol, 2017, 48(3): 451-460. DOI:10.1016/j.bjm.2017.01.005 |
| [40] |
Singh N, Gupta S, Marwa N, et al. Arsenic mediated modifications in Bacillus aryabhattai and their biotechnological applications for arsenic bioremediation[J]. Chemosphere, 2016, 9: 524-534. |
| [41] |
Park YG, Mun BG, Kang SM, et al. Bacillus aryabhattai SRB02 tolerates oxidative and nitrosative stress and promotes the growth of soybean by modulating the production of phytohormones[J]. PLoS One, 2017, 12(3): e0173203. DOI:10.1371/journal.pone.0173203 |
| [42] |
Bhattacharyya C, Bakshi U, Mallick I, et al. Genome-guided in sights into the plant growth promotion capabilities of the physiologically versatile Bacillus aryabhattai strain AB211[J]. Frontiers in Microbiology, 2017, 8(3): 411-426. |






