据报道我国的秸秆年产量位居世界第一。秸秆中含有丰富的有机质及氮、磷、钾、镁、钙和硫等农作物生长必需的营养元素, 充分发挥和利用秸秆还田的积极效应, 对促进农作物生长和养分资源的高效利用具有重要意义。有研究表明, 长期秸秆还田, 能增加土壤有机质, 改善土壤理化性状。并且可以减少农业生产造成的污染, 实现秸秆资源化利用[1-3]。小麦成熟后, 其秸秆中纤维素含量明显增高, 可高达51.16%[4], 经处理后在农业方面可用做肥料、饲料、生活燃料及食用菌基料等。如何加速秸秆纤维素的降解是提高秸秆在农业方面利用率的关键。
纤维素酶在秸秆降解过程中起着至关重要的作用。1906年, Seilliere在蜗牛的消化液中发现纤维素酶, 可以分解天然纤维素[5], 人们相继开展了利用微生物对作物秸秆进行降解的研究。自然界中存在大量能够产生纤维素酶的真菌和细菌, 20世纪40年代以来, 众多研究者已筛选出大量纤维素降解菌, 主要包括木霉属(Trichoderma)、青霉属(Penicillium)、曲霉属(Aspergillus)、漆斑霉属(Myrothecium), 毛壳霉属(Chaetomium)等, 为筛选秸秆降解菌提供了重要参考依据[6-10]。利用这些微生物处理纤维素具有纤维素分解效率高、无污染的特点, 这类微生物资源经分离筛选和驯化后一般对人畜无害、可提高生物转化效率并且作用条件温和。本实验主要从森林中的腐殖土、小草的根际土壤还有食用桑叶的蚕蛹粪便中进行筛选。
众多研究者在筛选纤维素降解菌时多采用刚果红染色法, 但刚果红染色法会造成菌落之间混杂以及假阳性等现象, 故本实验在筛选菌株时首先采用秸秆粉筛选培养基进行筛选, 以秸秆粉作为唯一碳源考察菌株的生长情况, 后用刚果红染色法进行进一步筛选, 以期更直接快速地筛选出理想菌株。将筛选得到的菌株液体培养, 测定小麦秸秆降解率以及纤维素酶活, 探究菌株的纤维素酶活与秸秆降解之间的关系。
1 材料与方法 1.1 材料 1.1.1 菌种筛选样品来源菜田土、小草根际土、蚕粪及森林土。
1.1.2 培养基(1) 赫奇逊氏(Huchinson)无机盐培养液:KH2PO4 1.0 g, NaCl 0.1 g, MgSO4·7H2O 0.3 g, NaNO3 2.5 g, CaCl2 0.1 g, FeCl3 0.01 g, 蒸馏水1 000 mL。(2)羧甲基纤维素钠(CMC-Na)培养基:CMC-Na 15 g, 琼脂20 g, 赫奇逊氏无机盐培养液1 000 mL。(3)秸秆粉平板培养基:小麦秸秆80℃烘干至恒重, 粉碎过100目筛。小麦秸秆粉10 g, 琼脂粉20 g, 赫奇逊氏无机盐培养液1 000 mL。(4)滤纸平板培养基:赫奇逊氏无机盐培养液中添加琼脂粉20 g/L, 待菌种转接至培养基后, 立刻铺一片无菌扇形滤纸片在培养基上。(5)液体产酶培养基:小麦秸秆粉20 g, 赫奇逊氏无机盐培养液1 000 mL。(6)秸秆降解培养基:小麦秸秆烘干剪成1 cm左右的段状, 段状秸秆20 g, 赫奇逊氏无机盐培养液1 000 mL。(7)生物量测定培养基:CMC-Na 15 g, 赫奇逊氏无机盐培养液1 000 mL。
1.2 方法 1.2.1 菌种的分离与纯化称取10 g样品接入90 mL无菌水中, 恒温震荡箱(28℃、120 r/min)中震荡30 min, 取样品悬液, 用无菌水稀释成10-1、10-2、10-3的浓度梯度, 吸取稀释浓度为10-3的稀释液, 涂布于秸秆粉平板培养基中[11], 置于28℃的恒温培养箱中培养5 d, 根据在以秸秆粉为唯一碳源的培养基中菌落的直径(即生长速度)来评估菌株对秸秆的降解利用情况, 选取直径较大的菌株进行分离纯化并保存。将纯化好的菌株分别点种在羧甲基纤维素钠培养基上, 28℃下培养4 d, 用1 g/L刚果红染液染色20 min, 弃去染液, 加入1 mol/L NaCl溶液, 洗涤20 min后测量菌落直径和透明圈直径, 分别用D和H来表示。根据透明圈直径和菌落直径比值大小初步判断菌株产纤维素酶的能力, 选取比值大的菌株进行下一步研究[12-14]。
1.2.2 秸秆降解将纯化保存的菌株分别转接至平板, 培养5 d后, 用无菌水制成菌悬液, 分别取5 mL菌悬液接种于每瓶秸秆降解培养基中, 置于恒温(28℃、120 r/min)震荡培养箱中培养。10 d后将秸秆取出, 用蒸馏水冲洗, 再用稀酸溶液冲洗, 以去除其上附着的菌体和CaCO3沉淀等, 再用蒸馏水冲洗3次, 80℃烘干至恒重, 以失重法计算秸秆降解率。

W0:初始秸秆干重; Wt:培养t时间后秸秆干重。
1.2.3 滤纸腐解将菌株转接至赫奇逊氏无机盐培养基后, 把灭菌后的扇形滤纸平铺至平板中。28℃下培养7 d, 观察滤纸的腐烂程度。
1.2.4 纤维素酶活的测定纤维素粗酶液的制备:制备每株菌株的菌悬液(方法同1.2.2), 接5 mL菌悬液入产酶培养基, 置于恒温震荡(28℃、120 r/min)培养箱中培养, 分别于1、2、3、5、6、9、12和15 d取培养液过滤, 滤液即为制备的粗酶液。
内切酶活(endo-1, 4-β-D-glucanase, EG/Cen)的测定:取4支带有刻度的试管, 编号后分别加入1.5 mL的0.5% CMC-Na溶液(0.5 g CMC-Na定容到100 mL 0.05 mol/L, pH4.8的醋酸-醋酸钠缓冲溶液中)作反应底物并提供缓冲环境, 0.5 mL粗酶液, 其中1号试管中加入2 mL DNS以钝化酶活性, 作空白对照。4支试管同时放入水浴锅中50℃保温30 min。保温反应后, 立刻取出, 并向2、3、4号试管中加入2 mL DNS以终止反应, 摇匀后沸水浴10 min, 之后冷却至室温并用蒸馏水定容至20 mL, 充分混匀。以1号试管的溶液为空白对照调零点, 在540 nm波长下测定2、3、4号试管溶液的吸光值[15]。葡萄糖标准曲线的绘制参见农业行业标准NY/T9122004[16], 根据每次测定的葡萄糖量, 计算出相应的酶活力。
外切酶活(exo-1, 4-β-D-glucanase, CBH/Cex)的测定:用50 mg脱脂棉作为反应底物, 加入1.5 mL的醋酸-醋酸钠缓冲溶液(0.05 mol/L, pH4.8), 代替内切酶活测定过程中CMC-Na溶液, 其余操作一致。
β-葡萄糖苷酶活(β-1, 4-glucosidase, β-Gase)的测定:用1.5 mL 1%的水杨苷溶液作为反应底物代替内切酶活测定过程中CMC-Na溶液, 其余操作一致。
酶活单位(U/mL)定义为:50℃下, 每毫升酶液在上述反应条件下1 min内催化底物水解生成1 μmol葡萄糖所需的酶量。
纤维素酶活力(U/mL)=(m×1000×n)/(M×V×t)。m:反应过程中产生葡萄糖的量(mg); n:粗酶液稀释倍数; M:葡萄糖分子质量(μg/μmol); V:反应体系中粗酶液的体积(mL); t:反应时间(min)。
1.2.5 生物量的测定根据干重法测定不同菌株的生物量。
2 结果 2.1 菌种的筛选 2.1.1 菌种的初筛挑选可以在以秸秆粉为唯一碳源的秸秆粉培养基长势较好和H/D较大的菌株。在秸秆粉平板中筛选得到5株菌株, 编号为z-5、4-1、3-1、2-2、m-2。其中z-5菌落直径最大, 在刚果红染色实验的结果中, 菌株z-5的H/D位居第二, 达到16.2 mm, 透明圈比较明显, 具有较大的研究潜力(表 1)。
本实验筛菌的主要目的是筛选秸秆降解菌, 故对菌株的秸秆降解率进行考察。将5株真菌分别接入秸秆降解培养基中, 置于28℃, 120 r/min下震荡培养10 d, 测得小麦秸秆降解率如图 1所示。
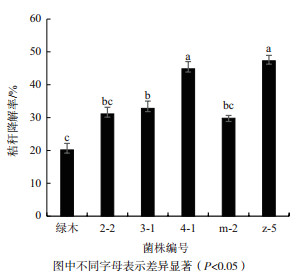
|
| 图 1 不同菌株的小麦秸秆降解率 图中不同字母表示差异显著(P<0.05) |
绿色木霉是目前已知的纤维素酶活较高的菌株, 常被应用于农作物秸秆的降解中, 因此以绿色木霉为参考菌株。由图 1可知, 5株真菌的秸秆降解率均高于绿色木霉。其中菌株z-5和菌株4-1的降解率最高, 分别为47%和45%, 其次是菌株3-1、菌株2-2和菌株m-2, 分别为32%、31%和29%。在相同的秸秆降解条件下, 绿色木霉的小麦秸秆降解率最低, 为20%左右, 菌株z-5的降解率是绿色木霉的2倍以上。
2.2 不同菌株的滤纸腐解情况将秸秆降解率高于30%的4株菌株分别涂布转接至滤纸培养基中培养7 d, 结果如表 2所示。其中菌株z-5和菌株4-1对滤纸的降解能力最强; 菌株3-1和菌株2-2次之, 实验结果与小麦秸秆降解率实验的结果相似。
将4株真菌进行液态培养, 分别测定它们在不同时期的外切葡聚糖酶活, 内切葡聚糖酶活和β-葡萄糖苷酶活。
在整个培养过程中, 菌株4-1、2-2和z-5的内切葡聚糖酶活均呈现先增后降的趋势, 而菌株3-1的内切葡聚糖酶活呈现逐渐增加的趋势(图 3)。菌株4-1和z-5的内切酶活在第3天达到最大, 分别为56 U/mL和49 U/mL; 而菌株2-2内切酶活在第5天达到最大值, 为76 U/mL。菌株3-1的内切酶活在第15天时达到14.62 U/mL。
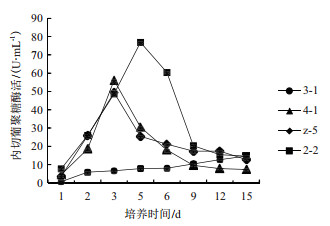
|
| 图 3 不同菌株的内切葡聚糖酶活 |
菌株4-1、菌株2-2和菌株z-5的外切葡聚糖酶活变化趋势与它们的内切葡聚糖酶活变化趋势相似, 即先增后降(图 4)。在第3天时3个菌株的外切酶活均达到最大, 分别为43 U/mL、58 U/mL和54 U/mL。第3-9天, 菌株z-5与菌株2-2的外切酶活值接近。第9天至第15天, 菌株z-5的外切酶活均大于菌株2-2。菌株3-1外切酶活在整个培养期中一直呈增长趋势, 在第15天达到10 U/mL。
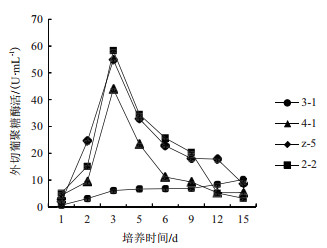
|
| 图 4 不同菌株的外切葡聚糖酶活 |
菌株4-1、菌株z-5和菌株2-2的β-葡萄糖苷酶活变化与它们的内、外切葡聚糖酶活变化趋势相似, 即先增后降(图 5)。菌株z-5和菌株4-1的酶活在第3天达到最大, 分别为47 U/mL和59 U/mL, 菌株2-2在第5天达到最大, 为76 U/mL, 其中菌株2-2的酶活峰值最大。在第9天, 3个菌株的酶活值接近。在第9-12天, 菌株z-5酶活下降不明显, 而菌株2-2和4-1均有明显下降, 其中菌株2-2下降幅度最大。菌株3-1的β-葡萄糖苷酶活随着培养时间延长不断增加, 第9天后增加幅度加大, 第15天达到了60 U/mL。
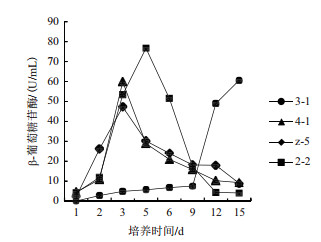
|
| 图 5 不同菌株的β-葡萄糖苷酶活 |
比较4个菌株的生物量发现, 培养10 d时菌株z-5的生物量最大, 其次是菌株3-1和菌株4-1, 菌株2-2的生物量最小, 表明菌株z-5生长速率最大, 菌株2-2生长速率最小(表 2)。菌株2-2的内切酶活与外切酶活峰值均是菌株3-1相应酶活峰值的5倍以上, 但两者的秸秆降解能力相似。在相同的培养条件下, 菌株2-2的生物量仅为菌株3-1的约1/4, 两者生物量差异显著(P < 0.05)。由此推测较低的生物量可能是造成菌株2-2秸秆降解率偏低的因素之一。
秸秆的主要成分是纤维素, 纤维素是葡萄糖以β-1, 4糖苷键结合形成的高分子化合物, 包括葡萄糖单位2 000-10 000个, 滤纸是聚合度中等的纤维素材料。本实验中所筛选菌株的滤纸腐解结果与它们的秸秆降解结果相似, 即菌株z-5和菌株4-1降解能力较高, 而菌株3-1和菌株2-2较低。同时, 通过对木质素降解酶系即木质素过氧化物酶、锰过氧化物酶和漆酶等酶活的测定, 未发现这些菌株具有木质素降解酶活(数据未呈现), 表明本实验所筛选的秸秆降解菌具有降解秸秆纤维素的能力, 但不具有降解秸秆木质素的能力。同时说明滤纸的腐烂程度能较好地反映出菌株的纤维素降解能力。
外切葡聚糖酶作用于纤维素链的末端, 产生纤维二糖。内切葡聚糖酶作用于纤维素内部的非结晶区, 水解纤维素分子内部的β-1, 4-糖苷键, 将长链纤维素分子打断, 为外切葡聚糖酶提供更多的还原端或非还原端。β-葡萄糖苷酶将纤维二糖水解成葡萄糖分子。该3种酶的合理搭配能够有效分解纤维素为葡萄糖。在纤维素酶活的检测中发现, 所筛选菌株均具有3种纤维素降解酶, 纤维素酶种类较为齐全, 但它们的纤维素酶活的变化趋势却不完全相同, 其中菌株3-1的3种纤维素降解酶活在实验过程中逐渐加大, 其他3株菌的3种纤维素酶活均为先增后降。菌株z-5和菌株4-1的3种酶活峰值均出现在同一天, 而菌株2-2的3种酶活峰值出现在不同时间内。菌株2-2的3种纤维素酶活的峰值均为最高, 但秸秆降解率却不是最高, 这与王洪媛和范丙全[17-18]研究结果不同。推测原因有二:其一, 菌株2-2的内切酶活和β-葡萄糖苷酶活峰值均出现在第5天, 外切酶活峰值则出现在第3天, 3种酶的协同性较低。其二, 菌丝的匍匐生长可破坏秸秆的致密结构, 菌株2-2的生长速率较低, 导致破坏秸秆结构作用减弱, 因此秸秆降解率最低。菌株z-5的3种酶的协同性较高, 而且生长速率快, 菌丝的蔓延对秸秆结构能产生一定破坏作用, 促进相应酶与底物接触, 由此秸秆降解率最高。虽然菌株4-1的生长速率低于菌株3-1, 但在秸秆降解的10 d内, 菌株4-1的3种酶活均高于菌株3-1, 由此菌株4-1的秸秆降解率高于菌株3-1, 表明纤维素酶的作用在秸秆降解中起着主导作用。
4 结论从土样中分离纯化出4株高效秸秆降解菌, 经初步鉴定4株菌株皆为真菌, 测定所得菌株的纤维素酶活、滤纸腐烂情况和小麦秸秆降解率。其中秸秆降解效果最好的为菌株z-5, 10 d内秸秆降解率可达47%, 并且菌株z-5酶系种类齐全, 滤纸腐解试验与小麦秸秆降解实验结果相似。
| [1] |
王洪兵. 浅谈秸秆还田现状及对策研究[J]. 吉林农业, 2011(5): 163. |
| [2] |
钟杭, 朱海平, 黄锦法. 稻麦秸秆全量还田对作物产量和土壤的影响[J]. 浙江农业学报, 2002, 14(6): 344-347. DOI:10.3969/j.issn.1004-1524.2002.06.010 |
| [3] |
黄婷苗, 郑险峰, 侯仰毅, 等. 秸秆还田对冬小麦产量和氮、磷、钾吸收利用的影响[J]. 植物营养与肥料学报, 2015, 21(4): 853-863. |
| [4] |
赵蒙蒙, 姜曼, 周祚万. 几种农作物秸秆的成分分析[J]. 材料导报, 2011, 25(16): 122-125. |
| [5] |
邱雁临. 纤维素酶的研究和应用前景[J]. 粮食与饲料工业, 2001(8): 30-31. DOI:10.3969/j.issn.1003-6202.2001.08.016 |
| [6] |
Tomme P, Van TH, Pettersson G, et al. Studies of the cellulolytic system of Trichoderma reesei QM 9414. Analysis of domain function in two cellobiohydrolases by limited proteolysis[J]. European Journal of Biochemistry, 1988, 170(3): 575-581. |
| [7] |
Singh R, Varma AJ, Laxman RS, et al. Hydrolysis of cellulose derived from steam exploded bagasse by Penicillium cellulases:comparison with commercial cellulose[J]. Bioresour Technol, 2009, 100(24): 6679-6681. DOI:10.1016/j.biortech.2009.07.060 |
| [8] |
Okunowo WO, Gbenle GO, Osuntoki AA, et al. Production of cellulolytic and xylanolytic enzymes by a phytopathogenic Myrothecium roridum and some avirulent fungal isolates from water hyacinth[J]. African Journal of Biotechnology, 2010, 9(15): 1074-1078. |
| [9] |
Geeraerts HAM, Vandamme EJ. Cellulolytic properties of Chaetomium crispatum[J]. Journal of Chemical Technology & Biotechnology Biotechnology, 2010, 33(2): 107-113. |
| [10] |
刘晓梅, 邹亚杰, 胡清秀, 等. 菌渣纤维素降解菌的筛选与鉴定[J]. 农业环境科学学报, 2015, 34(7): 1384-1391. |
| [11] |
沈萍. 微生物学实验[M]. 第3版. 北京: 高等教育出版社, 1999.
|
| [12] |
吴文韬, 鞠美庭, 刘金鹏, 等. 一株纤维素降解菌的分离、鉴定及对玉米秸秆的降解特性[J]. 微生物学通报, 2013, 40(4): 712-719. |
| [13] |
王海滨, 韩立荣, 冯俊涛, 等. 高效纤维素降解菌的筛选及复合菌系的构建[J]. 农业生物技术学报, 2015, 23(4): 421-431. DOI:10.3969/j.issn.1674-7968.2015.04.001 |
| [14] |
王贤丰, 单洪伟, 张家松, 等. 从海水环境分离筛选甘蔗渣纤维素降解菌[J]. 微生物学通报, 2015, 42(6): 981-989. |
| [15] |
孙江慧.几株食用菌对秸秆木质纤维素降解能力的研究[D].南京: 南京农业大学, 2012.
|
| [16] |
全国饲料工业标准化技术委员会. NY/Y9122004饲料添加剂纤维素酶活力的测定[S].北京: 中华人民共和国农业部, 2005.
|
| [17] |
王洪媛, 范丙全. 三株高效秸秆纤维素降解真菌的筛选及其降解效果[J]. 微生物学报, 2010, 50(7): 870-875. |
| [18] |
王海滨, 韩立荣, 冯俊涛, 等. 高效纤维素降解菌的筛选及复合菌系的构建[J]. 农业生物技术学报, 2015, 23(4): 421-431. DOI:10.3969/j.issn.1674-7968.2015.04.001 |







