人参(Panax ginseng C. A. Mey)是东北重要的药用植物, 具有抗氧化、抗衰老、增强机体免疫能力、治疗心血管、糖尿病及脑部疾病等多种药理作用[1-6]。然而人参的生长周期过长, 在其生长过程中受到多种病害的侵扰[7-8], 目前主要方法是喷洒农药, 但易使病原体产生耐药性并带来农药残留。研究抗菌肽[9]类的生物农药是解决这些问题的办法之一, 能够提高人参的产量, 带来良好的经济效益。近年来多种植物抗菌肽被发现并研究。硫堇蛋白是一种广泛存在于植物细胞, 具有广谱抑菌效果的小分子多肽。目前人参硫堇蛋白的抗菌效果尚未报道。前期通过人参转录组数据库, 进行人参发病情况及抗菌肽表达量的相关性分析, 筛选发现人参硫堇蛋白的表达与人参病害有着密切的关系。本研究拟通过构建人参硫堇蛋白的原核表达质粒, 在大肠杆菌中进行蛋白表达并纯化, 验证人参硫堇蛋白的抑菌活性。
1 材料与方法 1.1 材料表达载体pGEX-4T1、E.coli DH5α菌株、E.coli BL21由长春中医药大学生物工程实验室保存, 黑斑菌菌株由吉林农业大学中药材学院提供。限制性内切酶、DNA连接酶、胶回收试剂盒及质粒提取试剂盒等购自TaKaRa公司; 镍离子亲和层析预装柱和Amicon® Ultra-15 10K超滤管购自GE公司; 其他生化试剂均为国产分析纯或进口分装试剂。硫堇蛋白成熟肽基因由长春华大中天生物技术有限公司合成并连入亚克隆载体中。
1.2 方法 1.2.1 原核表达质粒的构建和鉴定将合成的pMD-18T-thionins质粒和原核表达载体pGEX-4T1分别进行BamHⅠ和NotⅠ双酶切, 回收。用T4 DNA连接酶16℃连接过夜, 连接产物转化DH5α感受态细胞, 接种氨苄抗性的LB固体培养基, 37℃过夜培养, 挑取单克隆进行酶切鉴定。
1.2.2 重组蛋白诱导表达的优化将鉴定正确的pGEX-4T1-thionins质粒转化到大肠杆菌BL21感受态细胞中, 接种氨苄抗性的LB固体培养基, 37℃过夜培养, 挑单克隆至试管, 过夜培养, 按照1:100的比例接种到LB培养液中, 培养至对数生长期, 共9份, 编号为1-9。1号为不加IPTG的空白对照; 2-9号分别加入终浓度为0.1、0.3、0.5、0.6、0.8、1.0、1.5和2.0 mmol/L的IPTG进行诱导。并分别在诱导3、5和8 h时取1 mL菌液进行SDS-PAGE。比较在不同IPTG浓度、不同诱导时间目的蛋白的表达情况, 筛选出最佳诱导条件。
1.2.3 SDS-PAGE和考马斯亮蓝染色取1 mL菌液于EP管中, 10 000 r/min离心1 min, 去上清, 沉淀使用100 μL ddH2O重悬, 取20 μL重悬液加入20 μL电泳上样缓冲液并煮沸10 min致蛋白变性, 使用SDS聚丙烯酰胺凝胶电泳进行样品分离。用考马斯亮蓝染色液37℃染色15 min。用脱色液将其脱色至可见清晰条带, 使用凝胶成像仪进行分析。
1.2.4 蛋白纯化将诱导后离心收集的菌体沉淀, 经PBS洗涤2次, 细胞裂解液裂解菌体, 加入PMFS和溶菌酶, 冰上搅拌20 min, 加入脱氧胆酸钠37℃搅拌10 min, 冰上超声破碎30 min, 最后加入核酸酶, 37℃反应30 min, 其间不断震荡至液体不再黏稠。液体10 000 r/min离心20 min, 收集包涵体沉淀。使用包涵体洗涤液洗涤沉淀, 包涵体溶解液(含1.5%十二烷基肌氨酸钠)溶解沉淀, 0.22 μm滤膜过滤, 使用1 mL Ni-NTA柱纯化, 结合液(含10 mmol/L咪唑)洗涤去除杂蛋白, 使用50 mmol/L咪唑缓冲液将目的蛋白从柱上洗脱, 收集洗脱液。将纯化后的蛋白溶液放入透析袋中梯度透析, 透析液为分别含有0.8%、0.6%、0.3%和0.1%十二烷基肌氨酸钠(SKL)的磷酸盐缓冲液, 0.1×PBS透析36 h。最后使用超滤管浓缩蛋白。
1.2.5 免疫印迹法SDS-PAGE后, 使用半干转仪将蛋白转移至硝酸纤维素膜上。置于5%的脱脂牛奶室温封闭30 min; PBST漂洗后一抗4℃孵育过夜; PBST漂洗3次, 加入二抗室温孵育45 min; PBST漂洗3次, 加入显色底物, 至特异性条带清晰可见时, 终止反应。
1.2.6 纸片扩散法将新华1号定性滤纸剪成6 mm直径的圆形小纸片并灭菌。将黑斑菌菌块接种到PDA培养基上, 28℃培养, 待菌丝生长到一定程度, 将纸片均匀的贴在培养基上, 保证各滤纸片距离中心的距离一致。向滤纸片滴加人参硫堇蛋白溶液, 空白加入GST蛋白溶液。放入28℃恒温箱内继续培养, 定期观察抑菌情况。生长抑制率(%)=1-(GST组真菌生长半径r0(cm)-硫堇蛋白组真菌生长半径r病(cm))/GST组真菌生长半径r0(cm)×100%。
1.2.7 半数抑制浓度(IC50)试验将菌块接种到液体土豆培养基(PDB)中, 28℃、160 r/min震荡培养3 d。然后用8层纱布过滤, 利用血球计数板进行孢子计数, 用培养基将孢子稀释到约3×104孢子数/mL, 96微孔板每孔加入90 μL孢子稀释液以及10 μL不同浓度的人参硫堇蛋白溶液, 混匀, 28℃暗培养, 36 h时使用酶标仪在595 nm波长下, 记录各孔吸光度值, 计算抑菌率, 得出半数抑制浓度。计算公式抑菌率(%)=(空白组OD值-实验组OD值)/空白组OD值×100。
1.2.8 质膜通透性试验96微孔板每孔加入100 μL孢子稀释液(浓度同上), 同时加入终浓度为14 μmol/L的人参硫堇蛋白和25 μmol/L SYTOX绿色荧光染料, 并设无蛋白的空白组, 在25℃孵育30 min。用荧光显微镜观察对质膜的透化作用。
2 结果 2.1 人参thionins的序列分析从NCBI中获得人参thionins序列, 长度228 bp, 编码75个氨基酸, 预测分子量为5.16 kD, 预测等电点为9.3, 二级结构包括29.33% α-螺旋、12%延伸链、8% β-转角和50.67%无规卷曲。根据Signalp-4.1Sig-nalp analysis软件分析, 人参thinoins蛋白的1-28位氨基酸为前导肽序列(图 1下划线处)。选取其成熟肽区域(29-75 aa)进行后续的表达和纯化。

|
| 图 1 人参硫堇蛋白的结构分析 |
对人参thinoins的成熟肽部分基因进行人工合成, 为了后续纯化在C末端加入6×His标签。将目的片段连入原核表达载体pGEX-4T1中。进行琼脂糖凝胶电泳分析。质粒线性大小约为5 000 bp, 但由于质粒的超螺旋结构, 在电泳结果呈现出2 000-3 000 bp大小的条带。经双酶切鉴定, 在5 000 bp和100-250 bp两处可见特异性条带, 分别为pGEX-4T1线性片段及thinoins片段(图 2), 证明pGEX-4T1-thinoins构建成功。

|
| 图 2 原核表达载体pGEX-4T1-thinoins的双酶切鉴定 1:pGEX-4T1-thinoins质粒双酶切鉴定;2:pGEX-4T1-thinoins质粒;M1和M2:DNA分子量标准 |
通过优化诱导条件, 获得最佳诱导方法:菌种过夜培养后转接于20 mL培养基中, 37℃200 r/min震荡培养, 待OD600值达到0.6-0.8, 加入终浓度为0.5 mmol/L的IPTG, 5 h后终止诱导。经SDS-PAGE电泳和考马斯亮蓝检测分析, 结果(图 3)显示, 在约33 kD处有一特异表达的蛋白带, 与预期的人参GST-thinoins-His融合蛋白的大小基本一致, 表明成功诱导了融合蛋白。
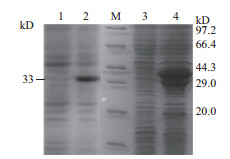
|
| 图 3 人参硫堇蛋白表达形式检测结果 1:诱导前;2:诱导后;M:蛋白分子量标准;3:诱导上清;4:诱导沉淀 |
诱导后裂解菌体, 分别取上清和沉淀进行SDS-PAGE检测蛋白表达形式, 特异性条带出现在沉淀中, 说明重组蛋白以包涵体的形式存在(图 3)。溶解包涵体后, 使用HisTrap FF柱进行分离纯化。当洗脱液中咪唑浓度为50 mmol/L时, 目的蛋白被充分洗脱(图 4)。洗脱液放入透析袋中梯度透析除盐。由于纯化后蛋白在25 kD处有另一条带, 对纯化蛋白进行免疫印迹分析, 结果与考马斯亮蓝结果类似, anti-GST抗体和anti-His抗体在33 kD和25 kD处均能检测得到目的蛋白(图 4), 说明25 kD处的条带可能是重组蛋白的不同剪切形式。

|
| 图 4 人参硫堇蛋白纯化及检测结果 1:上样流穿液;2、3:洗脱液;M:蛋白分子量标准;4:anti-GST抗体检测结果;5:anti-His抗体检测结果 |
通过对人参进行土传真菌黑斑菌的体外抑菌实验, 结果(图 5)表明, 人参硫堇蛋白在3和9 μmol/L浓度时对黑斑病菌丝的生长具有明显的抑制作用(形成抑菌圈)。根据公式计算生长抑制率分别为36.0%和51.1%。使用黑斑孢子来检测重组蛋白的半数抑制浓度, 结果如表 1所示, 利用不同蛋白浓度的抑菌率来绘制趋势线, 利用公式计算得出重组蛋白对黑斑孢子的半数抑制浓度为0.87 μmol/L。质膜通透性试验发现, 经硫堇蛋白处理过的黑斑孢子, SYTOX荧光染料可进入孢子内与DNA结合, 发出绿色荧光, 而空白组在显微镜下则没有荧光(图 6)。说明人参硫堇蛋白可以诱导黑斑孢子质膜通透性发生改变进而达到抑菌效果。
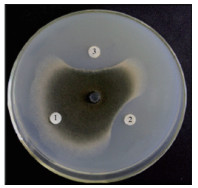
|
| 图 5 人参硫堇蛋白抑制黑斑病菌生长 1:GST蛋白阴性对照;2:硫堇蛋白3 mmol/L;3:硫堇蛋白9 mmol/L |

|
| 图 6 人参硫堇蛋白改变黑斑病菌孢子细胞膜通透性 1:空白组明场;2:空白组荧光;3:试验组明场;4:试验组荧光 |
趋势线公式y=47.69x+8.51
3 讨论植物在生长过程中不可避免地受到多种病原微生物的影响, 在长期的进化过程中, 植物形成了独特的防御机制来抑制病原微生物的侵染和传播。其中, 大量表达抗菌肽是一种重要的防卫机制。抗病毒蛋白和多肽包括几丁质酶、防御素和类防御素蛋白、亲环素蛋白、葡聚糖酶、过敏多肽、脂质转移蛋白、硫堇蛋白和过氧化物酶等[10-14]。其中, 硫堇蛋白已经在至少15种植物中被分离出来并鉴定[15-17]。
本研究使用分子生物学手段成功构建了人参硫堇蛋白成熟肽的原核表达质粒, 选择这一部分蛋白来单独表达是由于通过软件分析蛋白N端具有一个前导肽, 表达后引导蛋白定位在细胞壁上, 之后前导肽被剪切下来。因此发挥作用的硫堇蛋白应该是切除了前导肽的成熟肽部分。本研究采用原核表达载体pGEX-4T1, 该载体上带有GST融合蛋白, 能够增加重组蛋白的可溶性和表达量[18], 同时, 由于多数物种的硫堇蛋白具有抑菌活性, 为了防止人参硫堇蛋白在大肠杆菌中表达造成毒性产生菌体自溶, 加入融合蛋白可以中和这一毒性[19]。在本研究中, GST没能增加重组蛋白的可溶性, 但是中和了硫堇蛋白的毒性, 重组蛋白以包涵体形式成功表达。另外, 在C端加入6×His标签, 便于包涵体蛋白变性后亲和纯化。硫堇蛋白的成熟肽部分具有多个半胱氨酸, 其是否能够形成二硫键是未知的, 而通过变性后复性的纯化方法能否破坏二硫键进而影响蛋白功能也是需要研究的一个部分。未来可以通过人工合成该多肽, 然后分析活性、高分辨质谱精确分子量并进行肽指纹图谱分析, 进一步了解其构象和功能。
本研究发现, 多种抗菌肽的抗菌机制为在靶细胞膜上形成离子通道, 使细胞膜两侧的膜电位发生改变, 靶细胞因渗透压改变, 水溶性物质渗出而死亡[20]。本研究纯化的重组硫堇蛋白能够特异性的抑制黑斑病真菌的生长, 且机制为改变真菌细胞膜的通透性, 符合大部分抗菌肽的抗菌机制。
4 结论成功克隆了人参thionins, thionins蛋白体外具有活性, 能抑制黑斑病菌的生长。
| [1] |
崔巍, 赵洪艳, 王燕嬉. 人参皂苷抗衰老的研究进展[J]. 中国老年学杂志, 2006, 26(11): 1578-1581. DOI:10.3969/j.issn.1005-9202.2006.11.068 |
| [2] |
胡圣望, 胡勇, 王平. 人参皂苷Rg1对慢性应激大鼠空间学习能力的影响[J]. 四川中医, 2004, 22(3): 14-15. DOI:10.3969/j.issn.1000-3649.2004.03.007 |
| [3] |
Wesnes KA, Ward T, et al. The memory enhancing effects of a Ginkgo balboa/Panax ginseng combination in health middle aged volunteers[J]. Pschopharmacology, 2000, 152(4): 353-361. |
| [4] |
田建明, 李浩, 叶金梅, 等. 人参皂苷Rg2对大鼠化学性心肌缺血的影响[J]. 中国中药杂志, 2003, 28(12): 1191-1192. DOI:10.3321/j.issn:1001-5302.2003.12.028 |
| [5] |
张秋梅, 张喆, 于德民, 等. 人参糖肽治疗2型糖尿病的临床观察[J]. 中国现代医学杂志, 2003, 13(6): 59. DOI:10.3969/j.issn.1005-8982.2003.06.022 |
| [6] |
Shergis JL, Di YM, et al. Therapeutic potential of Panax ginseng and ginsenosides in the treatment of chronic obstructive pulmonary disease[J]. Complement Ther Med, 2014, 22(5): 944-953. DOI:10.1016/j.ctim.2014.08.006 |
| [7] |
Cai K, Wang J, Wang M, et al. Molecular cloning, recombinant expression, and antifungal functional characterization of the lipid transfer protein from Panax ginseng[J]. Biotechnology Letters, 2016, 38(7): 1229-1235. DOI:10.1007/s10529-016-2100-9 |
| [8] |
Zhang H, Wang J, Li S, et al. Molecular cloning, expression, purifcation and functional characterization of an antifungal cyclophilin protein from Panax ginseng[J]. Biomedical Reports, 2017, 7(6): 527-531. |
| [9] |
Tam JP, Wang S, Wong KH, et al. Antimicrobial peptides from plants[J]. Pharmaceuticals, 2015, 8(4): 711-757. |
| [10] |
Ghosh M. Antifungal properties of haem peroxidase from Acorus calamus[J]. Annals of Botany, 2006, 98(6): 1145-1153. DOI:10.1093/aob/mcl205 |
| [11] |
Guida V, Cantarella M, Chambery A, et al. Purification and characterization of novel cationic peroxidases from Asparagus acutifolius L. with biotechnological applications[J]. Molecular Biotechnology, 2014, 56(8): 738-746. DOI:10.1007/s12033-014-9752-2 |
| [12] |
Ajesh K, Sreejith K. A novel antifungal protein with lysozyme-like activity from seeds of Clitoria ternatea[J]. Applied Biochemistry and Biotechnology, 2014, 173(3): 682-693. DOI:10.1007/s12010-014-0880-8 |
| [13] |
Candido Ede S, Pinto MF, Pelegrini PB, et al. Plant storage proteins with antimicrobial activity:novel insights into plant defense mechanisms[J]. FASEB Journal, 2011, 25(10): 3290-3305. DOI:10.1096/fj.11-184291 |
| [14] |
Wong JH, Ng TB, et al. Proteins with antifungal properties and other medicinal applications from plants and mushrooms[J]. Appl Microbiol Biotechnol, 2010, 87(4): 1221-1235. |
| [15] |
Kulko AB, Kisl OV, Sadykova VS, et al. investigation of thionins from black cumin(nigella sativa L.)seeds showing cytotoxic, regulatory and antifungal activity[J]. Antibiol Khimioter, 2016, 61(9/10): 8-16. |
| [16] |
Ji H, Gheysen G, et al. The role of thionins in rice defence against root pathogens[J]. Mol Plant Pathol, 2015, 16(8): 870-881. DOI:10.1111/mpp.2015.16.issue-8 |
| [17] |
Lee OR, Kim Y, Balusamy SRD, et al. Ginseng g-thionin is localized to cell wall-bound extracellular spaces and responsive to biotic and abiotic stresses[J]. Physiol Mol Plant Pathol, 2011, 76(2): 82-89. |
| [18] |
Harper S, Speicher DW. Purification of proteins fused to glutathione S-transferase[J]. Methods Mol Biol, 2011, 681: 259-280. DOI:10.1007/978-1-60761-913-0 |
| [19] |
Yu H, Li H, Gao D, et al. Secretory production of antimicrobial peptides in Escherichia coli using the catalytic domain of a cellulase as fusion partner[J]. J Biotechnol, 2015, 214: 77-82. DOI:10.1016/j.jbiotec.2015.09.012 |
| [20] |
Barbosa PP, Del Sart RP, Silva ON, et al. Antibacterial peptides from plants:what they are and how they probably work[J]. Biochem Res Int, 2011, 2011(5): 250349. |





