2. 贵阳中医学院,贵阳 550025
2. Guiyang University of Chinese Medicine, Guiyang 550025
吲哚-3-乙酸(Indole-3-acetic acid,IAA)是植物体内主要的内源生长素(Auxin),参与调控植物生长发育的各个生命活动,如根初期发育与形态建成、维管束形成与分化及器官衰老等。目前,认为IAA生物合成途径根据是否依赖色氨酸可分为2条,其中依赖色氨酸途径一般划分色胺(Tryptamine,TAM)途径和吲哚-3-丙酮酸(Indole-3-pyruvate,IPA)途径等4条[1]。在植物体内,IAA的生物合成以TAM途径和IPA途径最为普遍。随着研究的不断深入,学者们研究认为TAM途径的一个限速酶和催化IPA途径的一个限速步骤均是YUCCA基因[2-6]。然而IAA在植物体内有游离态和结合态2种类型,其中具有活性的是游离态,而结合态可经水解降解成游离态。GH3编码的吲哚乙酸氨基化合成酶能催化IAA氨基化,导致IAA失活,进而维持植物体内IAA含量稳定[7]。可见,YUCCA和GH3对合成和调控植物体内的内源IAA动态平衡具有重要意义。
太子参Pseudostellaria heterophylla(Miq.)Pax ex Pax et Hoffm系石竹科植物,入药部位为干燥块根,因其药性甘、微苦且平,具有益气健脾、生津润肺的功效,是临床常用的补益中药。目前市场上太子参药材主要来自江苏句容、安徽宣州、福建柘荣和贵州施秉等地区的栽培品,其种植过程块根的生长发育情况是影响药材品质的重要因素。近年来,关于太子参块根形成与膨大的研究已有报道[8-11],研究显示太子参块根是由不定根发育而成,要经历不定根的发育和块根形成2个阶段,之后则是块根不断膨大阶段。而多效唑(Paclobutrazol,PBZ)为含氮杂环化合物,是一种植物生长延缓剂,具有抑制营养生长,进而促进生殖生长,达到增加产量与改善品质等作用。郑听等[12]研究表明使用适量浓度的PBZ能够提高太子参的产量。但未见从外源PBZ和内源IAA结合的角度对太子参块根生长发育进行研究的报道。
本研究以贵州施秉常用种源为实验材料,研究外施PBZ以及与PBZ有拮抗作用的赤霉素(Gibberellin,GA)的活性成分GA3对太子参块根形成后的膨大阶段的影响,旨在阐明外源PBZ对内源IAA含量的影响。同时,从Illumina平台测序构建的太子参转录组数据库中检索、鉴定和克隆太子参YUCCA和GH3,以期探明外源PBZ对IAA生物合成的相关基因YUCCA和GH3表达模式的影响,为太子参栽培提供理论参考。
1 材料与方法 1.1 材料2016年4月底,将生长健壮、长势一致的贵州施秉种源太子参幼苗移栽至含混合土(普通土:营养土:珍珠岩:蛭石=3:3:1:1)的塑料花盆中(30 cm×30 cm),盆下垫水盘,每盆6-7株,根据土壤表面湿润程度于每日傍晚19:00左右在叶面喷施适量清水。1周以后,太子参幼苗逐渐有新叶长出,选择长势优良均匀的幼苗随机分成4个组,每组重复3次,分别用200 mL 20 mg/L PBZ、150 mg/L GA3及GA3+PBZ(V/V=1﹕1)浇灌太子参根际土壤,以等量清水为对照组,进行挂牌标记;次日同一时段用200 mL营养液浇灌太子参根际土壤;均为每隔10 d浇灌1次。
样品材料为第1次激素处理后,第10、20、30、40和50 d进行采挖,选取大小均匀的块根经液氮速冻,置-80℃保存,处理后10-50 d的材料用于提取内源IAA,10、30和50 d的材料用于提取总RNA。其中第一次采样(处理后10 d)是太子参块根膨大初期,最后一次采样(处理后50 d)是太子参植株在倒苗后10 d左右[13]。
1.2 方法 1.2.1 内源IAA提取与含量测定根据酶联免疫吸附测定法试剂盒提供的操作方法提取处理后第10、20、30、40和50 d实验材料中的内源IAA,并测定其含量。
1.2.2 总RNA提取与cDNA第一链合成参照试剂盒RNAiso Plus和DNaseⅠ的操作说明对第10、30和50天的太子参块根总RNA进行提取纯化,用1.2%琼脂糖凝胶电泳检测其完整性,微量核酸测定仪检测其浓度和纯度并调节至800 ng,以OligoT11(50 μmol/L)为引物,SMART MMLV Reverse Transcrip-tase为反转录酶合成第一链cDNA,-20℃保存备用。
1.2.3 太子参IAA合成相关基因的鉴定与克隆以拟南芥和水稻的YUCCA和GH3家族成员核苷酸序列为query序列,借助Local BLAST-2.2.24+软件在太子参转录组数据库中进行同源比对分析,然后通过在线工具NCBI Blastn再一次进行分析。去除重复的序列后,运用在线数据库SMART、NCBI CD-Search和Pfam对候选基因进一步确认,获得太子参YUCCA和GH3家族基因。同时,对确认的YUCCA和GH3在太子参不同组织器官中的转录表达丰度进行分析,并根据每个基因对应的序列设计特异引物(表 1),以太子参块根cDNA为模板进行PCR扩增,扩增体系为Premix Taq(Ex Taq Version 2.0 plus dye)12 μL、上下游引物(10 μmol/L)各1 μL、cDNA模板1 μL,灭菌双蒸水补足到25 μL。扩增程序为98℃ 10 s;退火温度30 s,72℃ 2 min,35个循环;4℃保存。PCR产物经1%琼脂糖凝胶电泳检测,纯化后与pMD19-T连接,转化至大肠杆菌DH5α,筛选阳性克隆,送南京金斯瑞生物科技有限公司进行测序。
根据上述鉴定确定的3个GH3和1个YUCCA的CDS序列设计实时荧光定量PCR的特异性引物(表 1),分别以外源PBZ和GA3处理后10、30和50 d太子参块根的cDNA为模板,太子参PhACT2(GenBank登录号为KT363848)为内参基因[14-15],对IAA生物合成相关基因在经外源PBZ和GA3处理后太子参块根中的表达模式进行检测。采用SYBR® Premix Ex TaqTMⅡ(Tli RNaseH Plus)试剂盒在ABI公司的7500 Real Time PCR System进行实时荧光定量PCR扩增。PCR扩增体系为2×SYBR® Premix Ex TaqTM Ⅱ(Tli RNaseH Plus)10 μL、50×ROX Reference DyeⅡ 0.4 μL、上下游引物(10 μmol/L)各0.48 μL、cDNA模板2 μL,加ddH2O补至20 μL。每个反应生物学重复3次,操作重复3次。扩增程序为95℃ 30 s;95℃ 5 s,60℃ 34 s,40个循环。溶解曲线为95℃ 15 s,60℃ 1 min,95℃ 15 s。用2-△Ct法对各基因相对表达量进行分析。
1.2.5 数据分析采用GraphPad Prism 5软件对数据进行处理和绘图,应用SPSS 16中单因素方差(One-way ANOVA)分析对各组数据进行多重比较。
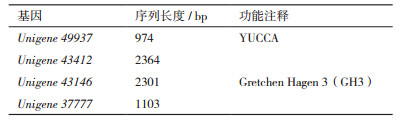
2 结果 2.1 外源PBZ、GA3处理对太子参块根中内源IAA含量的影响如图 1所示,太子参块根生长发育过程内源IAA的含量在第一次处理后10-20 d表现为下降,之后的含量基本稳定,维持在8-10 ng/g FW。根际土壤灌注20 mg/L PBZ溶液10、20和30 d后,根内源IAA含量均明显高于对照组,随后均低于对照,而处理10 d时内源IAA含量最高。而当太子参植株根际土壤灌注150 mg/L GA3溶液时,其内源IAA含量发生不同程度的改变,除在20 d时低于对照外,其他几个时期均高于对照,其中10 d时最高。有趣的是,在太子参块根形成后膨大的整个时期,4个实验组内源IAA的含量在处理后10 d均为最高,之后逐渐下降,到30 d之后基本保持动态平衡。
|
| 图 1 不同激素处理条件下太子参块根形成后膨大过程中内源IAA动态变化(n=3) 不同小写字母表示在P < 0.05时差异显著,下同 |
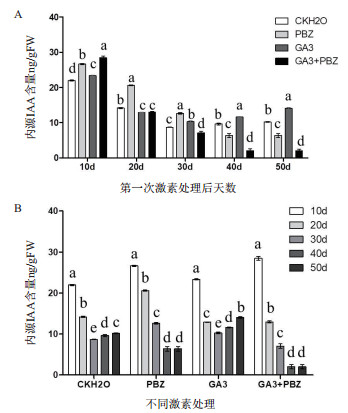
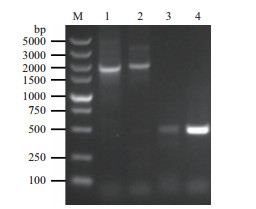
利用Local BLAST、SMART、NCBI CD-Search和Pfam方法,从太子参转录组数据库中鉴定获得3个GH3,序列为1 103-2 364个核苷酸长度;1个YUCCA,序列为974个核苷酸长度(表 2)。以太子参块根cDNA为模板,利用特异引物扩增所得的目的条带大小与预期大小一致(图 2)。通过分析太子参转录组中的转录表达数据(图 3),Unigene43146、Unigene37777和Unigene43412这3个GH3的表达模式相似,均在太子参块根的韧皮部和木质部中表达量最高,且均高于叶、茎和花;但编码YUCCA的Unigene49937的表达模式表现出相反趋势,具体为花 > 叶 > 块根韧皮部 > 茎 > 块根木质部。
|
| 图 2 太子参IAA生物合成相关基因cDNA扩增产物的电泳检测 M:DL5 000 DNA Marker;1-4:分别是Unigene 43412、Unigene 43146、Unigene 49937和Unigene 37777 |
|
| 图 3 太子参IAA生物合成相关基因在不同组织的表达分析(n=3) |
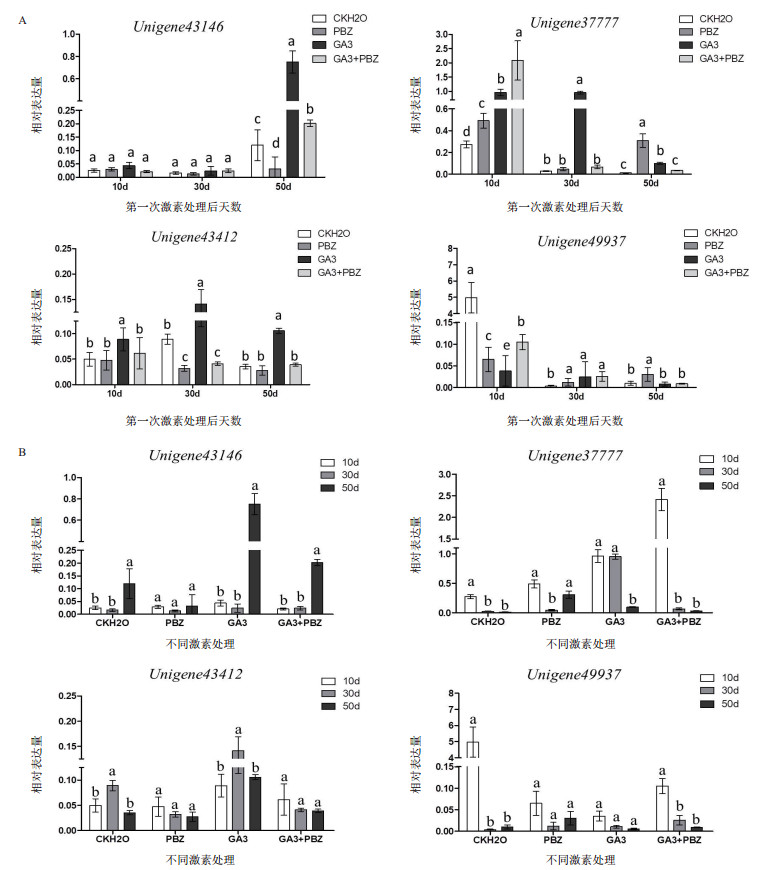
为了进一步探讨外源PBZ和GA3对内源IAA生物合成的影响,采用实时荧光定量PCR技术检测IAA生物合成相关基因表达的变化,进而分析对基因表达模式的影响(图 4)。
|
| 图 4 太子参IAA生物合成的相关基因YUCCA和GH3在不同激素处理块根中的表达分析(n=3) |
第1次激素处理后10 d时,外源PBZ处理组,Unigene37777受PBZ诱导表达量表现为上调,Unigene43146和Unigene43412的表达均无明显变化;外源GA3处理组,Unigene37777和Unigene43412这2个GH3表达量也明显上调。然而,YUCCA的Unigene49937的表达量在外源PBZ和GA3处理组均表现为下调。
30 d时,外源PBZ处理组,Unigene43146和Unigene37777的转录表达水平与对照组相比无显著变化,但下调了Unigene43412的表达和上调了Unigene49937的表达;有趣的是,在外源GA3处理组,除Unigene43146的表达水平无显著变化外,Unigene37777、Unigene43412和Unigene49937在受GA3诱导后的相对表达量均呈现显著上调。
50 d时,外源PBZ处理后,GH3除Unigene37777受PBZ诱导表达量表现为上调外,Unigene43146和Unigene43412的表达受到抑制,并且表达量有不同程度的降低。然而外源GA3处理后3个GH3表达量均明显上调。另外,YUCCA的Unigene49937的表达量在外源PBZ和GA3处理后表现截然相反的情况,受PBZ诱导,表达量显著增强,而受GA3抑制,表达量略微下调。
3 讨论植物生长发育过程中,IAA是一种必需激素,参与调控器官建成、器官发育、维管组织分化、细胞伸长、顶端优势和根的向地性等多个过程。本研究表明,外源PBZ和GA3处理对内源IAA均有增强效应,特别是在太子参块根膨大发育前期IAA含量尤为高,随后IAA含量基本呈现同样的下降趋势,并趋于动态平衡。这与植物中IAA的合成主要集中在处于快速细胞分裂器官的研究结果相一致[16]。说明IAA是太子参块根膨大初期生长发育的关键内源激素之一,但对块根膨大中后期的影响不大。然而,外源PBZ和GA3对太子参块根中内源IAA的合成都具有一定的促进作用,可能与它们都是植物生长调节剂有关。
IAA在块根发育各阶段的调控作用又受到其生物合成相关基因转录表达的影响。实时荧光定量PCR结果显示在第1次激素处理后的第50天时,外源PBZ能降低Unigene43146和Unigene43412的表达水平,而提高Unigene37777的表达水平;同样在对照组和外源GA3处理组3个基因表达水平也呈现为高低不一的情况,这3个GH3表达水平的各不相同,可能对催化自由态IAA向结合态转化的能力也不相同,最后通过整合作用参与块根成熟期IAA动态平衡的调节作用。
本研究还发现YUCCA和GH3在太子参各组织中的表达水平各不相同,其中Unigene43146、Unigene37777和Unigene43412块根韧皮部和木质部特异性表达,Unigene49377的特异性表达则在花和叶。这可能是因为IAA的合成具有组织特异性[17],是经特定细胞合成后再运输到不同组织部位[18-19]。因此推测IAA对太子参块根的膨大发育有着直接的调控作用,它的分布与浓度也直接影响块根膨大发育。
4 结论外源PBZ对太子参块根膨大发育阶段前期和中期的内源IAA积累表现出显著的诱导作用,后期则是抑制作用,这均与YUCCA和GH3的转录表达水平密切相关。
| [1] |
Woodward AW, Bartel B. Auxin:regulation, action, and interaction[J]. Annals of Botany, 2005, 95(5): 707-735. DOI:10.1093/aob/mci083 |
| [2] |
Zhao Y, Christensen SK, Fankhauser C, et al. A role for flavin monooxygenase-like enzymes in auxin biosynthesis[J]. Science, 2001, 291(5502): 306-309. DOI:10.1126/science.291.5502.306 |
| [3] |
Kim JI, Sharkhuu A, Jin JB, et al. yucca6, a dominant mutation in Arabidopsis, affects auxin accumulation and auxin-related phenotypes[J]. Plant Physiology, 2007, 145(3): 722-735. |
| [4] |
Won C, Shen X, Mashiguchi K, et al. Conversion of tryptophan to indole-3-acetic acid by tryptophan aminotransferases of Arabidopsis and YUCCAs in Arabidopsis[J]. Proceedings of the National Academy of Sciences of the USA, 2011, 108(45): 18518-18523. DOI:10.1073/pnas.1108436108 |
| [5] |
Mashiguchi K, Tanaka K, Sakai T, et al. The main auxin biosynthesis pathway in Arabidopsis[J]. Proceedings of the National Academy of Sciences of the USA, 2011, 108(45): 18512-18517. DOI:10.1073/pnas.1108434108 |
| [6] |
Park HC. Roles of YUCCAs in auxin biosynthesis and drought stress responses in plants[J]. Plant Signaling & Behavior, 2013, 8(6): 337-349. |
| [7] |
Staswick PE, Serban B, Rowe M, et al. Characterization of an Arabidopsis enzyme family that conjugates amino acids to indole-3-acetic acid[J]. The Plant Cell, 2005, 17(2): 616-627. |
| [8] |
彭华胜, 胡正海, 刘文哲, 等. 栽培太子参块根的发育解剖学研究[J]. 西北植物学报, 2008, 28(5): 861-867. DOI:10.3321/j.issn:1000-4025.2008.05.001 |
| [9] |
叶祖云, 阮少江, 王雅英, 等. 太子参微块根发育的解剖学与组织化学定位[J]. 植物生理学报, 2009, 45(10): 981-985. |
| [10] |
袁婧, 李金玲, 赵致, 等. 太子参块根膨大过程中生长规律初探[J]. 中国现代中药, 2013, 15(11): 959-965. |
| [11] |
郑伟, 周涛, 李军, 等. 太子参玉米黄质环氧化酶基因的克隆与表达分析[J]. 中国中药杂志, 2017, 42(4): 669-674. |
| [12] |
郑听, 曹国璠, 李金玲, 等. 多效唑对太子参光合特性与产量的影响[J]. 贵州农业科学, 2017, 45(2): 142-145. DOI:10.3969/j.issn.1001-3601.2017.02.034 |
| [13] |
肖承鸿, 周涛, 江维克, 等. 贵州太子参生物量与次生代谢物积累的动态变化分析[J]. 中国药学杂志, 2013, 48(16): 1346-1351. |
| [14] |
丁铃, 李军, 周涛, 等. 太子参3个肌动蛋白基因片段的克隆与序列分析[J]. 中草药, 2016(11): 1935-1942. DOI:10.7501/j.issn.0253-2670.2016.11.021 |
| [15] |
丁铃, 江维克, 周涛, 等. 太子参肌动蛋白基因PhACT2的全长cDNA克隆与生物信息学分析[J]. 分子植物育种, 2017(2): 460-467. |
| [16] |
张立军, 宋纯鹏, 王学路, 等. 植物生理学[M]. 2015: 437-460.
|
| [17] |
Robert HS, Grones P, Stepanova AN, et al. Local auxin sources orient the apical-basal axis in Arabidopsis embryos[J]. Current Biology, 2013, 23(24): 2506-2512. DOI:10.1016/j.cub.2013.09.039 |
| [18] |
Petrášek J, Friml J. Auxin transport routes in plant development[J]. Development, 2009, 136(16): 2675-2688. DOI:10.1242/dev.030353 |
| [19] |
Robert HS, Grunewald W, Sauer M, et al. Plant embryogenesis requires AUX/LAX-mediated auxin influx[J]. Development, 2015, 142(4): 702-711. |