2. 四川农业大学农学院,成都 611130;
3. 成都市农林科学院园艺研究所,成都 611130
2. Agricultural College, Sichuan Agricultural University, Chengdu 611130;
3. Institute of Horticulture, Chengdu Academy of Agricultural and Forestry Sciences, Chengdu 611130
香菇是全球第二大食用菌[1],同时也是我国特产,产量居世界前列。其味道鲜美,营养价值极高,兼具食物与药物功能,素有“山珍之王”之称[2-3]。香菇多糖是香菇的主要代谢产物,具有抗肿瘤、抗衰老、免疫调节、抗病毒感染等功能及生物活性强、毒性小等特点[4-5]。因此,提高香菇多糖的产量具有较大的经济价值。
多糖代谢途径极其复杂,有多种蛋白酶参与。真菌类多糖代谢是糖基转移酶将单糖从糖核苷酸依序地转移到脂类载体上,从而形成重复单元,随后在相关蛋白作用下聚合并输出形成多糖[6]。多糖代谢中,UDP-葡萄糖焦磷酸化酶(UDP-glucose pyrophosphorylase,UGP)能够可逆的催化UTP和葡萄糖-1-磷酸生成UDP-葡萄糖和焦磷酸,因其处于葡萄糖代谢的十字路口,在多糖代谢中具有重要作用,大肠杆菌UGP酶活随着pH值增加明显增强[7];葡萄糖磷酸变位酶(Phosphoglucomutase,PGM)催化葡萄糖-1-磷酸盐和葡萄糖-6-磷酸盐相互转化,其对灰树花胞外多糖的合成起正向促进作用[8];葡萄糖磷酸异构酶(Phosphoglucose isomerase,PGI)参与乳酸的代谢,在糖酵解过程中,决定葡萄糖-6-磷酸(G-6-P)是否更多转化为果糖-6-磷酸(F-6-P)。灵芝PGM与PGI酶活随着pH值的降低不断增加[9]。由此可知,多糖代谢关键酶对阐明香菇多糖代谢途径的研究,对进一步提高多糖产量具有重要参考意义。已有的研究大多只针对多糖代谢途径过程中关键酶蛋白水平上的研究,很少针对这些基因在转录水平上的变化。
香菇多糖成分与含量与其生长条件密切相关,其中培养基成分与培养条件是主要的影响因素。研究发现,在最适pH值发酵条件下,不同菌种的生物量及多糖含量存在差异[10-12],当pH值为5.5时,灵芝HAI 447胞内和胞外多糖合成量最大;当pH值从6.5不断降低至3.5时,灵芝CCGMC5.616的多糖含量不断提高,由此可见pH值是影响菌丝体生物量及多糖含量的关键因素之一。
实时荧光定量PCR技术(Quantitative real-time PCR,qRT-PCR)是研究基因表达水平的主要手段之一,但其结果的可靠性依赖于很多因素,其中筛选稳定表达的内参基因可有效增加结果的可靠性。近年来,内参基因的筛选已在多个物种中开展。黄真池等[13]分析桉属植物中4个候选内参基因,发现RARS是最稳定表达的;张宁等[14]分析了病毒TMV与PVX胁迫番茄后的4个候选内参基因的稳定性,揭示了ACT基因为番茄最优内参基因。基于此,本文利用RT-qPCR技术和3个常用软件(GeNorm、NormFinder和BestKeeper)分析了不同pH发酵条件下香菇新808中10个候选内参基因的稳定性,筛选出最稳定表达的内参基因,以此为基础,分析了香菇多糖代谢3个关键酶基因(UGP、PGM和PGI)的转录表达水平,结合香菇生物量、多糖含量的变化分析了pH对香菇生长和多糖代谢的影响,为进一步优化香菇多糖的发酵条件、阐明香菇多糖代谢机理提供参考。
1 材料与方法 1.1 材料供试菌种:香菇新808,由四川农业大学微生物系保存。
主要试剂:葡萄糖、蛋白胨、KH2PO4、MgSO4、维生素B1、琼脂粉、HCl、NaOH均为分析纯、逆转录试剂盒(TIANGEN TaKaRa,Shiga,Japan)、SYBR Green Master Mix(Vazyme)等。
主要仪器:DHP-9082电热恒温培养箱、iQ5荧光定量PCR仪(Bio-rad)等。
1.2 方法 1.2.1 菌株培养基及培养条件在超净工作台将菌株接种于PDA(马铃薯200 g,葡萄糖20 g,琼脂粉20 g,pH自然,定容至1 000 mL,115℃灭菌30 min)平板上,25℃恒温培养8 d,活化菌株。将活化的菌株用打孔器打孔,选择生长状态一致的3块菌块接种到50 mL发酵培养基(2.50%蛋白胨、2.50%葡萄糖、0.10%磷酸二氢钾、0.10%硫酸镁和0.01%维生素B1),每个培养条件设置3个重复,25℃恒温培养30 d收集样品,用于生物量、多糖含量测定及RNA提取。实验分别设置5个pH值(灭菌后调节):5.0、5.5、6.0、6.5和7.0。
1.2.2 香菇多糖含量及生物量的测定100目筛网过滤发酵液,并用蒸馏水洗涤3次,3 000 r/min离心20 min。分别用灭菌的剪刀取一半菌丝直接液氮速冻,用于RNA提取,另外一半菌丝体置滤纸上(预先烘干并称重),60℃烘干至恒重称取生物量,总生物量=2×实际测定生物量。
采用苯酚-硫酸法测定胞内多糖含量。以葡萄糖为标准品制作标准曲线;称取0.2 g烘干后的菌丝液氮研磨成粉末,加入50倍体积沸水,回流1 h,重复1次;将两次回流的样品4℃,3 000 r/min,离心30 min,得到上清液;加入上清液4倍体积95%乙醇,4℃过夜沉淀,4℃,3 000 r/min,离心10 min,将沉淀置于60℃,去除多余的乙醇;加入适量的蒸馏水溶解多糖沉淀,吸取适量的多糖溶液于洗干净的试管中,并补水至2 mL;加入1 mL 6%的苯酚溶液,振荡,再加入5 mL浓硫酸,迅速振荡均匀,置于25℃水浴30 min;于490 nm下测定其光密度,根据标准曲线及所测光密度计算单位生物量的胞内多糖含量。
取10 mL过滤后的培养液测定胞外多糖含量。加入3倍体积95%乙醇溶液;4℃,醇沉12 h;4 000 r/min,离心10 min,去除上清液,灭菌水溶解沉淀;吸取适量的多糖溶液于干净的试管中,并补水至2 mL;加入1 mL 6%的苯酚溶液,振荡,再加入5 mL浓硫酸,迅速振荡均匀,置于25℃水浴30 min;于490 nm下测定其光密度,根据标准曲线及所测光密度计算单位体积的胞外多糖含量。由于胞内多糖的总量与生物量相关,因此,总多糖的含量=胞内多糖含量(mg/g)×总生物量(mg)+胞外多糖(mg/mL)×总体积(mL)。
1.2.3 RNA的提取与逆转录将菌丝于液氮中研磨成细粉,取100 mg用TRIzol法提取总RNA[15]。样品纯度和浓度使用Nano drop(ND-1000 Thermo Scientific,Waltham,MA,USA)进行测量,并通过琼脂糖凝胶电泳检查完整性。使用逆转录试剂盒(TIANGEN TaKaRa,Shiga,Japan)将2.0 μg总RNA合成第一链cDNA。将合成的cDNA用无核酸酶的水稀释10倍并保存于-20℃。
1.2.4 荧光定量PCR以上述cDNA为模板进行qRT-PCR. SYBR green florescent染料检测产物。qRT-PCR在iQ5荧光定量PCR(Bio-Rad,USA)仪上进行。20 μL总反应体系中包括:1 μL cDNA,0.5 μL上下游引物(10 μmol/L),5 μL SsoFastTM EvaGreen® Supermix(Bio-Rad,USA)和13.5 μL RNAase free水。以ddH2O为模板作为负对照。反应程序:95℃ 2 min;95℃ 15 s,63℃ 20 s,72℃ 26 s,40个循环。通过将扩增子从60℃加热到90℃来产生溶解曲线分析产物的特异性。qPCR产物用2%的琼脂糖凝胶电泳检测,并将产物进行T-A克隆后送公司测序(生工生物工程股份有限公司)。
将cDNA模板进行10倍梯度稀释,稀释5个梯度,以此为模板进行标准曲线的制备,得到每个基因扩增的相关系数(R2值),以公式E(%)=(101/-斜率-1)*100计算扩增效率(E),运用Y = 10-(ΔCt/3)× 100%,计算目的基因相对表达量[16-17]。
1.2.5 内参基因的选择本实验选择了10个看家基因作为候选内参基因[18],利用GeNorm、BestKeeper和NormFinder分析每个内参基因的稳定性[19-21]。以qRT-PCR得到的Cq值为基础,根据每个软件的要求,将Cq值转变成相应的格式作为输入数据,计算每个内参基因的稳定性。
1.2.6 数据分析方法实验数据使用Excel进行平均值和标准值的计算,SPSS进行方差和显著性分析。
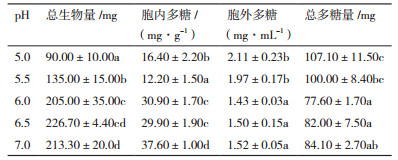
2 结果 2.1 不同pH发酵条件香菇菌丝体生物量不同pH发酵条件下香菇菌丝体总生物量存在显著差异(表 1,P < 0.05)。当pH值在5.0-6.5之间,总生物量随着pH值升高而增加,其中pH值为6.5(226.70 mg)时,其总生物量是pH值为5.0(90.00 mg)的2.5倍左右。当pH值进一步增大(pH=7.0),其总生物量有小幅下降。
除发酵培养基pH为6.0和6.5时,其余pH值发酵条件下,香菇菌丝体胞内多糖含量存在显著差异(表 1,P < 0.05)。当pH值为7.0时,其胞内多糖含量最高,达到37.60 mg/g,是pH为5.5(12.20 mg/g)发酵条件下的3.08倍。
与生物量和胞内多糖含量变化趋势相反,在pH值较低时,香菇菌丝体胞外多糖的含量相对较高(pH5.0,2.11 mg/mL),当pH值较高时(pH6.0或7.0),其含量较低,且无明显差异。
不同pH发酵条件下,香菇总多糖含量(胞内及胞外多糖)与胞外多糖含量变化趋势一致,在pH值较低(pH5.0或5.5)时,含量相对较高,随着pH值进一步增大,总多糖总量均较低。
2.3 内参基因的筛选为了筛选不同pH发酵条件下香菇最稳定表达的内参基因,以内参基因的Cq值为基础,利用GeNorm、BestKeeper和NormFinder分析了10个香菇内参基因在不同pH发酵条件下的稳定性。GeNorm软件输出数据以M值表示,M值越小,基因的稳定性越好[19]。BestKeeper软件评价基因的稳定性主要根据标准变异系数(SD)选择,若SD大于1.0,表明该基因稳定性差,不宜做内参基因;SD值越小,表明该基因越稳定[20]。NormFinder软件评价基因稳定性以方差S大小进行评价,S越小,基因表达越稳定,越宜作内参基因[21]。
5个pH值发酵条件下内参基因稳定性分析结果如图 1所示。由于每种软件使用的算法不一样,因此稳定性的排序也存在差异。GeNorm和NormFinder认为18S是最稳定表达的内参基因,BestKeeper也认为其稳定性较好(第3)。28S是BestKeeper认为最稳定表达的基因,GeNorm也认为其较为稳定(第3),但NormFinder显示其稳定性较差(第7),Rpl4和Pma在3个软件的分析中均是不稳定的基因之一。将3个软件分析的每一内参基因进行稳定性排序,结果(表 2)显示表明18S是最稳定的基因,其次是F-actin,rpl4是最不稳定的。

|
| 图 1 根据BestKeeper(A)、GeNorm(B)和NormFinder(C)软件对候选内参基因稳定性排序 |
为了分析香菇UGP、PGM和PGI三个基因在不同pH发酵条件下的响应特征,我们利用RT-PCR分析了不同pH发酵条件下UGP、PGM和PGI三个基因的转录表达水平,结果(图 2)显示3个基因在不同pH值发酵条件下的转录表达水平存在明显差异,总的来说,UGP的相对表达量最高,PGM和PGI的则要低一些。

|
| 图 2 不同pH发酵条件下UGP、PGM和PGI基因相对表达量 A:18S为内参基因时,3个关键酶基因的相对表达量;B:18S+F-actin为内参基因时,3个关键酶基因的相对表达量;C:rpl4为内参基因时,3个关键酶基因的相对表达量。 |
以18S作为内参基因结果如图 2-A,当pH6.5时,UGP的转录表达水平略有下调,而在其他4个pH发酵条件下,其转录表达水平差异不大。PGM在5个pH发酵条件下的转录表达水平差异不大。pH为5.5和7.0的发酵条件下,PGI基因的转录表达水平较高,但无明显差异。
以内参基因18S+F-actin同时作为内参基因时,UGP、PGM和PGI的相对表达量变化趋势与以18S作为内参基因时较为接近,而以不稳定的Rpl4为内参基因所得出的结果与前两者存在较大差异。以UGP的转录表达水平为例,当18S和18S+F-actin作为内参基因,其转录表达水平均在pH6.5发生下调,而在其他条件下无明显差异,而以Rpl4作为内参基因时,pH6.5发酵条件下,其转录表达水平远高于其他3个pH(5.0、5.5和7.0)发酵条件,研究结果进一步说明筛选合适的内参基因的重要性。
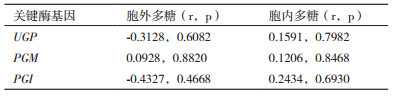
2.5 多糖含量与3个关键酶基因转录表达水平相关性分析UGP、PGM和PGI在多糖代谢途径中发挥重要的作用,通过皮尔森相关系数(Pearson correlation coefficient)分析了3个关键酶基因的转录表达水平与多糖含量之间的相关性。与已有的关于这3个蛋白酶活与多糖含量存在相关性的结果(表 3)比较,3个关键酶基因的转录表达水平与香菇多糖(胞内多糖和胞外多糖)的含量没有明显的相关性。
pH是影响真菌生长发育的重要因素之一。徐思炜等[22]研究发现香菇菌丝体最适生长pH值为5.0;赵俊杰等[10]通过改变香菇B08菌株的液体发酵条件,揭示了pH值为6.0是其最佳生长条件。由此可知,不同香菇菌株其最适pH值存在差异。本研究显示香菇新808菌丝体最适生长pH为6.5,在此条件下,其总生物量达到226 mg,是pH为5.0时的2倍左右。Simonic等[11]研究结果显示当pH为5.5时,灵芝胞内多糖含量最大;Fang等[12]通过对培养液初始pH研究显示,当初始pH值为6.5时灵芝多糖含量最高。香菇新808发酵液pH为7.0时,其胞内多糖产量最高,但pH为5.0时其胞外多糖含量最高,研究结果表明香菇新808生长、胞内多糖和胞外多糖生物合成受pH的影响存在差异。
为了进一步了解不同pH发酵条件下香菇多糖生物合成的分子机制,我们分析了不同pH发酵条件下香菇多糖代谢途径中3个关键酶基因转录表达水平。已有研究从蛋白水平分析了不同pH发酵条件下,UGP、PGM和PGI的酶活性存在差异[7-9]。本研究从转录水平上分析了不同pH发酵条件对UGP、PGI和PGM基因转录表达水平的影响。不同pH发酵条件下,UGP的相对表达量明显高于PGM与PGI;PGM相对表达量小且稳定;PGI相对表达量较小,但随pH值的变化波动较大。与蛋白酶和多糖含量之间存在相关性的结果相反,该研究中多糖含量与3个关键酶基因的转录表达水平无明显的相关性,这可能是由于基因转录到有活性的蛋白酶还需要经历复杂的翻译、翻译后修饰等过程。
荧光定量PCR结果的准确性依赖于很多因素,其中使用稳定表达的内参基因可以提高结果的可信度。故在计算相对表达量时,应先评估候选内参基因的稳定性。F-actin是一个常用的内参基因,但在黄瓜中盐胁迫下其转录表达不稳定[23]。通过对不同pH发酵条件下香菇中10个内参基因的稳定性分析显示,18S和rpl4分别是最稳定和最不稳定表达的内参基因。分别以18S、rpl4和18S+F-actin作为内参基因,分析了3个关键酶基因的转录表达水平,显示18S和18S+F-actin作为内参基因,3个关键酶基因的转录表达趋势一样,而以rpl4作为内参基因,其变化规律存在差异,进一步证实筛选稳定表达的内参基因可提高荧光定量PCR结果的可信度。
4 结论在实验用pH范围内,当pH较高时,香菇菌丝体生物量和胞内多糖含量较高,而胞外多糖与总多糖量则相对较低。GeNorm、NormFinder及BestKeeper三个软件分析出18S和rpl4分别是最稳定和最不稳定表达的内参基因。不同pH发酵条件下UGP的相对表达量较高,UGP和PGM相对表达量稳定,PGI相对表达随pH值的变化波动较大。
| [1] |
郭玉明, 钟厚贤. 香茹提取物对白血病细胞HL-60增殖的抑制作用[J]. 农产品加工(学刊), 2006, 4(8): 19-21. |
| [2] |
王贺祥. 食用菌学[M]. 北京: 中国农业大学出版社, 2007.
|
| [3] |
李月梅. 香菇的研究现状及发展前景[J]. 微生物学通报, 2005, 29(7): 149-152. |
| [4] |
Yu SH, Weaver V, Martin K, et al. The effects of whole mushrooms during inflammation[J]. BMC Immunology, 2009, 10(1): 1-13. |
| [5] |
Chandra LC, Smith BJ, Clarke SL, et al. Differential effects of shiitake-and white button mushroom-supplemented diets on hepatic steatosis in c57bl/6 mice[J]. Food & Chemical Toxicology, 2011, 49(12): 3074-3080. |
| [6] |
韩玉竹, 刘恩岐, 李彦岩, 等. 芽孢杆菌活性多糖的分离纯化及合成基因研究[J]. 食品科学, 2014, 35(11): 179-184. DOI:10.7506/spkx1002-6630-201411036 |
| [7] |
Lai X, Wu J, Chen S, et al. Expression, purification, and characterization of a functionally active mycobacterium tuberculosis udp-glucose pyrophosphorylase[J]. Protein Expression & Purification, 2008, 61(1): 50-56. |
| [8] |
Looijesteijn PJ, Boels IC, Kleerebezem M, et al. Regulation of Exopolysaccharide Production by Lactococcus lactis subsp.cremoris by the Sugar Source[J]. Applied & Environmental Microbiology, 1999, 65(11): 5003-5008. |
| [9] |
Peng L, Qiao S, Xu Z, et al. Effects of culture conditions on monosaccharide composition of ganoderma lucidum, exopolysaccharide and on activities of related enzymes[J]. Carbohydrate Polymers, 2015, 133: 104-109. DOI:10.1016/j.carbpol.2015.07.014 |
| [10] |
赵俊杰.香菇液体发酵及多糖提取工艺研究[D].郑州: 郑州大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10459-1014387720.htm
|
| [11] |
Simonic J, Stajic M, et al. Optimization of submerged cultivation conditions for extra and intracellular polysaccharide production by medicinal ling zhi or reishi mushroom ganoderma lucidum (w.curt.:fr.) p.karst.(aphyllophoromycetideae)[J]. Nternational Journal of Medicinal Mushrooms, 2008, 10(4): 351-360. DOI:10.1615/IntJMedMushr.v10.i4 |
| [12] |
Fang QH, Zhong JJ. Effect of initial pH on production of ganoderic acid and polysaccharide by submerged fermentation of ganoderma lucidum[J]. Process Biochemistry, 2002, 37(7): 769-774. DOI:10.1016/S0032-9592(01)00278-3 |
| [13] |
黄真池, 欧阳乐军, 等. 桉属植物内参基因的筛选及评估[J]. 西北农林科技大学学报:自然科学版, 2013, 41(10): 67-72. |
| [14] |
张宁, 魏周玲, 杜利娟, 等. TMV和PVX胁迫下云烟和番茄实时荧光定量内参基因筛选[J]. 西南大学学报:自然科学版, 2016, 38(7): 13-18. |
| [15] |
Meng L, Feldman L. A rapid TRIzol-based two-step method for DNA-free RNA extraction from Arabidopsis siliques and dry seeds[J]. Biotechnology Journal, 2010, 5(2): 183-186. |
| [16] |
Chen A, He S, Li F, et al. Analyses of the sucrose synthase gene family in cotton:structure, phylogeny and expression patterns[J]. BMC Plant Biology, 2012, 12(1): 85. |
| [17] |
Chen A, Chen X, Wang H, et al. Genome-wide investigation and expression analysis suggest diverse roles and genetic redundancy of pht1 family genes in response to pi deficiency in tomato[J]. BMC Plant Biology, 2014, 14(1): 61. |
| [18] |
Xiang Q, Li J, Qin P, et al. Identification and evaluation of reference genes for qrt-pcr studies in lentinula edodes[J]. PLoS One, 2018, 13(1): e0190226. DOI:10.1371/journal.pone.0190226 |
| [19] |
Vandesompele J, Preter KD, et al. Accurate normalization of real-time quantitative rt-pcr data by geometric averaging of multiple internal control genes[J]. Genome Biol, 2002, 3(7): 2002. |
| [20] |
Pfaffl MW, Tichopad A, Prgomet C, et al. Determination of stable housekeeping genes, differentially regulated target genes and sample integrity:bestkeeper--excel-Based tool using pair-wise correlations[J]. Biotechnology Letters, 2004, 26(6): 509-515. DOI:10.1023/B:BILE.0000019559.84305.47 |
| [21] |
Andersen CL, Jensen JL, Orntoft TF. Nomalization of real-time quantitative reverse transcription PCR data:a model-based variance estimation approach to identify genes suited for nomalization, applidto bladder and colon cancer data sets[J]. CancRes, 2004, 64(15): 5245-5250. |
| [22] |
徐思炜, 张君胜, 周雯. 香菇液体菌种培养条件优化[J]. 江苏农业科学, 2014, 42(12): 290-292. |
| [23] |
Wan HJ, Zhao ZG, Qian CT, et al. Selection of appropriate reference genes for gene expression studies by quantitative real-time polymerase chain reaction in cucumber[J]. Analytical Biochemistry, 2010, 399(2): 257-261. |