奶牛体内的脂肪组织主要分布在腹部、皮下和内脏等部位, 由脂肪细胞、血管和神经组成, 主要含有甘油三酯, 既是一个储能器官, 也是全身最大的内分泌器官, 通过脂肪细胞分泌脂肪酸、细胞因子、酶等, 与肝脏等众多组织器官相互联系, 进而参与机体脂代谢。肝激酶B1(Liver kinase B1, LKB1)也称为丝氨酸/苏氨酸蛋白激酶11(Serine-threonine kinase 11, STK11)主要位于细胞核中, 但其功能的表现主要是由细胞浆内的部分引发, 在控制和调节细胞能量代谢、细胞凋亡等过程中起重要作用[1]。腺苷酸活化蛋白激酶(AMP-activated protein kinase, AMPK)是一种高度保守的苏氨酸激酶, 广泛存在于各种真核细胞中, 在维持细胞内能量代谢平衡过程中起着重要的作用[2]。沉默信息调节因子1(Silent mating type information regulation 2 homolog1, SIRT1)是辅酶Ⅰ(Nicotinamide adenine dinucleotide, NAD+)依赖的组蛋白去乙酰化酶, 主要定位于细胞核中, 在哺乳动物的多种组织中广泛表达, 通过使底物发生去乙酰化作用参与细胞生存和物质代谢等过程的调节[3]。LKB1还可以作为AMPKα的上游磷酸化并激活AMPKα, 继而激活下游SIRT1、过氧化物酶体增殖物激活受体γ辅助激活因子-1α(Peroxisome proliferator-activated receptor gamma co-activator, PGC-1α)及一些转录因子等, 抑制耗能过程[4-5]。此外, SIRT1可通过去乙酰化LKB1继而增加AMPKα的活性[6]。近年来, LKB1、AMPKα、SIRT1信号通路在脂代谢中的作用引起了广泛关注。本文就LKB1、AMPKα、SIRT1在奶牛脂肪组织脂代谢中的作用机制做一综述与分析, 旨在为研究奶牛脂代谢紊乱性疾病提供新的思路。
1 LKB1分子结构及其对奶牛脂代谢的影响LKB1是一种与肿瘤发生紧密相关的基因, 广泛分布于胚胎及成人的多种组织中, 通过磷酸化和细胞定位两种机制进行信号调节, 可参与细胞内脂肪分化和生成等过程[7]。LKB1基因属于AMPKK家族成员, 可作为AMPKα相关的13种激酶的上游激酶, 磷酸化并激活AMPKα, 促进LKB1从细胞核内移位到细胞浆内[8], 而且这种激活属于组成性激活, 不依赖细胞内腺苷一磷酸/腺苷三磷酸(Adenosine monophosphate, AMP/Adenosine-triphosphate, ATP)比率等因素的刺激。研究表明LKB1可通过激活其上游PI3K (Phosphatidylinositol-3-kinase)-AKT (Related to the A and C kinase)信号通路抑制总胆固醇(Total cholesterol, TC)、甘油三酯(Triglyceride, TG)和低密度脂蛋白胆固醇(Low-density lipoprotein cholesterol, LDL-C)的合成, 参与脂肪生成调节, 从而抑制奶牛脂肪组织脂肪酸的合成[9]。另外, LKB1可使乙酰辅酶A羧化酶(Acetyl CoA carboxylase, ACC)活性降低, ACC活性降低会导致脂肪酸合成速率降低, 还可增加肉碱棕榈酰转移酶1(Carnitine palmitoyltransferse1, CPT1)、肉碱棕榈酰转移酶2(Carnitine palmitoyltransferse2, CPT2)的活性, 使脂氧化速率增加, 进而减少奶牛体内的脂肪含量[10]。因此, 激活的LKB1可以调控脂质合成与分解代谢, 最终降低脂肪的储存。
2 AMPK结构及对脂代谢的影响AMPK是一个进化保守的苏氨酸蛋白激酶, 由催化亚基α、调节亚基β和γ组成, AMPK活性调节需要3个亚基共同完成, AMPKα可通过对靶蛋白的磷酸化调节, 影响脂代谢[11]。胞内AMP/ATP比值的变化对AMPKα活性影响甚大, 当AMP/ATP增加时, AMPKα被活化, 使脂肪合成抑制[12]。AMPKα激活后可磷酸化胆固醇合成关键酶3-羟基-3-甲基戊二酸单酰辅酶A还原酶(3-hydroxy-3-methyl glutaryl coenzyme A reductase, HMGR), 抑制胆固醇的合成, 磷酸化脂肪酸合成关键酶ACC、脂肪酸酰基化关键酶甘油磷酸酰基转移酶(Glycerol-3-phosphate acyltransferase, GPAT), 抑制脂肪酸和TG的合成, 磷酸化激素敏感酯酶(Hormone-sensitive triglyceride lipase, HSL)促进脂酰甘油酯和胆固醇脂水解[13-14]。因此, AMPK活性降低可能导致血浆游离脂肪酸升高, 以及脂质在体内的异位沉积, 进而导致脂质代谢紊乱性疾病的发生。
3 SIRT1信号转导通路SIRT1是目前为止在Sirtuin家族中研究最为深入的一个成员[15]。SIRT1活性受NAD+/NADH调节, NAD+的生物合成随着年龄的增加逐渐下降, 导致SIRT1活性下降[16]。Kim等[17]研究表明DHA可通过增加AMPKα表达、导致SIRT1的过表达。目前已发现SIRT1可与多种蛋白分子、因子相互作用, 如叉头转录因子O亚家族(Forkhead box-containing protein O subfamily, FOXOs)、肝x受体(Liver x receptors, LXR)等, SIRT1通过使上述蛋白分子特定部位发生去乙酰化, 产生多种生物学效应[3]。SIRT1可以调节胆固醇的重要感受器LXR和脂质合成关键调节蛋白固醇调节元件结合蛋白(Sterol regulatory element-binding protein, SREBP)、过氧化物酶激活受体γ(Peroxisome proliferators-activated receptors, PPARγ)的活性进而调节脂类和胆固醇代谢, 抑制脂类的合成, 从而减少脂质储存[18]。
4 奶牛脂肪组织脂代谢奶牛体内的脂肪组织主要包括白色和棕色脂肪组织, 其分泌的细胞因子和肽类激素会影响和调节脂肪组织乃至整个奶牛机体的代谢, 随着脂肪组织的聚集, 其释放大量的游离脂肪酸(Free fatty acid, FFA)被运送到非脂肪组织, 将导致脂质代谢发生变化[19]。研究表明白色脂肪组织还可以通过PPARγ、腺苷等信号分子和miRNAs等转化为棕色脂肪组织[20], 降低奶牛机体脂肪的储藏量。因此, 有效控制脂肪的合成与分解, 对奶牛肥胖、高脂血症及其相关代谢综合征的治疗有重要的作用。
奶牛脂肪组织脂质代谢由许多转录因子调节, 其体内的脂肪储藏量取决于脂肪的合成与分解代谢, 脂合成和脂质分解是通过内源基因与外部调控因子之间相互作用完成的。奶牛脂合成是脂肪酸在细胞液内由脂肪酸合成酶(Fatty acid synthetase, FAS)等酶的催化下, 以乙酰CoA为引物, 通过丙二酰单酰CoA, 合成长链脂肪酸, 其中DGAT是合成甘油三酯的关键酶, DGAT表达升高可以促进TG合成[21-22]。
当机体缺乏能量时, 脂肪分解作用增强, 主要通过线粒体中β-氧化作用释放FFA和甘油进入血液, 经由大循环, 进入到其他组织[23]。HSL和脂肪甘油三酯脂肪酶(Adipose triacylglyceride lipase, ATGL)在脂质分解代谢过程中, 分工协作, 各自发挥作用, 共同完成对TG的分解作用。甘油作为脂肪分解释放的产物, 被运输到肝脏, 经过甘油激酶催化和糖异生作用释放氢供能, 同时脂肪分解产生的FFA在脂酰CoA合成酶和ACC氧化酶(1-aminocyclop ropane-1-carboxylic acid oxidase, ACO)的催化下进行氧化反应, 之后被转移到不同的组织器官中提供能量[24-25]。
5 LKB1-AMPKα-SIRT1信号通路对奶牛脂肪组织脂代谢的调节 5.1 LKB1-AMPKα-SIRT1相互作用的方式AMPKα是Sirt1上游, 可通过升高细胞内AMP/ATP的比例, 特别是NAD+/NADH的水平来提高Sirt1的活性[26], 而Sirt1通过使AMPKα上游激酶LKB1去乙酰化以促进LKB1移位至胞质中, 继而增加AMPKα磷酸化和活性, 调节脂代谢[27]。LKB1作为AMPKα的上游激酶, 可以通过不依赖细胞内AMP/ATP比率的方式与STRAD (STE20 related adaptor protein)-MO25(Mouse protein 25)组成异源三聚体磷酸化AMPKα进而参与奶牛脂肪组织脂代谢的调节[28], 通过抑制脂质合成和促进脂肪酸氧化来减少脂质积聚。因此, LKB1-AMPKα-SIRT1信号通路与奶牛脂代谢密切相关, 在奶牛脂肪组织脂代谢过程中起重要调节作用。LKB1-AMPKα-SIRT1信号通路, 如图 1所示。
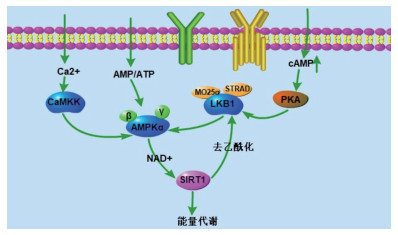
|
| 图 1 LKB1-AMPKα-SIRT1信号通路图 |
奶牛脂肪组织脂代谢由脂肪酸合成酶FAS、脂肪酸氧化酶(ACO、CPT1和CPT2), 脂肪酸转运蛋白(Apolipoprotein B, ApoB、Apolipoprotein E, ApoE)、脂肪酸调控关键酶脂联素(Adiponectin, ADPN)、脂蛋白脂酶(Lipoprteinlipase, LPL)以及转录调节因子PPARγ和SREBP-1c、碳水化合物反应元件结合蛋白(Carbohydrate response element binding protein, ChREBP)等多种因子相互作用共同调节。LKB1-AMPKα-SIRT1信号通路可通过上述一种或多种因子调控奶牛脂肪组织脂质代谢, 减少奶牛的脂肪沉积。
HMGR是AMPKα的一种作用底物, 主要调节胆固醇的合成, AMPKα通过磷酸化HMGR肽链中的Ser871位点抑制HMGR的活性, HSL是胆固醇脂的水解酶, 活化的AMPKα可以抑制HSL mRNA的表达, 抑制机体FFA的释放[29]。ACC是脂肪酸从头合成过程中的限速酶, 催化乙酰CoA形成丙二酸单酰CoA, 抑制脂肪酸氧化限速酶CPT-1活性, 阻碍脂肪酸进入线粒体, 降低脂肪酸的氧化[30]。AMPKα的激动剂5-氨基咪唑-4-氨甲酰核糖核苷(5-Aminoimidazole-4-carboxamide1-β-D-ribofuranoside, AICAR)可激活AMPKα活性并减少内源性FAS基因的表达, 磷酸化ACC (Ser79), 进而减少丙二酸单酰CoA的生成, 减少脂肪酸的合成并解除丙二酸单酰CoA对CPT-1的抑制, 增加CPT-1的活性, 促进脂肪酸进入到线粒体内进行β氧化, 减少细胞内甘油三酯的含量, 从而降低奶牛机体脂肪量[31-32]。当AMPK活性升高后, 使脂肪酸酰基化和甘油三酯合成关键酶GPAT失活, 不仅抑制了脂肪酸的合成, 还促进了脂肪酸的氧化分解[33]。
AMPKα还可以通过调节PPARγ在奶牛脂肪细胞中的表达来发挥作用。PPARγ具有脂肪组织特异性, 在脂肪细胞分化和脂肪代谢调控中起着重要作用, 其主要通过诱导脂肪酸转位酶(Fatty acid translocase, FAT)表达来促进脂肪酸的跨膜转运[34]。奶牛脂肪组织中SIRT1可负调控脂肪细胞中的PPARγ, 正调控PGC-1α表达, 使FAS表达减少, 降低脂肪沉积[35]。SREBP-1c转录因子通过促进脂肪和胆固醇生成基因的表达促进脂肪的储存, SIRT1的激活引起SREBP-1c蛋白表达水平下降, 使其目的基因如HMGR和FAS的表达量减少[36-37], 抑制了脂质的合成, 使奶牛体内脂肪蓄积减少。
研究表明在奶牛体内NEFA可以上调LKB1, 促进AMPKα磷酸化与PPARα表达, 促进脂氧化基因ACO等的表达[10, 37]。LKB1的受体LXRQ和其靶向基因SREBP-1c在脂肪的形成中扮演重要的角色, SREBPl-1C的作用分子包括ACC、胆固醇合成酶基因(3-hy-droxy-3-methylglutaryl coenzyme A, HMG-CoA)、HMG-CoA还原酶基因、FAS、脱羧酶基因等, SREBP-1c的活化由LXR-α介导完成, 使SREBP下游脂肪合成酶基因激活, 导致血浆甘油三酯合成增加[38-39]。当细胞内AMP/ATP比例升高时, 促进LKB1对AMPKα磷酸化, 继而激活SIRT1, 最终使下游靶点基因PGC-1α等发生去乙酰化, 促使脂合成基因ACC、FAS失活[40]。活化的LKB1促进脂解基因CPT1、CPT2的表达和转录, 抑制脂肪生成基因SREBP-1c和ChREBP的表达和转录活性, 研究表明ChREBP与SREBP-1c既相互独立又相互协同共同调控脂肪组织脂质合成作用, 不饱和脂肪酸(Polyunsaturated fatty acid, PUFA)可通过AMPKα信号通路负向调控ChREBP的转录活性, 促进ChREBP与SREBP的蛋白降解, 使细胞内含量降低, 减少下游靶标脂合成基因的表达, 以此来控制奶牛体内脂肪的生成[41]。此外, LKB1-AMPKα-SIRT1可通过载脂蛋白、维生素E、miRAN等多种调控因子间接调控奶牛脂肪组织的脂代谢过程[42-46]。因此, LKB1-AMPKα-SIRT1可通过调控脂肪酸合成与分解相关的基因来控制脂肪在奶牛体内的含量。
综上所述, LKB1-AMPKα-SIRT1相关信号通路可通过调节TG的合成与转化及脂合成、脂氧化基因与转录因子来控制奶牛脂肪组织脂质代谢。其与奶牛脂肪组织脂质代谢密切相关, 当此信号通路出现功能失调时, 奶牛脂质代谢就会紊乱, 导致脂代谢综合征及其并发症的形成。LKB1-AMPKα-SIRT1信号通路调控脂代谢的方式, 如图 2所示。

|
| 图 2 LKB1-AMPKα-SIRT1信号通路调控脂代谢的方式 |
奶牛脂肪代谢的调控涉及心、脑、肾、脂肪、肝脏和肌肉等多个组织器官的功能协调及脂肪、糖类、蛋白质等物质代谢途径之间的相互关系, 因而对奶牛脂肪组织脂代谢的研究, 应运用整体与部分的原理, 结合基因组学、代谢组学和蛋白质组学等, 绘制参与相关调控的网络, 在调控网络中探究关键的基因或代谢途经, 以期发现更多的治疗靶标。目前, LKB1的研究还未完全成熟, 其生物学结构及功能尚未得到全面的揭示, 有关AMPK调控脂肪代谢的研究主要集中于相关转录因子活性及表达, 今后应结合分子生物学等多种技术手段在细胞与整体水平上深入研究其调控机理。另外, 随着SIRT1上下游分子的不断发现以及基因研究的进一步开展, 可最终为LKB1-AMPK-SIRT1作为治疗靶点提供依据。
| [1] |
Deguchi A, Miyoshi H, Kojima Y, et al. LKB1 suppresses p21-activated kinase-1(PAK1) by phosphorylation of thr (109) in the p21-binding domain[J]. Journal of Biological Chemistry, 2010, 285(24): 18283-18290. DOI:10.1074/jbc.M109.079137 |
| [2] |
陈标, 满玉蓉, 高柳玲, 等. AMPK调控能量代谢研究进展[J]. 生物学杂志, 2017, 34(5): 78-82. DOI:10.3969/j.issn.2095-1736.2017.05.078 |
| [3] |
李莉萍, 曾卫民, 郭明日. SIRT1的生物学功能及其在胰岛素抵抗中的作用[J]. 生命科学研究, 2010, 14(4): 372-376. |
| [4] |
韩洁.LKB1抑制脂肪生成和分化的机制研究[D].天津: 天津医科大学, 2016.
|
| [5] |
Zeqiraj E, Filippi BM, Deak M, et al. Structure of the LKB1-STRAD-MO25 complex reveals an allosteric mechanism of kinase activation[J]. Science, 2009, 326(5960): 1707-1711. DOI:10.1126/science.1178377 |
| [6] |
Zhang BB, Zhou G, Li C. AMPK:an emerging drug target for diabetes and the metabolic syndrome[J]. Cell Metabolism, 2009, 9(5): 407-416. DOI:10.1016/j.cmet.2009.03.012 |
| [7] |
张霞, 孙琳琳, 钟殿胜. LKB1-AMPK-mTOR信号传导通路在肿瘤中的研究进展[J]. 中国肺癌杂志, 2011(8): 685-688. DOI:10.3779/j.issn.1009-3419.2011.08.09 |
| [8] |
Eggers C, Kline E, Zhong D, et al. STE20-related kinase adaptor protein α(STRADα) regulates cell polarity and invasion through PAK1 signal in LKB1-null cells[J]. Journal of Biological Chemistry, 2012, 287(22): 18758-18768. DOI:10.1074/jbc.M111.316422 |
| [9] |
Kováčik J, Kalafová A, Tušimová E. Relations between selected indicators of blood and milk of dairy cows with metabolic disorders[J]. Journal of Microbiology Biotechnology & Food Sciences, 2013(2): 1980-1987. |
| [10] |
李心慰.乙酸、非酯化脂肪酸、生长激素和催乳素调控奶牛肝细胞脂代谢的信号机制[D].长春: 吉林大学, 2013.
|
| [11] |
Hardie DG. AMPK:positive and negative regulation, and its role in whole-body energy homeostasis[J]. Current Opinion in Cell Biology, 2015(33): 1-7. |
| [12] |
耿凤豪, 张鹏, 董玲, 等. AMPK-能量代谢感受器与可激活AMPK相关的药物研究进展[J]. 心脏杂志, 2014(1): 97-100. |
| [13] |
张玉佩, 杨钦河, 邓远军, 等. 参苓白术散对高脂饮食诱导的NAFLD大鼠肝组织超微结构及AMPKα磷酸化的影响[J]. 中药药理与临床, 2016(1): 6-10. |
| [14] |
Lim JH, Gerharthines Z, Dominy JE, et al. Oleic acid stimulates complete oxidation of fatty acids through protein kinase a-dependent activation of sirt1-pgc1α complex[J]. Journal of Biological Chemistry, 2013, 288(10): 7117-7126. DOI:10.1074/jbc.M112.415729 |
| [15] |
Guarente L. Sirtuins as potential targets for metabolic syndrome[J]. Nature, 2006, 444(7121): 868-874. DOI:10.1038/nature05486 |
| [16] |
Ramsey K, Mills K, Satoh A, et al. Age-associated loss of Sirt1-mediated enhancement of glucose-stimulated insulin secretion in beta cell-specific Sirt1-overexpressing (BESTO) mice[J]. Aging Cell, 2008, 7(1): 78-88. DOI:10.1111/ace.2008.7.issue-1 |
| [17] |
Kim H, Mendez R, Chen X, et al. Lysine acetylation of crebh regulates fasting-induced hepatic lipid metabolism[J]. Molecular & Cellular Biology, 2016, 35(24): 4121-4134. |
| [18] |
邵芳, 郁建锋, 张燕萍, 等. SIRT1基因的表达调控及对动物脂类代谢的功能[J]. 常熟理工学院学报, 2015, 29(4): 8-14. DOI:10.3969/j.issn.1008-2794.2015.04.002 |
| [19] |
邓清华.NEFAs对犊牛原代肝细胞糖脂代谢的调控机制[D].长春: 吉林大学, 2015.
|
| [20] |
倪鸣, 王金焱, 王璟. 白色脂肪组织棕色化调控机制的研究进展[J]. 医学研究生学报, 2015(7): 771-775. |
| [21] |
秦佑.树豆酮酸A抑制3T3-L1脂肪细胞分化及调控其脂质代谢的作用研究[D].广州: 广州中医药大学, 2016.
|
| [22] |
张世奇.PLIN1对奶牛脂肪细胞脂代谢及炎性细胞因子合成的影响[D].长春: 吉林大学, 2017.
|
| [23] |
黄文钰, 李向平. 脂肪细胞三酰甘油分解代谢相关调节的研究进展[J]. 临床与病理杂志, 2013, 33(3): 230-234. DOI:10.3969/j.issn.1673-2588.2013.03.010 |
| [24] |
宋宇宙.牛蒡子苷元通过AMPK信号通路调节脂肪代谢的作用研究[D].广州: 广州中医药大学, 2017.
|
| [25] |
殷立恒.PRL、GC对奶牛脂肪细胞和肝细胞脂代谢的影响[D].长春: 吉林大学, 2015.
|
| [26] |
Cantãó C, Gerhart-Hines Z, Feige JN, et al. AMPK regulates energy expenditure by modulating NAD+ metabolism and SIRT1 activity[J]. Nature, 2009, 458(7241): 1056-1060. DOI:10.1038/nature07813 |
| [27] |
梁舒.小檗碱通过Sirt1改善3T3--L1脂肪细胞糖代谢的机制研究[D].南京: 南京中医药大学, 2017.
|
| [28] |
Hardie DG, Hawley SA, Scott JW. AMP-activated protein kinase-development of the energy sensor concept[J]. Journal of Physiology, 2010, 574(1): 7-15. |
| [29] |
孟胜喜, 冯琴, 彭景华, 等. BZL方对游离脂肪酸诱导HepG2细胞脂肪沉积和LKB1-AMPK-ACC信号传导通路的影响[J]. 中华中医药杂志, 2014(5): 1391-1396. |
| [30] |
匡霞, 陆付耳, 易屏. 小檗碱对HepG2胰岛素抵抗细胞模型中LKB1-AMPK-TORC2信号网络的影响[J]. 中国中西医结合消化杂志, 2015(7): 467-471. |
| [31] |
Li X, Li X, Chen H, et al. Non-esterified fatty acids activate the AMP-activated protein kinase signaling pathway to regulate lipid metabolism in bovine hepatocytes[J]. Cell Biochemistry & Biophysics, 2013, 67(3): 1157-1169. |
| [32] |
Li X, Li Y, Ding H, et al. Insulin suppresses the AMPK signaling pathway to regulate lipid metabolism in primary cultured hepatocytes of dairy cows[J]. Journal of Dairy Research, 2018(85): 157-162. |
| [33] |
高晓娜, 郭小权. 一磷酸腺苷激活的蛋白激酶对动物糖脂代谢的调节作用[J]. 动物营养学报, 2017, 29(12): 4287-4294. DOI:10.3969/j.issn.1006-267x.2017.12.007 |
| [34] |
李琳, 郑卓, 贺红专. PPARγ基因调控猪脂肪沉积研究进展[J]. 中国猪业, 2016, 11(8): 57-60. |
| [35] |
杜希良.miR-181a对犊牛原代肝细胞糖脂代谢稳态的调控机制[D].长春: 吉林大学, 2016.
|
| [36] |
Bellet MM, Nakahata Y, Boudjelal M, et al. Pharmacological modulation of circadian rhythms by synthetic activators of the deacetylase SIRT1[J]. Proc Natil Acad Sci USA, 2013, 110(9): 3333-3338. DOI:10.1073/pnas.1214266110 |
| [37] |
Liu L, Li X, Li Y, et al. Effects of nonesterified fatty acids on the synthesis and assembly of very low density lipoprotein in bovine hepatocytes in vitro[J]. Journal of Dairy Science, 2014, 97(3): 1328-1335. DOI:10.3168/jds.2013-6654 |
| [38] |
Ito M, Nagasawa M, Omae N, et al. A novel JNK2/SREBP-1c pathway involved in insulin-induced fatty acid synthesis in human adipocytes[J]. Journal of Lipid Research, 2013, 54(6): 1531-1540. DOI:10.1194/jlr.M031591 |
| [39] |
Zhang M, Zhang S, Hui Q, et al. β-hydroxybutyrate facilitates fatty acids synthesis mediated by sterol regulatory element-binding protein1 in bovine mammary epithelial cells[J]. Cellular Physiology & Biochemistry, 2015, 37(6): 2115-2124. |
| [40] |
Chau MD, Gao J, Yang Q, et al. Fibroblast growth factor 21 regulates energy metabolism by activating the AMPK-SIRT1-PGC-1alpha pathway[J]. Proc Natil Acad Sci USA, 2010, 107(28): 12553-12558. DOI:10.1073/pnas.1006962107 |
| [41] |
Li X, Chen H, Guan Y, et al. Acetic acid activates the AMP-activated protein kinase signal pathway to regulate lipid metabolism in bovine hepatocytes[J]. Journal of Steroid Biochemistry & Molecular Biology, 2013, 138(7): 445-454. |
| [42] |
王怡, 刘宗平. 奶牛围产期脂肪代谢的研究进展[J]. 畜牧与兽医, 2013, 45(4): 98-101. |
| [43] |
孙艳发, 张敏, 李焰, 等. 维生素E对动物脂肪代谢调控的研究进展[J]. 中国畜牧杂志, 2015, 51(13): 82-85. DOI:10.3969/j.issn.0258-7033.2015.13.018 |
| [44] |
Shi X, Li D, Deng Q, et al. Acetoacetic acid induces oxidative stress to inhibit the assembly of very low density lipoprotein in bovine hepatocytes[J]. Journal of Dairy Research, 2016, 83(4): 442-446. DOI:10.1017/S0022029916000546 |
| [45] |
Ono K, Horie T, Nishino T, et al. MicroRNA-33a/b in lipid metabolism-novel "thrifty" models[J]. Circulation Journal Official Journal of the Japanese Circulation Society, 2015, 79(2): 278-284. DOI:10.1253/circj.CJ-14-1252 |
| [46] |
靳青, 魏晨, 张相伦, 等. miRNA-33对胆固醇合成的调控作用及其在肉牛上的研究进展[J]. 草食家畜, 2018(4): 5-9. |




