2. 南京林业大学林学院,南京 210037;
3. 中南林业科技大学经济林培育与保护教育部重点实验室,长沙 410004
2. College of Forestry, Nanjing Forestry University, Nanjing 210037;
3. Key Lab of Non-wood Forest Nurturing and Protection of National Ministry of Education, Central South University of Forestry and Technology, Changsha 410004
银杏(Ginkgo biloba L.)又名白果,最早出现于古生代石炭纪,迄今已有3.45亿年,现仅存一科一属一种,是我国珍贵的孑遗植物[1-3]。不仅具有极高的观赏价值,还具有极高的经济价值和科学研究价值[4]。其中,银杏中的黄酮类化合物具有抗氧化、抑菌、治疗心血管疾病及保护神经系统等作用,是国内外植物药用成分的开发热点[5-6]。尽管银杏黄酮的传统提取方法已十分成熟,但由于占有大量耕地,也无法避免环境影响,仍存在许多不足[7]。运用植物组织培养的方法生产次生代谢产物能排除不良环境影响,解决自然资源短缺与森林破坏问题,是目前国内外研究的重要方向[8-9]。
然而,银杏愈伤组织在实际培养中存在生长缓慢、易褐化和次生代谢物产量低等问题,无法达到工业化标准。近年来,为了探究适宜银杏愈伤组织生长与黄酮积累的条件,国内外学者研究了取材部位、基本培养基和激素种类等方面的影响[9-11],但鲜有综合讨论细胞生长、褐化与黄酮积累的研究,更未见利用正交实验探究总黄酮实际产量的报道,缺乏工业生产指导性。同时程水源等[12]研究表明,银杏叶黄酮含量在不同月份间存在较大差异,且外植体中酚醌类底物随着月份的积累也可能会影响愈伤组织的生长与褐化[13],而目前尚未在银杏愈伤组织培养中见到关于外植体月份对细胞生长与黄酮积累影响的研究;综合研究外植体、激素和抗褐化剂共同影响下的银杏愈伤组织生长与黄酮积累,具有重要的现实意义。本研究以银杏4、5、6月份叶片诱导的愈伤组织为供试材料,选用萘乙酸(α-Naphthaleneacetic acid,NAA)为细胞生长素、呋喃氨基嘌呤(Kinetin,KT)为细胞分裂素,抗坏血酸(Ascorbic acid,VC)为抗褐化剂,在继代中设计正交实验考察四因素交互作用下银杏叶愈伤组织的生长指数、褐化指数及黄酮含量差异。结合供试银杏树4、5、6月叶片黄酮含量与愈伤组织的总黄酮产量,旨在发现银杏愈伤组织生长与黄酮积累规律,为工业化生产提供一定的技术参考。
1 材料与方法 1.1 材料 1.1.1 材料供试材料为4、5、6月中旬中南林2号叶片诱导且在恒温组培室中继代三次的愈伤组织。
1.1.2 试剂MS培养基自制(含3%蔗糖,0.6%琼脂);植物激素萘乙酸(NAA)和呋喃氨基嘌呤(KT)购自Sigma公司;抗坏血酸(VC)购自国药集团化学试剂公司。
1.1.3 仪器202-0A型电热恒温干燥箱(天津市泰斯特仪器有限公司),高效液相色谱仪LC-2010A HT(日本岛津),JY92-2D超声波破碎仪(宁波新芝科器研究所)。
1.2 方法 1.2.1 银杏愈伤组织正交继代培养各月份银杏叶愈伤组织在相同条件下继代3次后,选择生长旺盛、色泽黄绿的愈伤组织,按正交实验设计进行继代培养。每瓶愈伤组织接种鲜重为0.3 g,培养基选取MS基本培养基,添加激素为NAA与KT组合,抗褐化剂为VC,选用L9(34)正交设计表(表 1),在40 d的继代周期内设计正交实验考察银杏叶愈伤组织的生长、褐化及黄酮积累(表 2)。
培养温度为(25±1)℃,光照强度为2 000 lx,光照时间为12 h/d。
1.2.3 生长指数测定以每瓶银杏愈伤组织的鲜重(Fresh weight,FW)为生长指标,银杏愈伤组织处理每8 d随机取5瓶称鲜重,取平均值并计算生长指数,生物学重复3次。

每8 d对各组银杏愈伤组织处理总体进行观察,按以下标准评定褐化级别并计算褐化指数[14]。
愈伤组织褐化级别评定:0级:愈伤组织呈黄绿色;1级:愈伤组织呈淡黄色;2级:愈伤组织呈浅褐色;3级:愈伤组织呈深褐色。
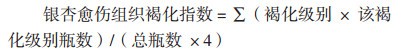
色谱柱supersil ODS2 5 μm;进样量:10 μL;流动相:甲醇-0.4%磷酸(50:50);流速:1 mL/min;检测波长360 nm。
1.2.5.2 对照品溶液的制备精密称定五氧化二磷干燥过夜的槲皮素标准品6 mg、山奈酚标准品6 mg、异鼠李素标准品4 mg于50 mL容量瓶中,加甲醇溶解定容至刻度,摇匀,得槲皮素、山奈酚、异鼠李素浓度分别为120、120、80 μg/mL的混合对照品溶液。
1.2.5.3 标准曲线绘制精密吸取该对照品溶液1.562 5、3.125、6.25、12.5和25 mL分别置于50 mL容量瓶,加甲醇定容至刻度。经0.45 μm微孔滤膜过滤后,取续滤液,高效液相色谱(High performance liquid chromatography,HPLC)依次进样,重复3次,以样品浓度(X)为横坐标,峰面积(Y)为纵坐标,绘制槲皮素、山奈酚、异鼠李素标准曲线。
1.2.5.4 银杏叶片黄酮提取与含量测定分别取4、5、6月中旬中南林二号当年生叶片,清水冲洗后转移至恒温烘箱110℃杀青10 min,随后转入60℃烘干12 h至恒重,冷却研细过100目筛,称量干重(Dry weight,DW)。按中国药典(2015)方法提取总黄酮并制备供试溶液,HPLC进样后,根据峰面积与标准曲线计算槲皮素、山奈素和异鼠李素的含量,按下式换算成总黄酮醇苷的含量,生物学重复3次。

各处理组继代培养至40 d时,每组随机取10瓶生长旺盛的银杏愈伤组织,按上述相同方法提取、测定并计算总黄酮含量,重复3次。
1.2.6 银杏愈伤组织总黄酮产量计算根据40 d时各组愈伤组织的平均干重(g/瓶)与总黄酮含量,以下式计算总黄酮产量:
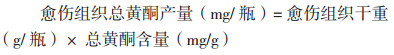
各月份银杏叶愈伤组织相同条件下继代3次后,按照正交实验设计进行40 d的继代培养,接种后每8 d计算各试验号生长指数;愈伤组织继代至40 d,均有明显生长(图 1),统计愈伤组织各时期生长指数,结果见图 2。

|
| 图 1 银杏愈伤组织生长进程 A:接种时银杏愈伤组织;B:继代24 d的银杏愈伤组织;C:继代40 d的银杏愈伤组织 |

|
| 图 2 银杏愈伤组织生长指数曲线 |
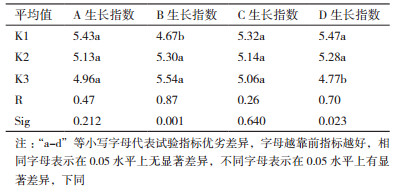
据图 2可知银杏愈伤组织生长趋势在不同时间节点间有较大区别,以0-16 d为缓慢生长期;16-32 d进入快速增长期;32 d以后生长速率又明显降低。截止到第40 d,银杏叶愈伤组织的正交继代实验中生长指数最高的为第6组,达到5.75,最低的第4组为4.20。
通过直观分析40 d时的银杏叶愈伤组织生长指数(表 3),银杏外植体采摘月份对愈伤组织生长影响不显著;激素影响中NAA对愈伤组织生长有极显著影响(P < 0.01),由低浓度升高时对愈伤组织生长有较大的促进作用,而KT浓度影响不显著;VC对银杏愈伤组织生长有抑制作用,且影响显著(P < 0.05),根据4因素的R值可判定它们对愈伤组织生长指数影响的主次顺序为:NAA浓度 > VC浓度 > 外植体月份 > KT浓度,银杏愈伤组织者最佳生长组合为A1B3C1D1。
银杏愈伤组织接种后,各试验号每8 d进行愈伤组织形态观察,计算各组愈伤组织褐化指数,绘制40 d内银杏愈伤组织褐化指数曲线如图 3。

|
| 图 3 银杏愈伤组织褐化指数曲线 |
据图 3,银杏愈伤组织色泽在继代后16 d左右开始由黄绿色出现转变,且32-40 d间褐化指数会大幅提升。截至40 d,褐化指数最高的为第5组51.88%,最低为第2组17.50%。
据表 4结果显示,4因素中VC浓度对褐化率影响极显著(P < 0.01),VC浓度从5 mg/L到20 mg/L,褐化指数呈现先下降后上升趋势,当VC浓度为10 mg/L时,平均褐化指数到达最低值22.71%;而其他3因素均对愈伤组织褐化无显著影响(P > 0.05)。根据4因素的R值判定它们影响愈伤组织褐化率的主次顺序为:VC浓度 > KT浓度 > 外植体月份 > NAA浓度,在最优组合为A1B1C2D2下,银杏愈伤组织的褐化指数能达到最低。
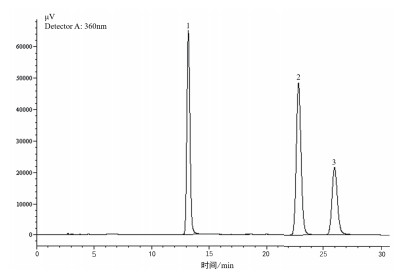
根据标准品HPLC图谱(图 4),以样品浓度(X)为横坐标,峰面积(Y)为纵坐标,绘制槲皮素、山奈酚、异鼠李素标准曲线(表 5),根据相关系数r可知槲皮素、山奈酚、异鼠李素在浓度范围为3.75-60.00 μg/mL、3.75-60.00 μg/mL及2.50-40.00 μg/mL范围内线性关系良好。
|
| 图 4 总黄酮苷对照品HPLC图 1:槲皮素;2:山萘酚;3:异鼠李素 |
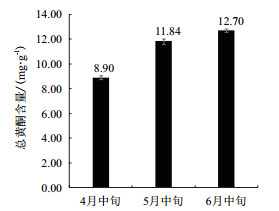
根据4、5、6月中旬银杏叶片黄酮含量趋势(图 5),4月银杏叶片黄酮含量为3个月份中的最低值8.90 mg/g;从4月中旬到6月中旬,银杏叶片黄酮含量呈上升趋势,以4月中旬到5月中旬为黄酮相对快速积累期,5月中旬到6月中旬黄酮积累减慢,在6月中旬叶片黄酮达到3个月份中的最高含量12.70 mg/g。
|
| 图 5 银杏叶片总黄酮含量 |
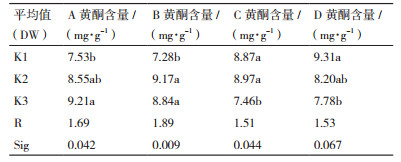
根据图 6中银杏愈伤组织黄酮含量及表 6直观分析,截至40 d,正交试验中黄酮含量最高的第9组达到11.04 mg/g,而最低的第3组仅为6.31 mg/g;根据直观与方差分析结果,愈伤组织黄酮含量随外植体月份的延后而有显著增长(P < 0.05);激素中NAA对黄酮含量有极显著影响(P < 0.01),KT浓度也对黄酮含量呈显著影响(P < 0.05),在激素配比为2.0 mg/L NAA+1.0 mg/L KT时愈伤组织黄酮积累量最大;而抗褐化剂VC浓度对黄酮积累的影响不显著,但最低与最高浓度间仍有显著差异。根据4因素的R值判定它们影响愈伤组织黄酮积累的主次顺序为:NAA浓度 > 叶片月份 > KT浓度 > VC浓度,银杏愈伤组织黄酮积累最优组合为A3B2C2D1。

|
| 图 6 40 d时银杏愈伤组织总黄酮含量 |
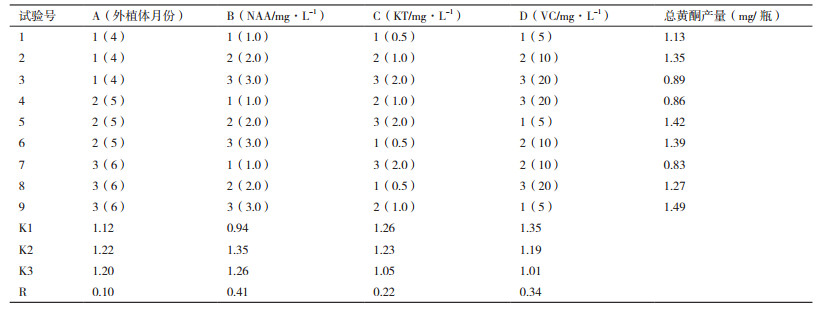
以40 d时各组的平均愈伤组织干重(g/瓶)和总黄酮含量(mg/g)DW,计算各组的总黄酮实际产量(表 7)。
直观分析结果显示,银杏愈伤组织继代培养40 d后,总黄酮产量最高的为第9组1.49 mg/瓶,最低为第7组0.83 mg/瓶。通过4因素的R值判定它们影响愈伤组织总黄酮产量的主次顺序为:NAA浓度 > VC浓度 > KT浓度 > 叶片月份;由于细胞生长差异影响,银杏愈伤组织中最佳黄酮积累条件并非适合生产黄酮,总黄酮产量的最佳组合为A2B2C1D1,即以5月份叶片为外植体诱导的愈伤组织,在MS+2.0 mg/L NAA+0.5 mg/L KT+5 mg/L VC条件下实际总黄酮产量达到最高。
3 讨论银杏是药用植物的开发热点,稳定高效地培养细胞,最大程度优化培养条件是银杏愈伤组织工业化生产黄酮的关键。植物细胞培养周期一般为20-40 d,本研究通过40 d的继代培养,发现银杏愈伤组织接种到新培养基后,会经历一段缓慢生长期,随后在16 d左右进入快速上升期,32 d后生长开始变得平缓,褐化指数却显著升高,在32-40 d阶段,褐化指数最高的第5组从23.13%上升至51.88%;认为在实际生产中银杏愈伤组织的合适继代周期为24-32 d之间,生长较快且不易褐化。
愈伤组织的生长与次生代谢受外植体影响,以银杏不同部位为外植体诱导愈伤组织,黄酮含量表现为叶 > 茎 > 子叶[15],同时房惠勇等[16]认为以原植物中次生代谢产物含量高的外植体诱导的愈伤组织,继代培养中也更易积累该产物。银杏叶愈伤组织培养中,供试外植体一般取4-6月银杏树当年生嫩叶,细胞全能性强,诱导率较高且不易染菌;本实验通过研究4、5、6月中旬银杏叶片诱导的愈伤组织,发现随着外植体月份的延后,其诱导的愈伤组织在继代中生长指数降低,褐化指数增加,但总体差异不显著;而银杏愈伤组织中黄酮含量随外植体采摘月份从4月到6月显著升高,以6月叶片诱导的愈伤组织在40 d后黄酮含量达到平均最高值9.21 mg/g(DW);对比4、5、6月中旬银杏叶片发现,从4月到6月叶片黄酮含量同样呈上升趋势,认为银杏愈伤组织的黄酮含量与其外植体本身呈正相关关系。
激素是植物愈伤组织生长与次生代谢的重要影响因子,在组织培养中,生长素与细胞分裂素间具有相互协同、拮抗等复杂的的调控关系,调节两者的比值能达到不同的促进效果。崔刚等[17]发现,相较于2,4-D和6-BA,NAA和KT的组合更适合银杏愈伤组织生长,且能提高继代过程中银杏细胞的叶绿素含量。本研究以NAA为生长素,KT为细胞分裂素,通过正交实验发现激素中NAA浓度的增加会显著提高愈伤组织继代中的生长指数,在NAA浓度为3.0 mg/L时愈伤组织40 d时平均生长指数可达到5.54,KT影响则不显著;而HPLC结果显示NAA与KT对愈伤组织中的黄酮含量都有显著影响,且直观分析显示过低或过高的激素浓度均不利于黄酮积累,在本实验正交设计组中,以6月叶片为外植体,在3.0 mg/L NAA+1.0 mg/L KT+5 mg/L VC组合下40 d时黄酮含量可达到最高值11.04 mg/g(DW),与5、6月银杏叶黄酮含量接近,高于4月银杏叶。据Cheng等[11]报道,以银杏胚芽为外植体诱导的愈伤组织,在MS+2.0 mg/L NAA+1.0 mg/L 6-BA条件下继代,45 d时黄酮含量为12.5 mg/g(DW);而陈学森等[15]将继代3个月的叶愈伤组织进行不同激素处理,发现在3.0 mg/L 2,4-D+1.0 mg/L 6-BA的激素配比下,40 d后黄酮含量可达23.7 mg/g(DW);通过与前人实验中银杏愈伤组织黄酮含量差异对比,认为银杏愈伤组织黄酮含量的影响因素是多元复合的,不仅受到激素种类和浓度影响,还受到种质资源、取材树树龄、取材部位、抗褐化剂等因子共同作用。
褐化是银杏愈伤组织继代中的常见问题,主要是由于愈伤组织内酚类物质易与空气中的氧结合形成醌类物质,使愈伤组织色泽转为褐色的同时阻碍细胞生长与代谢;合适的抗褐化剂能通过吸附或还原多酚,降低愈伤组织褐化率。VC是一类防氧化抗褐化剂,广泛用于组培中的抗褐化研究,高红兵等[18]发现培养基中添加VC能通过防止天女木兰中的咖啡酸与绿源酸氧化,使其外植体褐化率由52.2%降至12.2%;本实验中,培养基VC浓度由5 mg/L升高到10 mg/L时,银杏愈伤组织平均褐化指数由45.00%降至22.71%,效果显著(P < 0.05),是经济有效的愈伤组织抗褐化添加品。但研究同样发现VC浓度升高到20 mg/L时会显著抑制细胞的生长和黄酮积累,并提升褐化指数,猜测可能是高浓度VC降低了培养基PH,而培养基过酸或过碱都会阻碍细胞正常生长[13],需要在实际生产应用中严格控制浓度范围。同时,本研究发现一定范围内的VC虽然降低了愈伤组织褐化指数,但也降低了黄酮总产量,这其中的机理反应,还有待进一步深入研究。
4 结论本实验通过诱导4、5、6月银杏叶片形成愈伤组织,建立了稳定的银杏愈伤组织继代体系。并发现银杏愈伤的最佳继代周期为24-32 d;最佳生长组合为4月叶片诱导的愈伤组织+3.0 mg/L NAA+0.5 mg/L KT+5 mg/L VC;褐化指数最低的组合为4月叶片诱导的愈伤组织+1.0 mg/L NAA+1.0 mg/L KT+10 mg/L VC,适宜在银杏愈伤组织培养中长期继代;最佳黄酮积累组合为:6月叶片诱导的愈伤组织+2.0 mg/L NAA+1.0 mg/L KT+5 mg/L VC;结合愈伤组织干重与黄酮含量,发现不同于黄酮含量最高的条件,实际总黄酮产量最高的组合为5月叶片为外植体诱导的愈伤组织+2.0 mg/L NAA+0.5 mg/L KT+5 mg/L VC,适合利用银杏细胞生产黄酮。
| [1] |
朱红威, 邵菊芳, 李庆, 等. 不同培养条件对银杏愈伤组织生长及黄酮含量的影响[J]. 食品科学, 2007, 28(11): 102-105. DOI:10.3321/j.issn:1002-6630.2007.11.018 |
| [2] |
张辉, 于荣敏, 姚新生. 银杏愈伤组织和悬浮细胞培养及黄酮类化合物的产生[J]. 沈阳药科大学学报, 1999(2): 54-58. |
| [3] |
Bilia AR. Ginkgo biloba L.[J]. Fitoterapia, 2002, 3: 276-279. |
| [4] |
曹福亮. 中国银杏志[M]. 北京: 中国林业出版社, 2007.
|
| [5] |
Laurain D, Trémouillaux-Guiller J, Chénieux JC, et al. Production of ginkgolide and bilobalide in transformed and gametophyte derived cell cultures of Ginkgo biloba[J]. Phytochemistry, 1997, 46(1): 127-130. DOI:10.1016/S0031-9422(97)00217-3 |
| [6] |
陈西娟, 王成章, 叶建中. 银杏叶化学成分及其应用研究进展[J]. 生物质化学工程, 2008, 42(4): 57-62. DOI:10.3969/j.issn.1673-5854.2008.04.012 |
| [7] |
程勤贤, 陈鹏, 何爱华. 银杏种质资源分类研究综述[J]. 江苏林业科技, 2007, 34(4): 44-47. DOI:10.3969/j.issn.1001-7380.2007.04.013 |
| [8] |
Stöckigt J, Obitz P, Falkenhagen H, et al. Natural products and enzymes from plant cell cultures[J]. Plant Cell Tissue & Organ Culture, 1995, 43(2): 97-109. |
| [9] |
孙楠楠, 许锋, 黄小花, 等. 银杏组织培养及次生代谢分子生物学的研究进展[J]. 贵州农业科学, 2011, 39(10): 27-31. DOI:10.3969/j.issn.1001-3601.2011.10.008 |
| [10] |
胡选萍, 张晓娟, 任鹏斌, 等. 不同激素对银杏愈伤组织黄酮积累的影响[J]. 中成药, 2015, 37(12): 2787-2790. |
| [11] |
Cheng SY, Zhang WW, Sun N, et al. Production of flavonoids and terpene lactones from optimized Ginkgo biloba tissue culture[J]. Notulae Botanicae Horti Agrobotanici Cluj-Napoca, 2014, 42(1): 88-93. |
| [12] |
程水源, 王燕, 李俊凯, 等. 银杏叶黄酮含量变化及分布规律的研究[J]. 园艺学报, 2001, 28(4): 353-355. DOI:10.3321/j.issn:0513-353X.2001.04.017 |
| [13] |
戴莹, 杨世海, 赵鸿峥, 等. 药用植物组织培养中褐化现象的研究进展[J]. 中草药, 2016, 47(2): 344-351. |
| [14] |
罗晓芳, 田砚亭, 姚洪军. 组织培养过程中PPO活性和总酚含量的研究[J]. 北京林业大学学报, 1999, 21(1): 98-101. |
| [15] |
陈学森, 邓秀新, 章文才. 培养基及培养条件对银杏愈伤组织黄酮产量的影响[J]. 园艺学报, 1997, 24(4): 62-66. |
| [16] |
房慧勇, 朱虹, 丁海麦, 等. 影响愈伤组织中次生代谢产物含量的因素研究进展[J]. 中国中药杂志, 2014, 39(15): 2846-2850. |
| [17] |
崔刚, 唐蕾, 王武. 培养基和外源激素对银杏愈伤组织诱导、生长及叶绿素含量的影响[J]. 食品与生物技术学报, 2008, 27(2): 117-122. DOI:10.3321/j.issn:1673-1689.2008.02.025 |
| [18] |
高红兵, 杜凤国, 王欢. 抗褐化剂对天女木兰芽外植体褐化与酚酸氧化的影响[J]. 林业科学研究, 2017, 30(3): 525-532. |