2. 广西高校干细胞与医药生物技术重点实验室, 桂林 541004
2. Guangxi Universities Key Laboratory of Stem Cell and Biopharmaceutical Technology, Guilin 541004
间充质干细胞由于获取相对容易和具有多向分化潜能[1],已然成为干细胞治疗法的种子细胞。在2001年首次通过吸脂术抽取脂肪组织悬液培养出多能干细胞,引发了脂肪来源的间充质干细胞研究热[2]。脂肪间充质干细胞分为两种,白色脂肪来源间充质干细胞(white adipose-derived mesenchymal stem cells,WADSCs)和棕色脂肪来源间充质干细胞(brown adipose-derived mesenchymal stem cells,BADSCs),白色脂肪细胞以甘油三酯的形式储存多余的能量,而棕色脂肪细胞因为其解偶联蛋白的表达,可以以热的形式消耗能量,而这种产热能力可改善肥胖和与肥胖有关的疾病如胰岛素抵抗、2型糖尿病和脂肪肝病[3]。目前,大多数的研究集中在WADSCs,研究发现随着年龄的增长,WADSCs的增殖能力下降,凋亡和衰老细胞数增加[4]。也比较了WADSCs和BADSCs之间的成脂能力,发现WADSCs的成脂能力强于BADSCs[5]。而对于BADSCs研究很少,主要集中在BADSCs以热的形式消耗能量[6],其他方面的研究处于空白阶段,作为干细胞治疗的首选的种子细胞,供体的年龄是否对细胞有影响是一个重要的考察点[7]。本实验利用MTT增殖法、7-ADD-AnnexinV双染色、β-半乳糖苷酶染色法和成骨、成脂分化,对青年和老年小鼠原代培养的BADSCs进行鉴定,目的在于讨论年龄对BADSCs的生物学特性的影响,为进一步研究和应用BADSCs提供理论依据。
1 材料与方法 1.1 材料 1.1.1 实验动物实验使用C57BL/6近交系小鼠(青年2-3月龄,老年22-24月龄)。
1.1.2 试剂澳洲胎牛血清、DMEM/F-12(Thermo Fisher Scientific)Anti-Mouse CD29-PE、Anti-Mouse CD105-PE Cyanine7、Anti-Mouse CD44-APC eFluor780、Anti-Mouse CD73-Percp eFlour710(Biolegend);AnnexinV/PI双染检测试剂盒(碧云天生物技术研究所);β-半乳糖苷酶染色试剂盒、吲哚美辛、3-异丁基-1-甲基黄嘌呤、胰岛素、抗坏血酸、β-磷酸甘油、地塞米松、油红O染料、茜素红染料(Sigma)。
1.2 方法 1.2.1 棕色脂肪组织和白色脂肪组织鉴定CO2麻醉处死小鼠,取肩甲骨处的棕色脂肪组织和腹部白色脂肪组织进行Ha & E染色。棕色脂肪组织和白色脂肪组织进行细胞RNA提取和cDNA转录,以及进行UCP1和Leptin基因引物实时荧光定量PCR扩增,UCP1上游引物:5’-CTGCCAGGACAGTACCCAAG- 3’,UCP1下游引物:5’-TCAGCTGTTCAAAGCACACA-3’,Leptin上游引物:5’-GAGACCCCTGTGTCGGTTC-3’,Leptin下游引物:5’-CTGCGTGTGTGAAATGTCAT-TG-3’。总反应体系为20 μL,反应条件:95℃预变性10 min;95℃变性2 min,60℃退火15 s;40个循环,绘制熔解曲线,读取Ct值。
1.2.2 BADSCs的分离培养和鉴定CO2麻醉处死小鼠,在无菌条件下取肩胛骨间处取的棕色脂肪组织放在有PBS的皿中,用剪刀剪成1 mm×1 mm×1 mm的小块,加入I型胶原酶在37℃水浴消化30 min;每10 min吹打一次,过滤除去未消化组织,15 000 r/5 min离心去掉上清,加入培养基培养。待细胞汇合到90%时,用胰酶消化下来,进行1:2传代,传到第3代时进行鉴定。鉴定方法:第3代细胞用胰酶消化下来,加入CD29、CD105、CD44和CD73抗体,设置空白组和单染组,进行流式分析。
1.2.3 MTT增殖法取第3代细胞消化后计数细胞,将细胞配成1×104细胞悬液;取5块96孔板,将细胞悬液均匀接种到每一块96孔板中,每种细胞设4个复孔,每个孔接种1 000个细胞,即每个孔加入100 μL细胞悬液,设置一个空白孔,空白组没有细胞,只加100 μL培养基。然后把板放入培养箱中培养。分别在24 h、48 h、72 h、96 h、120 h后取出96孔板,加入10 μL MTT溶液后继续培养4 h后吸掉液体,后加入100 μL DMSO,放在摇床上10 min,于490 nm吸光度中检测OD值。
1.2.4 7-ADD-AnnexinV双染色用100 μL的1X结合缓冲液悬浮细胞,然后加入5 μL AnnexinV在室温下孵育15 min后,用缓冲液清洗,离心,用200 μL缓冲液悬浮,加入5 μL7-AAD孵育10 min后进行流式分析。
1.2.5 β-半乳糖苷酶染色法第3代细胞在室温下固定7 min,之后每孔加1 mL的染色混合物,在37℃的环境下孵育过夜,直到细胞被染成蓝色,计算10个不同视野下染成蓝色细胞数的平均值。
1.2.6 成骨、成脂分化比较加入成骨分化培养基(200 mmol/L抗坏血酸、10 mmol/L β-磷酸甘油、0.1 μmol/L地塞米松)进行成骨分化的诱导10 d后,用多聚甲醛固定30 min,用茜素红染色10 min,之后加入100 μL 10%氯化十六烷基吡啶,在酶标仪中于540 nm吸光度中检测OD值。加入成脂分化培养基(10 μmol/L胰岛素、200 μmol/L吲哚美辛、500 μmol/L 3-异丁基-1-甲基黄嘌呤、10 μmol/L地塞米松)成脂诱导7 d后,多聚甲醛固定30 min用油红O染色30 min,之后加入100 μL异丙醇,在酶标仪中于540 nm吸光度中检测OD值。根据染色的结果和OD值比较其分化能力强弱。
1.2.7 统计学分析采用Graphpad prism软件对实验数据进行one-way ANOVA分析,统计结果平均值±标准差(SD)表示,P < 0.05表示统计学上有显著差异。
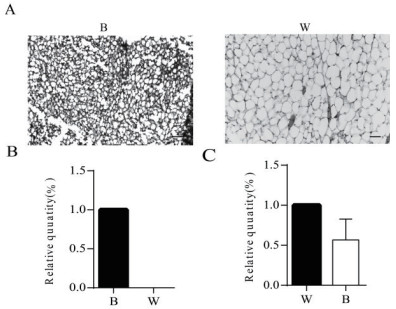
2 结果 2.1 棕色脂肪组织和白色脂肪组织鉴定在显微镜下观察棕色和白色脂肪组织的H & E染色切片,如下图 1-A,发现棕色脂肪组织的脂滴空泡明显比白色脂肪组织小。棕色和白色脂肪组织的UCP1和Leptin基因的荧光定量检测结果(图 1-B,1-C),发现在UCP1在棕色脂肪组织中特异性表达,Leptin在白色脂肪和棕色脂肪中没有显著性差异(P>0.5)。
|
| 图 1 棕色脂肪组织和白色脂肪组织H & E染色比较和UCP1和Leptin基因表达分析 A:棕色脂肪组织和白色脂肪组织H & E染色比较;B:UCP1基因在棕色和白色脂肪组织表达情况;C:Leptin基因在棕色和白色脂肪组织表达情况(B:棕色脂肪组织,W:白色脂肪组织)标尺:50 μm |
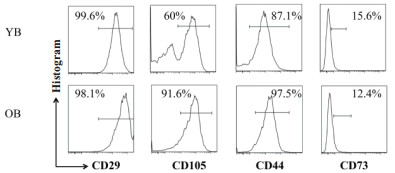
对第3代青年和老年的BADSCs进行流式分析检测了CD29、CD105和CD44细胞表面抗原,结果(图 2)显示青年和老年的BADSCs都表现为阳性表达,青年BADSCs的CD29表达量为98.1±1.1%、CD105表达量为61.4±2.9%、CD44表达量为97.3±1.7%、CD73表达量为14.6±0.34%,老年BADSCs的CD29表达量为98.1±1.3%、CD105表达量为93.5±3.3%、CD44表达量为97.8±1.8%、CD73表达量为13.1±1.5%。
|
| 图 2 不同年龄小鼠BADSCs的CD29、CD105、CD44和CD73细胞表面抗原表达量 YB:青年BADSCs,OB:老年BADSCs |
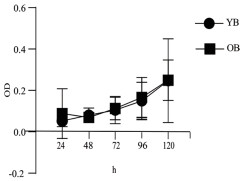
分别在24 h、48 h、72 h、96 h、120 h检测的OD值做成曲线图,如图 3所示,老年小鼠的BADSCs增殖能力与青年小鼠相比没有显著性差异(P>0.5)。
|
| 图 3 不同年龄小鼠BADSC的细胞增殖比较 YB:青年BADSCs,OB:老年BADSCs |
把青年和老年第3代的BADSCs细胞用胰酶消化下来,标志AnnexinV和7-ADD抗体,用流式细胞仪进行检测,结果(图 4)显示,青年的BADSCs早凋比例4.63±0.87%,老年的BADSCs早凋比例9.88±0.81%,有显著性差异(P < 0.5)。

|
| 图 4 不同年龄小鼠BADSCs的细胞凋亡比较 A:不同年龄小鼠BADSCs凋亡流式图分析;B:不同年龄小鼠BADSCs早调比例统计分析,YB:青年BADSCs,OB:老年BADSCs,* P < 0.05 |
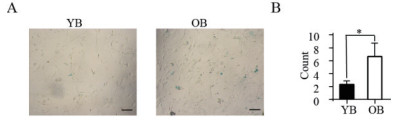
青年和老年组小鼠BADSCs的β-半乳糖苷酶染色的结果如图 5所示,青年组染成蓝色细胞数为2.33±0.3,老年组染成蓝色细胞数为6.66±1.2,有显著性差异(P < 0.05)。染色结果表明老年组小鼠BADSCs细胞衰老数比青年组多。
|
| 图 5 不同年龄小鼠BADSCs的β-半乳糖苷酶染色比较 A;不同年龄小鼠BADSCsβ-半乳糖苷酶染色,标尺:100 μm;B:不同年龄小鼠BADSCs β-半乳糖苷酶染色统计分析,YB:青年BADSCs,OB:老年BADSCs,* P < 0.05 |
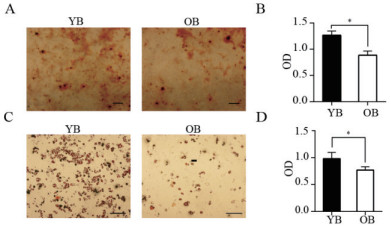
青年和老组小鼠BADSCs成骨、成脂分化染色结果如图 6所示,青年组成骨分化OD值为1.26±0.046,老年组成骨分化OD值为0.88±0.047,有显著性差异(P < 0.05)。青年组成脂分化OD值为0.980 8±0.066,老年组成脂分化OD值为0.769±0.035,有显著性差异(P < 0.05)。染色结果表明青年组小鼠BADSCs的成骨和成脂分化能力均强于老年组小鼠BADSCs。用青年组成骨分化OD值比上成脂分化OD值为1.28,而老年组的比值为1.14,说明青年组更倾向于成骨分化。
|
| 图 6 不同年龄小鼠BADSCs的茜素红和油红O染色比较 A:不同年龄小鼠BADSCs茜素红染色,标尺:200 μm;B.不同年龄小鼠BADSCs茜素红染色统计分析;C:不同年龄小鼠BADSCs油红O染色,标尺:100μm;D.不同年龄小鼠BADSCs油红O染色统计分析,YB:青年BADSCs,OB:老年BADSCs,* P < 0.05 |
脂肪干细胞(Adipose-derived stem cells,ADS-Cs)是一类细胞属性上为间充质干细胞(Mesenchymal stem cells,MSCs)的成体干细胞,其分化潜能仅次于胚胎干细胞。一个有趣的现象是,虽然MSCs分化为骨、软骨、肌腱、韧带等组织细胞的能力随年龄增加而减弱,但其脂肪分化的能力却增强。比较不同组织和不同年龄供体来源的ADSCs发现,其分化、增殖以及克隆形成能力不仅不受年龄的影响,甚至在老龄供体中有上升趋势[8]。但也有报道指出,在利用自体脂肪干细胞移植治疗时,老年ADSCs细胞的潜在分化能力和组织修复能力减弱,限制了其移植效果[9],这可能与ADSCs组织来源、分离方法等有关。
脂肪组织是一种复杂的内分泌器官,包括多种不同的细胞群,如脂肪细胞,前脂肪细胞,间充质干细胞,巨噬细胞和淋巴细胞。在人体内,这些细胞群体不是静止的,而是在肥胖和衰老过程中发生改变的。这些细胞群的变化使炎症和其他常见的代谢性并发症出现,因此脂肪组织细胞组成有助于调节其内分泌和调节功能。
脂肪组织存在两种形式:白色脂肪组织和棕色脂肪组织。白色脂肪组织是在哺乳动物中的主要脂肪器官,以甘油三酯的形式储存多余的能量,在健康成人的体重中占10%或更多,是专门储存多余的能量。然而人类和啮齿类动物有一种额外的脂肪组织,称为棕色脂肪组织组织,这是专门以热的形式消耗化学能。在进化上,棕色脂肪组织组织的功能是对低温的防御机制,特别是在婴儿、小型哺乳动物和冬眠的动物。已知棕色脂肪组织富含线粒体和特异性表达高水平的解耦联蛋白UCP-1能够燃烧脂肪消耗能量增强产热,具有拮抗实验动物肥胖形成的作用[10-11]。但是,很长时间以来关于成年人体不具有功能性棕色脂肪组织的错误认识,严重地阻碍了棕色脂肪组织在人类肥胖防治中的应用。
近年来的研究不仅明确了成年人体存在功能性棕色脂肪组织,而且发现在某些情况下,白色脂肪组织可褐变、形成诱导性棕色脂肪组织。那么,存在于褐色脂肪组织内的干细胞伴随着机体的衰老会发生哪些变化?为此,我们对2月和22月龄小鼠肩甲骨间的BADSCs进行原代培养,比较了青年和老年小鼠BADSCs的生物学特性。
取肩胛骨处棕色脂肪和白色脂肪组织进行H & E染色,比较棕色脂肪和白色脂肪的脂滴空泡大小,发现棕色脂肪细胞比白色脂肪细胞小。荧光定量分析发现棕色脂肪细胞特异性表达UCP1。利用CD29、CD44和CD105的表面抗原进行鉴定,本实验中从青年和老年小鼠的肩胛骨间处获取的BADSCs,在体外培养3代后均为阳性表达,证明本实验培养的确实是BADSCs。在保持同一传代次数的情况下,MTT检测法绘制的生长曲线表明,老年小鼠的BADSCs增殖能力与青年小鼠相比没有显著性差异(P>0.5)。利用7-ADD-AnnexinV双染色和半乳糖苷酶染色法进行检测发现老年小鼠的BADSCs的凋亡和衰老细胞数比青年小鼠的多,随着复制次数增多,细胞染色体两端的端粒逐渐缩短,细胞凋亡和衰老的细胞数量也变多。加入成骨和成脂分化培养基诱导青年和老年小鼠的BADSCs向成骨细胞和脂肪细胞方向分化,发现不论是成骨分化能力还成脂分化能力,都是青年小鼠的BADSCs分化能力强。用青年组成骨分化OD值与成脂分化OD值比值与老年组相比,青年组比值更大,说明青年组更倾向于成骨分化。结果显示,随着机体年龄的增加,出现了更多的凋亡和衰老的细胞。老年组成骨和成脂分化能力与青年组相比减弱,而且更加倾向于脂肪细胞方向分化。越来越多的研究显示,成体干细胞随年龄的变化可能是组织器官功能衰退乃至机体衰老的真正内因,与衰老相关疾病的发生也可能存在密切的联系。BADSCs伴随年龄增长的变化是否与肥胖、炎症和其他常见的代谢性并发症出现有关还需进一步的研究。
4 结论研究发现小鼠BADSCs的衰老细胞数和凋亡比例随着机体年龄增加而显著升高,成骨和成脂分化能力也下降,更加倾向于成脂分化。
| [1] |
Sara E, Jaap J, Willem F, et al. Adipose tissue-derived multipotent stromal cells have a higher immunomodulatory capacity than their bone marrow-derived counterparts[J]. Stem Cells Transl Med, 2013, 2: 455-463. DOI:10.5966/sctm.2012-0184 |
| [2] |
Patricia Z, MinI Z, Hiroshi M, et al. Multilineage cells from human adipose tissue:implications for cell-based therapies[J]. Tissue Engineering, 2001, 7(2): 211-228. |
| [3] |
Takeshi I, Juro S, Shingo K. Transcriptional and epigenetic control of brown and beige adipose cell fate and function[J]. Nat Rev Mol Cell Biol, 2016, 17(8): 480-495. DOI:10.1038/nrm.2016.62 |
| [4] |
齐立杰, 李琼, 郭志坤. 不同年龄小鼠脂肪源间充质干细胞体外原代培养衰老和凋亡的变化[J]. 解剖学报, 2012, 43(3): 366-371. DOI:10.3969/j.issn.0529-1356.2012.03.014 |
| [5] |
Shoshana B, Fnu N, Mia M, et al. Adipocytes in both brown and white adipose tissue of adult mice are functionally connected via gap junctions:implications for Chagas disease[J]. Microbes Infect, 2014, 16(11): 893-901. DOI:10.1016/j.micinf.2014.08.006 |
| [6] |
Cong Shujuan T H, Yajun W, et al. Changes in white and brown adipose tissue microRNA expression in cold-induced mice[J]. Biochem Biophys Res Commun, 2015, 463(3): 193-199. DOI:10.1016/j.bbrc.2015.05.014 |
| [7] |
Abu S, Matilda H, Samiksha W, et al. Effect of aging on stem cells[J]. World J Exp Med, 2017, 7(1): 1-10. DOI:10.5493/wjem.v7.i1.1 |
| [8] |
Olivia B, Vera F, Leroy C, et al. Impact of aging on the regenerative properties of bone marrow-, muscle-, and adipose-derived mesenchymal stem/stromal cells[J]. PLoS One, 2014, 9(12): 1-22. |
| [9] |
Anastasia E, Nina D, Natalia K, et al. Adipose-derived mesenchymal stromal cells from aged patients with coronary artery disease keep mesenchymal stromal cell properties but exhibit characteristics of aging and have impaired angiogenic potential[J]. Stem Cells Transl Med, 2014, 3(1): 32-41. DOI:10.5966/sctm.2013-0014 |
| [10] |
Jun h, Xi C, Jing D, et al. Nesfatin-1 in the lateral parabrachial nucleus inhibits food intake, modulates excitability of glucosensing neurons, and enhances UCP1 expression in brown adipose tissue[J]. Front Physiol, 2017, 8: 1-11. |
| [11] |
Yasuo O, Yoshihito F, Abulizi A, et al. Tetrahydrobiopterin activates brown adipose tissue and regulates systemic energy metabolism[J]. JCI Insight, 2017, 2(9): 1-19. |




