生物体受到外界胁迫时,会激活防御机制抵御外界侵害,例如诱导抗菌肽(Antimicrobial peptides,AMPs)的表达杀死入侵细菌是重要的免疫防御之一。抗菌肽是一类低分子量的短肽,大多数是由阳离子和疏水性残基组成的两亲性分子[1-3]。由于抗菌肽对革兰氏阳性菌、革兰氏阴性菌、丝状真菌和原生生物以及包膜病毒在内的微生物都具有快速且有效的杀伤效果,因此被称为“自然抗生素”[4-5]。抗菌肽与抗生素对细菌作用的机制不同,抗生素多是通过抑制细菌细胞壁的合成来抑制细菌的生长,滥用抗生素会产生高度耐受抗生素的细菌以及超级细菌,导致药效下降[6]。而大多数抗菌肽都是通过静电作用和疏水作用吸附于细菌细胞膜,破坏膜结构使内溶物外漏,发挥杀菌活性,这种独特的作用机制使细菌很难通过改变细胞膜成分对抗菌肽产生耐药性[7],因此抗菌肽成为了抗生素理想的替代品。
家蝇(Musca domestica)是双翅目蝇科昆虫,在我国分布广泛,与人类生活密切相关。它们携带成百上千种病菌,能够传播多种疾病,严重危害人类健康,被认为是一种世界性的卫生害虫。家蝇通常生活在腐败、肮脏的恶劣环境下,但种群却十分强大,咎其原因是由于家蝇具有强大的先天免疫系统,可以有效的抵御外源侵扰[8-9]。昆虫具有识别细菌、真菌、寄生虫和病毒等病原体的有效机制,通过信号转导途径引发细胞免疫和体液免疫反应[10-11],其中抗菌肽是昆虫体液免疫中关键的抗菌因子,在先天免疫中占据十分重要的地位。已鉴定的家蝇抗菌肽有attacin[12]、cecropin[13]、diptericin[14]、defensin[15]、MDAP-2D[16]及Muscin[17]等。本实验室通过生物信息学筛选出一个潜在的抗菌肽基因,将其命名为domesticin[18],该基因氨基酸序列具备抗菌肽分子量小、富含脯氨酸、疏水性氨基酸较多等特征,本文利用毕赤酵母(Pichia pastoris)真核表达系统对其进行体外表达,并验证其抗菌活性。
1 材料与方法 1.1 材料家蝇种蝇由中国科学院动物研究所何凤琴老师于2007年惠赠,一直在本实验室繁殖至今。由本实验室保种和饲养,幼虫饲料配方为90 g麸皮、5 g白糖、5 g奶粉及适量无菌水。饲养温度25℃,相对湿度50%-70%。
大肠杆菌感受态Trans-T-1购自北京全式金生物技术有限公司,表达载体pPIC9K由实验室保存,毕赤酵母KM71菌株由河北大学生命科学院李继刚教授实验室惠赠。遗传霉素G418购自北京博奥拓达科技有限公司,抗His标签兔多克隆抗体购自康为世纪生物科技有限公司,山羊抗兔抗体购自生工生物工程有限公司。His蛋白纯化试剂盒Ni Resin FF购自金斯瑞生物科技有限公司。抑菌实验所用菌种由中科院动物研究所朱顺义研究员和河北大学生命科学学院孙磊教授馈赠。革兰氏阳性菌:蜡样芽孢杆菌(Bacillus cereus)、巨大芽孢杆菌(Bacillus megaterium)、枯草芽孢杆菌(Bacillus subtilis)、藤黄微球菌(Micrococcus luteus)、氧化微杆菌(Microbacterium oxydans)、金黄色葡萄球菌(Staphylococcus aureus)、脲芽孢八叠球菌(Sporosarcina ureae);革兰氏阴性菌:根癌农杆菌(Agrobacterium tumefaciens)、伤寒杆菌(Salmonella typhi)、荧光假单胞菌(Pseudomonas fluorescens)、嗜水气单胞菌(Aeromonas hydrophila)、维式气单胞菌(Aeromonas veronii)、大肠杆菌(Escherichia coli)、变形菌(Proteus species)、铜绿假单胞菌(Pseudomonas aeruginosa)、痢疾菌属(Shigella sp.)、稳定伯克霍尔德菌(Burkholderia stabilis)、鼠伤寒沙门氏菌(Salmonella typhimurium)、黏质沙雷氏菌(Serratia marcescens)、鸡伤寒沙门氏菌(Salmonella gullinarum)、河生肠杆菌(Enterobacter amnigenus)、栖冷克吕沃尔菌(Kluyvera cryocrescens)。
1.2 方法 1.2.1 总RNA提取和反转录以Total RNA提取试剂RNAiso Plus提取3龄家蝇幼虫的总RNA,经1%的琼脂糖凝胶电泳检测其完整性后,利用核酸定量仪测定其浓度和纯度,取1 µg总RNA,以AOLP为引物:5'-GGCCACGCGTCGACTAGTACT16(G/A/C)-3'反转录合成cDNA。
1.2.2 基因克隆、重组表达载体的构建及电转化根据家蝇转录组序列信息,设计domesticin基因特异引物domesticin-F:5’-GTATCGGCATCTCGTGACTC-3’,以家蝇幼虫cDNA为模板,利用domesticin-F和AP:5’-GGCCACGCGTCGACTAGTAC-3’进行3’RACE扩增。根据家蝇domesticin基因编码成熟肽序列设计引物,在引物5’端分别引入酶切位点EcoRI和NotI,并在酶切位点EcoRI后加入6×His标签。上游引物P1:5’-CGGAATTCCATCATCATCATCATCATTCTCGTGACTCCAGACCTGTTC-3’(下划线处EcoRI酶切位点),下游引物P2:5’-AAGGAAAAAAGCGGCCGCTTAAGCGTACATAGTTTTTCGTC-3’(下划线处为NotI酶切位点)。以家蝇的cDNA为模板,以引物P1和P2进行目的片段的PCR扩增,回收目的片段后用EcoRI和Not I进行双酶切。将双酶切后的目的片段连接至经EcoR I和NotI双酶切后的pPIC9K载体,将其转化大肠杆菌感受态Trans-T-1中,筛选阳性克隆并测序验证表达载体pPIC9K-domesticin读码框是否正确。之后将表达载体pPIC9K-domesticin用Sac I线性化后电转化入毕赤酵母KM71感受态中,平行设置pPIC9K载体为对照。电转化后将转化子涂布在MD平板上(所含物质的质量浓度分别为无氨基酸酵母氮源基础培养基YNB 13.4 g/L、生物素0.4 mg/L、葡萄糖20 g/L、琼脂15 g/L),将平板置于30℃培养箱培养,直至出现单个菌落。
1.2.3 遗传霉素筛选及PCR鉴定转化子利用无菌水重悬酵母重组子,将酵母重组子分别涂布于含有不同遗传霉素浓度(0、0.25、0.5、1、2、3、4 mg/mL)的YPD平板上(所含物质的质量浓度分别为酵母粉10 g/L、蛋白胨20 g/L、葡萄糖20 g/L、琼脂15 g/L),于30℃培养。待不同遗传霉素条件下长出单克隆菌落后,在对应的遗传霉素条件下进行划线培养。挑取菌落为模板,以P1和P2,pPIC9K载体上的5’AOX1(5’-GACTGGTTCCAATTGACAA-GC-3’)和P2为引物,分别进行PCR扩增鉴定各转化子插入情况。
1.2.4 重组pPIC9K-Domesticin的诱导表达、蛋白检测及分离纯化将阳性重组子置于BMGY培养基中(所含物质的质量浓度分别为酵母粉10 g/L、蛋白胨20 g/L、磷酸钾缓冲液(pH 6.0)100 mL/L、YNB 13.4 g/L、生物素0.4 mg/L、甘油10 mL/L),在30℃ 200 r/min条件下培养,当OD600=2-6时收集菌体并重悬于BMMY培养基中(所含物质的质量浓度分别为酵母粉10 g/L、蛋白胨20 g/L、磷酸钾缓冲液(pH 6.0)100 mL/L、YNB 13.4 g/L、生物素0.4 mg/L、甲醇5 mL/L),于30℃下200 r/min培养,每间隔24 h添加无水甲醇,使其终浓度为0.5%。诱导96 h后收集发酵上清液进行Tricine-SDS-PAGE分析,并以抗His标签兔多克隆抗体为一抗,以山羊抗兔抗体为二抗对表达产物进行Western Blot检测。按照His标签蛋白纯化试剂说明书对带有6×His标签的融合蛋白Domesticin进行纯化,并用牛血清蛋白BSA作为对照,Bradford法测定蛋白的浓度。
1.2.5 Domesticin的抑菌活性检测将抑菌实验菌株在37℃ 200 r/min LB培养基中过夜培养,次日按照1%接种量转接培养至OD600=0.2左右。用新鲜LB培养基稀释菌液100倍备用。将纯化后的Domesticin蛋白用无菌水进行稀释,取90 μL细菌稀释液和10 μL蛋白稀释液加入96孔板中,23℃ 100 r/min培养12 h。分别以10 μL无菌水和10 μL氨苄青霉素(30 μg/mL)作为阴性和阳性平行对照。在OD600下检测实验组和对照组菌液的浊度,来判断其是否具有抑菌活性,并测定最小抑菌浓度(Minimal inhibitory concentration,MIC),MIC定义为与阴性对照组相比实验组达到85%以上细菌死亡的多肽浓度。不同浓度的样品进行3次实验重复。
2 结果 2.1 目的基因的扩增及表达载体pPIC9K-domesticin的构建PCR克隆获得家蝇domesticin基因全长cDNA序列364 bp,此序列包含198 bp完整的开放阅读框,5’末端非翻译区114 bp,3’末端非翻译区52 bp。该基因推导的氨基酸序列含有65个氨基酸,其中含有25个氨基酸的信号肽(图 1),其成熟肽理论分子量为4.58 kD。以家蝇cDNA为模板,P1和P2为引物对domesticin基因编码成熟肽序列进行PCR扩增,电泳结果(图 2)显示100-250 bp位置有特异性片段。对构建的pPIC9K-domesticin表达载体进行双酶切验证,双酶切后出现两条特异条带,其中小片段与domesticin大小一致,另一条带为pPIC9K线性质粒(图 3)。
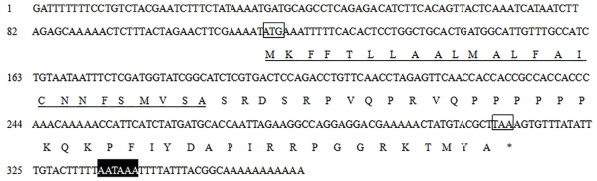
|
图 1 家蝇domesticin基因cDNA及其推导的氨基酸序列
 和 和 表示起始密码子和终止密码子,AATAAA为加尾信号,下划线表示信号肽 表示起始密码子和终止密码子,AATAAA为加尾信号,下划线表示信号肽ATG和TAA表示起始密码子和终止密码子,AATAAA为加尾信号,下划线表示信号肽 |

|
| 图 2 家蝇domesticin基因PCR产物电泳图 M:DNA Marker;1:家蝇domesticin基因PCR产物 |

|
| 图 3 重组表达载体pPIC9K-domesticin双酶切验证 M:DNA Marker;1:pPIC9K-domesticin质粒双酶切;2:pPIC9K-domesticin质粒 |
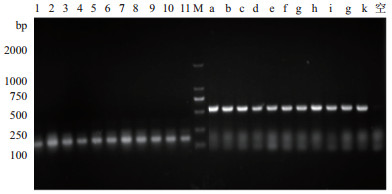
经遗传霉素G418不同浓度梯度筛选,浓度低于3 mg/mL的遗传霉素YPD平板上长出了数目不等的转化子,而4 mg/mL的遗传霉素YPD平板上未见转化子长出,在3 mg/mL遗传霉素的YPD平板上长出11个毕赤酵母转化子。引物P1和P2检测片段预期大小为123 bp,载体引物5'AOX1和引物P2检测片段预期大小为514 bp,同时以空质粒pPIC9K作为阴性对照,结果显示两种配对引物扩增的片段大小均与预期值相符,且11个转化子均为阳性克隆(图 4)。
|
| 图 4 pPIC9K-domesticin毕赤酵母转化子菌落PCR筛选 1-11:P1,P2为引物鉴定的阳性克隆;a-k:载体引物5' AOX1和P2为引物鉴定的阳性克隆;空:质粒pPIC9K阴性对照;M:DNA Marker |
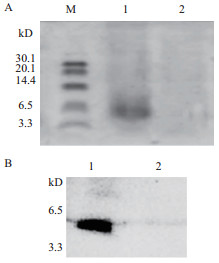
任取一株筛选到的酵母pPIC9K-domesticin高抗性转化子进行诱导培养,质粒pPIC9k转化子为阴性对照,分别收集诱导培养96 h的发酵上清,三氯乙酸浓缩后经Tricine-SDS-PAGE及Western Blot检测,发现在大约5.4 kD位置出现了与融合蛋白预期大小相符的条带,而pPIC9k质粒对照未出现条带(图 5)。镍柱纯化后得到Domesticin的蛋白浓度为78.22 μg/mL。
|
| 图 5 毕赤酵母表达Domesticin重组蛋白的Tricine-SDS-PAGE分析(A)及Western Blot鉴定(B) 1:酵母表达pPIC9K-domesticin重组产物;2:酵母表达pPIC9K质粒产物;M:蛋白分子质量标准 |
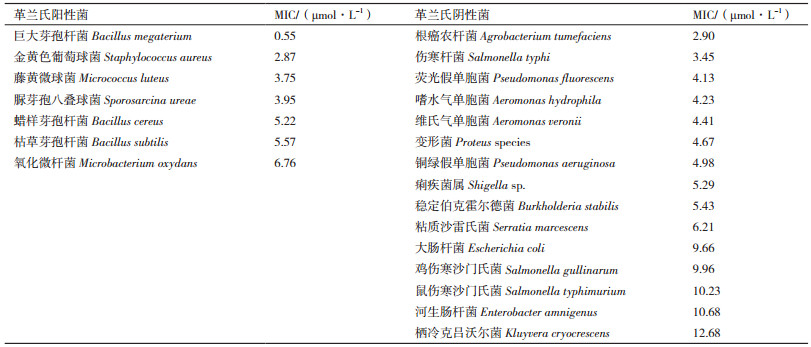
家蝇抗菌肽Domesticin对各种细菌的最小抑菌浓度(MIC)见表 1,实验表明Domesticin对巨大芽孢杆菌在内的22种受试细菌都具有抑菌作用,其中对革兰氏阳性菌巨大芽孢杆菌(Bacillus megaterium)抑制作用最强,其MIC值为0.55 μmol/L,对革兰氏阴性菌栖冷克吕沃尔菌(Kluyvera cryocrescens)的抑制作用最弱,其MIC值为12.68 μmol/L。从结果可以看出家蝇抗菌肽Domesticin对革兰氏阳性菌的抑制效果要强于革兰氏阴性菌。
抗菌肽可以直接从生物体中提取分离,但是由于生物体中天然抗菌肽含量较低,提取工艺复杂且难以得到较为单一的抗菌肽成分,从而在一定程度上限制了抗菌肽的研究[19-20]。虽然可以利用化学合成获得抗菌肽,但化学合成的抗菌肽与天然抗菌肽结构存在差异,往往需要对其结构进行修饰后才具有活性。如杨雪等[17]通过化学合成的线性抗菌肽1-Muscin无抑菌活性,而环化修饰后的c-Muscin对多种细菌都有抑制作用;Hao等[21]在Buforin Ⅱ衍生肽BF2-A的结构特征基础上设计合成了新肽BF2-X,BF2-X对细菌的抗菌活性强于BF2-A,且BF2-X杀菌速度比BF2-A快速;Xie等[22]通过化学合成了非洲爪蛙的抗菌肽CPF-C1,虽然CPF-C1对耐药性细菌有较好的抑菌活性,但是CPF-C1稳定性差,而对其结构改造后的类似物CPF-8稳定性好且抗菌活性持久。此外有研究者利用原核系统表达抗菌肽,凌霄利用原核表达系统对太平洋牡蛎的抗菌肽cgMolluscidin进行融合表达,但该系统缺乏蛋白翻译后修饰功能,使得该抗菌肽没有抑菌活性[23]。有时,由于抗菌肽强烈的抑菌活性,会在其表达过程中将宿主杀死,使得重组表达难以在原核微生物中进行。毕赤酵母能够表达各种重组异源蛋白,被认为是一种理想的真核表达宿主[24]。与其他真核及原核表达系统相比,毕赤酵母表达系统具有易于操作,多种转录后修饰(如多肽折叠,酰化,糖基化,甲基化等),遗传系统稳定及蛋白可高水平表达等优点[25]。Xu等[26]将鲎(Limulus polyphemus)中的基因tachyplesin Ⅱ转入毕赤酵母并成功表达具有抑菌活性的抗菌肽。Luiz等[27]利用酵母系统重组表达了蜜蜂的抗菌肽,该抗菌肽对大肠杆菌具有抑菌作用。
毕赤酵母菌株主要有KM71、GS115、SMD1168及X33等。蔡晶晶等[28]利用毕赤酵母GS115表达了来自黑鲷的抗菌肽hepcidin,发现其对大肠杆菌和溶壁微球菌具有抑菌活性。Chen等[29]利用毕赤酵母SMD1168表达了来自蜜蜂的抗菌肽IC-20,发现其对大肠杆菌具有抑制效果。Li等[30]利用毕赤酵母X33表达了来源于鸡的抗菌肽Fowlicidin-2,该抗菌肽对大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌以及粘质持沙雷氏菌具有明显的抑菌效果。在GS115、SMD1168及X33这些酵母菌株中,目的基因在转化及整合的过程中会产生Mut+及Muts两种不同表型,需要用甲醇最小培养基(MM)来筛选其属于何种表型,这使得操作变得复杂。
本研究利用毕赤酵母菌KM71作为表达宿主,其优势在于不需要用MM培养基来筛选Mut表型,因为其所有转化子都是Muts表型。这就为筛选转化子节省了精力及成本。常用的毕赤酵母表达载体主要有pPICZα-A和pPIC9K两种,前者属于胞内表达载体,后者属于分泌到胞外的载体。此外,载体不同筛选高拷贝转化子时所用的抗生素不同。pPICZα-A用博来霉素来筛选高拷贝转化子,而pPIC9K则用遗传霉素来进行筛选。抗生素浓度越高则插入到酵母基因组中的目的片段的拷贝数越多,一般认为0.25 mg/mL遗传霉素筛选含1-2个拷贝数,4 mg/mL含7-12个拷贝数,通过筛选出高抗生素浓度的转化子来提高蛋白表达量。本研究筛选出了遗传霉素浓度最高为3 mg/mL的转化子,对其进行诱导表达后发现其蛋白表达量高于遗传霉素浓度为0.25 mg/mL的转化子的蛋白表达量。
本实验室化学合成的Domesticin多肽对枯草芽孢杆菌(Bacillus subtilis)、氧化微杆菌(Microbacterium oxydans)、脲芽孢八叠球菌(Sporosarcina ureae)、变形菌(Proteus species)、稳定伯克霍尔德菌(Burkholderia stabilis)、鸡伤寒沙门氏菌(Salmonella gullinarum)、河生肠杆菌(Enterobacter amnigenus)、栖冷克吕沃尔菌(Kluyvera cryocrescens)的最低抑菌浓度均大于100 µmol/L[18],可认为对这些菌基本无抑菌作用。而本研究利用毕赤酵母表达的Domesticin对上述细菌都具有很强的抑制效果,这表明与合成Domesticin多肽相比,毕赤酵母表达的Domesticin抑菌谱更广。这可能是由于毕赤酵母真核表达系统所表达出的抗菌肽更加接近其天然构型,并呈现了其原有活性。此外,该抗菌肽对人类致病菌伤寒杆菌(Salmonella typhi)、痢疾菌属(Shigella sp.)、金黄色葡萄球菌(Staphylococcus aureus)、荧光假单胞菌(Pseudomonas fluorescens)和人畜共患致病菌鸡伤寒沙门氏菌(Salmonella gullinarum)均有抑制作用,这说明该抗菌肽具有成为新型抗生素的潜力,为解决细菌耐药性问题提供新的思路和方向。同时,Domesticin对水产动物重要致病菌嗜水气单胞菌(Aeromonas hydrophila)及维式气单胞菌(Aeromonas veronii)也有抑制作用,这可以为水产养殖中的病菌感染提供新的治疗方案。
4 结论本研究构建了家蝇新型抗菌肽Domesticin成熟肽在毕赤酵母KM71的表达载体,甲醇诱导表达后进行蛋白检测,Tricine-SDS-PAGE及Western Blot分析结果表明,Domesticin在毕赤酵母中成功表达,抑菌实验显示Domesticin对受试革兰氏阳性和革兰氏阴性菌都具有抑制作用,是一种新型广谱抗菌肽。
| [1] |
Brogden KA. Antimicrobial peptides:pore formers or metabolic inhibitors in bacteria[J]. Nature Reviews Microbiology, 2005, 3(3): 238-250. |
| [2] |
Hancock RE, Chapple DS. Peptide antibiotics[J]. Lancet, 1999, 43(9049): 418-422. |
| [3] |
Oren Z, Shai Y. Mode of action of linear amphipathic alpha-helical antimicrobial peptides[J]. Peptide Science, 1998, 47(6): 451-463. |
| [4] |
Yount NY, Bayer AS, Xiong YQ, et al. Advances in antimicrobial peptide immunobiology[J]. Peptide Science, 2010, 84(5): 435-458. |
| [5] |
English BK, Gaur AH. The use and abuse of antibiotics and the development of antibiotic resistance[J]. Hot Topics in Infection and Immunity in Children VI, 2010, 659: 73-82. |
| [6] |
尹昆仑, 王嘉榕, 孙红宾. 抗菌肽的研究进展及应用前景[J]. 中国生化药物杂志, 2015, 35(5): 181-185. |
| [7] |
Hamamoto K, Kida Y, Zhang Y, et al. Antimicrobial activity and stability to proteolysis of small liner cationic peptides with D-amino acid substitutions[J]. Microbiology and Immunology, 2013, 46(11): 741-749. |
| [8] |
Hoffmann JA. The immune response of Drosophila[J]. Nature, 2003, 426(6962): 33-38. DOI:10.1038/nature02021 |
| [9] |
Tanaka H, Ishibashi J, Fujita K, et al. A genome-wide analysis of genes and gene families involved in innate immunity of Bombyx mori[J]. Insect Biochemistry and Molecular Biology, 2008, 38(12): 1087-1110. DOI:10.1016/j.ibmb.2008.09.001 |
| [10] |
Graveley BR, Kaur A, Gunning D, et al. The organization and evolution of the dipteran and hymenopteran Down syndrome cell adhesion molecule (Dscam) genes[J]. RNA, 2004, 10(10): 1499-1506. |
| [11] |
Kocks C, Cho JH, Nehme N, et al. Eater, a transmembrane protein mediating phagocytosis of bacterial pathogens in Drosophila[J]. Cell, 2005, 123(2): 335-346. |
| [12] |
柳峰松, 孙玲玲, 唐婷, 等. 家蝇抗菌肽Attacin-2基因的克隆序列分析和诱导表达[J]. 昆虫学报, 2011, 54(1): 27-33. |
| [13] |
Lu X, Shen J, Jin X, et al. Bactericidal activity of Musca domestica cecropin (Mdc) on multidrug-resistant clinical isolate of Escherichia coli[J]. Appl Microbiol Biotechnol, 2012, 95(4): 939-945. |
| [14] |
柳峰松, 王丽娜, 唐婷, 等. 家蝇抗菌肽Diptericin基因的克隆与分析[J]. 昆虫学报, 2009, 52(10): 1078-1082. DOI:10.3321/j.issn:0454-6296.2009.10.003 |
| [15] |
Wang JX, Zhao XF, Liang YL, et al. Molecular characterization and expression of the antimicrobial peptide defensin from the housely (Musca domestica)[J]. Cellular and Molecular Life Sciences:CMLS, 2006, 63(24): 3072-3082. |
| [16] |
Pei ZH, Sun XN, Tang Y, et al. Cloning, expression, and purification of a new antimicrobial peptide gene from Musca domestica larva[J]. Gene, 2014, 549(1): 41-45. |
| [17] |
杨雪, 唐婷, 王一丽, 等. 家蝇新型抗菌肽Muscin的基因克隆、表达模式及抑菌活性[J]. 昆虫学报, 2015, 58(6): 617-624. |
| [18] |
杨雪.两种新型抗菌肽基因muscin和domesticin的鉴定[D].保定: 河北大学, 2015: 28.
|
| [19] |
冉琳, 何钢, 刘嵬, 等. 大头金蝇幼虫抗菌肽提取纯化及抑菌活性研究[J]. 食品科技, 提取物与应用, 2017, 42(10): 248-252. |
| [20] |
陆婕, 钟雅, 柳林, 等. 家蝇蛆抗菌肽提取工艺研究[J]. 昆虫学报, 2007, 50(2): 106-112. DOI:10.3321/j.issn:0454-6296.2007.02.003 |
| [21] |
Hao G, Shi YH, Tang YL, et al. Design and analysis of structure-activity relationship of novel antimicrobial peptides derived from the conserved sequence of cecropin[J]. Journal of peptide science, 2010, 14(3): 290-298. |
| [22] |
Xie J, Gou Y, Zhao Q, et al. Antimicrobial activities and membrane-active mechanism of CPF-C1 against multidrug-resistant bacteria, a novel antimicrobial peptide derived from skin secretions of the tetraploid frog Xenopus clivii[J]. Journal of Peptide Science, 2015, 20(11): 876-884. |
| [23] |
凌霄.抗菌肽cgMolluscidin和PaDef的重组表达、纯化及活性研究[D].天津: 天津科技大学食品工程专业, 2016: 33-34.
|
| [24] |
Macauley-Patrick S, Fazenda ML, McNeil B, et al. Heterologous protein production using the Pichia pastoris expression system[J]. Yeast, 2010, 22(4): 249-270. |
| [25] |
Tabarraei A, Kalhor HR, Armanmehr S. Production of a soluble and functional recombinant apolipoprotein in the Pichia pastoris expression system[J]. Protein Expression and Purification, 2016, 121(5): 157-162. |
| [26] |
Xu F, Meng K, Wang Y R, et al. Eukaryotic expression and antimicrobial spectrum determination of the peptide tachyplesin Ⅱ[J]. Protein Expression and Purification, 2008, 58(2): 175-183. |
| [27] |
Luiz D, Almeida J, et al. Heterologous expression of abaecin peptide from Apis mellifera in Pichia pastoris[J]. Microbial Cell Factories, 2017, 16(5): 76. |
| [28] |
蔡晶晶, 杨明, 蔡灵, 等. 黑鲷抗菌肽hepcidin在毕赤酵母中的表达及其抗菌活性[J]. 厦门大学学报:自然科学版, 2009, 48(5): 738-743. |
| [29] |
Chen XM, Li J, Sun HL, et al. High-level heterologous production and Functional Secretion by recombinant Pichia pastoris of the shortest proline-rich antibacterial honeybee peptide Apidaecin[J]. Scientific Reports, 2017, 7: 14543. |
| [30] |
Li WX, Shi XT, Wei G, et al. Recombinant expression and biological characterization of the antimicrobial peptide fowlicidin-2 in Pichia pastoris[J]. Experiment and Therapeutic Medicine, 2016, 12(4): 2324-2330. |