果实的成熟过程在分子水平上是由许多转录因子单独或协同调控特定的下游基因来完成的[1],其中一类转录因子就是SBP box家族。SBP box转录因子参与了植物发育的相转变、花器官建成、果实成熟,激素信号转导和铜的体内平衡等[2-10]。CNR是SBP box转录因子家族成员之一,其功能和作用研究甚少。
番茄突变体cnr(Colourless non-ripening)的果实不能成熟,类胡萝卜素合成减少,果皮为黄色,不会变软,且与成熟相关酶的相应基因的表达受到影响[11-12]。cnr突变体的多聚半乳糖醛酸酶、果胶酯酶的含量和活性都比同时期野生型果实的低[13]。Manning等[14]利用定点克隆发现LeSPL-CNR基因位于第2条染色体长臂上,属于SPL基因家族,编码SQUAMOSA promoter binding protein(SBP box)蛋白。在野生型AC和突变体cnr中LeSPL-CNR核酸序列没有差异,只是在突变体cnr中LeSPL-CNR启动子上游有一段286 bp序列的胞嘧啶甲基化程度特别高,即DNA甲基化的改变,引起cnr突变体番茄果实不能正常成熟。在野生型果实中沉默LeSPL-CNR,发现果实出现类似于cnr突变体的表型,说明LeSPL-CNR在番茄果实成熟过程中起重要作用。这不仅开创了SBP box转录因子在果实成熟过程中的研究,而且对农业的发展有重要意义。
蛋白水平是转录因子CNR发挥作用的水平,所以需要在蛋白水平上研究转录因子CNR,深入认识其功能。转录因子CNR在蛋白水平上的系统研究还很少,2018年,有研究证明LeSPL-CNR抑制番茄果实SlNR启动子的活性,与SlNR启动子序列结合[15]。但是到目前为止,CNR调控番茄果实成熟的机制和路径尚不清楚。因此,为了在蛋白水平上研究转录因子CNR,本研究首先构建CNR蛋白的原核表达载体,然后将原核表达出来的CNR蛋白进行纯化,并制备多克隆抗体,最后研究转录因子CNR在番茄果实不同成熟时期的表达模式,以期为进一步深入研究CNR调控番茄果实成熟的机制奠定基础。
1 材料与方法 1.1 材料番茄(Lycopersicon esculentum Mill. cv. Ailsa Craig)种植于天津农学院的大棚,统一精细管理,花期挂牌,采摘不同时期的番茄果实,并选取大小一致,无病害和虫害、无机械损伤的果实进行实验。
大肠杆菌(Escherichia coli)Rosetta和原核表达载体pET-30a,均购自Novagen公司。
1.2 方法 1.2.1 构建pET-CNR原核表达载体用TRIzol法提取番茄果实总RNA[16],以此为模板进行反转录合成cDNA。根据番茄CNR基因的mRNA序列(NM_001319308.1)设计一对引物,并且引入Eco RI和Xho I酶切位点(表 1)。
以反转录得到的cDNA为模板,建立25 μL反应体系,进行目的基因的PCR扩增。在冰上依次加入17.5 μL双蒸水,2.5 μL 10×Buffer,1 μL超纯dNTPs,各1 μL正向和反向引物(10 μmol/L),1 μL Taq DNA Polymerase(2 U/μL),1 μL cDNA模板。瞬时离心混匀,进行PCR反应。反应程序为95℃预变性5 min,95℃变性30 s,57℃退火45 s,72℃延伸60 s,72℃最后延伸10 min,共进行35次循环。将扩增出的CNR基因进行纯化,并与pET-30a都用Eco RI和XhoI切成双粘性末端,16℃连接4 h,然后转化大肠杆菌Rosetta。通过Kan抗性培养基筛选,挑取单个阳性菌落培养并提取质粒,最后通过双酶切鉴定CNR基因的插入情况,同时进行测序。
1.2.2 CNR蛋白的原核表达挑含有重组质粒pET-CNR的Rosetta单菌落,接种至LB液体培养基(含有100 μg/mL Kan)中过夜培养,具体按照王贺等[17]的方法进行操作。第2天按1%的接种量进行扩培,直到OD600在0.5-0.7之间,加入终浓度分别为0.1、0.4、0.8和1.0 mmol/L的IPTG,37℃培养3 h。4℃,10 000 g离心10 min,收集菌体。每克菌体加4 mL细胞裂解液(含1 mg/mL溶菌酶),重悬细胞。混匀后置于冰上,摇20 min。保持在冰上,超声波破碎(功率400 W,每次工作9 s,间隔9 s,共25次),4℃ 10 000 g离心10 min,分开上清与沉淀,并进行蛋白电泳检测[18]。
1.2.3 CNR蛋白的纯化 1.2.3.1 纯化前准备配置结合缓冲液(含20 mmol/L磷酸钠,20 mmol/L咪唑,500 mmol/L NaCl),漂洗缓冲液(含50 mmol/L咪唑,磷酸钠和NaCl的浓度不变),洗脱缓冲液Ⅰ-Ⅴ(分别含100、200、300、400和500 mmol/L咪唑,磷酸钠和NaCl的浓度不变)。将所有缓冲液的pH调为7.4,且全部用0.22 μm滤膜过滤。取经过超声波破碎、离心后的菌体上清溶液,经0.22 μm滤膜过滤后,作为蛋白粗品备用。排尽蛋白纯化仪内的气泡,并进行泵清洗。
1.2.3.2 纯化过程将亲和层析柱Ni Sepharose 6 Fast Flow接入蛋白纯化仪,按照程序清洗柱子。将流速调至0.5 mL/min,设置收集体积为0,load状态,将待纯化的蛋白粗品吸入注射器,并通过上样环上样。等样品全部进入亲和层析柱后拆下柱子,放入4℃冰箱,竖立静置1 h,以保证蛋白粗品与柱子充分结合。然后将柱子重新接回纯化仪,用漂洗缓冲液进行漂洗,流速1 mL/min,直至洗回基线。依次用洗脱缓冲液Ⅰ-Ⅴ进行洗脱,流速0.5 mL/min,收集体积设置为200 μL/管,直至洗脱峰出现,待洗脱峰洗平后继续收集2个柱体积,完成纯化。
将收集的蛋白溶液进行SDS-PAGE,选取含有单一条带的蛋白用BCA试剂盒测定浓度,将浓度≥1.0 μg/μL的蛋白溶液进行混合,用于抗体的制备。
1.2.4 CNR蛋白多克隆抗体的制备取纯化后的100 μg CNR蛋白作为抗原免疫小鼠,制备多克隆抗体[16]。免疫间隔期为14 d,在最后一次免疫后第10天采集小鼠血清。4℃下静置过夜,5 000 g离心10 min,取上清液待测。
1.2.5 CNR蛋白多克隆抗体的纯化、效价及特异性的测定参考李玲[16]的方法对CNR蛋白多克隆抗体进行纯化,用ELISA法检测抗体效价,并用蛋白印迹的方法测定抗体的特异性[18]。
1.2.6 番茄转录因子CNR的表达模式参考朱鸿亮[19]的方法提取番茄果实不同成熟时期的总蛋白,用蛋白印迹的方法研究CNR的表达模式。
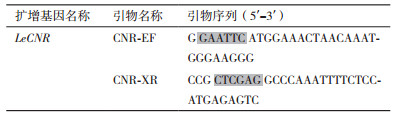
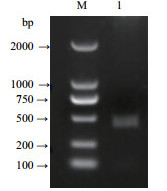
2 结果 2.1 pET-CNR原核表达载体的构建采用TRIzol法提取番茄果实总RNA。由图 1可以看出,提取的番茄总RNA完整性特别好,没有降解,也未受到DNA的污染,能够作为下一步理想的反转录模板。通过反转录PCR得到CNR基因片段(图 2),此片段的大小与实验预期结果大小相符。将CNR基因片段与pET-30a进行双酶切,经连接酶作用,构建原核表达载体pET-CNR,最后转化入感受态细胞Rosetta中。

|
| 图 1 番茄果实总RNA的电泳图 |
|
| 图 2 CNR基因的PCR扩增 M:Marker,1:CNR基因片段 |
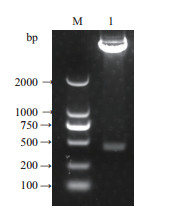
提取重组质粒pET-CNR,进行双酶切鉴定,得到大小420 bp的片段(图 3),该条带的大小与CNR基因大小相符。同时进行测序分析,结果(图 4)显示重组载体pET-CNR具有正确的读码框,没有错配且序列与已发表序列完全一致,证明pET-CNR重组载体构建成功。
|
| 图 3 pET-CNR原核表达载体的酶切验证 M:Marker,1:重组质粒双酶切 |

|
| 图 4 pET-CNR重组质粒测序结果序列对比 图中CNR-EX为GenBank中已知的CNR序列;CNR_菌1为测序所测得的序列 |
挑阳性单克隆转至LB液体培养基中过夜培养,第2天进行扩培。当OD600为0.5-0.7时,加入IPTG诱导蛋白表达,离心去上清,沉淀(菌体)用冰浴超声波破碎,之后对蛋白进行定量,用15%的SDS-PAGE分析结果。如图 5所示,没有加IPTG诱导剂的菌液在27 kD处没有蛋白表达,而加入IPTG诱导剂的菌液在27 kD处有蛋白表达,且分子量与实验设计表达的CNR蛋白分子量相符。说明pET-CNR重组载体能够表达CNR蛋白。

|
| 图 5 CNR蛋白的小量诱导表达 M:Marker,1-3:单克隆,4:未诱导 |
加入不同浓度的IPTG诱导蛋白表达,37℃、3 h后分别收集菌体,超声波裂解后,保留上清和沉淀。如图 6所示,菌体裂解液的上清中分子量为27 kD的蛋白有明显的表达,而在沉淀中无此蛋白表达,说明CNR蛋白在菌体裂解液的上清中表达。当加入1.0 mmol/L IPTG诱导剂时,CNR蛋白的表达量最大(图 6,泳道4),表明诱导剂IPTG的最适宜浓度为1.0 mmol/L。

|
| 图 6 不同浓度IPTG诱导CNR蛋白表达的结果 M:marker,1-4:细胞裂解液的上清部分,5-8:细胞裂解液的沉淀部分,1和5:0.1mmol/L IPTG,2和6:0.4 mmol/L IPTG,3和7:0.8 mmol/L IPTG,4和8:1.0 mmol/L IPTG |
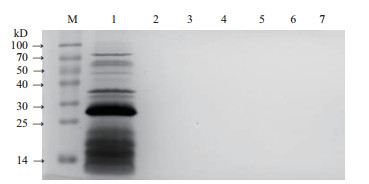
经1.0 mmol/L的IPTG诱导表达后收集的菌体用PBS溶液(含溶菌酶)进行重悬,超声波裂解菌体,将上清液加入亲和层析柱中进行纯化,结果如图 7所示。上清上柱后,蛋白全部与亲和柱结合,在流出液中没有27 kD的蛋白,说明CNR蛋白与Ni柱结合牢靠(图 7,泳道2)。当加入漂洗缓冲液和洗脱缓冲液Ⅰ-Ⅳ时,蛋白仍然没有被洗脱下来(图 7,泳道3-7)。
|
| 图 7 带有His标签的CNR蛋白的亲和纯化(一) M:Marker,1:纯化前的样品,2-7:分别为结合缓冲液、漂洗缓冲液、洗脱缓冲液Ⅰ、Ⅱ、Ⅲ、Ⅳ过柱后洗脱下来的蛋白 |
再用咪唑浓度为500 mmol/L的洗脱缓冲液Ⅴ对样品进行洗脱并收集洗脱液,每管收集200 μL。此时蛋白开始被洗脱下来,并且随着洗脱的进行,杂蛋白含量开始逐渐减少(图 8-A)。大量的杂蛋白已经被洗去,CNR蛋白条带开始变得单一(图 8-B)。继续洗脱,杂蛋白被完全洗脱掉,最后收集到纯度很高的CNR蛋白(图 8-C)。选取只含有CNR蛋白单一条带的收集液,通过BCA法测定蛋白含量,将蛋白含量≥1.0 μg/μL的收集液合并,作为制备多克隆抗体的抗原。

|
| 图 8 带有His标签的CNR蛋白的亲和纯化(二) M:Marker,各个泳道均为洗脱缓冲液Ⅴ过柱后按照时间顺序洗脱下来的蛋白 |
第4次CNR蛋白免疫后第10天,取小鼠全血大约1 mL,全血置4℃冰箱过夜。用DEAE-Sepharose FF离子交换柱对血清进行纯化。从图 9可知,管号为4-12的管中抗体含量较高,所以合并4-12管中的洗脱液,为纯化后的抗体。
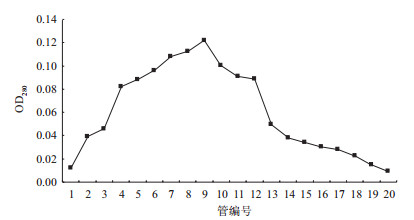
|
| 图 9 CNR蛋白抗体的纯化洗脱过程 |
用ELISA法检测抗体效价,从图 10-A中可以看出,在抗原是100 ng的条件下,OD450为0.5时,CNR抗体的稀释倍数为320 000,所以本实验制得的CNR蛋白多克隆抗体的效价为320 000。纯化的CNR蛋白与免疫小鼠获得的抗体在分子量27 kD附近发生特异性反应(图 10-B),表明制得的CNR多克隆抗体具有良好的特异性。

|
| 图 10 CNR蛋白抗体效价和免疫特异性分析 A:CNR蛋白抗体效价分析。抗体效价定义为:在实验条件下,450 nm处OD值为0.5的反应孔所对应的抗体的稀释倍数。图中数值为x±s误差(n = 4);B:CNR蛋白抗体免疫特异性分析 |
分别提取未熟期、绿熟期、破色期、粉红期、红熟期番茄果实总蛋白,在上样量均为20 μg的情况下进行CNR蛋白免疫印迹分析。从图 11中可以看出,在分子量27 kD附近出现条带单一的印迹,这与CNR蛋白的分子量相符。CNR蛋白在番茄果实的破色期表达量最高,而在红熟期几乎没有表达。这说明CNR蛋白的积累与番茄果实的发育和成熟关系密切。

|
| 图 11 番茄果实成熟过程中CNR蛋白的表达模式 1:未熟期,2:绿熟期,3:破色期,4:粉红期,5:红熟期 |
为了在蛋白水平上研究CNR转录因子,必需获得纯度高的CNR蛋白和特异性好的CNR蛋白抗体,所以本研究构建了pET-CNR原核表达载体。其中IPTG诱导剂的终浓度是原核表达系统表达外源蛋白的重要影响因素[20-21]。因此,对诱导剂IPTG的浓度进行优化,得出加入1.0 mmol/L IPTG,CNR蛋白的表达量最高。有研究发现如果抗原中存在杂蛋白会激发机体产生其他抗体,所以要制备效价高、特异性好的多克隆抗体,必需得到纯度很高的免疫原[22]。而纯化是获得高纯度蛋白免疫原的关键步骤,一般将目的蛋白的纯化分为包涵体蛋白的纯化和可溶性蛋白的纯化[22-23],可通过亲和层析法对可溶性蛋白进行纯化[24-25]。本研究的CNR蛋白在菌体上清液中表达,是可溶性蛋白,所以用Ni Sepharose 6 Fast Flow采用亲和层析法进行纯化,纯化结果很好。
CNR是SBP box转录因子家族中成员之一,SBP box转录因子参与了植物发育的许多方面,包括相转变、花器官的建成、果实成熟,植物激素信号转导和铜的体内平衡等[26],但是目前关于转录因子CNR的研究较少。有研究发现SlymiR157靶向作用于LeSPL-CNR可能影响转录因子LeMADS-RIN、LeHB1等基因的表达[27]。转录因子RIN靶位点的作用依赖于转录因子CNR基因位点上一个正常功能的等位基因,但是二者的关系不明确[28]。全基因组甲基化测序(Whole geonme bisulfite sequencing,WGBS)与病毒诱导基因沉默(Virus-induced gene silencing,VIGS)技术结合可以用来识别导致cnr突变体果实无色和未成熟表型的基因[29]。本实验在蛋白水平上研究了转录因子CNR在番茄果实发育和成熟过程中的表达模式。CNR蛋白在番茄果实的破色期表达量最高,说明转录因子CNR在番茄果实的破色期发挥了重要作用。但是,CNR蛋白在番茄果实的未熟期也有表达,表明转录因子CNR在番茄果实的未熟期也有一定的作用。查阅大量资料未发现其他研究者对此现象的分析,所以CNR蛋白与番茄果实发育和成熟之间的关系还有待于进一步的研究,这也是下一步工作的重点。
4 结论本研究首次成功构建了pET-CNR原核表达载体,确定IPTG的最佳诱导浓度为1.0 mmol/L,并纯化出纯度很高的CNR蛋白,制得了CNR蛋白的多克隆抗体,该抗体效价高、特异性好。CNR蛋白在番茄果实发育的破色期表达量最高,说明转录因子CNR在此时发挥了重要作用,但是其调控番茄果实发育和成熟的具体作用机制还有待于深入研究。
| [1] |
Giovannoni JJ. Fruit ripening mutants yield insights into ripening control[J]. Current Opinion in Plant Biology, 2007, 10(3): 283-289. DOI:10.1016/j.pbi.2007.04.008 |
| [2] |
Huijser P, Schmid M. The control of developmental phase transitions in plants[J]. Development, 2011, 138: 4117-4129. DOI:10.1242/dev.063511 |
| [3] |
Jung JH, Seo PJ, Kang SK, et al. miR172 signals are incorporated into the miR156 signaling pathway at the SPL3/4/5 genes in Arabidopsis developmental transitions[J]. Plant Molecular Biology, 2011, 76: 35-45. DOI:10.1007/s11103-011-9759-z |
| [4] |
Jung JH, Ju Y, Seo PJ, et al. The SOC1-SPL module integrates photoperiod and gibberellic acid signals to control flowering time in Arabidopsis[J]. Plant Journal, 2012, 69: 577-588. DOI:10.1111/tpj.2012.69.issue-4 |
| [5] |
Yu S, Galvao VC, Zhang YC, et al. Gibberellin regulates the Arabidopsis floral transition through miR156-targeted SQUAMOSA PROMOTER BINDING-LIKE transcription factors[J]. Plant Cell, 2012, 24: 3320-3332. DOI:10.1105/tpc.112.101014 |
| [6] |
Zhang SD, Ling LZ. Genome-wide identification and evolutionary analysis of the SBP-box gene family in castor bean[J]. PLoS One, 2014, 9(1): e86688. DOI:10.1371/journal.pone.0086688 |
| [7] |
Tan HW, Song XM, Duan WK, et al. Genome-wide analysis of the SBP-box gene family in Chinese cabbage (Brassica rapa subsp pekinensis)[J]. Genome, 2015, 58(11): 463-477. DOI:10.1139/gen-2015-0074 |
| [8] |
Xu Z, Sun L, Zhou Y, et al. Identification and expression analysis of the SQUAMOSA promoter-binding protein (SBP)-box gene family in Prunus mume[J]. Mol Genet Genomics, 2015, 290(5): 1701-1715. DOI:10.1007/s00438-015-1029-3 |
| [9] |
Zhang SD, ling LZ, Yi TS. Evolution and divergence of SBP-box genes in land plants[J]. BMC Genomics, 2015, 16: 787-796. DOI:10.1186/s12864-015-1998-y |
| [10] |
Zhang W, Li B, Yu B. Genome-wide identification, phylogeny and expression analysis of the SBP-box gene family in maize (Zea mays)[J]. Journal of Integrative Agriculture, 2016, 15(1): 29-41. |
| [11] |
Fraser P, Bramley P, Seymour GB. Effect of the Cnr mutation on carotenoid formation during tomato fruit ripening[J]. Phytochemistry, 2001, 58: 75-79. DOI:10.1016/S0031-9422(01)00175-3 |
| [12] |
Orfila C, Huisman MM, Willats WG, et al. Altered cell wall disassembly during ripening of Cnr tomato fruit:implications for cell adhesion and fruit softening[J]. Planta, 2002, 215: 440-447. DOI:10.1007/s00425-002-0753-1 |
| [13] |
Eriksson EM, Bovy A, Manning K, et al. Effect of the colorless non-ripening mutation on cell wall biochemistry and gene expression during tomato fruit development and ripening[J]. Plant Physiology, 2004, 136: 4184-4197. DOI:10.1104/pp.104.045765 |
| [14] |
Manning K, Tör M, Poole M, et al. A naturally occurring epigenetic mutation in a gene encoding an SBP-box transcription factor inhibits tomato fruit ripening[J]. Nature Genetics, 2006, 38(8): 948-952. DOI:10.1038/ng1841 |
| [15] |
Chen WW, Jin JF, Lou HQ, et al. LeSPL-CNR negatively regulates Cd acquisition through repressing nitrate reductase-mediated nitric oxide production in tomato[J]. Planta, 2018, 248(4): 893-907. DOI:10.1007/s00425-018-2949-z |
| [16] |
李玲.转录因子LeMADS-RIN调控番茄果实乙烯生物合成机制的研究[D].北京: 中国农业大学, 2011: 22-37.
|
| [17] |
王贺, 杨瑞金, 华霄, 等. 密苏里游动放线菌葡萄糖异构酶基因xylA的克隆及其表达条件的优化[J]. 食品科学, 2010, 31(15): 171-176. |
| [18] |
郭尧君. 蛋白质电泳实验技术[M]. 第2版. 北京: 科学出版社, 2005: 92-118, 255-268.
|
| [19] |
朱鸿亮.番茄果实成熟相关转录因子LeMADS-RIN的表达和功能分析[D].北京: 中国农业大学, 2008: 30.
|
| [20] |
秦伟, 黄昆仑, 贺晓云, 等. 水稻密码子优化的cry2A*基因在大肠杆菌中的表达及其表达产物的纯化[J]. 食品科学, 2008, 29(7): 267-271. DOI:10.3321/j.issn:1002-6630.2008.07.057 |
| [21] |
杨川, 胡敏. 斑马鱼SFPQ蛋白的原核表达及纯化[J]. 生物技术通报, 2016, 32(1): 163-168. |
| [22] |
李军.Nanog基因的原核表达、蛋白纯化及抗体制备[D].杨凌: 西北农林科技大学, 2007: 27-50. http://cdmd.cnki.com.cn/Article/CDMD-10712-2007188372.htm
|
| [23] |
宋振.人SUMO-1蛋白多克隆抗体的制备与鉴定及亚细胞结构的定位[D].杨凌: 西北农林科技大学, 2008: 21-28. http://cdmd.cnki.com.cn/Article/CDMD-10712-2008102116.htm
|
| [24] |
袁蓓, 李京生, 吴燕民. 利用植物生产药用蛋白的进展、局限及应对策略[J]. 草业学报, 2013, 22(4): 283-299. |
| [25] |
刘嘉霖.重组冷休克蛋白的表达纯化及其神经保护机制的研究[D].北京: 中国人民解放军医学院.2015: 3-22. http://cdmd.cnki.com.cn/Article/CDMD-90115-1015401367.htm
|
| [26] |
Zhang W, Li B, Yu B. Genome-wide identification, phylogeny and expression analysis of the SBP-box gene family in maize (Zea mays)[J]. Journal of Integrative Agriculture, 2016, 15(1): 29-41. |
| [27] |
Chen WW, Kong JH, Lai TF, et al. Tuning LeSPL-CNR expression by SlymiR157 affects tomato fruit ripening[J]. Scientific Reports, 2015, 5: 7852. DOI:10.1038/srep07852 |
| [28] |
Martel C, Vrebalov J, Tafelmeyer P, et al. The tomato MADS-box transcription factor RIPENING INHIBITOR interacts with promoters involved in numerous ripening processes in a COLORLESS NONRIPENING-dependent manner[J]. Plant Physiology, 2011, 157: 1568-1579. DOI:10.1104/pp.111.181107 |
| [29] |
Chen WW, Yu ZM, Kong JH, et al. Comparative WGBS identifies genes that influence non-ripe phenotype in tomato epimutant Colourless non-ripening[J]. Science China-Life Sciences, 2018, 61: 244-252. DOI:10.1007/s11427-017-9206-5 |