2. 广西大学农学院,南宁 530005;
3. 广西林业科学研究院,南宁 530002;
4. 南宁市绿化工程管理中心,南宁 530011;
5. 广西壮族自治区亚热带作物研究所,南宁 530001
2. College of Agriculture, Guangxi University, Nanning 530005;
3. Guangxi Forestry Research Institute, Nanning 530002;
4. Nanning City Greening Project Management Center, Nanning 530011;
5. Guangxi Subtropical Crops Research Institute, Nanning 530001
植物生长过程中难免会遭遇病虫害、干旱、盐渍、机械损伤、高温、低温等逆境胁迫。生物或非生物胁迫会使植物产生活性氧物质(Reactive oxygen species,ROS),包括超氧阴离子(O2-)、羟自由基(·OH)、单线态氧和过氧化氢(H2O2)等[1]。活性氧的过量积累会对植物体内的蛋白质、DNA与脂质等造成氧化,从而破坏其生物膜的结构和功能,对植物造成一定的伤害[2-3]。为了防御氧化胁迫,植物在长期进化过程中形成了相应的酶类(SOD、CAT和APXs)和非酶类(谷胱甘肽、生育酚、类胡萝卜素等小分子物质)两套防御体系来清除有害物质。抗坏血酸过氧化物酶(Ascorbate peroxidase,APX)是抗氧化系统中与H2O2亲和力最强的氧化酶。APX以抗坏血酸为电子供体,催化H2O2分解成H2O和O2,从而降低氧自由基浓度,减轻对细胞的伤害,保障植物在逆境环境中生长,因此,研究APX应对逆境胁迫具有重要意义。
目前,在拟南芥[4]、水稻[5]、小麦[6]、高粱[7]、马铃薯[8]、银杏[9]、棉花[10]、油菜[11]、甘蔗[12-13]等多种植物已克隆出APX。关于APX在抗逆境方面的作用也进行了较多报道,如转豌豆cAPX的转基因番茄过量表达能够提高其抗寒和抗盐能力[14];过表达SbpAPX的转基因马铃薯能够提高盐和干旱胁迫耐受性[15];过表达叶绿体APX的转基因拟南芥可以抵御强光氧化胁迫[16];高粱抗坏血酸过氧化物酶基因(Sb002G431100)在感蚜突变体RMES1介导的抗虫反应中发挥着积极作用[17];甘蔗抗坏血酸过氧化物酶基因(ScAPX)对SA、MeJA、H2O2、ABA、NaCl和PEG的胁迫表现出正响应[13]。
甘蔗是重要的糖料作物、能源作物和饲料作物,关于甘蔗耐寒性与抗坏血酸过氧化物酶关系的研究报道主要集中在低温胁迫后植物体内SOD、POD、CAT等酶活性的变化[18-22],甘蔗抗坏血酸过氧化物酶基因在不同抗性甘蔗品种及其与甘蔗抗寒性之间的机理研究报道较少。
本研究利用RT-PCR克隆甘蔗ScAPX1全长,利用生物信息学分析该基因的序列特征,通过荧光定量技术探讨在低温胁迫下甘蔗ScAPX1在甘蔗叶片中的时空表达模式,初步探明该基因与甘蔗抵御寒害等逆境的关系,为深入研究甘蔗APX1在低温胁迫中的功能及甘蔗抗寒育种的分子机理提供依据。
1 材料与方法 1.1 材料 1.1.1 材料试验材料是根据前期的研究结果选取甘蔗品种GT28(耐寒)和YL6(不耐寒)。将生长健壮,长势一致的单芽蔗茎种植于泥沙混合培养基质上,待甘蔗长到3叶时,选取长势较一致的蔗株移栽到300 mm×350 mm(直径×高)塑料桶,每桶装混合土17.5 kg(土:有机肥:沙=60:20:20,W/W),随机区组设计,每桶种植2-3株甘蔗,为增强透气性,在桶底打孔。将桶移至大棚,常规管理。待正常生长10个月后,甘蔗处于生长后期时,把材料分为2组:第一组正常管理,为对照组(CK),温度为25℃,光强为250-300 µmol/m2·s,12 h光周期,相对湿度60%-70%。;第二组进行低温处理(人工气候室),温度设为0-4℃,光强为250-300 µmol /m2·s,12 h光周期,相对湿度60%-70%;试验分别于低温后2、4、6和8 d后取样,于早晨8点采集+1叶和茎尖样品,速冻于液氮中,于-80℃保存备用。
1.1.2 试验试剂TRIzol总RNA提取试剂、PCR反应2×GoldStarTaqMasterMix购自北京康为世纪公司;M-MLVcDNA第一链合成试剂、PrimeScript® RT Reagent Kit With gDNA Eraser(Perfect Real Time)、PMD18-T vector及SYBR® Premix Ex TaqTM II均购自TaKaRa公司;Biospin Gel Extraction Kit购自BioFlux公司;引物由TaKaRa公司和上海生工生物工程有限公司合成。大肠杆菌(E. coli)DH5α由本实验室保存;其他常规试剂均为国产分析纯试剂。
1.2 方法 1.2.1 总RNA的提取和cDNA第一链的合成用TRIzol试剂提取2个甘蔗品种总RNA,提取步骤按说明书进行,使用紫外分光光度计和琼脂糖凝胶电泳检测RNA的浓度和完整性。以提取获得的RNA为模版,按照M-MLV cDNA第一链合成试剂盒说明书合成cDNA第一链。逆转录引物用Oligo(dT)18 Primer:5' -GGCCACGCGTCGACTAGTACTTTTTTTTTTTTTTTTTT-3' ,具体步骤按说明书进行。
1.2.2 ScAPX的克隆运用BLAST程序对GenBank进行搜索,选取与ScAPX同源性较高的高粱核苷酸序列进行比对分析并运用Primer软件设计上游引物APX-F:5' -ATGGCGAAG(A/T)(A/G)CTACCCGA-3' ,下游引物APX-R:5' -(A/T/C)GCATCAGC(A/G)AACCC(C/T)AGTTC-3' 。PCR扩增反应体系为10×Buffer 2.0 μL、dNTPs(10 mmol/L)0.4 μL、cDNA(100 μg/μL)1.0 μL、Taq DNA聚合酶(200 U/μL)0.16 μL、上下游引物(10 μmol/L)各1.0 μL和ddH2O 19.44 μL。PCR反应程序为95℃ 5 min;95℃ 40 s,58℃ 50 s,72℃ 2 min,35个循环;72℃ 10 min。PCR扩增产物经1.2%的琼脂糖凝胶电泳检测,回收目的条带,连接pMD18-T,热激法转化感受态细胞大肠杆菌DH5α,经菌液PCR检测验证后,阳性克隆送由华大上海生物工程公司测序。
1.2.3 ScAPX1的生物信息学分析用BioXM2.6预测基因氨基酸序列;利用NCBI中BLASTP工具查找甘蔗ScAPX蛋白同源氨基酸序列,并用DNAMAN 6.0软件多重比对同源氨基酸序列;在线软件(http://isoelectric.ovh.org/)分析基因氨基酸序列的蛋白质分子量和等电点大小;用MEGA6.0软件构建甘蔗ScAPX1氨基酸序列与其他物种APX氨基酸序列的进化树。
1.2.4 ScAPX1的实时荧光定量表达分析根据获得的ScAPX1全长序列设计荧光定量PCR特异性引物;以GAPDH(NCBI登录号为EF189713)作为内参基因,设计内参引物GAPDHF:5' -AAGGGTGGTGCCAAGAAGG-3' ,GAPDH R:5' -CAAGGGGAGCAAGGCAGTT-3' 。荧光定量PCR反应在LightCycler 480II(RoChe)real-time PCR仪上进行,数据用qBASE plus软件进行分析。反应体系为SYBR®PremixExTaqTMII(2×)10 µL、PCR Forward/Reverse Primer(10 µmol/L)各0.8 µL、cDNA模板(50 ng/µL)2.0 µL,加ddH2O补至20 µL。反应程序为:第一轮反应95℃ 30 s;95℃ 5 s,60℃ 20 s,45个循环;第二轮反应95℃ 1 s,65℃ 15 s,95℃ Continuous,1个循环,40℃ 30 s。样本基因和内参基因分别设定3个重复,以0 d材料作为对照。反应完成后进行融解曲线检验,采用2-ΔΔCt法计算相对表达量。
2 结果 2.1 总RNA和cDNA质量的检测甘蔗总RNA(TRIzol试剂盒提取)经1.0%琼脂糖凝胶电泳检测。从图 1可以看出,RNA带型完整清晰,18 S和28 S两条带比较完整且较亮,5 S则隐约可见,并无杂质污染,说明所提取的甘蔗RNA质量较好。总RNA逆转录后,经1.0%琼脂糖凝胶电泳检测,可以看出,逆转录产物在100-2 000 bp均匀弥散状的带,说明逆转录质量较好。
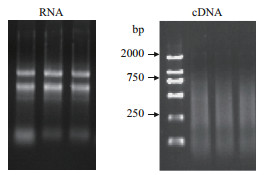
|
| 图 1 甘蔗叶片总RNA和cDNA琼脂糖检测 |
以2个甘蔗品种经不同低温处理的叶片等量混合的cDNA为模板,利用上游引物APX-F和下游引物APX-R进行PCR扩增,获得一段约750 bp的条带(图 2),经测序和比对,发现为甘蔗抗坏血酸过氧化物酶基因完整开放阅读框(ORF)全长,命名为ScAPX1,基因登录号为KC794939。ScAPX1的cDNA全长包含一个759 bp的ORF(图 3),编码252个氨基酸。
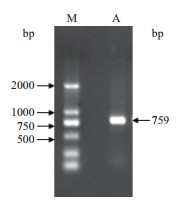
|
| M:DL2 000 marker;A:基因cDNA全长扩增结果 图 2 甘蔗ScAPX1的PCR扩增结果 |

|
| 图 3 ScAPX1编码区核苷酸序列及推导出的氨基酸序列 |
软件预测ScAPX1编码的氨基酸序列蛋白分子量大小为27.40 kD,等电点为5.78。在氨基酸序列组成中,Leu、Ala、Gly、Glu、Lys出现频率较高,分别占11.6%、11.2%、9.2%、7.6%和7.2%,Sec、Trp、Cys、Met、Asn出现频率较低,仅占0.0%、0.8%、1.2%、1.6%和2.0%。WoLF PSORT软件显示ScAPX1亚细胞定位于细胞质;该基因不含信号肽,是一个可溶性蛋白,无跨膜结构;ScAPX1编码的氨基酸疏水性在-4.5-4.5。SOPMA软件二级结构预测表明:α-螺旋92个(36.5%);随机卷曲111个(44.1%);延伸链28个(11.1%);β-转角21个(8.3%)。ScAPX1没有糖基化位点,含有磷酸化位点Ser 4个,Thr 4个,Tyr 2个。
ScAPX1蛋白功能结构域分析显示:在54-59、69-74和177-182位氨基酸为N-肉豆蔻酰化位点,50-52、59-61和207-209位为蛋白激酶C磷酸化位点,155-165位为抗坏血酸过氧化物酶近端血红素配体结构序列,33-44位为抗坏血酸过氧化物酶近端活性位点,90-252位为非动物抗坏血酸过氧化物酶位点,1-252位为抗坏血酸过氧化物酶家族区域,231-252位为伸展蛋白重复序列,117-124位为八肽重复区。根据克隆的ScAPX1所编码的氨基酸序列与其他物种比对发现,APX在不同物种之间是非常保守的(图 4)。
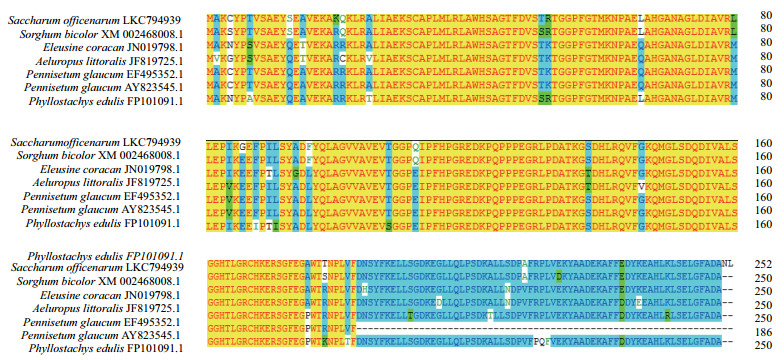
|
| 图 4 7种植物ScAPX氨基酸序列多重比对 |
根据NCBI BLAST检索,获得与甘蔗ScAPX1同源的其他10种植物APX的氨基酸序列,用MEDA4.0软件构建APX进化树(图 5)。通过在线分析可知,甘蔗ScAPX1与高粱的氨基酸序列同源性最高,聚为一类,其同源性为98%;其次是玉米,为96%;与苹果、芥菜的同源性较低,为80%。
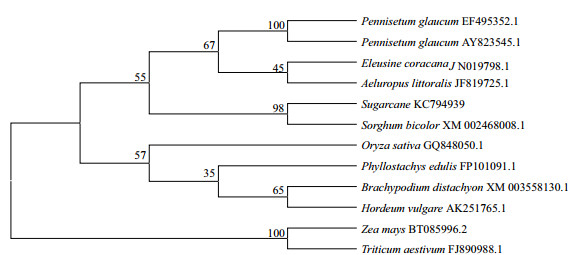
|
| 图 5 甘蔗ScAPX1与其他物种APX的氨基酸序列同源性分析 |
由图 6可知,低温胁迫过程中,2个甘蔗品种ScAPX1表达先升高后降低,都是在低温胁迫4 d时达到最大,此时GT28和YL6分别为处理0 d时的2.25倍和1.14倍,之后出现下降趋势。抗寒性强的GT28品种ScAPX1表达量上升速度要比不抗寒品种YL6快;低温胁迫8 d时,ScAPX1在GT28品种中的表达量仍高于对照,而不抗寒品种YL6在低温处理6 d时已低于对照水平。
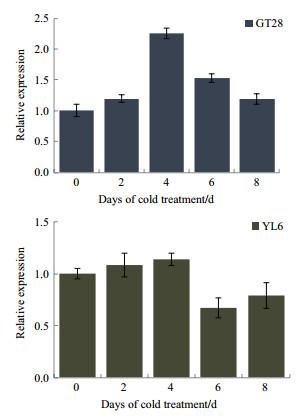
|
| 图 6 甘蔗ScAPX1在低温胁迫下的表达分析 |
抗坏血酸过氧化物酶(APX)是一类广泛存在于高等植物、藻类和少数蓝细菌中的亚铁血红素蛋白,其中,在高等植物中已报道有4种不同细胞定位的APX同工酶:叶绿体中的基质APX(sAPX)、类囊体APX(tAPX)、微体APX(mbAPX)和胞质APX(cAPX)[23],其在抗氧化防御系统中清除H2O2,降低植物体内活性氧的含量,提高植物应对逆境胁迫等方面发挥着重要作用。前人研究显示,APX编码蛋白相对分子质量大约为30 kD,多数以单体或二聚体形式存在[24]。本研究从甘蔗叶片中克隆得到甘蔗ScAPX1,该基因编码蛋白的生物信息学分析结果显示,其相对分子质量为27.40 kD,这与前人从高粱中推导的APX蛋白相对分子质量(27.1 kD)相似[7]。本研究氨基酸序列同源比对结果显示,甘蔗ScAPX1 与高粱的氨基酸序列同源性最高,达98%;陈国强等[7]有关高粱APX蛋白序列结构分析表明,其不含信号肽,疏水性弱,属于亲水蛋白,定位于细胞质概率大,第33-34位氨基酸序列是其酶活区域,第155-165位氨基酸序列是其亚铁血红素配基结合区域,二级及三级结构预测含有较多的不规则卷曲和α螺旋,三级结构上呈椭球体。黄菲等[12]参考水稻OsAPX2序列,运用电子克隆的方法获得甘蔗抗坏血酸过氧化物酶基因S-APX2,氨基酸结构预测中两者的等电点、分子量等均不同,且其为疏水性蛋白,具有信号肽,为分泌蛋白,无跨膜结构域,亚细胞定位线粒体。王竹青等[13]克隆得到的甘蔗抗坏血酸过氧化物酶基因(ScAPX)为亲水性蛋白,无信号肽,不存在跨膜螺旋区,为非分泌蛋白,亚细胞定位在线粒体基质和叶绿体基质的概率比较高。而本研究中,生物信息学预测分析显示ScAPX1是一个可溶性蛋白,不含信号肽序列,无跨膜结构,定位于细胞质,这与已报道的高粱过氧化物酶(APX)基因,其ORF为753 bp,编码250个氨基酸,无信号肽,属于亲水蛋白,推测其定位于细胞质的结论非常相似,均属于胞质型APX,推测与黄菲等[12]和王竹青等[13]克隆得到的S-APX2和ScAPX属于APX家族的不同成员。本研究中,二级结构预测表明,第33-44位氨基酸序列为抗坏血酸过氧化物酶近端活性位点,第155-165位氨基酸序列为抗坏血酸过氧化物酶近端血红素配体结构序列,进一步为甘蔗ScAPX1和高粱APX具高度同源性提供了佐证,也为进一步研究该基因的功能提供一定基础性资料。
本研究通过qRT-PCR分析ScAPX1在2个不同抗寒性的甘蔗品种叶片中的表达差异,发现其表达均呈先上升后下降趋势,这与前人在不同的植物逆境系统如丹参[24]、毛白杨[25]、蓬莱[26]中研究APX的表达结果相似,王利军等[27]用SA对葡萄处理,蒋明等[28]用SA对青花菜处理以及王竹青等[13]接种黑粉菌对抗、感基因型甘蔗处理,APX的表达量均有不同程度上升。但表达量存在差异,抗寒强的品种GT28在低温胁迫过程中,ScAPX1的表达量随着胁迫时间延长而增加,持续胁迫其表达量下降,但达到重度胁迫时ScAPX1表达量仍高于对照;而不抗寒品种YL6在胁迫6 d时其含量已低于对照,说明ScAPX1的表达与低温胁迫存在明显的关系,并且ScAPX1的诱导表达还与甘蔗品种本身的抗寒性密切相关,在整个胁迫过程中抗寒性强的品种该基因的表达量始终高于抗寒性较弱的品种。曾秀存等[11]研究表明,在低温胁迫下APX的表达量和酶活性均提高,超强抗寒性品种陇油7号APX表达量及酶活性高于抗寒性弱的耐寒品种天油4。有研究表明甘蔗在黑穗病菌胁迫下,抗黑穗病品种崖城05-179的酶活性全程明显高于对黑穗病敏感的柳城03-182[13]。杨树在遭真菌性溃疡病菌侵染后体内APX酶活性的变化也得出相似的结论[29],即APX酶活性在抗病品种中明显高于感病品种。由此推测,ScAPX1与其他APX的功能相似,在生物或非生物逆境胁迫中均发挥积极的作用。
目前,APX在植物抗逆中的作用已经引起越来越多的关注。本研究只探讨了ScAPX1低温胁迫下的表达模式,下一步将深入研究甘蔗ScAPX1在不同组织、不同逆境条件下的实时表达、揭示其表达强度与抗逆相关性,了解ScAPX1逆境应答的机理。
4 结论克隆获得ScAPX1(GenBank登录号为KC794939),其包含一个759 bp的完整开放阅读框,编码252个氨基酸。ScAPX1无跨膜结构,与高粱氨基酸的同源性为98%,推测其为胞质型抗坏血酸过氧化物酶基因。ScAPX1能够积极响应低温等逆境胁迫,在甘蔗抗寒胁迫过程中起到增强甘蔗抗寒性的作用。
| [1] |
杨淑慎, 高俊凤. 活性氧、自由基与植物的衰老[J]. 西北植物学报, 2001, 21(2): 215-220. |
| [2] |
Mittler R. Oxidative stress, antioxidants and stress tolerance[J]. Trends in Plant Science, 2002, 7(9): 405-410. DOI:10.1016/S1360-1385(02)02312-9 |
| [3] |
Apel K, Hirt H. Reactive oxygen species:metabolism, oxidative stress, and signal transduction[J]. Annual Review of Plant Biology, 2004, 55(4): 373-399. |
| [4] |
Tognolli M, Penel C, Greppin H, et al. Analysis and expression of the class Ⅲ peroxidase large gene family in Arabidopsis thaliana[J]. Gene, 2002, 288(1/2): 129-138. |
| [5] |
Teixeira FK, Menezes-Benavente L, Galvão VC, et al. Rice ascorbate peroxidase gene family encodes functionally diverse isoforms localized in different subcellular compartments[J]. Planta, 2006, 224(2): 300-314. DOI:10.1007/s00425-005-0214-8 |
| [6] |
Chen YP, Wang HZ, Wang X, et al. Cloning and expression of peroxisomal ascorbate peroxidase gene from wheat[J]. Molecular Biology Reports, 2006, 33(3): 207-213. DOI:10.1007/s11033-005-4536-1 |
| [7] |
陈国强, 孟鹏, 刘李黎, 等. 高粱抗坏血酸过氧化物酶基因的电子克隆及序列分析[J]. 生物信息学, 2011, 9(2): 125-130. DOI:10.3969/j.issn.1672-5565.2011.02.007 |
| [8] |
Pereira CS, da Costa DS, Teixeira J, et al. Organ-specific distribution and subcellular localisation of ascorbate peroxidase isoenzymes in potato(Solanum tuberosum L.)plants[J]. Protoplasma, 2005, 226(3/4): 223-230. |
| [9] |
Chen H, Li LL, Xu F, et al. Cloning, characterization and expression analysis of a cytosolic ascorbate peroxidase gene(APX)from Ginkgo biloba[J]. Journal of Fruit Science, 2013, 30(2): 214-221. |
| [10] |
刘娜, 吴金华, 安亚茹, 等. 陆地棉抗坏血酸过氧化物酶基因家族全基因组生物信息学分析[J]. 棉花学报, 2017, 29(1): 17-28. |
| [11] |
曾秀存, 孙万仓, 方彦, 等. 白菜型冬油菜抗坏血酸过氧化物酶(APX)基因的克隆、表达及其活性分析[J]. 作物学报, 2013, 39(8): 1400-1408. |
| [12] |
黄菲, 张云鹤, 李雪梅. 甘蔗抗坏血酸过氧化物酶的电子克隆及生物信息学分析[J]. 沈阳师范大学学报:自然科学版, 2013, 31(2): 295-300. |
| [13] |
王竹青, 陈云杨, 玉婷, 等. 甘蔗抗坏血酸过氧化物酶基因(ScAPX)的克隆及表达分析[J]. 农业生物技术学报, 2015, 23(2): 170-180. DOI:10.3969/j.issn.1674-7968.2015.02.004 |
| [14] |
Wang YJ, Wisniewski M, Meilan R, et al. Overexpression of cytosolic ascorbate peroxidase in tomato confers tolerance to chilling and salt stress[J]. Journal of the American Society for Horticultural Science, 2005, 130(2): 167-173. DOI:10.21273/JASHS.130.2.167 |
| [15] |
Singh N, Mishra A, Jha B. Over-expression of the peroxisomal ascorbate peroxidase(SbpAPX)gene cloned from halophyte salicornia brachiate confers salt and drought stress tolerance in transgenic tobacco[J]. Marine Biotechnology, 2014, 16(3): 321-332. DOI:10.1007/s10126-013-9548-6 |
| [16] |
Pang CH, Li K, Wang BS. Overexpression of SsCHLAPXs confers protection against oxidative stress induced by high light in transgenic Arabidopsis thaliana[J]. Physiol Plant, 2011, 143(4): 355-366. DOI:10.1111/j.1399-3054.2011.01515.x |
| [17] |
郭明欣, 何先锋, 邵玉涛. 高粱抗蚜反应中抗坏血酸过氧化物酶基因(Sb002G431100)的表达模式分析[J]. 种子, 2018, 37(2): 10-13. |
| [18] |
张木清, 陈如凯. 甘蔗抗寒性的研究Ⅱ.种茎低温处理幼苗叶片几种酶的变化[J]. 福建农学院学报, 1993, 22(1): 23-27. |
| [19] |
陆思思, 李素丽, 李琼, 等. 低温胁迫对不同抗寒性甘蔗品种节间几种酶活性的影响[J]. 西南农业学报, 2013, 26(3): 968-972. DOI:10.3969/j.issn.1001-4829.2013.03.026 |
| [20] |
孙波, 刘光玲, 杨丽涛, 等. 甘蔗幼苗根系形态结构及保护系统对低温胁迫的响应[J]. 中国农业大学学报, 2014, 19(6): 71-80. |
| [21] |
何静丹, 李志刚, 覃铃铃, 等. 自然降温对不同生长期甘蔗生理生化指标的影响[J]. 南方农业学报, 2011, 42(10): 1189-1192. DOI:10.3969/j.issn.2095-1191.2011.10.005 |
| [22] |
张保青, 杨丽涛, 李杨瑞. 自然条件下甘蔗品种抗寒生理生化特性的比较[J]. 作物学报, 2011, 37(3): 496-505. |
| [23] |
Shigeoka S, Ishikawa T, Tamoi M, et al. Regulation and function of ascorbate peroxidase isoenzymes[J]. Journal of Experimental Botany, 2002, 53(372): 1305-1319. DOI:10.1093/jexbot/53.372.1305 |
| [24] |
韩立敏.丹参APX和GPX基因克隆及其表达分析[D].西安: 陕西师范大学, 2007.
|
| [25] |
李娜.毛白杨APX基因的克隆及表达分析[D].北京: 北京林业大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10022-1011134972.htm
|
| [26] |
马长乐, 王萍萍, 曹子谊, 等. 盐地碱蓬(Suaedasalsa)APX基因的克隆及盐胁迫下的表达[J]. 植物生理与分子生物学学报, 2002, 28(4): 261-266. |
| [27] |
王利军, 黄卫东, 战吉成. 水杨酸和高温锻炼与葡萄抗热性及抗氧化的关系[J]. 园艺学报, 2003, 30(4): 452-454. DOI:10.3321/j.issn:0513-353X.2003.04.018 |
| [28] |
蒋明, 张志仙, 袁菱婧. 青花菜抗坏血酸过氧化物酶基因BoAPX2的克隆与表达分析[J]. 植物病理学报, 2012, 42(4): 374-380. DOI:10.3969/j.issn.0412-0914.2012.04.005 |
| [29] |
王媛, 梁军, 张星耀. 抗、感病杨树与溃疡病菌互作中活性氧及相关酶的动态[J]. 南京林业大学学报:自然科学版, 2008, 32(5): 41-46. |




