2. 江西农业大学医院,南昌 330045
2. Affiliated Hospital of Jiangxi Agricultural University, Nanchang 330045
随着世界人口的快速增长以及工业化水平的不断提高,传统化石能源的逐年消耗对人类社会的发展构成了严重威胁[1];而且传统化石能源是一种不可再生资源,其已探明的储量有限,因此世界各国对于可持续绿色能源的需求也日益增加[2-4]。生物柴油因其可持续再生而备受关注[5]。生物柴油是一种由动物脂肪和植物油转制加工而成的绿色燃料。微藻因其具有光合效率高、生长速度快以及总脂含量较高等优点而被公认为是生物柴油制造原料的一种极佳选择[6]。优良的藻种是提高微藻生物柴油生产性能的重要保障[7],因此建立一种简便、高效、快速的总脂含量测定方法对高总脂含量藻种的高通量筛选以及微藻高密度培养就显得尤为重要[8]。目前可查阅的文献中有很多关于微藻总脂含量的测定[8-9],但在已开展的测定方法中传统的方法诸如重量法、有机溶剂提取法等,虽然能较为准确地测量出油脂含量,但均需先将细胞中的油脂提取出来,此过程费时费力,不利于实际生产。随着科学技术的发展,许多更为高效的方法正得到广泛的关注,这些方法不需要对油脂进行提取,测量简便,而且可以进行快速、高效的测定。本文将从化学和物理方法两方面简要概述近年来广泛开展的微藻油脂测定方法的基本原理,并对其各自的优缺点进行比较,以期为广大研究者提供一定价值的参考。
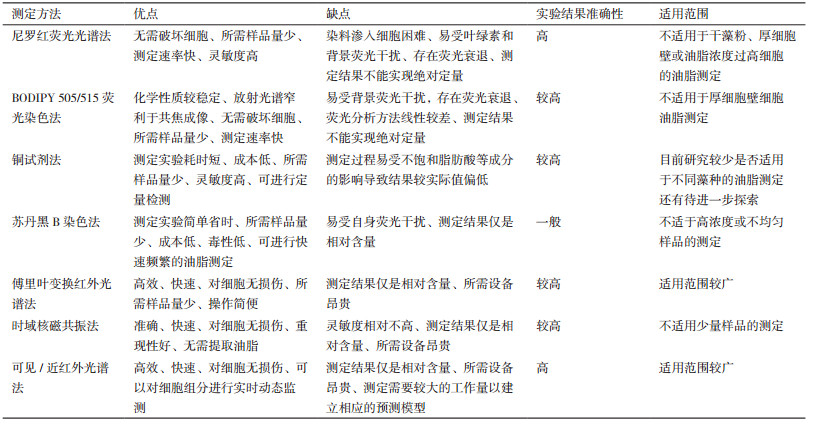
1 化学测定方法 1.1 尼罗红荧光光谱法尼罗红(9-diethylamino-5H-benzo[α]phenoxa-zine-5-one)是一种脂溶性的荧光染料,它经常用于测定不同微生物的脂类含量。尼罗红极易溶于有机溶剂且在有机溶剂中具有很强的荧光特性,它可以进入微藻细胞内与脂类(尤其是中性脂)结合,通过荧光显微镜或流式细胞仪检测到它在特定波长激发下发出的荧光检测信号[10],并以此来计算细胞内中性脂含量。其荧光强度与细胞内的中性脂含量呈线性关系[11],因此可以构建油脂含量和荧光强度的回归方程,由此来测定微藻细胞的油脂含量。曹素娟等[12]为探究快速高通量测定三角褐指藻油脂含量的方法,通过对三角褐指藻的油脂含量(x)与荧光强度(y)进行回归分析发现,两者相关性较好(R2 = 0.925),实验结果表明可以利用尼罗红荧光光谱法测定三角褐指藻的油脂含量,且与传统的有机溶剂提取法相比,尼罗红荧光光谱法具有无需对细胞进行破坏、所需样品量少、测定速率快、灵敏度高等优点[13]。丛峰等[14]对几种小球藻油脂含量检测方法进行了比较,结果显示,尼罗红荧光光谱法对湿藻粉所测得的油脂含量为12.5 ± 0.921%,其结果与其他测定方法所得结果基本一致。
然而,尼罗红荧光光谱法在实际实验过程中也存在一些不足之处,比如,此法对细胞壁较厚的微藻测定效果较差,测定结果易受尼罗红或藻液浓度大小的影响甚至染色时间和温度也会对测定结果造成干扰。所以许多研究者在使用此法进行微藻油脂含量测定之前,大多都会对其染色条件进行优化,以此来增加细胞壁或细胞膜的通透性从而提高染色效率。Chen等[15]在研究过程中发现,通过对染色条件进行优化来测定微藻油脂含量,与优化前的方法比较,优化后的测定结果与重量法测定结果相关性很高(R2 =0.998)。其优化后的条件为:20% DMSO(V/V),尼罗红染料浓度为0.5 μg/mL,染色10 min,激发波长为530 nm,发射波长为575 nm。Storms等[16]为测定小球藻中中性油脂的含量,对染色条件进行优化,首先利用乙醇作为溶剂,并且在测定荧光强度的过程中借助96孔板增加样本的容量,结果显示,所测的荧光强度和小球藻油脂含量具有很强的相关性。虽然优化后尼罗红荧光光谱法能够有一个较好的测定结果,但由于尼罗红自身的光谱特性对环境极性较为敏感,在一定程度上限制了其使用。
1.2 BODIPY 505/515荧光染色法氟硼荧又称氟化硼络合二吡咯甲川类化合物,(Boron-dipyrromethene,BODIPY 505/515),也是一种脂溶性的荧光染料,能够对活细胞内油滴进行染色,在激发光照射下会产生绿色荧光,通过对其荧光信号进行检测进而对细胞油脂含量进行测定。BODIPY 505/515相较于尼罗红而言,其渗透性与稳定性更好,即使在光照条件下也不易光解,而且其放射光谱较窄,有利于共焦成像,更利于实验观察[17]。Koreivienė[18]对尼罗红和BODIPY 505/515两者在微藻油脂含量测定方面的优缺点进行了比较,表明BODIPY 505/515对微藻进行染色后,其荧光更稳定,染色速率更快,染色受细胞壁的厚度影响更小,而且对于中性脂肪酸的选择性也强于尼罗红。Rumin等[19]讨论了尼罗红和BODIPY 505/515两者在诸如光谱特性、染料浓度、细胞浓度、染色温度和培养温度等方面的区别发现,无论是尼罗红或BODIPY 505/515对油脂的测定相较于传统的重量法,均具有十分显著的优点。但在实际应用中,它们的测定结果依旧会受到诸如染色时长、溶剂种类等因素影响,因此如何减少这些因素的影响,还有待进一步的研究。
1.3 铜试剂法最初铜试剂法是用来测定少量铜离子的方法,此法中所用的铜试剂为二乙基二硫代氨基甲酸钠[Sodium diethyldithiocarbamate,(C2H5)2NCSSNa·3H2O]。铜试剂作用原理是因为它可与铜离子在碱性溶液中发生颜色反应,生成黄棕色络合物,通过氯仿对此络合物进行萃取,然后在440 nm波长处测定其OD值,从而获得铜离子含量[20]。Wawrik等[21]在此原理基础上,并结合氯仿测定脂肪酸的技术,建立了一种利用铜试剂来测定微藻总脂含量的方法;该方法的具体测定过程如下:首先将微藻油脂皂化,随后将铜试剂加入到皂化后的溶液中,待成盐后,再用含二乙基二硫代氨基甲酸钠的氯仿进行萃取,皂化物在遇到二乙基二硫代氨基甲酸钠后会发生颜色反应,变成黄棕色,其在440 nm波长处有最大吸收,通过测量440 nm波长处的OD值,从而获得微藻的油脂含量。作者通过对小球藻和三角褐指藻细胞内的油脂进行测定,计算得出其产率分别为12.0 ± 0.56%、9.40 ± 1.77%。与传统油脂测定方法相比,铜试剂法所需样品量少,且具有耗时短(可以在2 h内完成大约30个样品的测定)、灵敏度很高、成本低(每次测定成本不足5美元)等优点,因此,此种方法不失为一种理想的微藻油脂测定方法。但在研究过程中,作者通过对各个脂肪酸的摩尔消光系数进行对比发现,铜试剂法会因为不饱和脂肪酸或者相关化学修饰(酮基和氨基酸结构)的影响而导致检测结果偏低[21]。同时,值得注意的是,目前关于此法测定其他藻种油脂含量的报道相对也较少,因此此种方法测定不同藻种油脂含量的有效性还需大量的实验进行进一步论证。
1.4 苏丹黑B染色法苏丹黑B是一种脂溶性的染色剂,它不仅价格低廉而且毒性非常微弱,能够与脂质特别是中性脂相结合而形成黑色或黑蓝色络合物,在645 nm波长处下有最大吸收峰,此吸收值的大小与细胞总脂含量呈显著线性相关,因此通过测定细胞经染色后的吸光值A645,再将其代入相应的线性方程中,即可计算出细胞内油脂含量,因此苏丹黑B被广泛地用于真菌、酵母、动物细胞内的油脂含量的检测[22-23]。Ren等[24]通过苏丹黑B染色法对不同生理状态的小球藻细胞的油脂含量进行测定,结果显示,经苏丹黑B染色后所得的吸光度值与油脂含量呈极显著相关(P < 0.001),表明苏丹黑B染色法用于微藻油脂含量测定的可行性。金雪洁等[25]以两株淡水小球藻为研究对象,对苏丹黑B染色法进行优化来提高染色效果,结果表明,微藻细胞的油脂含量与吸光值存在良好的线性关系,测得的油脂含量与传统方法测得的结果非常接近,表明苏丹黑B染色法对微藻油脂含量测定切实可行。彭悦等[26]采用此法对球等金鞭藻和小新菱形藻的油脂含量以及油脂积累过程油脂含量的快速检测进行了探究,结果表明,苏丹黑B染色法不仅对微藻油脂的含量检测具有较高的准确度,而且能快速频繁地对油脂含量进行测定。虽然苏丹黑B染色法在微藻油脂含量测定中有广泛的应用,但苏丹黑B染色法本身也存在一定的局限性,即当样品浓度过高或样品不够均匀时,苏丹黑B染色法的检测效果就不够理想,同时苏丹黑B染色后脂滴呈现蓝黑色观察起来会有误差,并且苏丹黑B染色法只能测定油脂的相对含量[27]。因此,如何减少自身荧光的干扰将是促进此法发展的关键。
2 物理测定方法 2.1 傅里叶变换红外光谱法傅里叶变换红外光谱法(Fourier transform infrared spectroscopy,FTIR)是微藻油脂含量检测的较理想的方法之一。FTIR法的基本原理是:物质会在红外光谱的特定区域内产生伸缩振动,形成特定的吸收峰,而后在干涉仪的作用下形成的干涉光会与微藻油脂作用形成干涉信号,再对这些信号进行傅里叶变换,形成相关的光谱图,通过对光谱图中相关吸收峰的位置和形状等信息进行分析,从而对物质含量进行测定[28]。FTIR法具有是高效、快速、所需样品量少、操作简便等特点[28]。Giordano等[29]通过FTIR法测定在氮浓度变化过程中牟氏角毛藻细胞内总脂、蛋白质和碳水化合物等的变化,结果表明FTIR法不仅对于总脂含量的测定很有效果,而且对于测定单细胞生物成分也十分可靠。Jyoti等[30]通过此法对不同地区的藻种细胞内的油脂、蛋白质以及碳水化合物进行测定,也得出了与Giordano等一致的结论。Dean等[31]利用此法对两种淡水藻进行细胞内脂类和碳水化合物的含量进行测定,得出的结果表明,FTIR法不仅是一种高效快速测定油脂的方法,也是测量其他组分的高效方法。陈小妹等[32]通过FTIR法对在不同氮浓度条件下的产油微藻细胞内蛋白质、总脂和碳水化合物等相关生化组分进行测定,结果显示最终总脂含量在低氮组达到最高(为66.1%),蛋白质和碳水化合物在高氮组达到最高,分别为13.05 g/L和23.36 g/L,与传统方法测得的结果都呈现了很好的相关性(R蛋白质2=0.953,R总脂2=0.982,R碳水化合物2=0.903),上述实验表明FTIR法不仅是一种有效测定微藻细胞内总脂含量的方法,还是一种测定细胞内生化组分的可靠的方法。但Jyoti等[30]研究显示重量法作为一种绝对定量的油脂测量方法,其测定结果可以做到绝对定量且较FTIR法更高,更准确,也从侧面说明FTIR法存在着一定的不足。从上述各项研究表明尽管FTIR法是一种十分高效、无损的油脂测定方法,但因其测定的是微藻中油脂的相对含量,同时测定值也相对偏小,且测定设备价格较为昂贵等,从而限制了此法在微藻油含量测定中的应用。
2.2 时域核磁共振法时域核磁共振技术(Time-Domain nuclear mag-netic resonance,TD-NMR)作为一种方便的物质测定方法,其在微藻生物柴油领域得到了越来越广泛的应用[33]。TD-NMR是通过脉冲将一段高能量的射频信号施加到样品上,在静磁场中样品的氢原子核发生能级跃迁,在一定时间内氢原子核从激发态恢复到平衡状态(此过程称为弛豫过程,它所需时间称为弛豫时间)并同时产生衰减信号,根据衰减信号的强度和信号衰减速率,可以区分脂质和其他氢核信号,并且以此测量脂质含量,更通俗而言就是根据氢质子在不同物质中弛豫时间不同来测量油脂含量[34]。Gao等[35]分别用TD-NMR和尼罗红荧光光谱法对原壳小球藻的总脂含量进行测定,结果表明,这两种方法均切实可行,且与常用的重量法相比更为简单,而且核磁共振法实验结果与重量法实验结果拟合的R2为0.997,因此作者认为TD-NMR法是一种准确、快速测量微藻油脂含量的方法。刘婷婷等[36]利用TD-NMR法,建立了一种直接测定微藻干藻粉和培养基中小球藻油脂含量的方法,其信号强度和油脂含量存在线性关系,无论是干藻粉还是藻液,它们油脂含量与信号强度拟合后的R2均高于0.99,具体分别为0.997和0.998。上述研究结果表明该方法对于微藻油脂含量检测的准确性和可行性,但因TD-NMR技术灵敏度的原因,此法仍需要较大的生物量才能准确地检测出油脂含量,不过相较于传统的油脂测定方法而言,TD-NMR法具有准确、快速、无损、重现性高、无需提取油脂等优点。因此,其在油脂测量方面将具有美好的应用前景。
2.3 可见/近红外光谱法可见/近红外(Vis/Near infrared spectrum instru-ment,NIRS)光谱技术是利用分子振动从基态向高能级跃迁产生的谱线进行检测的技术。可见/近红外光谱技术可以检测特定波长处的光谱信息,根据光谱的特征,并结合化学计量学方法就可以对样品进行定量或定性的分析[37]。魏萱等[38]采用NIRS技术获取了不同光源培养条件下的小球藻生长过程中油脂动态变化和油脂含量分布的光谱信息,通过与干重法获取的油脂含量建立多元线性回归预测模型,预测的相关系数R2达到0.940,表明NIRS技术可以实现对微藻内油脂含量的快速无损检测。Brown等[39]借助NIRS技术对产油微藻的油脂含量以及生物量进行检测,通过对这些物质的信息进行整合,开发了用于检测总生物量和油脂含量的模型,对于一些藻种油脂含量的检测,模型都给出了很好的检测效果(R2 ≥ 0.960),而且Brown在研究中还发现,此法可以进行快速的油脂检测,每天检测的样品可多达200余份,说明此法作为微藻油脂检测的高效性。但由于此法在微藻油脂测定方面的应用还处在发展阶段,在检测过程中,需要大量的样品及工作量来建立数据库,因此要完善此法的实际使用,还需要微藻研究者之间相互合作、数据共享,建立一个更为全面的图谱数据库,以完善此法的实际应用。
3 总结与展望由于微藻生物柴油具有可持续、高产油率、低能耗等诸多优势,微藻生物质柴油已经成为生物能源研究中的热点方向之一。建立一种高效、准确的微藻油脂测定方法对于快速筛选出高油脂含量藻株,以及对微藻培养过程进行优化以提高其产油能力是实现微藻生物质柴油能源化利用的关键。高效快速的油脂含量测定方法可以有效解决传统微藻油脂含量测定方法过程中效率低、耗时长、步骤繁杂、污染大等问题。本文以目前微藻筛选及培养过程中几种常见的高效快速的测定方法为例,介绍了其测定微藻油脂含量的基本原理以及具体的实际应用,同时对各种方法的优缺点、准确性、适用性等进行了比较。
从表 1可知,无论是化学方法或是物理方法都各有优劣,化学法多要借助荧光染料或专用的化学试剂,物理法则需要借助相应的仪器;化学法因无需购买昂贵的仪器测定所需总体成本相对物理法更低,但物理法却可以借助仪器实现更高效更快速的实验;而与传统的油脂测定方法相比,这些测定方法具有步骤简便、结果准确、测定快速等优势,但在实际应用中,还存在一些问题。例如,尼罗红等荧光染料在水溶液中的稳定性、红外光谱检测结果的可重复性问题,上述问题也是未来有关优化微藻油脂快速测定的方向和重点。针对这些问题研究者可以通过对染料本身进行改性,在不改变其自身的光学性质情况下,增强其稳定性,同时减少荧光淬灭;此外,可以通过结合化学计量学方法解决红外光谱检测结果的重复性问题。然而在实际操作中,即使对单一测定方法进行了优化和改进,仍然会存在一定的局限性。因此,若未来在微藻油脂的高通量测定过程中能在优化的基础上再通过与多种方法相结合,优势互补,以满足不同实验过程的测定需求,从而建立起一套快速、科学、高效的微藻油脂高通量测定方法,以加快高油脂含量微藻藻株的选育过程及提高微藻生物柴油的生产性能,微藻生物柴油工业将具有广泛的应用前景。
| [1] |
Gatamaneni BL, Orsat V, Lefsrud M. Factors affecting growth of various microalgal species[J]. Environmental Engineering Science, 2018, 35(10): 1037-1048. |
| [2] |
Faried M, Samer M, Abdelsalam E, et al. Biodiesel production from microalgae:Processes, technologies and recent advancements[J]. Renewable and Sustainable Energy Reviews, 2017, 79: 893-913. |
| [3] |
Živković SB, Veljković MV, Banković-Ilić IB, et al. Technological, technical, economic, environmental, social, human health risk, toxicological and policy considerations of biodiesel production and use[J]. Renewable and Sustainable Energy Reviews, 2017, 79: 222-247. |
| [4] |
Japar AS, Takriff MS, Yasin NHM. Harvesting microalgal biomass and lipid extraction for potential biofuel production:A review[J]. Journal of Environmental Chemical Engineering, 2016, 5(1): 555-563. |
| [5] |
Shomal R, Hisham H, Mlhem A, et al. Simultaneous extraction-reaction process for biodiesel production from microalgae[J]. Energy Reports, 2019, 5: 37-40. |
| [6] |
Goh BHH, Ong HC, Cheah MY, et al. Sustainability of direct biodiesel synthesis from microalgae biomass:A critical review[J]. Renewable and Sustainable Energy Reviews, 2019, 107: 59-74. |
| [7] |
胡文军, 罗玮, 李汉广, 等. 产油微藻筛选和鉴定及其产油性能的研究[J]. 中国生物工程杂志, 2012, 32(12): 66-72. |
| [8] |
Wei D, Yuan XY, Xiang WZ. Comparison of methods for rapid determination of total lipid content in microalgae[J]. Modern Food Science & Technology, 2014, 30(7): 242-246. |
| [9] |
Silva MTLD, Reis A. Biodiesel production from microalgae methods for microalgal lipid assessment with emphasis on the use of flow cytometry[M]// Gordon R, Seckbach J. The Science of Algal Fuels. Lisbon: Springer Netherlands, 2012: 255-267.
|
| [10] |
Greenspan P, Fowler SD. Spectrofluorometric studies of the lipid probe, Nile Red[J]. Journal of Lipid Research, 1985, 26(7): 781-789. |
| [11] |
蒋晓艳, 王婉玉, 钟敏, 等. 裂殖壶菌胞内油脂尼罗红荧光染色快速检测方法的研究[J]. 中国油脂, 2016, 41(1): 51-55. |
| [12] |
曹素娟, 柳科欢, 任玲萱, 等. 快速高通量测定三角褐指藻油脂含量[J]. 四川大学学报:自然科学版, 2018, 55(6): 1331-1336. |
| [13] |
Orr V, Rehmann L. Improvement of the Nile Red fluorescence assay for determination of total lipid content in microalgae independent of chlorophyll content[J]. Journal of Applied Phycology, 2015, 27(6): 1-9. |
| [14] |
丛峰, 孙雪, 徐年军. 几种小球藻油脂含量检测方法的比较及优化[J]. 宁波大学学报:理工版, 2012, 25(1): 20-23. |
| [15] |
Chen W, Zhang C, Song L, et al. A high throughput Nile Red method for quantitative measurement of neutral lipids in microalgae[J]. Journal of Microbiological Methods, 2015, 77(1): 41-47. |
| [16] |
Storms ZJ, Cameron E, De LHSH, et al. A simple and rapid protocol for measuring neutral lipids in algal cells using fluorescence[J]. Journal of Visualized Experiments Jove, 2014(87): e51441. |
| [17] |
郝翠翠, 梁成伟, 石蕾. 尼罗红和BODIPY荧光染料在微藻油脂含量测定中的应用[J]. 生物学杂志, 2017, 34(1): 70-74. |
| [18] |
Koreivienė J. Microalgae lipid staining with fluorescent BODIPY dye[J]. Methods in Molecular Biology, 2017. DOI:10.1007/7651.2017-101 |
| [19] |
Rumin J, Bonnefond H, Saintjean B, et al. The use of fluorescent Nile red and BODIPY for lipid measurement in microalgae[J]. Biotechnology for Biofuels, 2015, 8(1): 42. |
| [20] |
石玉新, 穆迪, 武洪庆, 等. 微藻油脂含量的几种快速测定方法[J]. 安徽农业科学, 2012, 40(21): 11067-11069. |
| [21] |
Wawrik B, Harriman BH. Rapid, colorimetric quantification of lipid from algal cultures[J]. Journal of Microbiological Methods, 2010, 80(3): 262-266. |
| [22] |
Subramaniam HN, Chaubal KA. Evaluation of intracellular lipids by standardized staining with a Sudan Black B fraction[J]. Journal of Biochemical & Biophysical Methods, 1990, 21(1): 9-16. |
| [23] |
Thakur MS, Prapulla SG, Karanth NG. Estimation of intracellular lipids by the measurement of absorbance of yeast cells stained with Sudan Black B[J]. Enzyme and Microbial Technology, 1989, 11(4): 252-254. |
| [24] |
Ren J, Lang XY, Liu ZY, et al. Rapidly determinating relative lipid level of Chlorella vulgaris sp. by three dyeing methods[J]. Journal of Agricultural Biotechnology, 2015, 23(7): 967-972. |
| [25] |
金雪洁, 巩三强, 夏金兰, 等. 苏丹黑B染色法原位检测2株淡水小球藻胞内油脂累积[J]. 中南大学学报:自然科学版, 2014, 45(8): 2547-2552. |
| [26] |
彭悦, 刘玉莹, 祁艳霞, 等. 微藻油脂含量不同测定方法的比较研究[J]. 大连海洋大学学报, 2015, 30(5): 455-460. |
| [27] |
杜秀秀, 房志家, 陈忠翔, 等. 酵母中性脂快速检测及积累动态分析[J]. 生物技术通报, 2014(8): 208-214. |
| [28] |
李贵丽, 韩志萍, 魏晓奕, 等. 能源微藻油脂积累及油脂含量检测技术研究进展[J]. 广东农业科学, 2018, 45(10): 134-142. |
| [29] |
Giordano M, Kansiz M, Heraud P, et al. Fourier transform infrared spectroscopy as a novel tool to investigate changes in intracellular macromolecular pools in the marine microalga Chaetoceros muellerii(Bacillariophyceae)[J]. Journal of Phycology, 2010, 37(2): 271-279. |
| [30] |
Jyoti S, Smitas K, Narsi RB, et al. Screening and enrichment of high lipid producing microalgal consortia[J]. Journal of Photochemistry and Photobiology B:Biology, 2019, 192(3): 8-12. |
| [31] |
Dean AP, Sigee DC, Estrada B, et al. Using FTIR spectroscopy for rapid determination of lipid accumulation in response to nitrogen limitation in freshwater microalgae[J]. Bioresource Technology, 2010, 101(12): 4499-4507. |
| [32] |
陈小妹, 张敬键, 吕雪娟, 等. FTIR法快速测定产油微藻细胞内生化组分[J]. 生物技术, 2013, 23(2): 60-65. |
| [33] |
Sarpal AS, Teixeira CMLL, Silva PRM, et al. NMR techniques for determination of lipid content in microalgal biomass and their use in monitoring the cultivation with biodiesel potential[J]. Applied Microbiology and Biotechnology, 2016, 100(5): 2471-2485. |
| [34] |
曹玉坡, 刘义军, 黄晖, 等. 应用低场核磁共振技术测定腰果仁中的含油量[J]. 食品与发酵科技, 2016, 52(5): 71-74. |
| [35] |
Gao C, Wei X, Zhang Y, et al. Rapid quantitation of lipid in microalgae by time-domain nuclear magnetic resonance[J]. Journal of Microbiological Methods, 2008, 75(3): 437-440. |
| [36] |
刘婷婷, 王涛, 杨翼, 等. 低场核磁共振技术快速检测小球藻油脂含量及其在高通量选育中的应用[J]. 生物工程学报, 2016, 32(3): 385-396. |
| [37] |
刘京华, 陈军, 秦松, 等. 红外光谱在微藻领域的应用研究进展[J]. 光谱学与光谱分析, 2019, 39(1): 79-86. |
| [38] |
魏萱, 蒋璐璐, 赵艳茹, 等. 小球藻生长过程脂肪含量动态变化快速无损检测方法研究[J]. 光谱学与光谱分析, 2016, 36(5): 1352-1357. |
| [39] |
Brown MR, Frampton DMF, Dunstan GA, et al. Assessing near-infrared reflectance spectroscopy for the rapid detection of lipid and biomass in microalgae cultures[J]. Journal of Applied Phycology, 2014, 26(1): 191-198. |