2. 西北民族大学生命科学与工程学院,兰州 730030
2. College of Life Science and Engineering, Northwest Minzu University, Lanzhou 730030
促卵泡激素(Follicle stimulating hormone,FSH)是从垂体前叶嗜碱性细胞中合成并分泌的一种促性腺物质[1-2],它属于糖蛋白激素家族,其分子结构由α、β两个可解离的亚基以非共价键结合构成,种属间存在差异[3-5]。FSH与膜受体结合激活腺苷酸环化酶,进而促使环磷酸腺苷反应元件结合蛋白CREB(cAMP-response element binding protein,CREB)发生磷酸化[6],从而增加了P450芳香化酶的转录,促进了结缔组织生长因子(Connective tissue growth factor,CTGF)的表达,而CTGF进一步促进了卵泡颗粒细胞的生长与分化,促使卵泡生成发育[7-8]。另外FSH与膜受体结合后还可促进黄体生成激素(Luteinizing hormone,LH)受体的产生,LH作用于细胞内膜,可产生睾酮或者十九碳底物-雄烯二酮,它们在活化的芳香酶作用下转变为雌激素(17-β雌二醇),雌激素进一步诱导促性腺激素生成及排卵[9]。
目前促卵泡激素被用于家禽的超数排卵与胚胎移植工作,我国在引进种羊繁殖的过程中,就使用促卵泡激素增进种羊种群的快速繁殖[10]。我国畜用FSH多数是从垂体中提取的,但是从垂体中提取FSH代价高昂,对工艺要求较高,感染病毒的风险较大[11-13]。医用FSH一般是采用尿源性的FSH,即从绝经期妇女尿液中提取,纯度仅为95%,其中5%的杂质源自尿液中残留的一些成分,这些成分大都具有蛋白性质,会影响FSH的生物学活性[14]。并且尿源性FSH生产成本依旧较高,如果进一步提高纯度,成本会更加昂贵,所以畜用FSH采用该种方式的可能性非常小。近年来,随着分子生物学的快速发展,基因重组技术逐渐趋于成熟,因此使用重组DNA技术生产FSH成为可能,这解决了我国畜用FSH成本高昂的问题并且为下一步工业化应用奠定了基础。
1 材料与方法 1.1 材料E.coli BL21感受态细胞,CHO-K1全悬浮细胞(命名为CHO-K1-S2)均由西北民族大学生物医学研究中心提供。DNA ladder购自北京中科瑞泰生物科技有限公司;ExRed核酸染料购自北京庄盟国际生物基因科技有限公司;高纯质粒小提中量试剂盒购自北京天根生化科技有限公司;限制性内切酶BamH I、EcoR I均购自宝日医生物技术(北京)有限公司;绵羊促卵泡激素ELISA检测试剂盒购自武汉云克隆科技股份有限公司;孕酮ELISA检测试剂盒、促黄体生成激素ELISA检测试剂盒均购自武汉伊莱瑞特生物科技股份有限公司;促卵泡激素蛋白标准品购自武汉优尔生商贸有限公司;SFM4-CHO培养基购自兰州百灵生物技术有限公司;G418购自美国Gibco公司;电转染缓冲液、pmaxGFPTM Vector购自瑞士Lonza公司;超滤膜包购自美国PALL公司;6周龄雌鼠购自甘肃华瑞祥和生物科技有限公司。
1.2 方法 1.2.1 重组FSH设计及合成从NCBI数据库中获取绵羊FSH-α(GenBank:NM_001009464.1)和绵羊FSH-β(GenBank:NM_001009798.1)的核苷酸序列。经在线信号肽分析工具分析FSH-β核苷酸序列中前1-18位为信号肽,在信号肽序列前加入Kozark序列用来增强真核基因的翻译效率,并加入102 bp的N4(4个N连糖基化位点)核苷酸序列作为Linker来连接FSH-β和FSH-α,同时上游加入酶切位点BamH I,下游加入酶切位点EcoR I,与真核表达载体pcDNA3.1进行连接,序列设计完成后由南京金斯瑞公司进行密码子优化并合成重组表达质粒。
1.2.2 重组质粒pcDNA3.1-FSHβα的酶切、测序鉴定将重组质粒pcDNA3.1-FSHβα用BamH I和EcoR I限制性内切酶进行双酶切验证,酶切体系如下:DEPC H2O 30 μL,10×K buffer 5 μL,BamH I 2.5 μL,EcoR I 2.5 μL,重组质粒10 μL,37℃恒温水浴中酶切4 h。并将重组质粒经由上海生工进行测序,测序正确后提取高纯质粒备用。
1.2.3 重组质粒pcDNA3.1-FSHβα电转染CHO-K1-S2细胞采用电转染法将重组质粒pcDNA3.1-FSHβα转染至CHO-K1-S2细胞中,同期设置对照组,对照质粒为pmaxGFP。平衡阶段:将CHO-K1细胞专用电转试剂置于室温平衡30 min;细胞培养板中加入完全培养基,置于37℃培养箱中进行预热。吸取活力≥95%,密度为2×106个cells/mL的CHO-K1-S2细胞1 mL于900 r/min离心10 min。于1支新的EP管中加入电转液:82 μL Volume of Nucleofector Solution和18 μL Volume of Supplement混匀备用。收集细胞,加入上述混匀的电转液,轻轻吹打混匀,再加入4 μg质粒,立即将混合液转入电转杯中进行电转。电转完成后加入完全培养基,将电转液和细胞吸至预平衡好的6孔板中,置于37℃ 5% CO2培养箱中培养,48 h后使用荧光倒置显微镜对细胞进行观察,并取细胞上清进行ELISA检测。
1.2.4 CHO-K1-S2-FSH单克隆细胞筛选将细胞以每孔2 000个接种至96孔培养板,加入400 µg/mL G418进行初步筛选。15 d后观察,寻找形成细胞群落的孔,并取细胞上清进行ELISA检测,将初筛得到的细胞命名为CHO-K1-S2-FSH。之后将初筛后的细胞接种至24孔培养板,并加入400 µg/mL G418加压培养。待视野中细胞汇合度达到约90%后,用不含G418的培养基稀释细胞,按1个细胞每孔接种于96孔培养板中,第2天进行观察,对状态良好的细胞再次进行加药筛选。培养7 d左右再次进行观察,得到单克隆细胞。经ELISA试剂盒检测,将FSH表达量高的细胞进行扩大培养,并冻存。其余孔细胞合为一瓶,进行扩大培养,并冻存。
1.2.5 单克隆细胞的生物反应器培养将成功筛选得到的FSH表达量高的单克隆细胞以5×105个/mL的接种量在生物反应器上放大培养,培养总体积为3 L。参数设置为:pH值7.2,温度37℃,溶氧40%,转速160 r/min。白天为自动控制溶氧即dO2保持在40%左右,夜间采取培养液表面通空气的方法,防止细胞缺氧。在整个培养过程中,每间隔12 h进行细胞计数,并吸取1 mL细胞上清液进行ELISA检测,测定FSH浓度,直至检测到细胞中FSH表达量开始出现下降趋势时即可停止培养,并收取细胞上清于-20℃保存。
1.2.6 重组绵羊FSH蛋白超滤将10 kD的膜包安装在超滤设备上,通入0.1 mol/L的NaOH将膜包清洗20 min,然后用纯水继续清洗10 min,通入1.2.5中收取的含有重组绵羊FSH的上清运行20 min,收集滤过部分与未滤过部分,并做好标记。通入纯水清洗10 min,更换为0.1 mol/L NaOH清洗20 min,最后封住管路,使0.1 mol/L NaOH充满整个膜包。
1.2.7 重组绵羊FSH小鼠试验经BLAST比对本研究设计的重组绵羊FSH蛋白与小鼠FSH蛋白的同源性可达85%,因此选择小鼠对重组绵羊FSH蛋白的生物活性进行检测。共分为5组:200 ng/mL小鼠FSH蛋白标准品作为阳性对照组(PC),生理盐水作为阴性对照组(NC),50 ng/mL重组绵羊FSH组,100 ng/mL重组绵羊FSH组,200 ng/mL重组绵羊FSH组。采取皮下多次注射的方法免疫小鼠,注射一次后,间隔48 h再次进行注射,72 h后进行眼球采血,收集到的血样4 000 r/min离心5 min,获取血清,用ELISA试剂盒检测血清中LH和孕酮(Pro-gesterone,Pg)含量。随后解剖获取小鼠卵巢,于体式显微镜下进行拍照并称重,比较各组之间的差异。
1.2.8 统计学分析采用GraphPad Prism 5.0软件进行统计学处理。试验数据用均数±标准差(x±s)表示,采用单因素ANOVAs进行分析。以P < 0.05为差异有统计学意义(*P < 0.05;** P < 0.01;*** P < 0.001)。
2 结果 2.1 重组表达质粒pcDNA3.1-FSHβα的酶切、测序验证重组质粒pcDNA3.1-FSHβα经双酶切鉴定(BamH I/ EcoR I),得到798 bp的插入片段和5 428 bp的载体片段,酶切后的目的基因的大小和载体的大小均符合预期(图 1)。测序结果显示重组质粒pcDNA3.1-FSHβα与NCBI数据库中FSH的核苷酸序列同源性为100%,说明重组质粒构建成功。
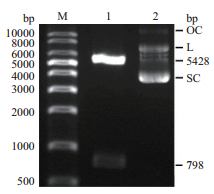
|
| M:DNA Ladder;1:重组质粒pcDNA3.1-FSHβα的双酶切产物;2:重组质粒pcDNA3.1-FSHβα 图 1 重组质粒pcDNA3.1-FSHβα的双酶切验证 |
重组表达质粒pcDNA3.1-FSHβα电转染至CHO-K1-S2细胞中,同期设置pmaxGFP作为对照。转染48 h后,使用荧光倒置显微镜对试验组及对照组细胞进行观察,结果显示,转染48 h后对照组绿色荧光信号很强,表明此次转染效率达标(图 2),试验组细胞上清经ELISA检测有重组FSH的表达,表达量为130.16 ng/mL。说明重组表达质粒pcDNA3.1-FSHβα在CHO-K1-S2细胞中成功分泌表达。
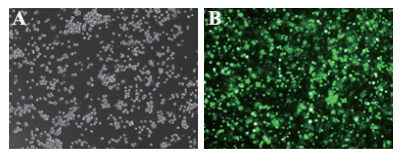
|
| A:重组质粒pcDNA3.1-FSHβα;B:pmaxGFP组 图 2 转染48 h后的CHO-K1-S2细胞 |
使用400 µg/mL G418加压筛选CHO-K1-S2-FSH单克隆细胞,具体方法见1.2.4,经过筛选得到19株单克隆细胞,分别命名为M-FSH-βα-B31A7,M-FSH-βα-B31A8,M-FSH-βα-B31B3,M-FSH-βα-B31B4,M-FSH-βα-B31B6,M-FSH-βα-B31B8,M-FSH-βα-B31C6,M-FSH-βα-B31C7,M-FSH-βα-B31D7,M-FSH-βα-B31E8,M-FSH-βα-B31F6,M-FSH-βα-B31F8,M-FSH-βα-B31G7,M-FSH-βα-B31G10,M-FSH-βα-B32B3,M-FSH-βα-B32B8,M-FSH-βα-B32C2,M-FSH-βα-B32G3(图 3)。并对单克隆细胞的上清液进行ELISA检测(表 1),筛选出蛋白高表达的单克隆细胞,最终我们选择单克隆细胞CHO-K1-S2-FSHβα-B31A4进行后续试验。
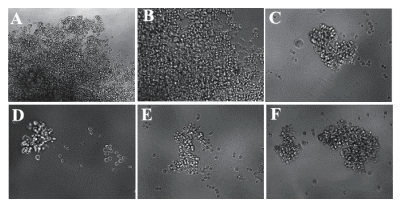
|
| A:M-FSHβα-B31A4;B:M-FSHβα-B31A7;C:M-FSHβα-B31A8;D:M-FSHβα-B31B3-E:M-FSHβα-B31B4-F:M-FSHβα-B31B6 图 3 单克隆细胞 |
将CHO-K1-S2-FSHβα-B31A4单克隆细胞进行生物反应器扩大培养,每间隔12 h测定细胞密度和FSH浓度,结果见图 4。此次培养周期中,细胞没有出现泡沫过多和细胞结团的现象,当培养到72 h时,表达的蛋白量出现下降趋势,此时细胞密度为3.87×106个cells/mL,蛋白表达量为297.97 ng/mL。此时进行收样,获取重组绵羊FSH。
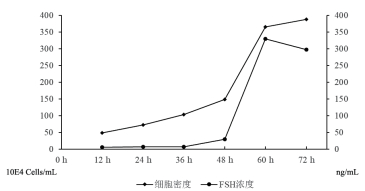
|
| 图 4 CHO-K1-S2-FSHβα-B31A4 5L生物反应器培养 |
对制备的重组绵羊FSH进行10 kD膜包超滤,超滤浓缩液进行ELISA检测,FSH浓度为531 ng/mL,提高了1.78倍,且浓度达到注射浓度。
2.6 重组FSH对小鼠卵巢重量的影响使用体式显微镜对小鼠卵巢进行观察并拍照(图 5),然后对卵巢进行称重,试验组小鼠卵巢重量较阴性对照组明显增加且差异显著(图 6),说明注射一定剂量的重组绵羊FSH蛋白可以促进卵巢生长。

|
| A,B,C为三组平行试验 图 5 小鼠卵巢(10×) |

|
| **P < 0.01,***P < 0.001 图 6 各组间小鼠卵巢重量 |
将采集到的各组小鼠血清用孕酮Pg和黄体生成激素LH的ELISA试剂盒分别进行检测,由结果可知(图 7-A、7-B),注射一定剂量的重组绵羊FSH(FSH浓度≥50 ng/mL)可以显著增加小鼠体内孕酮Pg和黄体生成激素LH的含量,各试验组之间不呈剂量依赖性,且与阳性对照组相比差异不显著。

|
| A:小鼠血清中孕酮含量的ELISA检测(***P < 0.001);B:小鼠血清中黄体生成激素LH含量的ELISA检测(***P < 0.001) 图 7 小鼠生殖激素的检测结果 |
基因工程手段表达FSH的关键是糖基化修饰,FSH只有经过糖基化修饰才具有生物活性[15]。如果使用原核表达FSH,蛋白能够成功表达,但是表达产物存在以下几点问题:(1)表达产物是包涵体,不利于获取蛋白;(2)在变性和复性过程中,二硫键不能全部复原,会影响空间构象;(3)原核生物无糖基化修饰功能。所以FSH的表达不能选用原核表达,只能选用真核表达系统。人类试管婴儿技术中,果纳芬(Gonal-F)和普丽康(Puregon)是最常见的促排卵药物,它们均运用了基因工程技术,将促卵泡激素FSH的基因导入CHO细胞真核表达系统中进行制备,并且目前上市的大部分复杂蛋白药物均由CHO细胞真核表达系统表达[16-19]。在真核表达系统中,表达双亚基结构的蛋白有两种方案:(1)将两种亚基的基因分别构建在两个载体上进行蛋白的表达;(2)将两种亚基的基因构建在同一个载体上进行蛋白的表达。果纳芬采用的是第一种方案,即将α亚基基因构建在携带DHFR的表达载体上,β亚基基因构建在正常表达载体上,然后共转染至DHFR缺陷型CHO细胞中,使用MTX进行单克隆细胞的筛选,从而筛选出表达量高、遗传稳定的重组人FSH表达细胞。普丽康采用的则是第2种方案,即将α和β两个亚基构建在同一载体pBR327上,该表达载体上携带有G418抗性基因和MT-ⅡA基因,然后转染至CHO细胞后使用G418进行筛选,从而获取生产所用的细胞[20]。
本研究采用第2种方案进行重组绵羊FSH的制备,同时为了增强真核基因的翻译效率,在信号肽序列前加入Kozark序列,并用N4核苷酸序列作为Linker来连接FSH-β和FSH-α。构建成功的重组表达质粒电转至CHO细胞后,采用G418加压筛选获取了高表达绵羊重组FSH蛋白的工程细胞。将生物反应器放大培养并超滤浓缩后获得的重组FSH免疫小鼠测定其生物活性,结果显示,当注射重组FSH后,小鼠卵巢重量增加,孕酮和黄体生成素均上调,但是重组FSH无明显的浓度依赖性,当浓度大于50 ng/mL时,重组FSH已经显著促进了孕酮和黄体生成素的产生。FSH一直在动物超数排卵、胚胎移植、繁殖育种和相关疾病治疗上有广阔的应用前景,并且由于目前我国畜用FSH生产成本极高,因此重组绵羊FSH将对工业化应用具有重大意义。
4 结论本研究成功构建了重组质粒pcDNA3.1-FSHβα,并实现其在全悬浮CHO-K1-S2细胞中分泌表达,经单克隆筛选获得FSH表达量高的细胞株,然后利用生物反应器进行扩大培养,收集上清超滤浓缩后获得重组绵羊FSH;之后将制备的重组绵羊FSH免疫雌鼠,结果显示注射重组绵羊FSH后小鼠卵巢体积增大、重量增加,并且小鼠血清中的黄体生成素LH和孕酮Pg含量均显著上调。这些结果均证明重组绵羊FSH对小鼠具有一定的生物活性。
| [1] |
John P, et al. Glycoprotein hormones:structure and function[J]. Annual Reviews of Biochemistry, 1981, 50: 465-495. |
| [2] |
Sandro S, Paola S, Chiara DE, et al. Evidence for expression and functionality of FSH and LH/hCG receptors in human endometrium[J]. Journal of Assisted Reproduction and Genetics, 2018, 35(9): 1703-1712. |
| [3] |
关洪斌, 李庆章. 卵泡刺激素研究进展[J]. 东北农业大学学报, 2002, 33(3): 209-212. |
| [4] |
Gharid D, Wierman E, et al. Molecular biology of the pituitary gonadotropins[J]. Endocrine Reviews, 1990, 11(1): 177-199. |
| [5] |
Clara L, Laura R, Samantha S, et al. Inferring biallelism of two FSH receptor mutations associated with spontaneous ovarian hyperstimulation syndrome by evaluating FSH, LH and HCG cross-activity[J]. Reproductive Biomedicine, 2019, 38(5): 816-824. |
| [6] |
王碧君, 郭艺红, 王笑, 等. PPARγ激动剂对多囊卵巢综合征患者颗粒细胞中细胞色素P450芳香化酶调控机制的研究[J]. 生殖与避孕, 2015, 35(6): 359-365. |
| [7] |
Harlow R, Bradshaw C, Rae T, et al. Oestrogen formation and connective tissue growth factor expression in rat granulosa cells[J]. Endocrinology, 2007, 192(1): 41-52. |
| [8] |
张彦明, 王建辰. 促卵泡及其在家畜产科中的应用[J]. 国外兽医学·畜禽疾病, 1983(3): 1-6. |
| [9] |
Gheorghiu ML. Actualities in mutations of luteinizing hormone(LH)and follicle-stimulating hormone(FSH)receptors[J]. Acta Endocrinologica, 2019, 5(1): 139-142. |
| [10] |
杨彦玲, 操玉平. 重组促卵泡激素对波尔山羊超数排卵效果的影响[J]. 中国草食动物科学, 2019, 39(1): 69-71. |
| [11] |
魏红芳, 赵金艳. 羊超数排卵的方法及影响其效果的因素[J]. 黑龙江畜牧兽医, 2010(1): 153-154. |
| [12] |
郝海生, 耿少旺, 陈余, 等. 不同FSH对和牛超数排卵效果的影响[J]. 中国牛业科学, 2014, 40(2): 34-37. |
| [13] |
华荣茂, 曾斌. FSH研究进展[J]. 江西科技师范大学学报, 2014(6): 7-12. |
| [14] |
张建辉, 高竞. 女性闭经后萎缩性尿道炎患者血清FSH、LH、PRL检验的临床意义分析[J]. 中国性科学, 2017, 26(6): 53-55. |
| [15] |
Wang H, Butnev V, Bousfield GR, et al. A human FSHB transgene encoding the double N-glycosylation mutant(Asn7Δ Asn24Δ)FSHβ subunit fails to rescue Fshb null mice[J]. Molecular and Cellular Endocrinology, 2016, 426: 113-124. |
| [16] |
曹敏, 王俊玲, 吴彦卓, 等. 重组人卵泡刺激素的研究进展[J]. 药物生物技术, 2014, 21(1): 86-90. |
| [17] |
Fauser BC, et al. Advances in recombinant DNA technology:corifollitropin alfa, a hybrid molecule with sustained follicle-stimulating activity and reduced injection frequency[J]. Human Reproduction Update, 2009, 15(3): 309-321. |
| [18] |
Jazayeri SH, Amiri-Yekta A, et al. Comparative assessment on the expression level of recombinant human follicle-stimulating hormone(FSH)in serum-containing versus protein-free culture media[J]. Molecular Biotechnology, 2017, 59: 490-498. |
| [19] |
Omasa T, Onitsuka M, Kim WD. Cell engineering and cultivation of Chinese hamster ovary(CHO)cells[J]. Current Pharmaceutical Biotechnology, 2010, 11(3): 233-240. |
| [20] |
Olijve W, Boer WD, et al. Molecular biology and biochemistry of human recombinant follicle stimulating hormone(Puregon)[J]. Molecular Human Reproduction, 1996, 2(5): 371-382. |





