2. 扬州大学兽医学院 江苏省转基因动物制药工程研究中心,扬州 225009
2. Jiangsu Provincial Research Center for Animal Transgenesis and Biopharming, College of Veterinary Medicine, Yangzhou University, Yangzhou 225009
动物转基因技术渗透于细胞生物学、发育生物学、基因工程等各领域,在遗传育种、性状改良、抗病和建立疾病模型等方面都具有不可比拟的优势[1-3]。通过体细胞核移植技术制备的转基因动物普遍都含有新霉素磷酸转移酶基因(Neo)[4]、嘌呤霉素乙酰转移酶基因(Puro)、绿色荧光蛋白基因(GFP)等[5]标记基因,主要用于转基因阳性细胞克隆筛选。然而,标记基因存在于表达载体的某些部位可能会对外源基因的表达产生干扰,对受体动物的生长以及生物安全产生诸多不利的影响,Pham等[6]证实标记基因(PGK-Neo)整合到基因敲除的小鼠染色体之后,破坏了基因座上相关基因的表达,最终产生异常的表型;Rucker等[7]将Neo基因放在bcl-x基因的启动子前,电转染整合到小鼠体内,结果雌雄后代均出现了精原细胞、滤泡数减少及不育等生殖缺陷,通过Cre重组酶去掉Neo基因后,bcl-x基因恢复了正常的表达。因此,有必要对标记基因进行删除,以消除潜在的生物安全隐患。
Cre/Loxp系统首先发现于噬菌体[8]。该系统包含两部分,即Cre重组酶和Loxp位点。Cre重组酶能够识别特异性的Loxp核苷酸序列,不需借助任何的辅助因子,不需要消耗能量,通过其酪氨酸残基与该序列结合,然后在特定位点对该序列进行剪切[9],不受切割片段长度及所处染色体位置的限制。因此,该系统广泛的应用于转基因研究中的部分DNA序列删除,同时可在哺乳动物细胞水平删除基因组上的标记基因,具有高效、快速、便捷等诸多优点[10-12]。但是,目前大多数研究集中在成纤维细胞和动物个体,兰翀等[13]利用Cre/Loxp系统删除转基因山羊耳尖成纤维细胞标记基因,吴慧[14]利用Cre/Loxp系统删除转基因绒山羊胎儿成纤维细胞标记基因,获得的细胞株用于生产转基因克隆绒山羊个体、周期长。而本实验选取的山羊乳腺上皮细胞作为研究对象,可在细胞水平诱导表达筛选、周期短,在国内外较少见报道。
本研究通过Cre/Loxp系统瞬时表达Cre重组酶,删除hLF转基因山羊乳腺上皮细胞中的Neo标记基因,彻底消除其潜在的生物安全性风险,并以此探索Cre/Loxp删除效率以及删除标记基因前后乳腺上皮细胞诱导功能基因表达量的变化,旨在建立一套高效便捷的山羊乳腺上皮细胞标记基因删除系统,为不同转基因细胞中标记基因的删除积累经验,为进一步扩大生产无标记基因的转基因山羊及其它动物奠定基础。
1 材料与方法 1.1 材料 1.1.1 质粒PBS185质粒(含CMV启动子、GFP基因)和BLC14质粒由本实验室保存(包含Loxp位点,图 1)。

|
| 箭头所示为剪切位点;方框所示为Cre酶识别序列 图 1 BLC14载体和Cre酶特异性识别的Loxp位点 |
PCR引物设计借助于Primer 5.0软件完成,引物(表 1)由上海生工生物有限公司合成。
DMEM/F12(Sigma,Cat No.D2906)、FBS(Hyclone,Cat No.SH30070.03)、Electroporation Buffer(Eppendorf,Cat No.940002150)、Hydrocortisone(Sigma,Cat No.H-0888)、Transferrin(Sigma,Cat No.T-1283)、Insulin(Sigma,Cat No.I-5500)、Trypsin(Amresco,Cat No.0458)、Proteinase K(Sigma,Cat No.P6556)、Ethanolamine(Sigma,Cat No. 411000)、青链霉素(Hyclone,Cat No. SV30010)、去内毒素质粒提取试剂盒(Promega,Cat No. A1223)、鼠抗hLF单克隆抗体(Santa Cruz,sc-53498)、羊抗鼠单克隆抗体IgG-HRP(Santa Cruz,sc-2005)、各种内切酶(宝生物工程)、口控式移卵针(自制)(图 2),其余化学试剂购自上海生工生物有限公司、国药集团化学试剂有限公司及Sigma-Aldrich公司。
|
| 图 2 自制口控式移卵针 |
hLF转基因奶山羊乳腺上皮细胞(通过核移植制备的人乳铁蛋白转基因克隆山羊,以BLC14为载体,整合外源基因hLF)取自扬州大学兽医学院转基因动物制药工程研究中心。
乳腺上皮细胞培养液:DMEM/F12 15.6 mg/mL,NaHCO3 1.2 mg/mL,乙酸钠5 mmol/L,转铁蛋白5 µg/mL,乙醇胺0.5 mmol/L,胰岛素10 µg/mL,氢化可的松5 µg/mL,青霉素100 U/mL,链霉素100 µg/mL,10% FBS(pH 7.2-7.4)。
1.2 方法 1.2.1 山羊乳腺上皮细胞的复苏、纯化、传代从液氮中取出原代hLF转基因山羊乳腺上皮细胞,迅速置于37℃水浴溶解,D-Hank’s溶液清洗2次后,细胞计数并用乳腺上皮细胞培养液调整密度至1×106个/mL接种于六孔板内,置于37℃、5%CO2、饱和湿度的培养箱内静置培养。第2天,D-Hank’s溶液清洗去除死亡漂浮细胞,添加培养液继续培养。待细胞长至80%左右时,弃去原有培养液,用D-Hank’s清洗细胞2次,加入胰蛋白酶消化液,消化1-5 min,待大部分的成纤维细胞漂浮脱落,而乳腺细胞没有变化时,用吸管轻轻吹打,弃去消化液与浮起的成纤维细胞,剩余的细胞添加新鲜的胰蛋白酶继续消化5 min,添加培养液终止,吹打并收集细胞计数1×106个/mL,六孔板内进行传代培养。
1.2.2 PBS185质粒转染hLF转基因细胞系取PBS 185菌种100 μL接种至50 mL灭菌LB内,37℃扩增10 h,经内毒素质粒纯化试剂盒提纯质粒,稀释浓度至100 μg/mL。0.1% Trypsin-0.04% EDTA的消化液收集对数生长期的山羊乳腺上皮细胞,用电转染液洗涤离心后,重悬调整密度至1×106个/mL,添加PBS185纯化质粒,使其终浓度为20 μg/mL,在径宽2 mm的电转染杯内,以2 kV/cm、250 μs的条件电击2次,静置3 min,转移到正常的乳腺上皮细胞培养液内,接种六孔板,置于37℃、5%CO2、饱和湿度的培养箱内静置培养。
1.2.3 单克隆细胞株的获取转染后按1×106个/mL细胞密度接种六孔板24 h后,清洗更换培养液去除大部分漂浮未贴壁细胞,隔天换液一次,培养至10-14 d左右,荧光倒置显微镜(IX-71,Olympus,日本)下可观察到绿色荧光细胞集落(PBS185质粒含GFP),即单克隆细胞形成。0.1% Trypsin-0.04% EDTA消化乳腺上皮细胞,使用口控式移卵针挑取单克隆细胞,置于48孔板、37℃、5%CO2、饱和湿度的培养箱内静置培养。
1.2.4 细胞株的PCR检测待单克隆细胞长满至80%左右时,收集部分细胞悬液,2 500 r/min离心5 min,弃上清,加入10 μL细胞裂解液,重悬细胞,45℃孵育45 min、96℃孵育15 min后可直接作为PCR模板,共设计3对引物用于检测标记基因是否删除,引物序列。经PCR检测删除标记基因的细胞株及时进行细胞传代和冻存。
1.2.5 ELISA检测删除标记基因的细胞株传代至24孔板进行培养,至细胞汇集约60%时,添加含5μmol/L催乳素进行功能基因的诱导表达,同时设置未删除标记基因的转基因细胞作为对照,72 h后收集细胞诱导液。使用鼠抗hLF单克隆抗体作为一抗(sc-53498,Santa Cruz)、羊抗鼠单克隆抗体IgG-HRP(sc-2005,Santa Cruz)作为二抗进行ELISA检测[15-16],显色后酶标仪测定OD450值,并绘制曲线、计算hLF表达量。
1.2.6 Western Blot检测收集细胞诱导液,取30 μL诱导液和6 μL 6×SDS-PAGE电泳上样缓冲液混匀,煮沸10 min,冷却后,按照常规方法进行12% SDS聚丙烯酰胺凝胶电泳(SDS-PAGE)[15-17]。通过转移缓冲液(1.93 g/L tris,9 g/L glycine)将蛋白转移至PVDF膜上,250 mA,转印4 h。超纯水冲洗后,37℃封闭(20 mmol/L Tris,137 mmol/L NaCl,0.1% Tween-20,10% FBS,pH 7.6),3 h。加入一抗稀释液(1:1 000稀释,鼠抗hLF单克隆抗体,sc-53498,Santa Cruz),37℃孵育2 h。TTBS(20 mmol/L tris,137 mmol/L NaCl,1% Tween-20,pH 7.6)洗涤3次后,加入二抗-HRP稀释液(1:2 000稀释,羊抗鼠单克隆抗体IgG-HRP,sc-2005,Santa Cruz)中,37℃孵育2 h。取出PVDF膜,PBS洗净后,添加显色液(DAB 50 mg,0.05 mol/L TB100 mL,30 μL 30% H2O2,pH7.6),室温15 min,晾干后拍照、记录并保存。
2 结果 2.1 乳腺上皮细胞的复苏、纯化与传代培养未纯化的山羊乳腺上皮细胞混杂着大量的成纤维细胞生长(呈梭形长条状或旋涡状)(图 3-A),通过胰蛋白酶消化纯化后培养的山羊乳腺上皮细胞呈现典型的短梭形或鹅卵石状(图 3-B)。

|
| A:未纯化的山羊乳腺上皮细胞;B:纯化后的乳腺上皮细胞。GFFC:山羊胎儿成纤维细胞;GMEC:山羊乳腺上皮细胞 图 3 山羊乳腺上皮细胞的培养(100×) |
收集细胞裂解进行细胞PCR检测。其中DRB引物用于检测细胞基因组经裂解后是否完整,若基因组完整则PCR能扩增出大小为276 bp的条带(图 4);hLF-Neo引物用于检测标记基因Neo是否删除,若正确删除标记基因则扩增不出条带,反之则扩增出1 158 bp大小条带,如图 5所示,10#、11#、12#细胞株未见条带,疑似删除标记基因;hLF-BLG为跨标记基因引物,如果得到的产物为2 056 bp则标记基因仍然存在;如果得到的条带为667 bp则标记基因已删除,如图 6所示,10#、11#、12#三株单克隆细胞株均出现667 bp条带,故判断该3株细胞为成功删除标记基因的细胞株。本实验总共检测细胞株18株,实际获得删除细胞系3株(单克隆10#、11#、12#),删除效率为16.7%(3/18)。

|
| 1-18:转染PBS185质粒的单克隆乳腺上皮细胞基因组;19:正常细胞基因组;20:BLC14质粒;21:空白对照(PBS);M:DL 2000 Marker 图 4 DRB引物检测乳腺上皮细胞转PBS185单克隆细胞基因组 |
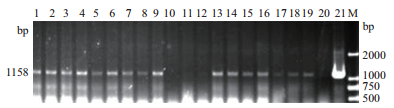
|
| 1-18:转染PBS185质粒的单克隆乳腺上皮细胞基因组;19:未转染PBS185质粒的单克隆乳腺上皮细胞基因组;20:正常细胞基因组;21:BLC14质粒;M:DL 2000 Marker 图 5 hLF-NEO引物检测乳腺上皮细胞转PBS185单克隆细胞的标记基因删除 |
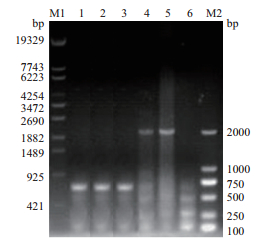
|
| 1:10#单克隆细胞;2:11#单克隆细胞;3:12#单克隆细胞;4、5:未删除标记基因的纯化转基因细胞;6:正常非转基因细胞;M2:DL 2000 Marker 图 6 hLF-BLG引物检测乳腺上皮细胞转染PBS185单克隆 |
以人乳清标准品浓度(g/L)作为横坐标、OD450值作为纵坐标,制作标准曲线(图 7),根据曲线计算ELISA检测结果显示:删除标记基因的单克隆细胞株(10#、11#、12#)表达hLF水平分别为2.73 g/L、2.82 g/L、2.85 g/L,最高表达水平可达2.85 g/L,而未删除标记基因的转基因山羊乳腺上皮细胞(已纯化)表达hLF水平约0.35 g/L,删除标记基因后的细胞株表达水平高出约8倍,说明标记基因的删除明显地提高了外源基因hLF的表达量。
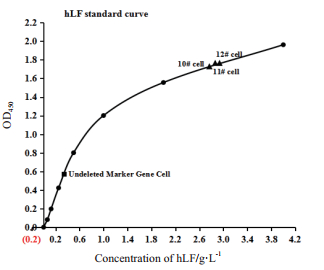
|
| 人乳清标准品浓度分别是0、0.0625、0.125、0.25、0.5、1.0、2.0和4.0 g/L 图 7 细胞诱导液中hLF浓度检测曲线图 |
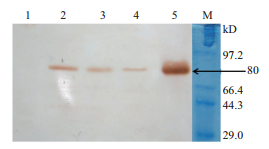
删除标记基因后的单克隆细胞株诱导表达的Western Blot检测结果如图 8所示,出现约80 kD大小的条带,与目标蛋白hLF蛋白条带大小一致。
|
| 1:正常乳腺上皮细胞诱导液(已纯化);2:12#单克隆细胞诱导液;3:11#单克隆细胞诱导液;4:10#单克隆细胞诱导液;5:人乳清(hLF内参蛋白);6:Protein marker 图 8 删除标记基因的乳腺上皮细胞诱导表达的hLF检测 |
Cre/Loxp系统是一种高效的基因删除系统,在P1噬菌体内被发现,目前已成功的应用于酵母,植物及哺乳动物身上[9, 18-19]。本实验选取含有Cre/Loxp系统的表达质粒PBS185在山羊乳腺上皮细胞内也能够较好地诱导表达出Cre重组酶,但与以往的基因转染研究不同[16],此次我们选择的质粒转染后瞬时表达。瞬时表达是近年来发展的一种基因快速表达的有效方法,由Dillen等[20]首先在植物中成功运用。瞬时表达相比于传统的整合表达,是一种相对独立的表达系统,当外源基因进入细胞表达相关蛋白后,很快就会发生降解,不会遗传给后代,同时具有快速,简便,周期短,安全等显著优点[21-22]。
山羊乳腺上皮细胞具有诱导表达功能,可使用催乳素等诱导[16],国内外尚未见在山羊乳腺上皮细胞中进行删除标记基因的研究,多数集中在成纤维细胞的研究[13-14]。本研究在细胞水平利用Cre/Loxp系统删除标记基因,并诱导山羊乳腺上皮细胞表达来检测删除标记基因前后功能蛋白hLF的表达差异,这一项研究在国内外较少见报道。山羊乳腺上皮细胞是一种分化程度很高的终末分化细胞,对培养条件有严格的要求[16, 23]。据有关文献报道[23-24],相比于胎儿成纤维细胞,乳腺上皮细胞生长缓慢、易老化、不宜传代培养,如果培养的乳腺细胞密度太低将会直接影响其生长和增殖。本研究中采用一种新颖的单克隆细胞株获取方法,即利用自制的口控式移卵针挑取单克隆细胞。口控式移卵针包含吸头、滤器、硅胶管和玻璃移卵针等几部分构成,通常用于胚胎操作的卵母细胞转移[16],本实验室长期从事胚胎研究工作具有一定的技术经验积累,将这一技术用于细胞单克隆的挑取,尤其是山羊乳腺上皮细胞单克隆的挑取,是一种大胆的创新尝试。这样可以缩短胰酶消化时间、增加单克隆细胞的纯度,从而提高细胞的活力,更利于传代培养。
本研究中选择的是hLF转基因乳腺上皮细胞作为研究对象,其取自于通过核移植制备的转基因克隆山羊,随机整合了乳腺特异性表达人乳铁蛋白(hLF)的载体BLC14[25]。结果显示总共获得65株细胞,检测其中状态较好的18株单克隆细胞,最终确定有3株(10#、11#、12#)成功地删除了标记基因Neo,删除效率为16.7%(3/18),后期我们将进一步扩大删选细胞株,进行大量删选以期获得更多的标记基因删除细胞株。值得注意的是我们在PCR检测过程中,我们应用双重引物进行筛选,即经hLF-Neo引物检测没有条带的细胞系理论上应为删除标记基因的细胞株,同时还应用hLF-BLG引物进一步检测,确保标记基因完全删除,实验结果证明了该引物检测的准确性(3株细胞均为标记基因删除细胞株)。此外,关于标记基因删除效率的研究报道较多见,兰翀等[13]对选择标记基因(SMGs)的删除效率研究、Cui等[26]对红色荧光标记基因DsRed和绿色荧光标记基因GFP的删除与置换效率的研究,删除效率均超过50%以上。但是,较少有研究者在乳腺上皮细胞中进行标记基因删除研究,尤其是对删除标记基因前后的表达水平相关研究更少。本实验通过ELISA和Western bolt检测首次研究标记基因删除前后的功能蛋白hLF表达情况。从结果来看,删除标记基因的细胞株表达hLF水平明显提高至8倍左右,表达hLF量高达2.85 g/L,而经过胰蛋白酶纯化后的未删除标记基因的细胞株表达水平仅约0.35 g/L。可能是BLC14乳腺特异性表达构建中的标记基因Neo对hLF基因表达造成较大的影响,这与很多的研究报道中阐述的标记基因本身对外源基因表达会产生一系列影响相吻合[6-7, 27]。同时,本研究中删除标记基因的3株细胞表达hLF量存在一定的微小差异,可能是因为不同的单克隆细胞株虽然来源相同,外源基因拷贝数也相同,但是单克隆细胞的纯度及后期细胞生长状态均有可能存在一定的差异所致。此外,由于转基因中外源基因的表达受多种内在机制的调节影响,不能单独考虑某一特定因素,故本研究后期将进一步深入开展。
4 结论本研究采用转染后瞬时表达Cre重组酶的方法,利用Cre/Loxp系统成功删除hLF转基因山羊乳腺上皮细胞株的标记基因,最终成功获得3株完全删除标记基因的细胞株,且诱导表达检测删除标记基因后的hLF目的蛋白表达水平明显提高达8倍,表达hLF量达2.85 g/L。
| [1] |
Bertolini LR, Meade H, Lazzarotto CR, et al. The transgenic animal platform for biopharmaceutical production[J]. Transgenic Res, 2016, 25(3): 329-343. |
| [2] |
de la Peña JB, Dela Peña IJ, Custodio RJ, et al. Exploring the validity of proposed transgenic animal models of attention-deficit hyperactivity disorder(ADHD)[J]. Mol Neurobiol, 2018, 55(5): 3739-3754. |
| [3] |
Gu H, Li J, Ying F, et al. Analysis of differential gene expression of the transgenic pig with overexpression of PGC1α in muscle[J]. Mol Biol Rep, 2019. DOI:10.1007/s11033-019-04805-8 |
| [4] |
Afolabi AS, Worland B, Snape J, et al. Novel pGreen/pSoup dual-binary vector system in multiple T-DNA co-cultivation as a method of producing marker-free(clean gene)transgenic rice(Oriza sativa L)plant[J]. Afr J Biotechnol, 2005, 4(6): 531-540. |
| [5] |
Brakta S, Mas A, Al-Hendy A. The ontogeny of myometrial stem cells in OCT4-GFP transgenic mouse model[J]. Stem Cell Res Ther, 2018, 9(1): 333. |
| [6] |
Pham CT, Macivor DM, Hug BA, et al. Long-range disruption of gene expression by a selectable marker cassette[J]. Proceedings of the National Academy of Sciences of the United States of America, 1996, 93(23): 13090-13095. DOI:10.1073/pnas.93.23.13090 |
| [7] |
Rucker EB, Dierisseau P, Wagner KU, et al. Bcl-x and Bax regulate mouse primordial germ cell survival and apoptosis during embryogenesis[J]. Molecular Endocrinology, 2000, 14(7): 1038-1052. DOI:10.1210/mend.14.7.0465 |
| [8] |
McLellan MA, Rosenthal NA, Pinto AR. Cre-loxP-mediated recom-bination:general principles and experimental considerations[J]. Curr Protoc Mouse Biol, 2017, 7(1): 1-12. DOI:10.1002/cpmo.22 |
| [9] |
Xu C, Wang K, Ding YH, et al. Claudin-7 gene knockout causes destruction of intestinal structure and animal death in mice[J]. World J Gastroenterol, 2019, 25(5): 584-599. DOI:10.3748/wjg.v25.i5.584 |
| [10] |
Li Y, Chen S, Fang J, et al. Construction of an attenuated Tian Tan vaccinia virus strain by deletion of TA35R and TJ2R genes[J]. Virus Res, 2018, 256: 192-200. DOI:10.1016/j.virusres.2018.06.017 |
| [11] |
Ma Y, Yu L, Pan S, et al. CRISPR/Cas9-mediated targeting of the Rosa26 locus produces Cre reporter rat strains for monitoring Cre-loxP-mediated lineage tracing[J]. FEBS J, 2017, 284(19): 3262-3277. DOI:10.1111/febs.14188 |
| [12] |
Zhong Y, Huang W, Du J, et al. Improved Tol2-mediated enhancer trap identifies weakly expressed genes during liver and β cell development and regeneration in zebrafish[J]. J Biol Chem, 2019, 294(3): 932-940. DOI:10.1074/jbc.RA118.005568 |
| [13] |
兰翀, 任丽娜, 吴敏, 等. 利用Cre/LoxP系统删除转基因山羊体内的选择标记基因[J]. 生物工程学报, 2013, 29(12): 1847-1854. |
| [14] |
吴慧. Cre/loxp重组系统介导转基因绒山羊标记基因删除的研究[D].呼和浩特: 内蒙古大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10126-1014269802.htm
|
| [15] |
Song SZ, Ge X, Cheng YB, et al. High-level expression of a novel recombinant human plasminogen activator(rhPA)in the milk of transgenic rabbits and its thrombolytic bioactivity in vitro[J]. Mol Biol Rep, 2016, 43: 775-783. DOI:10.1007/s11033-016-4020-0 |
| [16] |
宋绍征.转基因兔乳腺特异性表达重组人纤溶酶原激活剂(rhPA)及其药效学研究[D].扬州: 扬州大学, 2015. http://cpfd.cnki.com.cn/Article/CPFDTOTAL-ZGXJ201610006063.htm
|
| [17] |
Song SZ, He ZY, Mei JY, et al. Affinity purification of recombinant human plasminogen activator from transgenic rabbit milk using a novel polyolresponsive monoclonal antibody[J]. Tropical Journal of Pharmaceutical Research, 2016, 15(5): 905-911. DOI:10.4314/tjpr.v15i5.2 |
| [18] |
Nguyen HN, Ishidoh KI, Kinoshita H, et al. Targeted cloning of a large gene cluster from Lecanicillium genome by Cre/loxP based method[J]. J Microbiol Methods, 2018, 150: 47-54. DOI:10.1016/j.mimet.2018.05.017 |
| [19] |
李秀, 高慧英, 杨小玉, 等. 基于LoxP-Cre系统的Ronin基因造血系统条件性敲除小鼠模型的构建及鉴定[J]. 军事医学, 2018, 42(9): 657-661. |
| [20] |
Dillen W, De Clercq J, Kapila J, et al. The effect of temperature on Agrobacterium tumefaciens-mediated gene transfer to plants[J]. Plant Journal, 1997, 12(6): 1459-1463. DOI:10.1046/j.1365-313x.1997.12061459.x |
| [21] |
Chang JC, Lee SJ, Kim JS, et al. Transient expression of foreign genes in insect cells(sf9)for protein functional assay[J]. J Vis Exp, 2018(132): e56693. |
| [22] |
Roberts R, Zhang J, Mihelich N, et al. Manipulation of oat protoplasts for transient expression assays[J]. Methods Mol Biol, 2017, 1536: 55-70. |
| [23] |
Liu J, Luo Y, Liu QQ, et al. Production of cloned embryos from caprine mammary epithelial cells expressing recombinant human beta-defensin-3[J]. Theriogenology, 2013, 79(4): 660-666. DOI:10.1016/j.theriogenology.2012.11.021 |
| [24] |
Xu HF, Luo J, Zhang XY, et al. Activation of liver X receptor promotes fatty acid synthesis in goat mammary epithelial cells via modulation of SREBP1 expression[J]. J Dairy Sci, 2019, 102(4): 3544-3555. DOI:10.3168/jds.2018-15538 |
| [25] |
袁玉国, 丁国梁, 安礼友, 等. 以经过转染的乳腺上皮细胞生产克隆羊[J]. 生物工程学报, 2009, 25(8): 1138-1143. DOI:10.3321/j.issn:1000-3061.2009.08.003 |
| [26] |
Cui WT, Ren LM, Hou J, et al. A model study:simulation of marker gene deletion and target gene replacement mediated by Cre/loxp system in cell line[J]. Progress in Biochemistry and Biophysics, 2008, 35(6): 650-660. |
| [27] |
Lv Y, Edwards H, Zhou J, et al. Combining 26s rDNA and the Cre-loxP system for iterative gene integration and efficient marker curation in yarrowia lipolytica[J]. ACS Synth Biol, 2019, 8(3): 568-576. |





