广藿香(Pogostemon cablin(Blanco)Benth.)为原产于菲律宾本土的唇形科植物,在中国的广东和海南有较大面积种植[1]。广藿香的干燥地上部分,为常用的芳香化湿中药,其味辛,性微温,归脾、胃、肺经,具有芳香化浊、发表解暑、和中止呕的作用[2]。广藿香中存在多种活性成分,其中,广藿香醇作为一种天然的倍半萜,为广藿香挥发油的主要成分。目前,广藿香的倍半萜合成途径研究较为清楚,其中,合成途径下游的广藿香法尼基焦磷酸酶(Fentanyl pyrophosphatase of patchouli,PatFPPS)催化生成法尼基焦磷酸(Farnesyl pyrophosphate,FPP),FPP又作为底物,最终催化生成萜类化合物广藿香醇[3-4]。因此,PatFPPS是广藿香醇合成途径的关键酶,是影响广藿香药效品质的的重要调控位点。
在植物细胞中,合成酶经常与其他蛋白互作结合,这些互作蛋白对酶的活性及功能起到重要影响,进而引起代谢物在含量和组成上的变化。另一方面,一些诱导子对萜类次生代谢具有显著的调控,茉莉酸甲酯(Methyl jasmonate,MeJA)作为外源性植物激素,能显著影响广藿香醇的含量[5],但是其具体的调节机制也未能得到解析。因此,开展广藿香醇合成下游关键酶的蛋白表达,进一步筛选互作蛋白,比较外源激素诱导的差异变化,有助于进一步阐明广藿香萜类药效化合物的合成分子调控机制。
为快速筛选目的蛋白的互作蛋白,GST Pull-Down是被证实可行高效的策略方法。其基本原理是将靶蛋白与GST融合并亲和固化在谷胱甘肽亲和树脂上,与总蛋白进行体外孵育,随后捕获与之相互作用的蛋白,洗脱结合物后联合质谱对互作蛋白进行鉴定[6]。赵文等[7]利用GST Pull-Down联合质谱技术,共筛选出31个只在PID3介导的抗稻瘟病反应中能与其特异结合的PID3互作蛋白,这些互作蛋白包括受体激酶、LRR类蛋白、ATP酶、磷酸羧化酶和离子通道蛋白等,广泛参与了调控细胞程序化死亡、胁迫防御反应、物质与能量代谢和信号传导等多个生物学过程。此外,SDR1作为调控营养信号转导和植物生长调节剂合成的关键酶,利用GST Pull-Down技术亦筛选到1个与其互作的蛋白[8]。
针对PatFPPS的互作蛋白,国内外至今尚未有相关报道。本研究拟利用GST Pull-Down联合质谱的方法筛选鉴定PatFPPS的互作蛋白,有助于进一步揭示广藿香醇合成途径酶蛋白的调节机理,以期促进广藿香醇合成分子机制的理解,为提高广藿香活性代谢成分产量及植物萜类代谢研究奠定理论基础。
1 材料与方法 1.1 材料广藿香来源于广州中医药大学药用植物种质资源圃。用300 μmol/L茉莉酸甲酯对广藿香幼苗进行处理,作为MeJA处理组,并设置CK对照组,对其叶片表面进行喷湿处理,8 h后,纯水冲洗并擦干,由叶柄处剪取叶片,液氮冻存备用。
1.2 方法 1.2.1 原核表达载体的构建将陈立凯团队课题组前期克隆得到的PatFPPS编码区,进行PCR扩增,片段以Infusion的方法连接在pGEX-6P-1载体上(EcoRⅠ和NotⅠ酶切位点),连接产物转化大肠杆菌DH5α,经菌落PCR和菌液测序结果验证后提取重组质粒。
1.2.2 带有GST标签的融合蛋白表达和纯化重组质粒及空载质粒转化至BL21(DE3)菌株,验证成功的阳性菌落加入到5 mL含羧苄5 μL的液体LB培养基中,225 r/min,37℃培养过夜。按照1:100稀释扩大培养,取1 mL菌液到100 mL培养基,225 r/min,37℃振荡培养至OD600=0.4-0.6,分别加入IPTG至终浓度为0.1、0.3、0.5和1.0 mmol/L,16℃震荡培养20 h。4 602×g离心5 min收集菌体。加20 mL PBS(1 mmol/L PMSF)重悬菌体,高压均质机破碎3次,每次30 s。破碎后的细胞13 523×g离心20 min,离心后取上清蛋白液,4℃保存备用。
用10BP预冷PBS清洗GST纯化柱,其余上清蛋白液过GST柱子,以10-15 cm/h流出,用20BP预冷PB洗脱杂蛋白,用提前配制的洗脱缓冲液(配制方法:0.154 g还原性谷胱甘肽溶于50 mL的50 mmol/L Tris-HCl,pH8.0)洗脱目标蛋白。蛋白在10%的分离胶电泳,结束后用考马斯亮蓝染色液染色10 min,后用脱色液过夜脱色,更换2-3次脱色液,直到条带清晰。
1.2.3 广藿香总蛋白的提取根据试剂盒说明书,将冻存的广藿香叶片组织转移至5 mL玻璃匀浆器,加入溶液A和溶液B混合液充分研磨后,涡旋震荡60 s,6 010×g离心5 min,将下层含有可溶性总蛋白的水相吸出,备用。
1.2.4 验证总蛋白不与GST柱吸附吸取2 mL混悬谷胱甘肽树脂到柱中,并用10 mL的1×PBS(均加入蛋白酶抑制剂和DTT,保存于4℃)洗涤谷胱甘肽树脂。加入提取的广藿香总蛋白,使蛋白与树脂完全融合。4℃放置60 min后,流出的上清液作为总蛋白流出液。并用20 mL的1×PBS洗涤谷胱甘肽树脂,将最后的流出液作为洗杂液。用提前配制洗脱缓冲液洗脱GST柱,流出液作为洗脱液。将总蛋白流出液,洗杂液,洗脱液进行SDS-PAGE,考马斯亮蓝染色。
1.2.5 验证总蛋白不与GST标签吸附将GST标签上清蛋白液加入到含有2 mL混悬谷胱甘肽树脂的平衡柱中,蛋白质溶液进入柱子后,加入20 mL体积的1×PBS洗涤柱子。加入广藿香总蛋白,使蛋白与树脂完全融合,后续步骤按1.2.4相应方法进行。
1.2.6 GST Pull-Down试验将含有GST融合蛋白的上清蛋白液加入到含有2 mL混悬谷胱甘肽树脂的平衡柱中,蛋白质溶液进入柱子后,加入20 mL的(冷)1×PBS洗涤柱子。加入提取的广藿香总蛋白,使蛋白与树脂完全融合,4℃放置60 min后。用20 mL的谷胱甘肽洗脱缓冲液洗脱GST标签融合蛋白和互作蛋白的复合蛋白,分别通过SDS-PAGE分析所有样品以确认靶蛋白的存在。将胶条切下,进行质谱鉴定。
1.2.7 质谱检测和鉴定方法胶条经水洗、脱色、还原等过程进行蛋白酶解成肽段,用样品溶解液(0.1%甲酸、2%乙腈)溶解,充分振荡涡旋,16 363×g,4℃离心10 min,上清液转移至上样管中,进行质谱鉴定;色谱柱信息:300 μm i.d. × 5 mm,packed with AccLaim PepMap RSLC C18,5 μm,100 A,nanoViper,流动相A:0.1%甲酸,流动相B:0.1%甲酸,80%乙腈,流速:300 nL/min,每个组分分析时间:60 min。B流动相在0-5 min,5%;5-50 min,5%-90%;50-55 min,90%;55-60 min,90%-5%。
分离后的肽段使用质谱仪进行在线检测,分析其氨基酸序列。利用MASCOT软件在NCBI数据库(https://www.ncbi.nlm.nih.gov/)检索,检索参数如下:固定修饰(Fixed modifications):Carbamidomethyl(C)、可变修饰(Variable modifications):Oxidation(M)、酶(Enzyme):Trypsin、遗漏酶切位点(Maximum missed cleavages):2、一级质谱误差(Peptide mass tolerance):20 ppm、二级质谱误差(Fragment Mass Tolerance):0.6 Da、肽段/碎片离子质量数(Mass values):Monoisotopic(单同位素)、显著性阈值(Significance threshold):0.05。
2 结果 2.1 融合蛋白的诱导表达通过不同浓度IPTG诱导,并提取和纯化蛋白。结果(图 1)表明,纯化后的蛋白条带清晰且单一,与预测的PatFPPS(66 kD)蛋白大小一致,说明该原核表达体系适用于PatFPPS的表达,纯化效果较好。
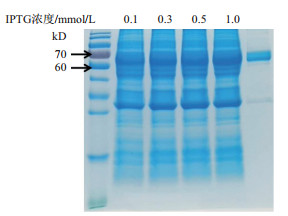
|
| 图 1 不同浓度IPTG诱导的细胞破碎上清蛋白及纯化后的GST-FPPS融合蛋白 |
利用广藿香叶片总蛋白验证与GST柱吸附情况(图 2)发现,CK组和MeJA组总蛋白经纯化柱后的溶液含有大部分蛋白,PBS清洗后,可将少部分残留蛋白洗脱,而洗脱液中未发现蛋白条带,表明总蛋白不与GST柱相吸附。
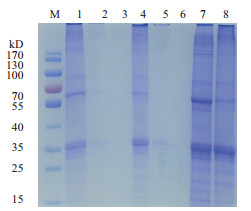
|
| M:Marker;1:纯化柱+CK组总蛋白流出液;2:纯化柱+CK组总蛋白洗杂液;3:纯化柱+CK组总蛋白洗脱液;4:纯化柱+MeJA组总蛋白流出液;5:纯化柱+MeJA组总蛋白洗杂液;6:纯化柱+MeJA组总蛋白洗脱液;7:CK组总蛋白;8:MeJA组总蛋白 图 2 验证总蛋白不与GST柱吸附的凝胶电泳图 |
进一步验证总蛋白是否与GST标签结合(图 3)发现,CK组和MeJA组总蛋白过吸附有GST标签的纯化柱后的溶液含有大部分总蛋白,经PBS清洗后,溶液中未发现有条带。而经过洗脱液洗脱后,能明显看到与GST标签(26 kD)大小一致条带,且未有其他杂条带,表明总蛋白不与GST标签吸附。
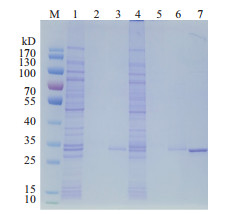
|
| M:Marker;1:GST+CK组总蛋白流出液;2:GST+CK组总蛋白洗杂液;3:GST+CK组总蛋白洗脱液;4:GST+MeJA组总蛋白流出液;5:GST+MeJA组总蛋白洗杂液;6:GST+MeJA组总蛋白洗脱液;7:GST标签 图 3 验证总蛋白不与GST标签吸附的凝胶电泳图 |
利用GST Pull-Down技术对PatFPPS互作蛋白进行筛选(图 4)。PatFPPS蛋白纯化后的纯度较高,并且CK组及MeJA组叶片提取的总蛋白在40 kD左右较为集中。将筛选得到的CK组及MeJA组的互作蛋白胶条切下进行LC-MS/MS鉴定,获得PatFPPS的候选互作蛋白信息。

|
| M:Marker;1:GST-FPPS融合蛋白;2:GST-FPPS与CK组互作蛋白;3:GST-FPPS与MeJA组互作蛋白;4:CK组总蛋白;5:MeJA组总蛋白 图 4 利用GST Pull-Down技术得到的PatFPPS互作蛋白凝胶电泳图 |
利用LC-MS/MS质谱技术鉴定分析互作蛋白序列,通过筛选质谱中鉴定到的肽段匹配数≥2或者1(总肽段数等于1)的蛋白,分别得到表 1所示的候选蛋白。
在PatFPPS Pull-Down鉴定结果中,CK组和MeJA组中共同鉴定得到的候选蛋白分别有14个,包括AKM21345.1(核酮糖-1,5-二磷酸羧化酶)和ANO53386.1(甘油醛-3-磷酸脱氢酶A)等具有酶活特性,此外,还筛选得到一些floricaula(AIC82084.1)、肌动蛋白(APU50940.1)和微管蛋白(AVW82638.1)等。而MeJA处理后,还鉴定得到热休克蛋白(AKT44364.1)、细胞色素P450(AJD25213.1)、MYB相关转录因子(AGN52117.1)和碱性螺旋-环-螺旋转录因子(AKN09649.1)等。
3 讨论广藿香作为具有重要经济价值的药用植物,作为大宗常用中药材在临床广泛应用,此外还在香料工业等用作原料制造各种化妆品和口腔卫生产品[9],工业价值显著。而广藿香醇、广藿香酮作为主要的活性药用组成成分,在广藿香挥发油中占60%以上[10],并且广藿香醇含量已经明确作为药典中广藿香质量标准的指标。探明广藿香主要有效成分的合成机制,为广藿香萜类代谢调控奠定基础,同时也为植物挥发性萜类代谢研究提供有价值的参考。
目前,未有针对广藿香醇合成途径关键酶PatFPPS的互作蛋白研究报道,仅局限于酶基因的分离克隆、酶学功能和代谢工程应用等。互作蛋白的筛选主要有酵母双杂交和GST Pull-Down技术,而利用该技术,无需在构建基因文库的基础上实现较高通量的分子筛选。前人也通过此技术从水稻中分离得到一个抗稻瘟病相关蛋白的新互作蛋白,该蛋白可以降解稻瘟病病菌细胞壁从而产生抗性[11]。
利用GST Pull-Down技术,PatFPPS筛选了多个候选互作单白,其中,核酮糖-1,5-二磷酸羧化酶、floricaula、肌动蛋白和微管蛋白在CK组及MeJA组均检测到。Floricaula(FLO/LFY)是一种花分生组织特异性表达的同源异型基因,分别自金鱼草(Antirrhinum majus)和拟南芥(Arabidopsis thaliana)中分离得到,控制顶端分生组织向花分生组织转变,同时控制花器官发育ABC模型中后续同源异型基因的表达[12-13]。而肌动蛋白作为细胞的组成结构成分,在许多基本细胞过程中也起作用,如繁殖、发育和对非生物和生物刺激的响应[14]。结果中,筛选得到的核酮糖-1,5-二磷酸羧化酶作为羧化酶参与光合作用,并与植物的抗逆有关[15]。研究表明,植物激素脱落酸(ABA)能与核酮糖-1,5-二磷酸羧化酶结合,从而产生弱抑制作用[16]。LeNCED1作为编码核酮糖-1,5-二磷酸羧化酶/加氧酶(Rubisco)小亚基的启动子基因,提高LeNCED1的表达,可以产生具有更高水平的ABA积累的植物,并能影响萜类化合物叶绿素和类胡萝卜素含量[17]。而本研究表明MeJA诱导后,鉴别得到较多核酮糖-1,5-二磷酸羧化酶,但是否有影响作用尚未研究。
MeJA诱导后,还鉴别获得到1个碱性螺旋-环-螺旋转录因子(bHLH)。其结构域大概包含了60个氨基酸,由一个碱性氨基酸区和一个螺旋-环-螺旋(HLH region)区组成,为一个转录因子特有的结构域。bHLH不仅普遍参与包括光形态发生,光信号转导和次级代谢等植物生长和代谢过程,也在植物对胁迫的反应中起重要作用[18]。许多研究证明,bHLH转录因子参与JA诱导的防御信号调控,还响应JA信号在萜类合成中的调控作用[19-20]。这些蛋白都具有多种生物学功能,可能响应JA信号参与萜类合成,但其作用机制还需进一步的研究。
综上所述,这些筛选的互作蛋白可能与PatFPPS互作来调节萜类通路的下游关键酶从而影响萜类化合物的合成,并可能与MeJA的诱导调控有一定关联。下一步可继续利用其他方法验证这些候选的互作蛋白,并且进行功能研究,深入地了解其调节机理。
4 结论成功表达并纯化得到PatFPPS大量可溶性重组蛋白,经鉴定,获得多个候选互作蛋白,包括核酮糖-1,5-二磷酸羧化酶、floricaula、肌动蛋白、碱性螺旋-环-螺旋转录因子等蛋白。
| [1] |
Hu LF, Li SP, Cao H, et al. GC-MS fingerprint of Pogostemon cablin in China[J]. J Pharm Biomed Anal, 2006, 42(2): 200-206. |
| [2] |
国家药典委员会. 中华人民共和国药典(第一部)[M]. 北京: 中国医药科技出版社, 2015: 236.
|
| [3] |
蒋玲, 谷巍, 等. 濒危药用植物茅苍术法呢基焦磷酸合酶基因克隆及其表达分析[J]. 中草药, 2017, 48(4): 760-766. |
| [4] |
刘信丹, 张英, 吴孟华, 等. 广藿香醇合成酶基因Pc-PTS_1的克隆和生物信息学分析[J]. 中药材, 2018, 41(2): 292-298. |
| [5] |
何梦玲, 何芳, 熊洋, 等. 茉莉酸甲酯对广藿香叶中百秋里醇含量的影响[J]. 北方园艺, 2014(5): 147-150. |
| [6] |
张盼盼, 闫慧, 袁业锋, 等. GST pull-down联合质谱筛选(肌)营养不良短小蛋白结合蛋白1在小鼠睾丸组织中的相互作用蛋白质[J]. 中国生物化学与分子生物学报, 2017, 33(3): 286-293. |
| [7] |
赵文, 王静, 李伟滔, 等. 应用GST pull-down技术筛选水稻抗稻瘟病蛋白PID3互作蛋白的研究[J]. 植物病理学报, 2015, 45(5): 476-485. |
| [8] |
许惠滨, 徐倩, 连玲, 等. 杂交水稻恢复系福恢7185 OsSDR1基因的克隆与序列分析[J]. 福建农业学报, 2017, 32(9): 939-945. |
| [9] |
Sandes SS, Zucchi MI, Pinheiro JB, et al. Molecular characteriza-tion of patchouli(Pogostemon spp)germplasm[J]. Genetics and Molecular Research, 2016, 15(1). |
| [10] |
林彦君, 许莉, 陈佳江, 等. 川藿香与广藿香挥发油化学成分GC-MS对比分析[J]. 中国实验方剂学杂志, 2013, 19(20): 100-102. |
| [11] |
Akiyama T, Pillai MA. Cloning, characterization and expression of OsGLN2, a rice endo-1, 3-beta-glucanase gene regulated developmentally in flowers and hormonally in germinating seeds[J]. Planta, 2004, 220(1): 129-139. DOI:10.1007/s00425-004-1312-8 |
| [12] |
程磊.海芋FLORICAULA/LEAFY第二内含子序列克隆及系统发育分析[C].中国生态学会.生态学与全面·协调·可持续发展--中国生态学会第七届全国会员代表大会论文摘要荟萃.中国生态学学会, 2004.
|
| [13] |
马月萍, 戴思兰, 方晓华, 等. 甘菊中FLORICAULA/LEAFY同源基因DFL的基因组序列(登录号:AY672542)(英文)[J]. 分子植物育种, 2005(2): 293-294. DOI:10.3969/j.issn.1672-416X.2005.02.023 |
| [14] |
Janda M, Matoušková J, Burketová L. Interconnection between actin cytoskeleton and plant defense signaling[J]. Plant Signaling & Behavior, 2014, 9(11): e976486. |
| [15] |
Liu X. Photosynthetic acclimation to high temperatures associated with heat tolerance in creeping bentgrass[J]. Journal of Plant Physiology, 2008, 165(18): 1947-1953. DOI:10.1016/j.jplph.2008.05.001 |
| [16] |
Galka MM, Rajagopalan N, Buhrow LM, et al. Identification of inte-ractions between abscisic acid and ribulose-1, 5-bisphosphate car-boxylase/oxygenase[J]. PLoS One, 2015, 10(7): e0133033. DOI:10.1371/journal.pone.0133033 |
| [17] |
Tung SA, Smeeton R, White CA, et al. Over-expression of LeNCED1 in tomato(Solanum lycopersicum L.)with the rbcS3C promoter allows recovery of lines that accumulate very high levels of abscisic acid and exhibit severe phenotypes[J]. Plant Cell Environ,, 2008, 31: 968-981. DOI:10.1111/j.1365-3040.2008.01812.x |
| [18] |
Sun X, Wang Y. Transcriptional regulation of bHLH during plant response to stress[J]. Biochem Biophys Res Commun, 2018, 503(2): 397-401. DOI:10.1016/j.bbrc.2018.07.123 |
| [19] |
李欣, 李影, 曲子越, 等. bHLH转录因子在茉莉酸信号诱导植物次生产物合成中的作用及分子机制[J]. 植物生理学报, 2017, 53(1): 1-8. |
| [20] |
张凯伦, 罗祖良, 郭玉华, 等. bHLH转录因子调控药用植物萜类化合物生物合成的研究进展[J]. 中国现代中药, 2017, 19(1): 142-147. |





