伪狂犬病(Pseudorabies,PR)是的一种由伪狂犬病毒(Pseudorabies virus,PRV)感染引起的,能引发多种动物奇痒、发热、脑脊髓炎的急性传染病,又称Aujeszky病。其主要感染猪,仔猪感染后表现为严重的中枢神经症状,引发急性死亡,死亡率可达100%。成年猪感染后可长期潜伏带毒,引发种猪不育、妊娠母猪繁殖障碍等症状,给我国养猪业造成了极大的经济损失[1-2]。
PRV是猪疱疹病毒Ⅰ型病毒,属于疱疹病毒科和α-疱疹病毒亚科,是双链线状DNA病毒。其中,gE是PRV重要的毒力基因,全长1.7 kb,位于病毒基因组US区,编码的蛋白属于Ⅰ型跨膜糖蛋白[3],在介导细胞之间病毒的扩散、细胞的感染融合、病毒粒子的释放以及病毒侵袭神经系统等方面均起着重要作用[4-5]。近年来,PRV已在很多国家养猪业中得到净化,中国也颁布了相关的净化计划。gE-ELISA诊断技术和gE基因缺失疫苗作为目前伪狂犬病防控的主要手段,是伪狂犬病能否净化的关键[6]。
目前国内外报道中[7-14],PRV gE蛋白的表达方式主要有原核表达、昆虫细胞表达和酵母细胞表达3种。然而,原核表达系统的缺点是包涵体蛋白不易纯化、蛋白修饰不完整、表达的蛋白生物活性低。昆虫细胞表达系统的缺点是效率比较低,载体构建时间长,杆状病毒表达系统所能表达的外源蛋白基本为非分泌蛋白,不能表达带有完整N联聚糖的真核糖蛋白。而酵母表达系统存在克隆基因的表达量低,发酵时间长,不正确的蛋白糖基化及抗细胞分裂,培养上清多糖浓度高不利于纯化等缺点。与上述3种表达系统相比,哺乳动物细胞表达系统虽然成本偏高,但表达的蛋白基本是可溶性蛋白,便于纯化和产业化,且其翻译后再加工修饰产生的外源蛋白质,就活性而言,远胜于原核、昆虫细胞及酵母细胞表达系统,最接近于天然蛋白质。
为了表达PRV gE蛋白,本研究设计了2种重组表达方式[gE-6×His和gE-mouse Fc(gE-mFc)],将其在哺乳动物细胞表达系统HEK293F细胞中进行瞬时表达,比较其表达情况,以期获得表达量高纯度好的分泌性gE蛋白。用PRV灭活全病毒免疫小鼠,利用获得的gE蛋白通过间接ELISA筛选和IFA鉴定出9株稳定性和特异性好的分泌阳性杂交瘤细胞株,以期为PRV诊断试剂的开发奠定良好的物质基础。
1 材料与方法 1.1 材料 1.1.1 质粒、病毒、细胞及实验动物pcDNA3.4载体购自invitrogen;pcDNA3.4-mFc2载体由重庆市畜牧科学院生物工程所保存;伪狂犬病全病毒株和gE缺失株由成都安迪斯生物技术有限责任公司赠予;SP2/0细胞和PK-15细胞均保存于重庆市畜牧科学院生物工程所;HEK293F瞬时表达系统试剂盒购自北京诺进生物技术有限公司;6-8周龄Balb/C小鼠购自成都达硕实验动物有限公司。
1.1.2 主要试剂质粒提取试剂盒购自全式金公司;胰蛋白胨(Tryptone)和酵母提取物(Yeast extract)购自OXOID;感受态细胞DH5α、Taq DNA聚合酶、DNA限制性内切酶均购自TaKaRa公司;DNA Marker购自广州东盛生物科技有限公司;Ni-NTA纯化柱和Protein G纯化柱均购自GE公司;阴离子纯化柱购自博格隆(上海)生物技术有限公司;蛋白浓缩管购自eppendorf公司;弗氏佐剂购自sigma公司;ClonaCellTM-HY培养基D购自STEMCELL公司;1640培养基购自Hyclone公司;HT培养基购自Gibco公司;电融合液购自BTX公司;鼠抗his单克隆抗体购自santa cruz公司;抗鼠IgG(H+L)的荧光二抗购自invitrogen;羊抗鼠IgG-Fab HRP抗体购自sigma公司;FITC标记的羊抗鼠IgG抗体购自Abcam公司。
1.2 方法 1.2.1 gE-6×His重组蛋白真核表达载体的构建根据NCBI发表的PRV gE基因序列(GenBank:KX266909.1),对gE蛋白信号肽在http://www.cbs.dtu.dk/services/SignalP/网址在线预测,对gE蛋白跨膜区在http://www.cbs.dtu.dk/services/TMHMM/网址在线预测。找出gE蛋白信号肽、胞外区序列并在N端加上Kozak sequence和HindⅢ酶切位点,C端加上His标签和EcoRI酶切位点进行合成,构建入pcDNA3.4真核表达载体中。质粒测序正确后,命名为pcDNA3.4-gE-6×His。
1.2.2 gE-mFc重组蛋白真核表达载体的构建从pcDNA3.4-gE-6×His载体中扩增目的片段,并在两端加入HindⅢ和EcoRI酶切位点,(扩增上游引物:5'-aagcttGCCACCATGCG-3';扩增下游引物:5'-TGAAGTAATAAGaattc-3')将目的片段构建入实验室已有的含小鼠IgG2-Fc基因片段(705 bp)的pCDNA3.4-mFc真核表达载体中。质粒测序正确后,命名为pCDNA3.4-gE-mFc。
1.2.3 重组gE蛋白的表达、纯化和鉴定将已鉴定的重组质粒转化入大肠杆菌感受态细胞DH5α中,挑取单个菌落接种于LB培养基中,37℃,200 r/min摇床培养过夜,收取菌液进行质粒无内毒素提取,将大提的质粒用0.45 μm滤膜过滤后备用。准备HEK293F细胞,转染前一天,取对数生长期的HEK293F细胞按0.8×106 cells/mL密度进行传代至200 mL培养基中。转染时,准备2个无菌EP管各加入2 mL HEK293F基础培养基,分别加入200 μg质粒DNA和600 μL转染试剂,混匀室温孵育5 min。将转染试剂稀释液快速加入DNA稀释液中,室温孵育15-20 min。将DNA与转染试剂混合液快速加入细胞悬液,分别在转染48 h、96 h、144 h后加入HEK293F补料培养基10 mL,待细胞活率降至60%左右时,离心收取细胞上清液,进行Western blot鉴定其表达情况。表达的gE-6×His蛋白用Ni-NTA柱和阴离子交换柱纯化,gE-mFc蛋白用Protien G柱纯化,并进行SDS-PAGE鉴定纯化情况。
1.2.4 小鼠免疫将PRV全病毒用5×PEG8000-NaCl进行纯化浓缩,并溶于PBS中,用Nanodrop2000微量紫外分光光度计测得病毒浓度。向病毒溶液中加入0.1%-0.2%的甲醛37℃灭活过夜,取终浓度为2 mg/mL的灭活PRV全病毒,以1:1(V/V)加入弗氏佐剂,接种6-8周龄Balb/C小鼠,每间隔2周免疫一次。首次免疫,加弗氏完全佐剂,皮下多点注射,200 μL/只;再次免疫,加弗氏不完全佐剂,腹腔注射,200 μL/只。三免一周后采微量尾血包被PRV灭活全病毒进行ELISA测定,抗体效价达到1:10 000以上的小鼠,杂交瘤融合前3 d,取200 μg抗原不加佐剂进行加强免疫。
1.2.5 单克隆抗体的制备取SP2/0细胞与免疫小鼠脾细胞按1:5混合,加入电融合液进行电融合,融合后细胞用ClonaCellTM-HY半固体培养基D培养,10-14 d后挑取单克隆至HT培养基中,培养2-3 d后观察培养基颜色变黄以后,取细胞上清,以gE-mFc表达蛋白为检测抗原包被ELISA板,以羊抗鼠IgG-Fab HRP抗体为二抗进行间接ELISA,筛选阳性细胞克隆株。将阳性克隆全部冻存,并进行有限稀释,用间接ELISA检测,直至单克隆全阳性为止,扩大培养高阳性的单克隆,冻存备用。
1.2.6 间接免疫荧光试验(IFA)鉴定单克隆抗体将PK-15细胞传代至24孔板中,待细胞长成单层后,分别接种PRV全病毒株和PRV gE缺失株,同时设正常细胞对照。24 h后待细胞出现轻微病变,用-20℃预冷的甲醇室温固定10 min,PBS洗3遍,5% BSA 37℃封闭1 h,加入待检的杂交瘤培养上清,4℃孵育过夜。PBS洗3遍,避光加入1:1 000稀释的FITC标记的羊抗鼠IgG,37℃避光孵育1 h,PBS洗3遍,在荧光显微镜下观察荧光。
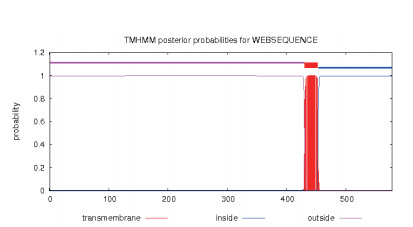
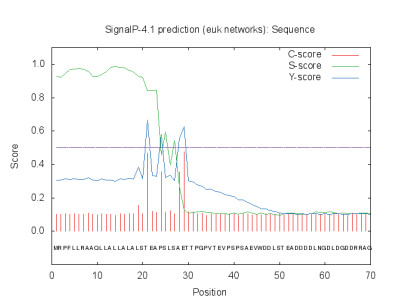
2 结果 2.1 gE蛋白序列生物信息学分析通过http://www.cbs.dtu.dk/services/TMHMM/网站对gE蛋白跨膜区预测,可知gE蛋白1-430位氨基酸位于细胞膜外(胞外区)、431-453位氨基酸位于跨膜区、454-578位氨基酸位于胞质内(胞内区),其中胞外区的1-430位氨基酸是gE蛋白的主要抗原区域,结果如图 1。通过http://www.cbs.dtu.dk/services/SignalP网站对gE蛋白信号肽预测,可知1-20位氨基酸是gE蛋白的信号肽,结果如图 2。因此,本研究拟表达gE蛋白胞外区的1-430位氨基酸。通过https://www.hiv.lanl.gov/content/sequence/GLYCOSITE/glycosite.html网站预测gE蛋白胞外区N-糖基化位点,发现其共有5个潜在的N-糖基化位点,结果如图 3。通过http://www.cbs.dtu.dk/services/NetOGlyc/网站预测gE蛋白胞外区O-糖基化位点,发现其分别第25、27、30、31、36、40、42、305、393、410、411、425位氨基酸共有12个潜在的O-糖基化位点。
|
| 图 1 gE蛋白跨膜区预测结果 |
|
| 图 2 gE蛋白信号肽预测结果 |

|
| 图 3 gE蛋白胞外区N-糖基化位点预测结果 |
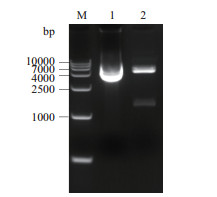
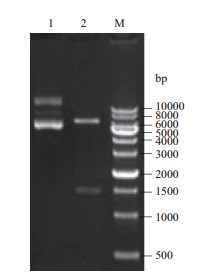
如图 4所示,用HindⅢ和EcoRI对测序正确的pcDNA3.4-gE-6×His质粒进行酶切鉴定,结果得到大小与预期的1 335 bp和5 987 bp一致的两条带。如图 5所示,用HindⅢ和PvuI对测序正确的pcDNA3.4-gE-mFc质粒进行酶切鉴定,得到大小与预期的1 480 bp和6 529 bp一致的两条带。
|
| M:DL15000 Maker;1:重组pcDNA3.4-gE-6×His质粒;2:pcDNA3.4-gE- 6×His质粒的双酶切产物 图 4 pcDNA3.4-gE-6×His质粒酶切鉴定 |
|
| M:1kb ladder;1:重组pcDNA3.4-gE-mFc质粒;2:pcDNA3.4-gE-mFc质粒的双酶切产物 图 5 pcDNA3.4-gE-mFc质粒酶切鉴定 |
取pcDNA3.4-gE-6×His转染的HEK293F细胞上清,用浓缩管浓缩10倍,将原液和浓缩液以30 μL体积上样SDS-PAGE电泳并电转移至PVDF膜,用5%脱脂奶粉室温封闭1 h,洗涤后,用1:1 000稀释的鼠抗His单克隆抗体,4℃孵育过夜,再用1:10 000稀释Alexa FluorTM 680 donkey anti-mouse IgG(H+L)室温孵育1 h后显色,结果如图 6。由结果可知,与原液比较,浓缩后样品能够在100 kD和70 kD成功检测到目的蛋白。说明gE-6×His蛋白成功表达,但表达量很低,表达的目的蛋白分子量和预期的(45 kD)比较偏大,可能是糖基化修饰所致。
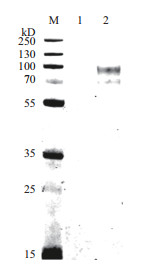
|
| M:蛋白质分子质量标准;1:pcDNA3.4-gE-6×His细胞上清;2:pcDNA3.4-gE-6×His浓缩细胞上清 图 6 gE-6×His蛋白表达Westernblot鉴定图 |
将转染pcDNA3.4-gE-6×His质粒的细胞上清先后用Ni-NTA柱和阴离子交换柱进行纯化,纯化后的蛋白进行SDS-PAGE电泳和考马斯亮蓝染色,结果如图 7,发现gE-6×His蛋白进行2次纯化后,其纯度仍然不高,且蛋白稳定性太差,蛋白在浓缩和纯化的过程出现沉淀和降解,分析可能是蛋白的结构不够稳定,聚集性太强。
|
| M:蛋白质分子质量标准;1:Ni-NTA柱纯化gE-6×His蛋白;2:阴离子交换柱纯化gE-6×His蛋白 图 7 gE-6×His蛋白纯化SDS-PAGE电泳图 |
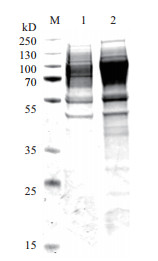
为解决gE-6×His蛋白遇到的表达量低,蛋白稳定性太差,且不能纯化到纯度较高的蛋白的问题。本研究重新设计了pcDNA3.4-gE-mFc质粒,表达得到gE-mFc蛋白。取pcDNA3.4-gE-mFc转染的HEK293F细胞上清,以30 μL体积上样SDS-PAGE电泳并电转移至PVDF膜,用5%脱脂奶粉室温封闭1 h,洗涤后,用1:10 000稀释Alexa FluorTM 680 donkey anti-mouse IgG(H+L)室温孵育1 h后显色,结果如图 8。由结果可知,样品能够在100 kD到190 kD之间成功检测到目的蛋白。说明gE-mFc蛋白成功表达,且表达量较gE-6×His有明显提高,但由于糖基化修饰,表达的目的蛋白分子量较预期(70 kD)偏大。

|
| M:蛋白质分子质量标准;1:pcDNA3.4-gE-mFc转染细胞上清 图 8 gE-mFc蛋白表达Westernblot鉴定图 |
将转染pcDNA3.4-gE-mFc质粒的细胞上清用Protein G柱进行纯化,纯化后的蛋白进行SDS-PAGE电泳和考马斯亮蓝染色,结果如图 9,发现gE-mFc蛋白进行纯化后,其纯度较gE-6×His蛋白有明显提高,且蛋白稳定性好,不会出现蛋白沉淀和降解的情况。

|
| M:蛋白质分子质量标准;1:proteinG柱纯化gE-mFc蛋白 图 9 gE-mFc蛋白纯化SDS-PAGE电泳图 |
为了快速获得gE单克隆抗体,本研究选择在蛋白表达初期利用PRV灭活全病毒免疫小鼠,细胞融合后,再利用表达的gE-mFc蛋白进行筛选。经细胞融合和ELISA初步筛选,得到20株阳性克隆,又进行2次单克隆,直至所有克隆孔的阳性反应率达100%,最后获得9株稳定分泌的能和gE-mFc表达蛋白发生阳性反应的细胞株(图 10)。
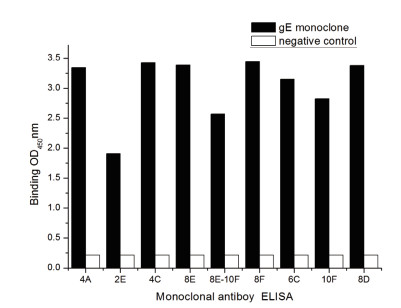
|
| 图 10 ELISA筛选特异性gE-mFc单克隆抗体 |
IFA检测gE单克隆抗体与PRV全病毒株和PRV gE缺失株特异性结合反应。结果显示(图 11),9株gE单克隆抗体4A、2E、4C、8E、8E-10F、8F、6C、10F和8D均能与PRV全病毒株反应,而不能与PRV gE缺失株以及对照的PK-15细胞反应,证明9株单克隆抗体能特异性结合PRV的gE蛋白。
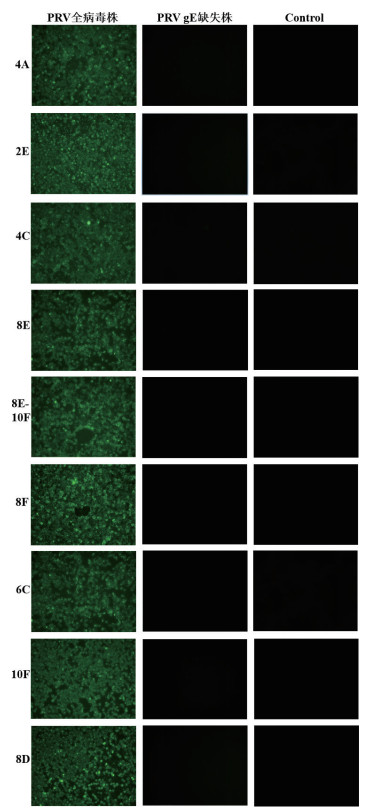
|
| 图 11 IFA鉴定gE蛋白单克隆抗体特异性 |
PRV gE蛋白由胞外区、跨膜区和胞质区构成,研究已发现了6个抗原表位,其中5个抗原位于N端52-238位氨基酸[15]。由于gE蛋白是一种非必需的囊膜糖蛋白,PRV缺失gE基因后不会影响其复制和免疫原性,但毒力却大大减弱,目前gE基因缺失疫苗广泛使用于全国各大猪场,gE蛋白成为了区分PRV疫苗株和野毒株的重要标志性蛋白。因此,可溶性gE蛋白和gE特异性单克隆抗体在PRV的防治和净化过程中起着重要的作用。
本研究通过生物信息学的手段预测了gE蛋白的信号肽、胞外区、跨膜区和糖基化位点。根据在线程序signalP4.1预测其信号肽位于1-20位氨基酸。根据TMHMM2.0预测其21-430位氨基酸位于细胞膜外(胞外区)、431-453位氨基酸位于跨膜区、454-578位氨基酸位于胞质内(胞内区)。
根据预测结果,本研究构建了真核表达载体pcDNA3.4-gE-6×His和pcDNA3.4-gE-mFc两种表达载体,将gE胞外区域(21-430 aa)分别与6×His和mFc融合表达。结果显示gE-6×His能够在HEK293F细胞中表达,且有糖基化修饰。但其表达量很低,蛋白稳定性差,容易出现沉淀。利用Ni-NTA柱和阴离子交换柱进行纯化后,纯度仍很低,这可能是蛋白折叠过程中His被包裹在内,暴露太差的原因。而将标签换成mFc后,蛋白表达量大大增加,蛋白稳定性也较好,利用Protein G柱一次纯化后即获得纯度高达85%的蛋白。
同时本研究选用了mouse Fc和gE蛋白进行融合表达,在后期利用其免疫小鼠,可以产生更多gE抗体,而尽可能减少Fc抗体的产生。IgG-Fc融合蛋白是将生物活性蛋白与IgG的铰链区和Fc片段(CH2、CH3功能区)进行基因重组而表达的融合蛋白,早已广泛应用于人蛋白的表达[16]。加入的Fc片段能显著提高融合蛋白的半衰期和稳定性[17],并且能提高融合蛋白在哺乳动物细胞中的表达量,有利于融合蛋白的纯化与检测[18-19]。本研究将鼠IgG2-Fc片段与gE蛋白胞外区进行融合表达,产生的gE-mFc蛋白不仅稳定性好,且便于纯化与检测,能更好地应用于PRV诊断试剂的开发,同时也为今后制备更多的鼠单克隆抗体提供了好的思路。
无论是gE-6×His还是gE-mFc蛋白,在HEK293F悬浮细胞瞬时表达系统中表达后,获得的蛋白均略大于理论值。通过生物信息学方法分析发现gE蛋白胞外区包含5个潜在的N-糖基化修饰位点和12个潜在的O-糖基化修饰位点。这也与之前的文献报道一致。周金龙等[11]通过昆虫细胞表达系统、敖敬群等[13]通过酵母表达系统表达的gE蛋白均出现蛋白大小大于理论值的情况。本研究中使用的HEK293F表达系统是哺乳动物表达系统,较昆虫细胞表达系统和酵母表达系统有更复杂的翻译后修饰加工体系,因此,两次表达的gE-6×His蛋白和gE-mFc蛋白都得到比目的蛋白大的两条带,可能是HEK293F表达后对其进行翻译后修饰加工如糖基化修饰所致。
近年来,已有很多关于PRV gE单克隆抗体的制备相关的文章[20-22],市面上也有很多PRV gE-ELISA试剂盒,但其抗原大多是通过原核表达的gE蛋白,筛选出来的抗体与天然病毒结合能力不强。本研究通过哺乳细胞表达的gE-mFc蛋白具有稳定性好、半衰期长、便于纯化和鉴定及蛋白活性更接近天然蛋白等优点。且其mouse Fc标签是鼠的抗体Fc段,不会在小鼠免疫时产生免疫原性。但为了快速获得gE单克隆抗体,本研究选择在蛋白表达初期利用PRV灭活全病毒免疫小鼠,用哺乳细胞表达的gE-mFc蛋白进行ELISA筛选,获得的抗体也能更好地与天然病毒结合,通过IFA进一步鉴定其特异性,获得了9株单克隆抗体都能特异性与gE蛋白结合,为今后建立特异性强、稳定性好和结合能力高的PRV诊断试剂提供了条件。
4 结论本研究成功构建了真核表达载体pcDNA3.4-gE-6×His和pcDNA3.4-gE-mFc,并在HEK293F细胞中表达得到gE-6×His和gE-mFc可溶性蛋白。利用gE-mFc蛋白成功筛选到9株能特异性与gE蛋白结合的单克隆抗体,为今后PRV诊断试剂的开发奠定了良好的理论基础。
| [1] |
Pomeranz LE, Reynolds AE, Hengartner CJ. Molecular biology of pseudorabies virus:impact on neurovirology and veterinary medicine[J]. Microbiology & Molecular Biology Reviews, 2005, 69(3): 462-500. |
| [2] |
杨国淋, 李阳友, 文心田. 猪伪狂犬病诊断技术的研究进展[J]. 饲料与畜牧, 2017, 6(3): 37-42. |
| [3] |
Tirabassi RS, Townley RA, Eldridge MG, et al. Characterization of pseudorabies virus mutants expressing carboxy-terminal truncations of gE:evidence for envelope incorporation, virulence, and neurotropism domains[J]. Journal of Virology, 1997, 71(9): 6455-6464. |
| [4] |
Granzow H, Weiland F, Jöns A, et al. Ultrastructural analysis of the replication cycle of pseudorabies virus in cell culture:A reassessment[J]. Journal of Virology, 1997, 71(3): 2072-2082. |
| [5] |
Whealy ME, Card JP, Meade RP, et al. Effect of brefeldin A on alphaherpesvirus membrane protein glycosylation and virus egress[J]. Journal of Virology, 1991, 65(3): 1066-1081. |
| [6] |
Allepuz A, Saez M, Solymosi N, et al. The role of spatial factors in the success of an Aujeszky's disease eradication programme in a high pig density area(Northeast Spain, 2003-2007)[J]. Preventive Veterinary Medicine, 2009, 91(2-4): 153-160. DOI:10.1016/j.prevetmed.2009.06.005 |
| [7] |
方六荣, 陈焕春, 肖少波, 等. 伪狂犬病病毒gE基因在昆虫细胞中的高效表达[J]. 生物工程学报, 2001, 17(4): 449-451. DOI:10.3321/j.issn:1000-3061.2001.04.021 |
| [8] |
敖敬群, 王瑾雯, 陈新华, 等. PRV闽A株gE基因抗原编码区片段在昆虫细胞中的表达研究[J]. 中山大学学报:自然科学版, 2004, 43(5): 76-79. |
| [9] |
华俊清.利用杆状病毒系统表达猪伪狂犬病毒gE蛋白和猪繁殖与呼吸综合征病毒核衣壳N蛋白[D].武汉: 湖北大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10512-1013172799.htm
|
| [10] |
Serena MS, Geisler C, Metz GE, et al. Expression and purification of Suid Herpesvirus-1 glycoprotein E in the baculovirus system and its use to diagnose Aujeszky's disease in infected pigs[J]. Protein Expression & Purification, 2013, 90(1): 1-8. |
| [11] |
周金龙, 王同燕, 颜世君, 等. 伪狂犬病病毒gE基因在昆虫细胞中的表达[J]. 中国兽医科学, 2016, 46(2): 180-184. |
| [12] |
覃雅丽, 陈焕春, 唐勇, 等. 伪狂犬病病毒Ea株gE基因主要抗原区在巴斯德毕赤酵母中的表达[J]. 微生物学报, 2002, 42(5): 543-549. DOI:10.3321/j.issn:0001-6209.2002.05.005 |
| [13] |
敖敬群, 王瑾雯, 陈新华, 等. 伪狂犬病病毒闽A株gE基因去信号肽片段在Pichia pastoris中的表达[J]. 生物化学与生物物理进展, 2003, 30(4): 629-633. DOI:10.3321/j.issn:1000-3282.2003.04.024 |
| [14] |
任雪枫.猪伪狂犬病病毒gE抗原表位基因在巴斯德毕赤酵母中的表达和初步应用[D].南京: 南京农业大学, 2004. http://cdmd.cnki.com.cn/article/cdmd-10307-2004086226.htm
|
| [15] |
Morenkov OS, Fodor N, Sobko YA, et al. Immunological characterisation of glycoprotein E of Aujeszky's disease virus[J]. Virus Research, 1997, 51(1): 65-79. DOI:10.1016/S0168-1702(97)00077-4 |
| [16] |
陈沁韵, 万延民. IgG-Fc融合蛋白的研究进展[J]. 中国生物制品学杂志, 2015, 28(11): 1223-1227. |
| [17] |
Roopenian DC, Akilesh S. FcRn:the neonatal Fc receptor comes of age[J]. Nature Reviews Immunology, 2007, 7(9): 715-725. DOI:10.1038/nri2155 |
| [18] |
Lo K, Sudo Y, Chen J, et al. High level expression and secretion of Fc-X fusion proteins in mammalian cells[J]. Protein Engineering, 1998, 11(6): 495-500. DOI:10.1093/protein/11.6.495 |
| [19] |
Ghose S, Hubbard B, Cramer SM. Evaluation and comparison of alternatives to Protein A chromatography:Mimetic and hydrophobic charge induction chromatographic stationary phases[J]. Journal of Chromatography A, 2006, 1122(1-2): 144-152. DOI:10.1016/j.chroma.2006.04.083 |
| [20] |
孙海凤, 顾真庆, 董静, 等. 伪狂犬病病毒gB和gE蛋白单克隆抗体的制备与鉴定[J]. 中国兽医科学, 2015(3): 247-252. |
| [21] |
雷有玲, 李国泰, 鲍玉林, 等. 猪伪狂犬病毒gE蛋白单克隆抗体制备与鉴定[J]. 畜牧与兽医, 2018, 50(1): 109-112. |
| [22] |
王淑杰, 蔡雪辉, 刘永刚, 等. 伪狂犬病病毒gE基因的表达及gE蛋白单克隆抗体的制备[J]. 中国兽医科学, 2007, 37(8): 679-683. |




