雄性不育是高等植物中普遍存在的一种自然现象,指植物花器官从分化成雄蕊原基开始到产生功能性花粉期间,因受各种外界环境(光照、温度、化学试剂)及其自身特性的影响,造成植物的雄性生殖器官不能产生正常的功能性花粉,但雌性生殖器官正常发育[1]。植物的雄性不育来源比较广泛,可借助各种人工手段来获取雄性不育系,如天然的不育品种、自交、种间或种属间杂交、理化诱导和T-DNA插入诱导、基因工程等[2]。由于胞质雄性不育植株在生产应用上既可以筛选保持系,又可以获得恢复系,因此,可以利用“三系配套”进行高效人工制种。目前,国内获得辣椒三系品种的有向阳椒中发现并转成稳定不育系的8021A,以及21号牛角椒中发现并转育的不育系9704A,该品种的不育系和不育度均高达100%,经济性状优良、抗性好、品质优、有较强的配合力和社会生产价值[3-4]。
根据花粉的败育时期,将胞质雄性不育(Cytoplasmic male sterility,CMS)分为孢子体雄性不育和配子体雄性不育,两者都是在花粉发育的过程中出现了异常[5]。研究发现,9704A的不育系属于孢子体败育型。通过显微和超微结构观察发现,不育系9704A的成熟花药的药隔维管组织发育正常,但花药绒毡层细胞的核膜在花粉母细胞的细线期消失,随后核裂解消失,绒毡层进入花粉囊,与花粉母细胞黏连,导致减数分裂不能正常进行[6]。高等植物CMS的发生与RNA编辑有一定的关系。基因转录后通过碱基的插入、缺失或替换,使RNA产物的长度、结构发生变化从而影响基因的表达模式或创造嵌合基因,导致线粒体的功能紊乱,造成胞质雄性不育[7-9]。
ATP9作为线粒体呼吸代谢过程中的复合酶亚基基因,是一种重要的功能基因。大量研究表明,CMS与atp6、atp9等一些线粒体功能基因相关,一旦这些基因功能受损,将会直接影响生物体的正常能量供应,影响其生命活动[10]。目前,已有研究表明atp9是烟草的雄性不育相关基因,同时烟草也是植物基因工程常用的模式植物[11]。陶瑶[12]研究发现,与对照相比,转基因烟草的花粉活力明显下降。
植物线粒体atp9在棉花CMS系和保持系间编码区序列存在差异,并且在两系中发生不同的RNA编辑频率,改变蛋白质的疏水结构,增加物种间的保守性[13]。姜伟[14]研究推测atp9与大豆的败育可能存在一定的关系。吴国平[15]通过分子标记技术发现甜椒细胞质雄性不育系特异片段CMS T6A201的功能可能与逆转座子有关。
目前,关于辣椒胞质雄性不育形成机理的研究已经从细胞生物学、分子生物学、遗传学等角度展开并取得一定的研究进展,而与线粒体的作用关系一直是研究的热点。线粒体基因组和核基因组的相互冲突,影响了转录水平,转录后水平基因的调控,造成了雄性不育的发生。Touzet等[16]指出一些研究表明花粉的生产中断是由于线粒体的呼吸作用能量缺乏而导致的,并就CMS的未知机制的相关研究提出排他性的假说:花粉生产中断被一种只存在花药中且能改变细胞结构的物质所作用[17]。在辣椒雄性可育和不育株系中的线粒体atp6基因,通过反向PCR进行扩增,检测不育系中的该基因在3' 编码区域被截断[18]。新的开放阅读框可能来自线粒体NADH脱氢酶的基因,可能来自线粒体细胞色素氧化酶的基因,也可能是线粒体F0F1-ATP合酶的相关基因[19]。
本研究以辣椒胞质雄性不育系和同型保持系为试验材料,分离ATP9,比较ATP9的一级结构在2个材料和转录前后的差异,并进行时空表达分析,为研究辣椒胞质雄性不育机理提供依据。
1 材料与方法 1.1 材料选取湖南省蔬菜研究所选育的辣椒胞质雄性不育系9704A(不育率高达100%)和同型保持系9704B为试验材料。种植于云南农业大学后山园林园艺学院蔬菜实验基地。2个品种均于2017年1月上旬播种,2017年4月下旬定植,定植之后进行生长期常规管理。
待辣椒进入盛花盛果时期取样。在盛花期,取胞质雄性不育系9704A与同型保持系9704B的4个不同花期(造孢细胞增殖期、花粉母细胞减数分裂期、小孢子单核靠边期和小孢子成熟期)花蕾作为研究两系表达谱差异的材料; 在盛果期,取同型保持系9704B植株的茎、叶、花、果皮、胎座和种子6个不同组织作为组织表达材料。所取材料均需液氮冷冻后-80℃保存备用,用于DNA和RNA的提取。
1.2 方法 1.2.1 DNA和RNA的提取及cDNA的合成利用BioTeKe公司试剂盒提取DNA,用TRIzol试剂对各组织与花蕾不同发育时期的RNA进行提取,提取完毕后立即用紫外分光光度计和1%琼脂糖凝胶电泳双重检测RNA浓度与纯度,检测合格后,使用TaKaRa公司的反转录试剂盒进行cDNA的合成。
1.2.2 目的基因CaATP9的扩增根据GENbANK中公布的辣椒线粒体基因组中假定的ATP9序列为模板设计特异性引物扩增其CDS全长编码序列。用Primer 5.0设计特异性引物F1(5' -TTCAGTGTACCGCTTGTGACGCCTAT-3' )和R1(5' -CGCTCGCTCCCACCTGTCTTCTT-3' ),引物序列合成和基因测序均由昆明擎科生物技术有限公司完成。PCR反应条件为98℃ 2 min; 98℃ 10 s,58℃ 15 s,72℃ 10 s,35个循环; 72℃ 5 min,4℃保存。RT-PCR反应体系为94℃ 2 min; 94℃ 30 s,55℃ 30 s,72℃ 10 s,39个循环; 72℃ 5 min; 4℃保存。
1.2.3 生物信息学分析利用NCBI(http://www.ncbi.nlm.nih.gov)服务器上的Conserved Domain Architecture Retrieval Tool(CDART)工具(http://www.ncbi.nlm.nih.gov/BLAST)获取蛋白质的保守结构域; 利用GenScan(http://genes.mit.edu/GENSCAN.html)预测cDNA序列; 通过Compute pI/Mw Tool(http://us.expasy.org/tools/pi_tool.html)预测氨基酸的分子量(Mw)和等电点(pI); 利用SOPMA程序(http://npsa-pbil.ibcp.fr/)预测蛋白质二级结构; 使用DNAStar、BioEdit、ClustalX、MEGA 4和DNAman软件进行核苷酸序列及氨基酸序列的比对和构建系统进化树。
1.2.4 实时荧光定量PCR分析采用TaKaRa公司荧光定量试剂盒进行实时荧光定量PCR分析,染料为SYBR Green,在Applied Biosystem荧光定量PCR仪上进行,根据CaATP9的测序结果设计荧光定量引物为F2(5' -GAAGGTGCAAAATCAATGGG-3' )和R2(5' -CTAAAGGACTTGGAATACGA-3' )。qRT-PCR反应体系(20 μL)为10 μL SYBR Premix Ex TaqⅡ(购于TaKaRa公司)、10 µmol/L上下游引物各0.8 μL、2 μL cDNA模板、0.4 μL ROX Reference Dye Ⅱ和6 μL dH2O。反应程序为95℃ 30 s; 95℃ 5 s,60℃ 34 s,40个循环。每个样品设3次重复。熔解曲线分析:在65℃-95℃进行,每上升0.5℃读板一次,每次时间为5 s。
采取相对定量的方法,以ddH2O为阴性对照,以ACTIN为阳性内对照,所用引物为F3(5' -TGCAGGAATCCACGAGACTAC-3' )和R3(5' -TACCACCACTGAGCACAATGTT-3' ),采用2-ΔΔCT方法计算相对表达量。
2 结果 2.1 CaATP9的扩增分别以辣椒胞质雄性不育系9704A与同型保持系9704B的DNA和cDNA为模板进行扩增。均能扩增出一条约500 bp的目的条带,与预期结果相符(图 1)。
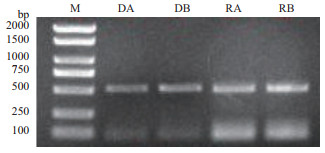
|
| M:DL2000;DA:9704A的DNA模板; DB:9704B的DNA模板; RA:9704A的RNA模板; RB:9704B的RNA模板 图 1 辣椒CaATP9扩增结果 |
经测序,该片段包含一个完整的开放阅读框(Open reading frame,ORF),长度为234 bp,编码一条由77个氨基酸残基组成的肽链(蛋白质)。分析发现,CaATP9在不育系和保持系之间的扩增序列完全一致。利用Compute pI/Mw Tool推测,发现CaATP9蛋白含有77个氨基酸残基(图 2),等电点为8.760,分子量为7.886 51 kD,无信号肽,PSORT程序亚细胞定位显示该蛋白位于内质网的概率是55.6%。DNA测序结果表明该片段在保持系和不育系中的片段序列完全一致,长度为234 bp,在两系之间不存在任何碱基差异。

|
| *代表终止密码子 图 2 辣椒CaATP9的CDS全序列及其编码的氨基酸序列 |
对CaATP9的DNA和cDNA序列进行比较,发现在保持系中,从RNA转录生成cDNA过程中,存在5处编辑位点,编辑方式均为c→t,不育系中也存在相同的编辑位点和编辑方式。这些编辑位点的出现,改变了氨基酸的种类,由4个亲水性氨基酸(DNA模板)变换成4个疏水氨基酸。编辑提高了蛋白质结构的疏水性,也增强了蛋白质三级结构的稳定性(图 3)。不育系和保持系中的DNA序列一致,cDNA序列也完全一致,不管是保持系还是不育系,都只是在DNA转录生成cDNA的过程中发生改变。

|
| 图 3 CaATP9在9704A与9704B中转录本的编辑位点 |
利用NCBI服务器上的Conserved Domain Archit-ecture Retrieval Tool(CDART)工具(http://www.ncbi.nlm.nih.gov/BLAST)对所推导的CaATP9蛋白质的保守结构域进行预测,该蛋白的保守结构域为ATPE和ATP-synt_C域,推测其属于超ATP-synt_C家族(图 4)。
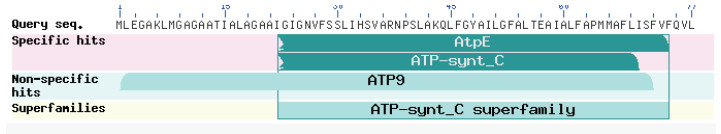
|
| 图 4 辣椒CaATP9编码蛋白质的保守域 |
利用SOPMA程序预测CaATP9蛋白的二级结构,其含65个α-螺旋(84.42%),6个β-转角(7.79%),6个无规则卷曲(7.79%)。预测的该蛋白质二级结构见图 5。
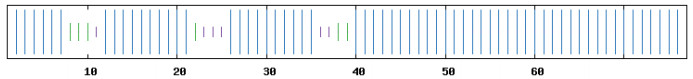
|
| 图 5 辣椒CaATP9蛋白的二级结构 |
CaATP9在胞质雄性不育系9704A与同型保持系9704B中编码的氨基酸序列无差异。通过Blast(protein)比对,并利用DNAStar、MEGA4、ClustalX、DNAMAN等生物信息学软件进行分析,发现辣椒CaATP9推导出来的蛋白质氨基酸序列与GenBank中烟草(YP_173404.1)、天仙子(YP_009121945.1)、阔叶十大功劳(AAW30239.1)、胡萝卜(AFB77174.1)、轮藻(NP_943666.1)、绿竹(ABY55207.1)ATP9氨基酸序列具有相似性(图 6)。
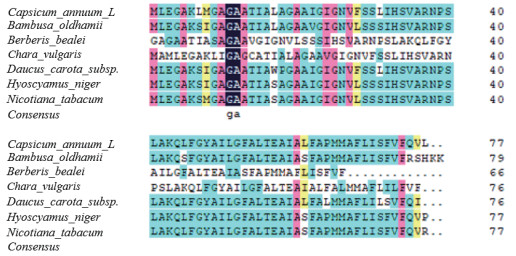
|
| 图 6 辣椒CaATP9蛋白与其他种类ATP9蛋白质序列比较 |
将辣椒CaATP9氨基酸序列与烟草(YP_173404.1)、天仙子(YP_009121945.1)、阔叶十大功劳(AAW30239.1)、胡萝卜(AFB77174.1)、轮藻(NP_943666.1)、绿竹(ABY55207.1)的ATP9氨基酸序列构建系统进化树,表明辣椒CaATP9与轮藻、胡萝卜的亲缘关系较近,与其他物种的亲缘关系稍远(图 7)。

|
| 图 7 辣椒CaATP9系统进化树 |
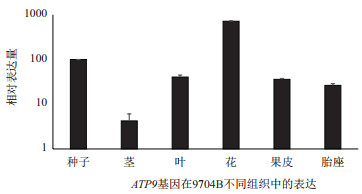
通过对CaATP9在辣椒同型保持系9704B的茎、叶、花、果皮、胎座、种子6个组织中的表达分析,结果(图 8)表明,6个组织中,CaATP9均有表达,但在不同组织中表达量差异较为明显,其中在花中的表达量最高,在茎中表达量最低。
|
| 图 8 CaATP9在9704B不同组织中的表达分析 |
利用实时荧光定量的方法,以辣椒胞质雄性不育系9704A与同型保持系9704B为材料,选取盛花期4个不同发育阶段的花蕾,对CaATP9的表达量进行分析。结果表明,CaATP9表达量在胞质雄性不育系9704A与保持系9704B中存在一定差异,特别是小孢子成熟期辣椒胞质雄性不育系与同型保持系中的表达水平差异极显著。伴随着小孢子的发育过程,在同保持系9704B花蕾中表现为先升高再下降的变化趋势,在小孢子单核期表达水平最高,在成熟期表达量最低。而辣椒胞质雄性不育系9704A中CaATP9的表达量呈现持续上升的趋势,在小孢子成熟期达到最高。
在不同材料花蕾发育的同一时期,CaATP9的表达也存在一定差异,在花蕾发育的造孢细胞增殖期和花粉的减数分裂时期,两种材料的表达水平差异不大; 在小孢子单核期,CaATP9的表达水平在辣椒胞质雄性不育系9704A中明显低于同型保持系9704B;在小孢子成熟期,CaATP9在辣椒胞质雄性不育系9704A的表达量明显高于同型保持系9704B,在同型保持系9704B中几乎不表达(图 9)。

|
| 1:造孢细胞增殖期; 2:花粉母细胞减数分裂期; 3:小孢子单核期; 4:小孢子成熟期 图 9 CaATP9在9704A与9704B花蕾不同发育时期中的表达 |
RNA编辑是一种发生在高等植物中转录后水平的基因表达调控现象,主要通过替换或插入、缺失等方式进行。在多数情况下,替换方式主要发生在植物线粒体和叶绿体基因组的转录本中[20]。发生RNA编辑的位点大多数都会影响氨基酸的序列,影响蛋白正常功能的发挥。通过分析发生RNA编辑后的氨基酸残基及其在蛋白质中的结构功能发现,编辑后的氨基酸通常由丝氨酸→亮氨酸/苯丙氨酸、精氨酸→色氨酸,由亲水性氨基酸变为疏水性氨基酸,增强了蛋白亚基互作的疏水性,可能更有助于蛋白间的互作; 其次RNA编辑的发生位点一般在蛋白二级结构的核心区,通过α螺旋的中断与折叠,增强蛋白三级结构的稳定性[21-22]。在本研究中,所选取的CaATP9在不育系和保持系均存在RNA编辑,且编辑方式为碱基替换,替换方式均为C-T的替换,该替换是因为基因组DNA编码的C残基发生了脱氨基来完成的[23]。CaATP9在不育系和保持系中发生碱基替换,且替换的位点和方式均一致,发生的编辑一般都是在密码子的第一、第二位,仅个别发生在第三位,发生在密码子第三位的RNA编辑一般不会造成氨基酸种类的改变,而第一、第二位点的RNA编辑会通过改变氨基酸的种类,增加蛋白结构的疏水性,提高蛋白三级结构的稳定性。
线粒体作为植物能量的“动力工厂”,为植物提供90%以上的必需能量。线粒体内膜上的5个复合体,参与氧化呼吸,通过一系列递氢和递电子传递链,产生ATP。能量是植物正常生长发育的必要条件,贯穿植物的整个生命活动过程。植物的呼吸速率不仅代表代谢活动的强弱,也可以显示植物生长过程的能量代谢强度。一些研究表明,花药发育过程中,不育系的呼吸速率明显低于保持系[24-25]。在保持系9704B的各组织中,基本呈现生殖器官(花、果、种子)CaATP9的表达量高于营养器官(茎、叶),与前人的研究成果“生殖器官的呼吸速率明显高于营养器官”一致[26-29]。
小孢子的正常发育是决定植株可育的关键因素。目前,单子叶植株的花粉败育主要发生在小孢子成熟后期,双子叶植物的花粉败育主要发生在四分体时期或小孢子发育时期[30]。辣椒作为典型的双子叶植物,其败育主要发生在四分体时期。本研究表明,在小孢子发育过程中,辣椒胞质雄性不育系的9704A的CaATP9基因的表达与同型保持系9704B相比存在较大的差异,这种表达差异有可能造成线粒体能量代谢系统的紊乱,导致在小孢子发育期间能量供应不足,引起败育。
4 结论CaATP9通过碱基替换、插入或缺失的方式进行编辑。推测该基因的RNA编辑产物可能会导致线粒体功能不能正常发挥而引起雄性不育。
在辣椒花蕾发育的4个时期,CaATP9在不育系9704A和保持系9704B中表达量差异较为明显。由于CaATP9与线粒体呼吸代谢活动相关,推测其可能在转录后水平对辣椒的胞质雄性不育起作用。
| [1] |
范彦君, 王瑜, 刘齐元, 等. 植物细胞质雄性不育研究进展[J]. 中国农学通报, 2016, 32(18): 70-75. DOI:10.11924/j.issn.1000-6850.casb15110120 |
| [2] |
李六林. 植物雄性不育机理研究[M]. 北京: 中国农业科学技术出版社, 2008.
|
| [3] |
杨世周, 赵雪云. 辣椒8021A雄性不育系的选育及三系配套[J]. 中国蔬菜, 1984(3): 9-13. |
| [4] |
邹学校, 周群初, 戴雄泽, 等. 辣椒雄性不育系9704A的选育[J]. 湖南农业科学, 2000(5): 39-40. DOI:10.3969/j.issn.1006-060X.2000.05.020 |
| [5] |
邵贵芳, 张凡, 王姣, 等. 辣椒雄性不育的研究进展[J]. 生物技术通报, 2017, 33(8): 7-13. |
| [6] |
何长征, 刘志敏, 熊兴耀, 等. 辣椒细胞质雄性不育系9704A花药发育的细胞学观察[J]. 园艺学报, 2008(4): 521-528. DOI:10.3321/j.issn:0513-353X.2008.04.009 |
| [7] |
Wei L, Yan ZX, Ding Y. Mitochondrial RNA editing of FO-ATPase subunit 9 gene(atp9)transcripts of Yunnan purple rice cytoplasmic male sterile line and its maintainer line[J]. Acta Physiol Plant, 2008, 30(5): 657-662. DOI:10.1007/s11738-008-0162-6 |
| [8] |
Zhao YH, Liao XF, et al. Mutation in the coding sequence of atp6 are associated with male sterile cytomaplasm in kenaf(Hibiscus cannabinus L.)[J]. Euphytica, 2016, 207(1): 169-175. DOI:10.1007/s10681-015-1559-0 |
| [9] |
Sttahl R, Sun S, et al. RNA editing of transcripts of a chimeric mitochondrial gene associated with cytoplasmic male-sterility in Brassica[J]. Nucl Acids Res, 1994, 22(11): 2109-2113. DOI:10.1093/nar/22.11.2109 |
| [10] |
Hanson MR, Bentolila S. Interactions of mitochondrial and nuclear genes that affect male gametophyte development[J]. The Plant Cell, 2004, 16: 5154-5169. |
| [11] |
谢丽娟, 陶瑶, 等. 烟草atp9基因RNAi表达载体的构建及遗传转化[J]. 江西农业大学学报, 2017, 39(1): 28-36. |
| [12] |
陶瑶. orf25和atp9基因干扰对烟草雄性不育性的影响[D].南昌: 江西农业大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10410-1017272421.htm
|
| [13] |
史计, 张晓, 郭三堆.棉花线粒体atp9基因克隆及表达分析[C]//中国棉花学会, 2010年年会论文汇编.
|
| [14] |
姜伟.大豆质核互作雄性不育系与保持系基因差异表达分析及atp9基因RNA编辑研究[D].南京: 南京农业大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10307-1012272547.htm
|
| [15] |
吴国平.甜椒CMS育性相关基因的分子标记筛选与应用[D].南京: 南京农业大学, 2012. http://d.wanfangdata.com.cn/Thesis/Y2362092
|
| [16] |
Touzet P, Meyer EH. Cytoplasmic male sterility and mitochondrial metabolism in plants[J]. Mitochondrion, 2014, 19: 166-171. DOI:10.1016/j.mito.2014.04.009 |
| [17] |
Flavell R. A model for the mechanism of cytoplasmic male sterility in plants, with special reference to maize[J]. Plant Science Letters, 1974, 3(4): 259-263. DOI:10.1016/0304-4211(74)90096-0 |
| [18] |
Kim DH, Kim BD. The organization of mitochondrial atp6 gene region in male fertile and CMS lines of pepper(Capsicum annuum L.)[J]. Curr Genet, 2006, 49(1): 59-67. |
| [19] |
Horn R, Gupta KJ, Colombo N. Mitochondrion role in molecular basis of cytoplasmic male sterility[J]. Mitochondrion, 2014, 19(3): 198. |
| [20] |
何鹏, 陈海燕, 俞嘉宁. PPR蛋白参与RNA编辑机制的研究进展[J]. 西北植物学报, 2013, 33(2): 415-421. DOI:10.3969/j.issn.1000-4025.2013.02.032 |
| [21] |
Sugita M, Miyata Y, Maruyama K, et al. Extensive RNA editing in transcripts from the PsbB operon and RpoA gene of plastids from the enigmatic moss Takakia lepidozioides[J]. Bioscience, Biotechnology and Biochemistry, 2006, 70(9): 2268-2274. DOI:10.1271/bbb.60204 |
| [22] |
Yuar K, Go M. Correlation between amino acid residues converted by RNA editing and functional residues in protein three-dimensional structures in plant organelles[J]. BMC Plant Biology, 2008, 8: 79-85. DOI:10.1186/1471-2229-8-79 |
| [23] |
Licht K, Jantsch MF. Rapid and dynamic transcriptome regulation by RNA editing and RNA modifications[J]. Cell Biol, 2016, 213: 15-22. DOI:10.1083/jcb.201511041 |
| [24] |
王永勤, 曹家树, 虞慧芳, 等. 白菜核雄性不育两用系生理生化特性的分析[J]. 园艺学报, 2003, 30(2): 212-214. DOI:10.3321/j.issn:0513-353X.2003.02.021 |
| [25] |
Villarreal F, Martín V, et al. Ectopic expression of mitochondrial gamma carbonic anhydrase 2 causes male sterility by anther indehi-scence[J]. Plant Molecular Biology, 2009, 70(4): 471-485. DOI:10.1007/s11103-009-9484-z |
| [26] |
梁峥, 郑光植. 植物呼吸代谢多条路线与代谢工程[J]. 植物生理学通讯, 1994, 30(4): 290-292. |
| [27] |
邹立基. 植物呼吸作用教学的体会[J]. 植物生理学通报, 1991(4): 303-305. |
| [28] |
肖敬平, 汤佩松. 对植物整体呼吸代谢和能力系统的探索[J]. 植物生理学通讯, 1987(1): 73-77. |
| [29] |
薛应龙.呼吸代谢的生理意义及调控问题//植物生理学专题讲座[C].北京: 科学出版社, 1987: 211-243.
|
| [30] |
邱义兰, 刘珠丽, 等. 辣椒细胞质雄性不育花药败育及淀粉粒分布的细胞学观察[J]. 分子细胞生物学报, 2008(4): 283-293. |




