2. 青藏高原动物遗传资源保护与利用国家教育部重点实验室,成都 6100041
2. Key Laboratory of Qinghai-Tibetan Plateau Animal Genetic Resource Reservation and Exploitation of Ministry of Education, Chengdu 610041
牦牛(Bos grunniens)是起源于中国的原始物种,主要分布于青藏高原及其周围海拔3 000 m以上的高原地区,其适应高寒、低氧能力强,被誉为“高原之舟”,是当地牧民获取肉、奶、皮毛、役力、燃料等生产生活资料的重要来源。然而牦牛较普通牛种繁殖性能低下,多为两年一胎或三年两胎,因此极大限制了牦牛产业发展[1]。卵泡发育、卵母细胞成熟以及排卵等过程受各种因子及卵泡内外环境共同调控[2-4]。肿瘤坏死因子α诱导蛋白(Tumor necrosis factor-alpha induced protein,TNFAIP)由肿瘤坏死因子(Tumor necrosis factorα,TNFα)诱导产生。该家族的成员包括TNFAIP(1-9)[5]。TNFAIP6又被称为TNF刺激基因6(TNF-stimulated gene-6,TSG-6),之前普遍认为该基因由机体对炎症信号做出反应而表达[6],但随着研究进展发现促黄体素(LH)也能够诱导卵巢卵丘细胞(Cumulus cells,CCs)表达TNFAIP6基因[7-8]。研究表明TNFAIP6正向调控CCs扩散过程,在卵泡发育、排卵、黄体化及胚胎发育中起着非常关键的作用[9-10]。因此,进行牦牛卵巢TNFAIP6基因研究对进一步探索其在牦牛生殖中的作用机制具有重要意义。
TNFAIP6蛋白包含Link和CUB两个结构域,其中Link结构域介导该蛋白与透明质酸(Hyaluronic acid,HA)及α-胰蛋白酶抑制剂(Inter-α trypsin inhibitor,ⅠαⅠ)共价结合,形成稳定的三元复合物存在于包括卵丘卵母细胞复合体(COCs)在内的多种生物系统中,参与细胞附着、增殖、分化和凋亡等生物学过程[11-13]。早期对TNFAIP6基因的研究较多是在癌症机制方面,如乳腺癌[14]、直肠癌[15]等。另外TNFAIP6基因参与炎症过程,在关节炎患者的关节滑液中检测到该基因有表达[16],其还通过调控肺部嗜酸性粒细胞的细胞周期而影响小鼠的哮喘进程[17]。随着研究深入,发现TNFAIP6基因在生殖中具有重要作用。LH能够诱导小鼠颗粒细胞中TNFAIP6基因表达,并且该基因在靠近卵母细胞的内层颗粒细胞中表达显著高于外层颗粒细胞[7-8]。研究发现TNFAIP6基因在发情周期受损的小鼠卵巢中低表达,引起生殖激素分泌紊乱,导致卵母细胞功能不全并影响排卵[18-19]。猪卵母细胞体外成熟24 h时TNFAIP6表达量达到最高,这有利于减数分裂进程以及胚胎发育,但TNFAIP6持续高表达会影响卵母细胞减数分裂成熟和后续的胚胎发育[20]。Ochsner等[7]研究表明,TNFAIP6由cAMP/PKA信号通路诱导产生,抑制该信号通路后TNFAIP6表达缺失。TNFAIP6缺失后,TNFAIP6/HA复合物形成受到抑制,卵丘扩散受损而导致小鼠不孕[21]。
目前关于TNFAIP6基因的研究主要集中在肿瘤等疾病及其他动物生殖方面,而在牦牛生殖作用中研究尚未见报道。本研究以牦牛为对象,克隆获得TNFAIP6基因序列并对其进行生物信息学及蛋白功能结构预测分析; 半定量PCR法检测TNFAIP6基因在牦牛各组织中的表达情况; 采用蛋白免疫印迹(Western blot,WB)和实时荧光定量PCR(Quantitative real-time PCR,qRT-PCR)法分别检测TNFAIP6在不同发情期牦牛卵巢中的蛋白和mRNA表达水平。为深入研究牦牛TNFAIP6基因及其在促进牦牛卵巢发育和排卵等方面的作用机制提供基础资料。
1 材料与方法 1.1 材料 1.1.1 样品采集本试验所有样本均采自四川省广汉市屠宰场。3-5岁健康的空怀期雌性牦牛(n=9),屠宰后无菌采集心脏、肺脏、脾脏、肾脏、肝脏、子宫、小肠、胃、肌肉和处于不同活动时期(卵泡期、红体期、黄体期)的卵巢组织,采集后用无菌生理盐水清洗,剪成约1 cm3大小后装入冻存管,投入液氮罐2-3 h内带回实验室保存备用。
1.1.2 主要材料与试剂TRIzol提取试剂从Invitro-gen公司购入; PrimeScriptTM RT Reagent Kit反转录试剂盒、Premix TapTM DNA聚合酶、pMD-19T载体、DNA Marker及SYBRⓇ Premix Ex TaqTMⅡ试剂盒均从TaKaRa公司购入; 抗体从Abcam公司购入; 感受态细胞DH5α购于天根生化科技有限公司; BCA蛋白浓度测定试剂盒、DNA胶回收试剂盒从Beyotime公司购入; 所有引物均由南京金瑞斯生物科技有限公司合成。其他未作说明的化学试剂均为国产分析纯。
1.2 方法 1.2.1 组织总RNA和总蛋白提取 1.2.1.1 各组织总RNA的提取和反转录严格按照Trizol法说明书步骤提取组织总RNA。核酸浓度测定仪测定其纯度,选择范围为1.8-2.0的RNA作为模板。按照TaKaRa公司的PrimeScriptTM RT Reagent Kit反转录试剂盒说明书合成cDNA,-20℃保存备用。
1.2.1.2 不同发情时期卵巢组织总蛋白的提取卵巢组织剪部分称重后分别置于提前预冷标号的EP管中,再将根据RIPA裂解液说明书混匀后的裂解液按照0.1 g组织/0.6 mL的比例加入EP管中,利用超声破碎仪将组织打碎,待匀浆即EP管中无明显组织碎块后加入缓冲液(总体积的1/3),水浴锅中97℃煮5 min,再将EP管放入离心机中16 000 r/min,15 min后取上清液置于新的EP管中。根据BCA蛋白浓度测定试剂盒说明书测定蛋白浓度。
1.2.2 引物设计及合成根据NCBI数据库中GenBank所公布野牦牛(Bos mutus)TNFAIP6基因的mRNA序列(GenBank登录号:XM_005894773.2)和GAPDH基因的mRNA序列(GenBank登录号:AC_000162.1),利用Premier 5.0软件分别设计目的基因的PCR扩增引物和荧光定量引物,将设计的引物用NCBI中Primer-BLAST在线比对工具进行质量检测。引物序列见表 1。
以牦牛卵巢cDNA为模板进行扩增。TNFAIP6基因扩增体系25 μL:2×LA Taq Master Mix 12.5 μL,上游、下游引物各1 μL,cDNA模板1 μL,ddH2O 9.5 μL。反应条件:94℃预变性4 min,94℃变性45 s,61℃退火45 s,72℃延伸1 min,35个循环,72℃再延伸7 min,最后4℃保存。用1.5%琼脂糖凝胶电泳检测PCR扩增结果,按照胶回收试剂盒说明书纯化回收目的DNA。将胶回收产物连接转化后,筛选3个阳性克隆。样品送生工生物工程有限公司进行测定。
1.2.4 牦牛TNFAIP6基因生物信息学分析利用NCBI中BLAST和ConservedDomin程序对测序所得牦牛TNFAIP6核苷酸序列分别进行同源性分析和结构域预测; ProtParam预测牦牛TNFAIP6蛋白的基本理化性; MEGA5.0和ClustalX1.83构建系统进化树。PredictProtein和SWISS-MODEL预测TNFAIP6的二级结构和三级结构。
1.2.5 牦牛TNFAIP6基因组织表达谱分析以内参基因GAPDH作为参照,采用半定量PCR检测TNFAIP6基因在牦牛心脏、肺脏、脾脏、肾脏、肝脏、子宫、小肠、胃、肌肉和卵巢中的表达情况,并检测条带灰度值确定相对表达量。为使比较更加明显,将各组织cDNA模板浓度进行检测后一致调整为40 ng/μL。反应条件同1.2.3。1.5%琼脂糖凝胶电泳检测PCR扩增结果。
1.2.6 TNFAIP6在牦牛发情周期卵巢活动中的时序表达分析 1.2.6.1 Western blot法检测TNFAIP6蛋白表达水平提取蛋白后加入5×蛋白Loading Buffer,混匀后100℃水浴10 min使蛋白变性,水浴结束后12 000 r/min离心1 min。将离心好的蛋白质进行SDS-聚丙烯酰胺凝胶电泳,当溴酚蓝移至凝胶下缘时停止电泳,剥下凝胶后放入PVBD膜上并与之完全贴合。用封闭液将PVBD膜完全浸没后置于摇床上40 r/min摇动封闭1 h。将PVBD膜与TNFAIP6兔抗人多克隆抗体(1:1 000稀释)封在塑胶薄膜中,放于40 r/min摇床后4℃过夜孵育。次日取出PVBD膜后用TBST洗膜,重复洗3次,每次10 min。将洗后的PVBD膜与辣根过氧化物酶(HRP)标记的羊抗兔二抗(1:2 000稀释)封在塑胶薄膜中,放于40 r/min摇床,室温摇动1 h孵育。孵育结束用TBST洗膜,重复洗3次,每次10 min。GAPDH作为内参照,洗膜后曝光显影。
1.2.6.2 qRT-PCR法检测TNFAIP6 mRNA表达水平以TNFAIP6基因作为研究对象,内参基因GAPDH作为参照,根据SYBR® Premix Ex TaqTM Ⅱ试剂盒说明书进行qRT-PCR。反应体系为15 μL:7.5 μL SYBR® Premix Ex TaqTMⅡ,0.5 μL上游引物,0.5 μL下游引物,1 μL模板cDNA,5.5 μL ddH2O。反应条件为:95℃预变性3 min; 95℃变性10 s,60℃退火30 s,72℃延伸30 s,40个循环; 熔解曲线:从60℃以0.5℃/10 s的速度升至95℃。引物见表 1,每个样品重复3次。
1.2.7 数据分析利用SPASS软件进行分析。荧光定量结果采用2-∆∆Ct进行分析,ANOVA显著性差异分析,P > 0.05表示差异不显著,P < 0.01表示差异极显著。
2 结果 2.1 牦牛TNFAIP6基因克隆和扩增测序采用RT-PCR法对TNFAIP6基因进行扩增,用1.5%琼脂糖凝胶电泳检测PCR扩增结果,得到与预期大小1 082 bp基本一致的目的片段,如图 1所示。阳性菌液经公司测序验证获得牦牛TNFAIP6基因核苷酸序列全长1 082 bp,其中编码区为830 bp。

|
| M:DNA相对分子质量标准DL2000;1:TNFAIP6;2:空白对照 图 1 牦牛TNFAIP6基因PCR扩增结果 |
利用NCBI在线比对程序对牦牛TNFAIP6测定序列编码区与设计引物所用野牦牛(Bos mutus GenBank登录号:XM_005894773.2)的对应序列进行比对,结果显示同源性为99.4%,且测序所得牦牛TNFAIP6基因序列编码区共存在4处碱基突变,密码子变化由TGT→TGC、CAG→AAG、GAG→GAA、ACA→AGA,第2、4个密码子改变导致第28位、133位氨基酸变化由Q→K、T→R。
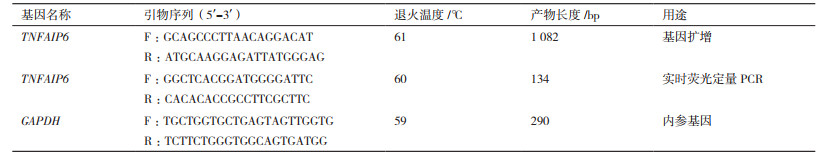
2.3 TNFAIP6基因物种间的同源性比对利用NCBI在线比对程序对克隆得到的牦牛TNFAIP6核苷酸序列与野牦牛(Bos mutus GenBank登录号:XM_005894773.2)、黄牛(Bos taurus GenBank登录号:NM_001007813.2)、马(Equus caballus GenBank登录号:NM_001081906.1)、人(Homo sapiens GenBank登录号:NM_007115.4)、小鼠(Mus musculus GenBank登录号:NM_009398.2)、猕猴(Nemestrina GenBank登录号:XM_011759906.1)、家兔(Oryctolagus cuniculus GenBank登录号:NM_001082311.1)、黑猩猩(Pan paniscus GenBank登录号:XM_003818305.1)、野猪(Sus scrofa GenBank登录号:NM_001159607.1)和北极熊(Ursus maritimus GenBank登录号:XM_008686978.1)的TNFAIP6核苷酸序列进行同源性比对(图 2)。结果显示,牦牛TNFAIP6基因序列与野牦牛和黄牛的同源性高达99.4%和99.3%;与马、人、猕猴、家兔、黑猩猩、野猪和北极熊的同源性也较高。表明牦牛TNFAIP6基因在哺乳动物长期进化的过程中保守性较强。
|
| 图 2 牦牛TNFAIP6基因与其他物种的同源性比对 |
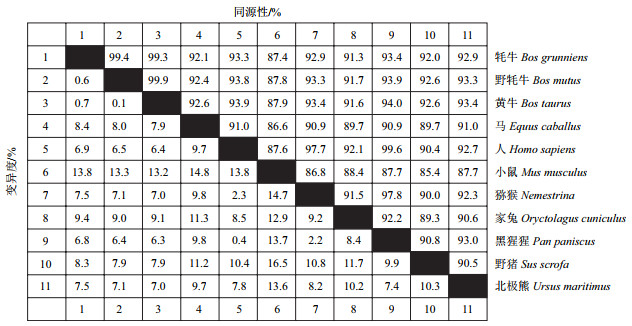
利用MEGA5.0软件对11个物种TNFAIP6基因的CDS区进行了遗传进化树分析,结果如图 3所示,牦牛与黄牛及野牦牛的亲缘关系最近; 与人、马、野猪、猕猴、黑猩猩、北极熊形成一个分支; 与小鼠和家兔的亲缘关系较远。
|
| 图 3 牦牛TNFAIP6基因与其他物种的系统进化树 |
牦牛TNFAIP6蛋白的理化性质结果显示,该蛋白原子总数为4 396,分子量为32 kD,分子式为C1438H2168N378O404S12。脂肪族指数81.79,预计半衰期为30 h,理论等电点为6.31,不稳定指数为36.26,亲水性平均值为-0.237,可推测TNFAIP6蛋白为稳定的亲水酸性蛋白。TNFAIP6蛋白共包含20种氨基酸,出现频率较高的有Gly(10.0%)、Leu(7.9%)、Ala(7.2%)、Ile(6.5%)、Tyr(6.5%)、Val(6.5%),无Pyl和Sec。带负电荷的残基总数(Asp+Glu)为33个,带正电荷的残基总数(Arg+Lys)为30个,因此该蛋白整体上带负电。
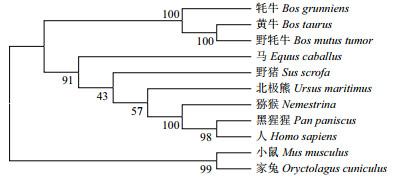
ProtScale工具进行亲水性预测分析,牦牛TNFAIP6蛋白亲水性在第6位最大为3.400,第120位最小为-2.433,且大多数氨基酸残基亲水性分值小于零,即具有亲水性,这与该蛋白的理化性质分析结果一致。跨膜结构域和信号肽分析结果表明,牦牛TNFAIP6蛋白无跨膜结构,在第17-18位氨基酸存在信号肽。NCBI中CDD分析该蛋白结构域,结果显示该蛋白共包含2个结构域,其中第36-128位氨基酸为Link(透明质酸结合域)结构域,第135-244位氨基酸为CUB结构域(图 4)。编码区蛋白修饰磷酸化位点预测显示,该蛋白具有36个磷酸化位点,其中丝氨酸(Ser)位点17个、酪氨酸(Tyr)位点12个、苏氨酸(Thr)位点7个; 糖基化位点预测显示,该蛋白具有N-糖基化位点和O-糖基化位点各1个,且阈值均在0.5以上。牦牛TNFAIP6蛋白二级结构预测显示,该蛋白含114个无规卷曲占40.86%,83个α-螺旋占29.75%,58个延伸链占20.79%,24个β-折叠占8.60%,可推测该蛋白的主要组成元件为无规卷曲和α-螺旋,与该蛋白三级结构预测结果一致(图 5)。
|
| 图 4 牦牛TNFAIP6蛋白结构域预测 |

|
| 图 5 牦牛TNFAIP6蛋白的三级结构预测 |
半定量PCR检测TNFAIP6基因在牦牛各组织中的表达,电泳图(图 6-A)及灰度分析(图 6-B)结果显示,TNFAIP6基因在牦牛各组织中均有表达,但存在一定的差异。其中,卵巢、子宫、脾脏和肌肉组织中表达量显著高于其他组织,心脏次之,肺脏、肾脏、肝脏、小肠、胃中表达相对较少。
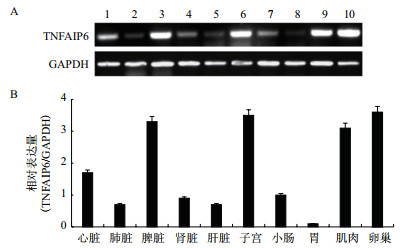
|
| 1:心脏; 2:肺脏; 3:脾脏; 4:肾脏; 5:肝脏; 6:子宫; 7:小肠; 8:胃; 9:肌肉; 10:卵巢 图 6 牦牛TNFAIP6基因组织表达(A)及灰度分析(B) |
内参基因GAPDH作为参照,采用qRT-PCR法检测发情周期牦牛卵巢TNFAIP6基因的表达水平,并用Western blot法检测发情周期牦牛卵巢TNFAIP6蛋白的表达量。Western blot结果显示,卵泡期TNFAIP6蛋白水平最高,其次为黄体期(图 7-A)。qRT-PCR结果显示TNFAIP6基因在牦牛不同发情期的卵巢中均有表达,其中卵泡期表达水平极显著高于其他两个时期(P < 0.01),而红体期与黄体期表达水平差异不显著(P > 0.05)(图 7-B)。不同时期卵巢中TNFAIP6蛋白水平与转录水平基本一致。

|
| 不同小写字母代表差异极显著(P < 0.01),相同小写字母代表差异不显著(P > 0.05) 图 7 牦牛发情周期卵巢组织中TNFAIP6蛋白(A)和mRNA(B)的表达 |
TNFAIP6是一类分泌蛋白,介导多种免疫调节和修复,直接或间接参与细胞黏附、生长分化、迁移等生物学过程[22-23]。有研究表明,TNFAIP6基因在卵丘细胞外基质中具有结构作用,或增强ⅠαⅠ的抗保护作用,以保护细胞外基质不被降解,对排卵过程至关重要[24]。目前,国内外关于TNFAIP6基因在牦牛上的研究尚未见报道。本试验首次以牦牛卵巢为模板克隆得到TNFAIP6基因序列,其中包含完整的CDS区。与设计引物所用的野牦牛序列进行比对,发现编码区序列有4处碱基突变,导致部分氨基酸序列发生改变,但这种改变是否会造成该基因对生殖功能的影响有待进一步验证。结构域分析表明该蛋白具有Link和CUB两个结构域,Briggs等[25]研究发现TNFAIP6蛋白的Link结构域具有HA特异性结合位点,能够调节HA活性。同源性分析发现,该基因与野牦牛、黄牛的同源性最高,与进化树亲缘关系分析结果相符,提示牦牛TNFAIP6基因在长期进化过程中具有较高的保守性。
组织表达谱研究发现,TNFAIP6基因在牦牛各组织和器官中均有表达,但表达量存在差异,其中在卵巢、子宫和脾脏组织中表达水平较高,这与已有研究结果相近[26-27]。TNFAIP6作为抗炎症因子[28],其在结肠炎[29]、胰腺炎[30]等炎症及癌症[31]中发挥重要作用,脾脏是机体最大的免疫器官,TNFAIP6基因在其内的高表达说明该基因的抗炎抑癌作用可能与机体的免疫系统相关,此问题有待进一步验证。同时该基因在卵巢和子宫组织中的高表达提示其可能对牦牛生殖调控具有一定作用。
哺乳动物性成熟后其卵巢会进行周期性排卵活动,即突出于卵巢表面的成熟卵泡发生破裂,COCs随基质排出[32],这个过程受卵丘细胞(Cumulus cells,CCs)扩散等生物学过程的调节[33]。有研究表明CCs的增殖扩散对卵泡生长、排卵以及黄体化过程具有重要的作用[10]。Mukhopadhyay等[8]免疫组织化学法检测排卵前卵泡发现,TNFAIP6蛋白与HA共同分布在CCs周围的基质中。同时Assidi等[9]指出TNFAIP6参与卵泡发育及卵丘扩散等生物学过程的调控。为了进一步探索TNFAIP6在牦牛生殖过程中的作用,本试验通过Western blot和qRT-PCR法检测该蛋白在牦牛发情周期卵巢活动中的表达规律。结果显示,随着发情周期卵巢活动变化,TNFAIP6的蛋白表达水平与转录水平均存在规律性变化,且二者表达规律基本一致,其中卵泡期表达水平极显著的高于红体期和黄体期。有研究表明,TNFAIP6主要在卵泡内层颗粒细胞中表达,而外层颗粒细胞基本不表达,卵泡发育过程中卵泡腔逐渐形成,外层和内层颗粒细胞也分别分化形成壁颗粒细胞和CCs[7, 10]。随着卵泡不断生长发育,CCs中TNFAIP6表达量增加,并且发育至排卵前卵泡时,CCs及其周围的基质中TNFAIP6 mRNA表达量达到最高[8]。另外,LH能促进TNFAIP6蛋白表达[7],排卵前LH激增,高表达的TNFAIP6蛋白与HA和ⅠαⅠ结合形成三元复合物共同调节细胞基质形成并积聚在CCs之间[12]。最终引起基质膨胀以及卵丘细胞扩散[34]。因此,排卵前(卵泡期)TNFAIP6的高表达可归于该基因对卵泡期卵丘细胞扩散的调控作用。排卵后卵巢进入红体期,此时由于成熟卵泡中富含TNFAIP6的基质以及CCs随卵母细胞排出卵泡腔[32],导致TNFAIP6表达量下降。之后卵巢进入黄体期,牛卵巢发情周期中存在2个卵泡波,当第2个卵泡波的优势卵泡进行排卵后,卵巢又进入第1个卵泡波,开始发育新的卵泡[35],同时内层颗粒细胞也向CCs分化,CCs中的TNFAIP6表达量也随之上升,参与到基质形成中,所以黄体期TNFAIP6的表达显著低于卵泡期而稍高于红体期。以上结果表明,TNFAIP6基因参与牦牛卵巢活动的调控,在牦牛繁殖中起着重要的作用。
4 结论本试验成功克隆牦牛TNFAIP6基因。该基因编码区长830 bp,在生物进化过程中具有很强的保守性。牦牛TNFAIP6 mRNA在各组织中广泛表达,其中在卵巢、子宫、脾脏和肌肉组织中表达较高。牦牛不同发情期卵巢中TNFAIP6蛋白表达水平与转录水平基本一致,且卵泡期表达量均显著高于红体期和黄体期,提示该基因参与了牦牛卵泡的发育,具体作用机制有待进一步研究。
| [1] |
兰道亮, 熊显荣, 位艳丽, 等. 基于RNA-Seq高通量测序技术的牦牛卵巢转录组研究:进一步完善牦牛基因结构及挖掘与繁殖相关新基因[J]. 中国科学:生命科学, 2014, 44(3): 307-317. |
| [2] |
Abbara A, Clarker SA, Dhillo WS. Novel concepts for inducing final oocyte maturation in in vitro fertilization treatment[J]. Endocr Rev, 2018, 39(5): 593-628. DOI:10.1210/er.2017-00236 |
| [3] |
Kirkpatrick BW, Morris CA. A major gene for bovine ovulation rate[J]. PLoS One, 2015, 10(6): e0129025. DOI:10.1371/journal.pone.0129025 |
| [4] |
Knapp E, Sun J. Steroid signaling in mature follicles is important for Drosophila ovulation[J]. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(4): 699-704. DOI:10.1073/pnas.1614383114 |
| [5] |
李涛, 李敏, 姬新颖, 朱玉楠. 肿瘤坏死因子α诱导蛋白家族与疾病的关系[J]. 细胞与分子免疫学杂志, 2014, 30(4): 433-436. |
| [6] |
Lee RH, Pulin AA, Seo MJ, et al. Intravenous hMSCs improve myocardial infarction in mice because cells embolized in lung are activated to secrete the anti-inflammatory protein TSG-6[J]. Cell Stem Cell, 2009, 5(1): 54-63. DOI:10.1016/j.stem.2009.05.003 |
| [7] |
Ochsner SA, Day AJ, Rugg MS, et al. Disrupted function of tumor necrosis factor-α-stimulated gene 6 blocks cumulus cell-oocyte complex expansion[J]. Endocrinology, 2003, 144(10): 4376-4384. DOI:10.1210/en.2003-0487 |
| [8] |
Mukhopadhyay D, Hascall VC, Day AJ, et al. Two distinct populations of tumor necrosis factor-stimulated gene-6 protein in the extracellular matrix of expanded mouse cumulus cell-oocyte complexes[J]. Archives of Biochemistry and Biophysics, 2001, 394(2): 173-181. DOI:10.1006/abbi.2001.2552 |
| [9] |
Assidi M, Dufort I, Ali A, et al. Identification of potential markers of oocyte competence expressed in bovine cumulus cells matured with follicle-stimulating hormone and/or phorbol myristate acetate in vitro[J]. Biology of Reproduction, 2008, 79(2): 209. DOI:10.1095/biolreprod.108.067686 |
| [10] |
Blase FH, Kimble KM. Functional signaling and gene regulatory networks between the oocyte and the surrounding cumulus cells[J]. BMC Genomics, 2018, 19(1): 351. DOI:10.1186/s12864-018-4738-2 |
| [11] |
Higman VA, Briggs DC, Mahoney DJ, et al. A refined model for the TSG-6 link module in complex with hyaluronan:use of defined oligosaccharides to probe structure and function[J]. The Journal of Biological Chemistry, 2014, 289(9): 5619-5634. DOI:10.1074/jbc.M113.542357 |
| [12] |
Kohda D, Morton CJ, Parkar AA, et al. Solution structure of the link module:A hyaluronan-binding domain involved in extracellular matrix stability and cell migration[J]. Cell, 1996, 86(5): 767-775. DOI:10.1016/S0092-8674(00)80151-8 |
| [13] |
Nagyova E. The biological role of hyaluronan-rich oocyte-cumulus extracellular matrix in female reproduction[J]. International Journal of Molecular Sciences, 2018, 19(1): 283. DOI:10.3390/ijms19010283 |
| [14] |
Zhang Y, He W, Zhang S. Seeking for correlative genes and signaling pathways with bone metastasis from breast cancer by integrated analysis[J]. Front Oncol, 2019, 9: 138. DOI:10.3389/fonc.2019.00138 |
| [15] |
Offenberg H, Brunner N, Mansilla F, et al. TIMP-1 expression in human colorectal cancer is associated with TGF-B1, LOXL2, INHBA1, TNF-AIP6 and TIMP-2 transcript profiles[J]. Molecular Oncology, 2008, 2(3): 233-240. DOI:10.1016/j.molonc.2008.06.003 |
| [16] |
Mahoney DJ, Swales C, Athanasou NA, et al. TSG-6 inhibits osteoclast activity via an autocrine mechanism and is functionally synergistic with osteoprotegerin[J]. Arthritis and Rheumatism, 2011, 63(4): 1034-1043. DOI:10.1002/art.30201 |
| [17] |
Swaidani S, Cheng G, Lauer ME, et al. TSG-6 protein is crucial for the development of pulmonary hyaluronan deposition, eosinophilia, and airway hyperresponsiveness in a murine model of asthma[J]. Journal of Biological Chemistry, 2013, 288(1): 412-422. DOI:10.1074/jbc.M112.389874 |
| [18] |
Hohos NM, Cho KJ, Swindle DC, et al. High-fat diet exposure, regardless of induction of obesity, is associated with altered expression of genes critical to normal ovulatory function[J]. Molecular and Cellular Endocrinology, 2018, 470: 199-207. DOI:10.1016/j.mce.2017.10.016 |
| [19] |
Vigone G, Merico V, Prigione A, et al. Transcriptome based identification of mouse cumulus cell markers that predict the developmental competence of their enclosed antral oocytes[J]. BMC Genomics, 2013, 14: 380. DOI:10.1186/1471-2164-14-380 |
| [20] |
Yuan Y, Ida JM, Paczkowski M, et al. Identification of developmental competence-related genes in mature porcine oocytes[J]. Molecular Reproduction and Development, 2011, 78(8): 565-575. DOI:10.1002/mrd.21351 |
| [21] |
Fuloop C, Szanto S, Mukhopadhyay D, et al. Impaired cumulus mucification and female sterility in tumor necrosis factor-induced protein-6 deficient mice[J]. Development, 2003, 130(10): 2253-2261. DOI:10.1242/dev.00422 |
| [22] |
Prockop DJ. Inflammation, fibrosis, and modulation of the process by mesenchymal stem/stromal cells[J]. Matrix Biology, 2016, 51: 7-13. DOI:10.1016/j.matbio.2016.01.010 |
| [23] |
Day AJ, Milner CM. TSG-6:A multifunctional protein with anti-inflammatory and tissue-protective properties[J]. Matrix Biology, 2018. |
| [24] |
Fulop C, Kamath RV, Li Y, et al. Coding sequence, exon-intron structure and chromosomal localization of murine TNF-stimulated gene 6 that is specifically expressed by expanding cumulus cell-oocyte complexes[J]. Gene, 1997, 202(1-2): 95-102. DOI:10.1016/S0378-1119(97)00459-9 |
| [25] |
Briggs DC, Birchenough HL, Ali T, et al. Metal ion-dependent heavy chain transfer activity of TSG-6 mediates assembly of the cumulus-oocyte matrix[J]. The Journal of Biological Chemistry, 2015, 290(48): 28708-28723. DOI:10.1074/jbc.M115.669838 |
| [26] |
Liu Q, Li Y, Feng Y, et al. Single-cell analysis of differences in transcriptomic profiles of oocytes and cumulus cells at GV, MI, MⅡ stages from PCOS patients[J]. Scientific Reports, 2016, 6: 39638. DOI:10.1038/srep39638 |
| [27] |
Ashworth MD, Ross JW, Stein D, et al. Endometrial gene expression of acute phase extracellular matrix components following estrogen disruption of pregnancy in pigs[J]. Animal Reproduction Science, 2010, 122(3-4): 215-221. DOI:10.1016/j.anireprosci.2010.08.013 |
| [28] |
Zhang C, Zhang B, Wang H, et al. Tumor necrosis factor alpha-stimulated gene-6(TSG-6)inhibits the inflammatory response by inhibiting the activation of P38 and JNK signaling pathway and decreases the restenosis of vein grafts in rats[J]. Heart and Vessels, 2017, 32(12): 1536-1545. DOI:10.1007/s00380-017-1059-3 |
| [29] |
Song WJ, Li Q, Ryu MO, et al. TSG-6 secreted by human adipose tissue-derived mesenchymal stem cells ameliorates DSS-induced colitis by inducing M2 macrophage polarization in mice[J]. Scientific Reports, 2017, 7(1): 5187. DOI:10.1038/s41598-017-04766-7 |
| [30] |
Li Q, Song WJ, Ryu MO, et al. TSG-6 secreted by human adipose tissue-derived mesenchymal stem cells ameliorates severe acute pancreatitis via ER stress downregulation in mice[J]. Stem Cell Research and Therapy, 2018, 9(1): 255. DOI:10.1186/s13287-018-1009-8 |
| [31] |
Rachidi SM, Qin T, Sun S, et al. Molecular profiling of multiple human cancers defines an inflammatory cancer-associated molecular pattern and uncovers KPNA2 as a uniform poor prognostic cancer marker[J]. PLoS One, 2013, 8(3): e57911. DOI:10.1371/journal.pone.0057911 |
| [32] |
Duffy DM, Ko C, Jo M, et al. Ovulation:parallels with inflamma-tory processes[J]. Endocrine Reviews, 2019, 40(2): 369-416. DOI:10.1210/er.2018-00075 |
| [33] |
Bender HR, Trau HA, Duffy DM. Placental growth factor is required for ovulation, luteinization, and angiogenesis in primate ovulatory follicles[J]. Endocrinology, 2018, 159(2): 710-722. DOI:10.1210/en.2017-00739 |
| [34] |
Jang YJ, Park JI, Moon WJ, et al. Cumulus cell-expressed type Ⅰ interferons induce cumulus expansion in mice[J]. Biology of Reproduction, 2015, 92(1): 20. |
| [35] |
Ginther OJ. Variations in follicle-diameter deviation and a growth spurt in the dominant follicle at deviation in Bos taurus heifers[J]. Animal Reproduction Science, 2018, 188: 155-164. DOI:10.1016/j.anireprosci.2017.11.020 |