2. 内蒙古农业大学食品科学与工程学院,呼和浩特 010018
2. College of Food Science and Engineering, Inner Mongolia Agricultural University, Hohhot 010018
类黄酮(Flavonoids)是广泛存在于植物中的次级代谢产物,泛指2个苯环通过脂肪族三碳链相互联结而成的一系列低分子量酚类化合物[1]。迄今为止,已有10 000多个类黄酮类化合物被分离鉴定[2]。类黄酮分布广泛,在植物的生长、发育、开花、结果及耐盐、抗旱、抵抗紫外线、抗菌、抗病等方面都起着重要作用[3-4]。类黄酮类物质是具有多种生物学活性的一类植物次级代谢产物,具有重要的食用和药用价值,一直以来都受到国内外众多研究者的高度重视[5-6]。近年来,类黄酮研究领域一直非常活跃,并取得许多重要进展[7]。目前已发现其在人体内可以发挥抗氧化活性、保护肝脏活性、抗菌活性、抗炎活性及抗癌活性及抗病毒活性等[8-9]。
类黄酮是在胞浆多酶复合体的催化下,经由苯丙烷代谢途径合成的[10]。参与类黄酮生物合成途径的酶主要包括:查尔酮合成酶(Chalcone synthase,CHS)、查尔酮异构酶(Chalcone isomerase,CHI)和黄酮醇合成酶(Flavonol synthase,FLS)等[11]。查尔酮异构酶(EC 5.5.1.6)是类黄酮合成途径中的第二个关键酶,催化分子内的环化反应[12]。查尔酮异构酶是一个多基因家族,但由于在进化上源自共同的祖先,因此,不同基因的编码区同源性很高,其结构和催化机制也极其相似。但在不同物种中,其基因拷贝数和时空表达模式存在很大差异,并且受到多种因素的诱导[13]。查尔酮异构酶是植物体内花青素以及其他类黄酮合成的必需酶,通常以单体的形式存在于植物中,由于其蛋白三维折叠结构的特异性,常作为植物特有的标记基因[14]。作为类黄酮合成途径上游的重要酶,查尔酮异构酶对调控整个代谢途径起着重要作用,直接影响下游各种类黄酮化合物,如异黄酮、花青素等的含量。近年来应用外源CHI基因转化植物的研究报道很多,主要集中在改变观赏植物的花色和提高果蔬、药用植物中类黄酮的含量等方面[15]。
中间锦鸡儿(Caragana intermedia)是豆科锦鸡儿属植物,落叶灌木,具有广泛的适应性和很强的抗逆性,在长期抵御逆境的过程中,形成了一系列适应在恶劣环境下生存的特有机制[16-17]。中间锦鸡儿营养物质含量丰富,还含有类黄酮、芪类、苯丙素和萜类等多种次级代谢产物,是传统中、蒙药药材,其花、根、种子等部位均可入药[18-19]。但对其抗逆机制、类黄酮代谢及其与抗逆性之间的关系鲜见报道。
本研究以豆科已知CHI基因的保守结构域设计简并引物,以中间锦鸡儿cDNA为模板,克隆CiCHI的cDNA全长,并对其进行了序列分析和系统进化分析,通过转基因拟南芥研究CiCHI的功能,为进一步揭示中间锦鸡儿的抗逆机制提供理论依据。
1 材料与方法 1.1 材料中间锦鸡儿种子采自内蒙古自治区呼和浩特市和林格尔县(111.82°E,40.38°N)。野生型拟南芥Columbia-0生态型(Col-0)、大肠杆菌DH5α、根癌农杆菌GV3101和植物表达载体质粒pCanG-HA由内蒙古自治区植物逆境生理与分子生物学重点实验室保存。T载体pMD19-T Vector购自TaKaRa公司。
1.2 方法 1.2.1 CiCHI的克隆及分析采用TRIzol法[20]提取中间锦鸡儿和拟南芥总RNA。去除样品中的DNA后,反转录合成cDNA第一链。
根据豆科已知CHI基因的保守结构域设计简并引物(表 1),以中间锦鸡儿cDNA为模板,使用Clontech公司的RACE试剂盒获得3'-和5'-末端序列。通过分析、比对、拼接后得到CiCHI的全长序列。PCR引物合成及产物测序由上海生工生物公司完成。
将CiCHI的ORF(Open reading frame)序列在NCBI上进行Blast比对,筛选出与其相似度最高的序列进行系统进化分析。利用Mega 5.0软件,采用Neighbour-Joining算法构建系统进化树[21]。不同物种的CHI基因序列分别从NCBI数据库(https://www.ncbi.nlm.nih.gov/)、TAIR数据库(http://www.arabidopsis.org/)和植物基因组数据库(https://phytozome.jgi.doe.gov/pz/portal.html)中获得。
1.2.2 中间锦鸡儿的处理方法选取植物培养室(温度22℃,16 h光照/8 h黑暗)生长一个月左右、长势一致的中间锦鸡儿幼苗进行胁迫处理,检测CiCHI的表达量变化。每个样品均为3株幼苗地上部分的混合样品。紫外(UV-C)辐照处理(紫外光强度为120.5 lx,紫外灯照射距离为1 m)、NaCl和脱落酸(Abscisic acid,ABA)胁迫处理(NaCl浓度200 mmol/L,ABA浓度200 μmol/L)的取样时间为0、0.5、1、3、6、9、12和24 h。进行3次生物学重复。提取胁迫处理样品的总RNA,以CkEF1α(KC679842)作为内参基因,利用qRT-PCR在Light Cycler 480实时荧光定量PCR仪(Roche公司)上对CiCHI的表达量进行检测。基因表达量以2-ΔCT法计算。
1.2.3 pCanG-CiCHI植物表达载体的构建获得CiCHI编码区(ORF),并插入克隆载体pEASY-Blunt Simple中(北京全式金生物公司),将测序验证后的序列用In-Fusion酶连入由CaMV35S启动子驱动的植物表达载体pCanG-HA中,进行菌落PCR及双酶切验证,将验证正确的重组质粒电转化农杆菌GV3101感受态细胞,进行菌落PCR鉴定。
1.2.4 拟南芥遗传转化及纯合体筛选采用浸花法将重组植物表达载体pCanG-CiCHI转入野生型拟南芥(Col-0)[22],收取成熟的种子种在含有25 μg/mL卡那霉素的1/2 MS平板培养基上筛选阳性植株。提取T3代转基因植株总RNA,反转录成cDNA,利用特异引物CiCHI-F-5' 和CiCHI-F-3' 进行PCR鉴定。利用qRT-PCR对CiCHI在转基因株系中的表达量进行检测。反应体系为SYBR Premix Ex Taq(TaKaRa公司)10 μL、稀释的cDNA模板5 μL、上、下游引物各0.8 μL(10 μmol/L)和DEPC水3.4 μL。反应程序为95℃ 30 s; 95℃ 5 s,60℃ 30 s,72℃ 15 s,40个循环。AtEF1α(AT5G60390)作为内参基因,基因表达量以2-ΔCT法计算,选取4株表达水平较高的不同转化株系进行后续表型试验。
1.2.5 转基因拟南芥总黄酮含量检测剪取正常生长条件下(22℃,16 h光照/8 h黑暗)40日龄的拟南芥植株地上部分,每个株系取3株植物,用液氮研磨成粉末。采用硝酸铝比色法进行总黄酮含量的测定[23],3次生物学重复。
2 结果 2.1 CiCHI的克隆与序列分析据豆科已知CHI基因的保守序列设计简并引物,扩增得到509 bp的单一条带(图 1-A),经测序后比对,发现该片段与蒺藜苜蓿CHI基因相似度最高(84%)。利用RACE技术克隆其缺失的cDNA序列,分别得到248 bp的5'-端和473 bp的3'-端cDNA序列(图 1-B)。
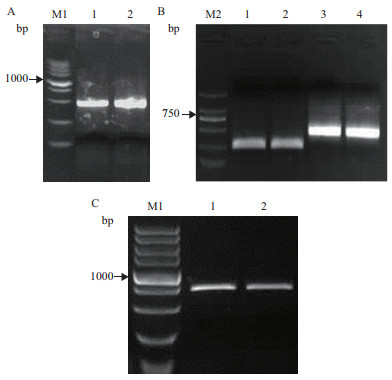
|
| A:CiCHI中间片段; B:CiCHI RACE扩增结果,1、2为5'-RACE扩增产物,3、4为3'-RACE扩增产物; C:CiCHI的ORF扩增结果; M1为DL5000 Marker; M2为DL2000 Marker 图 1 CiCHI的克隆 |
经测序分析正确后,利用Vector NTI 10将克隆到的序列片段进行拼接,得到CiCHI的cDNA全长序列。以中间锦鸡儿cDNA为模板,使用特异引物扩增其cDNA序列(图 1-C),连接克隆载体验证后,确定拼接结果正确。得到CiCHI的cDNA全长为1 005 bp,其中ORF为678 bp,5'-UTR为110 bp,3'-UTR为217 bp,编码225个氨基酸。
2.2 CiCHI蛋白的系统进化分析为进一步了解CiCHI与其他物种该类基因之间的进化关系,将CiCHI蛋白序列与其他已知物种中相似度最高的CHI蛋白序列进行比对,并构建系统进化树(图 2)。结果表明,CiCHI与蒺藜苜蓿的CHI最为相似,二者与其他豆科植物的CHI构成一个大分支; 而同为芸香科的蜜桔、柚子和甜橙构成一个分支。说明CiCHI与豆科植物的CHI功能最相近。进化树中使用的序列都是NCBI中注释为Chalcone isomerase(CHI)的基因,即查尔酮异构酶基因家族的成员,因此可以确定CiCHI为该基因家族的成员。
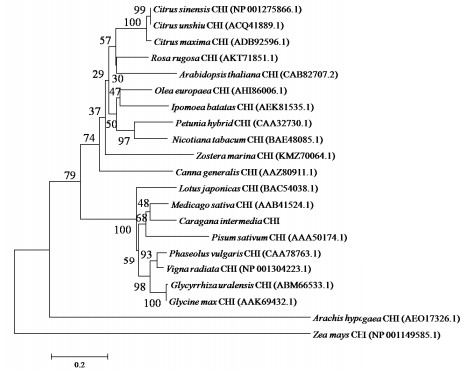
|
| 图 2 CiCHI与其他物种来源的CHI构建的系统进化树 |
查尔酮异构酶催化类黄酮的生成,起到抵抗氧化胁迫的作用。通过检测CiCHI在紫外、NaCl和ABA等胁迫处理下的表达模式(图 3)发现紫外照射处理下,CiCHI表达量呈先升高后降低的趋势,在6 h时表达量最高(图 3-A)。NaCl处理下,CiCHI表达量同样先升高后降低,在1 h时表达量最高(图 3-B)。ABA处理下,CiCHI的表达受到抑制,在1 h表达量最低(图 3-C)。
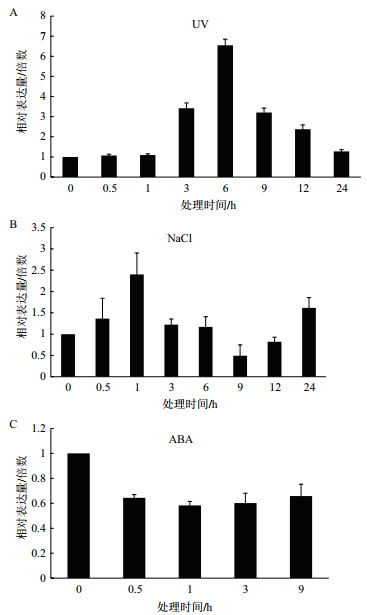
|
| 图 3 不同胁迫处理下CiCHI的表达分析 |
通过对30日龄中间锦鸡儿根、茎、叶中CiCHI进行qRT-PCR分析(图 4)发现,CiCHI在所有被检测的组织中都有不同程度的表达。在室内种植的叶中表达量最高,茎中相对较高,根中最少。在野外采摘的花中表达量高,种子中表达量低。
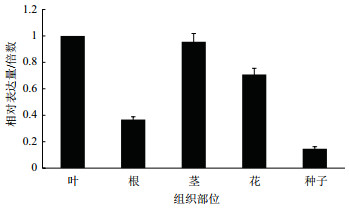
|
| 图 4 CiCHI的组织特异性表达分析 |
对重组质粒进行双酶切鉴定,可以获得目的片段,表明载体构建成功。
通过农杆菌介导的浸花法获得具有卡那霉素抗性的来自不同转化的阳性植株10株,提取这些株系的总RNA并合成cDNA,利用qRT-PCR检测CiCHI在转基因株系中的表达水平(图 5),选取表达量较高的4个株系OE-13、OE-32、OE-37和OE-46进行后续表型检测试验。
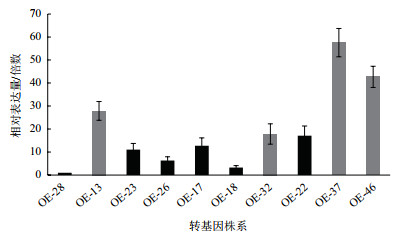
|
| 灰色柱代表的4个转基因株系表达量较高,选为后续表型试验所用株系 图 5 转基因株系CiCHI表达水平检测 |
按照硝酸铝比色法的具体步骤绘制芦丁标准曲线(图 6-A)。芦丁质量浓度X和吸光值Y的关系为:Y=1.081X-0.004,R2=0.999,表明在芦丁浓度0-0.96 mg/mL中,该标准曲线线性良好。按此方法进行转基因拟南芥总黄酮含量的测定(图 6-B)。结果表明,转基因各株系总黄酮的含量均高于野生型,且达到显著水平。说明过表达CiCHI可以使拟南芥中总黄酮含量明显增加。
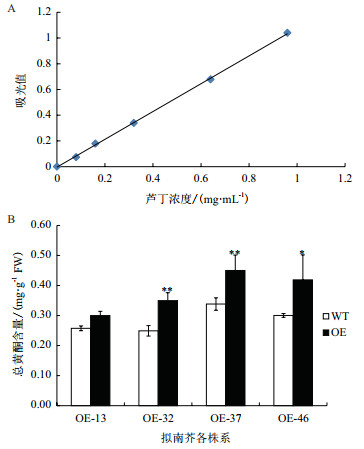
|
| A:芦丁标准曲线; B:转基因拟南芥的总黄酮含量; *和**分别表示在P < 0.05和P < 0.01水平差异显著 图 6 野生型和转基因拟南芥总黄酮含量比较 |
类黄酮是锦鸡儿中迄今为止被发现的最重要的活性成分,在植物-环境相互作用中发挥着极其重要的功能。类黄酮在植物体内的生物合成几乎完全是由氧化胁迫引起的,是植物组织在不同胁迫下的抗氧化防御系统。它们可以吸收最具能量的太阳光(UV),抑制活性氧的产生,一旦活性氧过量形成可以将其及时清除; 类黄酮可以调节生长素的运输和代谢作用,对植物在胁迫诱导下形态的发生具有重要价值[24]。本研究检测了转基因拟南芥中总黄酮的含量,由于CiCHI的大量表达,4个转基因株系的总黄酮含量均显著高于野生型,说明CiCHI参与了拟南芥的类黄酮代谢,为研究植物类黄酮代谢提供了新的基因源。
查尔酮异构酶是类黄酮生物合成途径的第二个限速酶,是植物体内类黄酮合成的必需酶,对调控整个代谢途径起着重要作用,可使反应速率提高107倍,直接影响下游各种类黄酮化合物的生成[13]。系统进化分析显示,CHI在整个进化过程中相对保守,序列相似性达51%-94%[14]。经过比对分析发现本研究获得的CiCHI与蒺藜苜蓿的CHI基因相似度最高,达84%,可以确定其为查尔酮异构酶。
查尔酮异构酶基因家族不同成员的表达具有明显的组织特异性[13]。本研究检测了CiCHI在不同部位的表达量发现,其表达量存在很大差异。结果显示CiCHI在室内种植的叶中表达量最高; 茎中相对较高; 根中最少。在野外采摘的花中表达量高,种子中表达量低,与已报道的研究结果一致[25-26]。由于根、茎、叶采自室内幼苗,花和种子采自野外自然生长的植物。因此,其生长条件、生长时间等各方面因素均不相同,使其表达量无法比较。
查尔酮异构酶家族基因受不同胁迫处理诱导,如UV、干旱、损伤和NaCl等,从而引起类黄酮含量的增加,使其抗氧化等抵御逆境的能力提高[15, 27]。本研究发现中间锦鸡儿CiCHI受到紫外、NaCl和ABA等处理的诱导,不同处理方式下该基因的表达模式不同。在受到紫外和NaCl胁迫时表达模式基本一致,开始受到胁迫影响时,表达量升高,生成大量类黄酮以帮助机体抵抗氧化胁迫的影响。但随着胁迫压力的增加,其表达量开始降低,可能其产物水平已经达到一定量并不再大量增加,此时机体也可能已经启动了其他的胁迫响应机制。ABA处理使CiCHI的表达受到抑制。
4 结论克隆得到中间锦鸡儿CiCHI,其开放阅读框678 bp,编码225个氨基酸。CiCHI受到紫外、NaCl、ABA等胁迫诱导。在叶中表达量最高,茎中相对较高,根中最少; 花中表达量高,种子中低。拟南芥中超表达CiCHI可使其总黄酮含量增加。
| [1] |
Julkunen-Tiitto R, Nenadis N, Neugart S, et al. Assessing the response of plant flavonoids to UV radiation:an overview of appropriate techniques[J]. Phytochemistry Reviews, 2014, 14(2): 273-297. |
| [2] |
Li X, Zhang L, Ahammed GJ, et al. Nitric oxide mediates brassinosteroid-induced flavonoid biosynthesis in Camellia sinensis L.[J]. Journal of Plant Physiology, 2017, 214: 145-151. DOI:10.1016/j.jplph.2017.04.005 |
| [3] |
Hichri I, Barrieu F, Bogs J, et al. Recent advances in the transcriptional regulation of the flavonoid biosynthetic pathway[J]. Journal of Experimental Botany, 2011, 62(8): 2465-2483. DOI:10.1093/jxb/erq442 |
| [4] |
Ma DY, Sun DX, Wang CY, et al. Expression of flavonoid biosynthesis genes and accumulation of flavonoid in wheat leaves in response to drought stress[J]. Plant Physiology and Biochemistry, 2014, 80: 60-66. DOI:10.1016/j.plaphy.2014.03.024 |
| [5] |
Dixon RA, Pasinetti GM. Flavonoids and isoflavonoids:from plant biology to agriculture and neuroscience[J]. Plant Physiology, 2010, 154(2): 453-457. DOI:10.1104/pp.110.161430 |
| [6] |
Kumar S, Pandey AK. Chemistry and biological activities of flavonoids:an overview[J]. The Scientific World Journal, 2013, 2013(11/12): 162750. |
| [7] |
Perez-Vizcaino F, Fraga CG. Research trends in flavonoids and health[J]. Archives of Biochemistry & Biophysics, 2018, 646: 107-112. |
| [8] |
Lotha R, Sivasubramanian A. Flavonoids nutraceuticals in prevent and treatment of cancer:a review[J]. Asian Journal of Pharmaceutical and Clinical Research, 2018, 11(1): 42-47. DOI:10.22159/ajpcr.2018.v11i1.23410 |
| [9] |
Stanisic D, Costa AF, Cruz G, et al. Studies in natural products chemistry:Chapter 6- Applications of flavonoids, with an emphasis on hesperidin, as anticancer prodrugs:phytotherapy as an alternative to chemotherapy[M]. Amsterdam: Elsevier, 2018: 161-212.
|
| [10] |
Ferreyra MLF, Rius SP, Casati P. Flavonoids:biosynthesis, biological functions and biotechnological applications[J]. Frontiers in Plant Science, 2012, 3: 222. |
| [11] |
Petrussa E, Braidot E, Zancani M, et al. Plant flavonoids--biosynthesis, transport and involvement in stress responses[J]. International Journal of Molecular Sciences, 2013, 14(7): 14950-14973. DOI:10.3390/ijms140714950 |
| [12] |
Morita Y, Takagi K, Fukuchi-Mizutani M, et al. A chalcone isomerase-like protein enhances flavonoid production and flower pigmentation[J]. The Plant Journal, 2014, 78(2): 294-304. DOI:10.1111/tpj.12469 |
| [13] |
Park SH, Lee CW, Cho SM, et al. Crystal structure and enzymatic properties of chalcone isomerase from the Antarctic vascular plant Deschampsia antarctica Desv.[J]. PLoS One, 2018, 13(2): e0192415. DOI:10.1371/journal.pone.0192415 |
| [14] |
Yin YC, Zhang XD, Gao ZQ, et al. The research progress of chalcone isomerase(CHI)in plants[J]. Molecular Biotechnology, 2019, 61(1): 32-52. DOI:10.1007/s12033-018-0130-3 |
| [15] |
Wu YQ, Zhu MY, Jiang Y, et al. Molecular characterization of chalcone isomerase(CHI)regulating flower color in herbaceous peony(Paeonia lactiflora Pall.)[J]. Journal of Integrative Agriculture, 2018, 17(1): 122-129. DOI:10.1016/S2095-3119(16)61628-3 |
| [16] |
Bai J, Kang T, Wu HD, et al. Relative contribution of photorespiration and antioxidative mechanisms in Caragana korshinskii under drought conditions across the Loess Plateau[J]. Functional Plant Biology, 2017, 44(11): 1111-1123. DOI:10.1071/FP17060 |
| [17] |
Yang FY, Yang TR, Liu K, et al. Analysis of metabolite accumulation related to pod color variation of Caragana intermedia[J]. Molecules, 2019, 24(4): 717. DOI:10.3390/molecules24040717 |
| [18] |
Luan GX, Wang HL, Lv HH, et al. Separation and purification of five flavone glucosides and one lignan from Caragana korshinskii Kom. by the combination of HSCCC and semi-preparative RPLC[J]. Chromatographia, 2016, 79(13): 823-831. |
| [19] |
Zeng Z, Ji ZY, Hu N, et al. A sensitive pre-column derivatization method for the analysis of free fatty acids by RP-HPLC with fluorescence detector and its application to Caragana species[J]. Journal of Chromatography B, 2017, 1064: 151-159. DOI:10.1016/j.jchromb.2017.07.037 |
| [20] |
韩晓敏.中间锦鸡儿3个非生物胁迫相关转录因子的克隆与功能分析[D].呼和浩特: 内蒙古农业大学, 2015: 24-26. http://cdmd.cnki.com.cn/Article/CDMD-10129-1016907241.htm
|
| [21] |
白洁, 杨杞, 郭琳, 等. 中间锦鸡儿查尔酮合成酶基因的克隆和表达分析[J]. 基因组学与应用生物学, 2016, 35(1): 87-93. |
| [22] |
Clough SJ, Bent AF. Floral dip:a simplified method for Agrobacterium-mediated transformation of Arabidopsis thaliana[J]. The Plant Journal, 1998, 16(6): 735-743. DOI:10.1046/j.1365-313x.1998.00343.x |
| [23] |
杨飞芸, 武燕燕, 崔爽, 等. 异源表达CiRS基因通过生成白藜芦醇增强拟南芥的抗氧化能力[J]. 中国生物工程杂志, 2017, 37(12): 27-33. |
| [24] |
Zhang QF, Liu MY, Ruan JY. Metabolomics analysis reveals the metabolic and functional roles of flavonoids in light-sensitive tea leaves[J]. BMC Plant Biology, 2017, 17(1): 64. DOI:10.1186/s12870-017-1012-8 |
| [25] |
Dastmalchi M, Dhaubhadel S. Soybean chalcone isomerase:evolution of the fold, and the differential expression and localization of the gene family[J]. Planta, 2014, 241(2): 507-523. |
| [26] |
Wang HL, Wang W, Zhan JC, et al. Tissue-specific accumulation and subcellular localization of chalcone isomerase(CHI)in grapevine[J]. Plant Cell, Tissue and Organ Culture, 2019. DOI:10.1007/s11240-019-01557-y |
| [27] |
Morita Y, Takagi K, Fukuchi-Mizutani M, et al. A chalcone isomerase-like protein enhances flavonoid production and flower pigmentation[J]. The Plant Journal, 2014, 78(2): 294-304. DOI:10.1111/tpj.12469 |





