2. 沈阳农业大学土地与环境学院 土肥资源高效利用国家工程实验室,沈阳 110866
2. College of Land and Environment, Shenyang Agricultural University/National Engineering Laboratory for Efficient Utilization of Soil and Fertilizer, Shenyang 110866
土壤盐渍化是制约农业发展、威胁粮食生产安全的全球性问题。据统计,盐渍危害致使全球每年新增绝收耕地面积(0.3-1.5)×106 hm2、减产耕地面积(0.20-0.46)×106 hm2[1]。当前,全世界现有灌溉农业耕地面积2.3×108 hm2[2],其中约20%的面积已经遭到不同程度的盐渍化危害,受全球气候变化和不合理农事活动的继续影响,预计到2050年,这一比例还将进一步扩大到50%[1-2]。遏制盐渍化蔓延,开发、利用盐渍土地和发展耐盐农业生产迫在眉睫。
番茄(Solanum lycopersicum L.)是一种世界性蔬菜作物,具有产量高、营养丰富、用途广泛、栽培方式灵活以及栽培季节较长等诸多特点,它的规模化种植在促进世界各国农民增收和确保全球粮食生产安全方面具有举足轻重的作用[3-4]。栽培番茄虽中度耐盐[4],但生长介质中的盐分浓度过高也会致其组织水分亏缺,并造成离子毒害和营养失衡,进一步抑制了光合作用的充分发挥,最终表现为产量降低,商品性变差,给农业生产造成严重的经济损失。因此,研究盐渍逆境下番茄植株的生理、生态变化及其机制,对其高产、优质栽培及耐盐品种选育鉴定具有极其重要的意义。
水杨酸(Salicylic acid,SA)又名邻羟基苯甲酸,是普遍存在于植物体内的一种小分子酚类化合物。作为信号分子,SA介导了植物生长发育及其相关生理代谢的诸多过程。如种子萌发、细胞生长、幼苗发育、气孔关闭、光合与呼吸作用、开花和衰老等[5-6]。SA还可参与植物对病虫[7-8]、旱涝、盐渍、热激、低温、紫外辐射和重金属等[5, 9-18]生物与非生物逆境胁迫的防御应答。多年来,围绕应用外源SA增强植物抗逆性的研究一直是学术界广泛关注的热点。大量研究表明,SA的施用效应除了决定于植物种类、生长发育阶段及胁迫强度外,还与其施用的浓度和方式(叶面喷施、浸种或根部处理)有关[18]。
目前,外源SA调节番茄适应盐渍胁迫适宜浓度筛选的研究多限于对其喷施方式的探讨[14],并且研究手段也较为单一(仅限于对抗氧化酶、渗透调节物质或光合色素等单一指标的报道),有关同步利用气体交换、叶绿素荧光技术和测定抗氧化生理指标系统分析不同浓度SA影响植物光合生理特征的研究鲜见报道。
本研究以“秦丰保冠”番茄幼苗为材料,通过NaCl模拟盐害环境,研究不同浓度(50、100、200、400、800 μmol/L)SA对盐胁迫下幼苗生长、叶片光合及抗氧化相关生理指标的影响,旨在探究根施SA对番茄幼苗盐胁迫伤害的缓解效应,并筛选出适宜的SA使用浓度,为进一步探明SA调节番茄幼苗耐盐的生理生态机制,合理利用SA解决番茄栽培中的盐害问题和培育抗盐番茄品种提供一定科学依据。
1 材料与方法 1.1 材料供试番茄品种为“秦丰保冠”,种子由西安秦丰蔬菜研究所提供。选取均匀、饱满、大小一致的种子浸泡于55℃温水中,3-4 h取出后放在铺有湿润纱布的培养皿内,置于29℃恒温箱中催芽,露白后将芽势相近的种子播于装有蛭石的塑料营养钵(直径10 cm,高10 cm)中,每钵播2粒,当幼苗破心后,每钵保留1株。在日光温室内培育,待第一片真叶展平后每2 d浇1/8浓度Hoagland营养液1次,每钵浇50 mL,当幼苗长至4-5片真叶时,挑选长势较好且一致的植株,洗净根部育苗基质后,定植于水培箱(60 cm×40 cm×20 cm)中,每箱6株,株、行距均为15 cm,用1/4浓度Hoagland营养液栽培,利用充气泵24 h不间断补充营养液中氧气,每2 d更换1次营养液。
定植后恢复生长10 d后,开始进行试验。共设7个处理,(1)对照(CK):1/4 Hoagland营养液; (2)盐胁迫处理(SS0):1/4Hoagland营养液+100 mmol/L NaCl; (3)SS1处理:1/4Hoagland营养液+100 mmol/L NaCl+50 μmol/L SA; (4)SS2处理:1/4Hoagland营养液+100 mmol/L NaCl+100 μmol/L SA; (5)SS3处理:1/4Hoagland营养液+100 mmol/L NaCl+200 μmol/L SA; (6)SS4处理:1/4Hoagland营养液+100 mmol/L NaCl+400 μmol/L SA; (7)SS5处理:1/4Hoagland营养液+100 mmol/L NaCl+800 μmol/L SA。每处理重复3次,水培箱随机排列,为保证处理浓度的稳定性,处理期间每天更换1次处理液。NaCl胁迫浓度根据预备试验筛选确定,依据是NaCl达到100 mmol/L时,番茄幼苗生长抑制程度在70%左右,同时各项形态指标数值的降低几乎均达到了显著水平。处理第6天,取幼苗上数第2片完全展开叶进行各项生理指标的测定,第10天结束处理处后进行生长量和干物质积累的测定。
1.2 测定项目与方法 1.2.1 生长指标的测定用直尺测量株高(茎基部至生长点); 用游标卡尺测量茎粗(子叶下部2/3处); 分离植株根、茎、叶,分别洗净(自来水冲洗3次,蒸馏水冲洗2次)后吸干表面水分并立刻称鲜重,在鼓风干燥箱中105℃杀青15 min后降温至75℃烘干,称干重。计算壮苗指数=(茎粗/株高+根干重/茎叶干重)×全株干重。各指标测定均为3次重复,每个重复随机取样调查6株,取平均值。
1.2.2 叶绿素含量和气体交换参数的测定以80%丙酮(25 mL)浸提剪碎的叶片(0.2 g)24 h(期间震荡摇匀2次),参照王学奎等[19]方法测定和计算叶绿素含量; 利用Li-6400XT便携式光合仪(Li-Cor,USA)测定叶片净光合速率(Pn)、气孔导度(Gs)、细胞间隙CO2浓度(Ci)和蒸腾速率(Tr),每处理重复测定6株。测定时,使用内置LED红蓝光源(6400-02B)和开放式气路,控制叶室温度为(28±2)℃、光强为800 µmol/(m2·s)、CO2浓度为(360±20)µL/L,设定空气流速为500 μmol/s。
1.2.3 叶绿素荧光参数的测定采用Junior-PAM便携式脉冲调制叶绿素荧光仪(Walz,Germany)测定叶绿素荧光参数,每处理重复测定6株。将叶片暗适应30 min后,开启检测光,测得最小荧光(Fo),之后由饱和脉冲光激发,得到最大荧光(Fm)。接着打开内源光化光,10 min后获得光下的稳态荧光(Fs),再次照射饱和脉冲光以获得光下最大荧光(Fm' )。关闭光化光的同时快速遮光测定叶片,用远红光测定光下最小荧光(Fo' )。PSⅡ最大光化学效率(Fv/Fm)、光化学猝灭系数(qP)、非光化学猝灭系数(non-photochemistry quenching,NPQ)和实际光化学效率(ΦPSⅡ)均由仪器自动给出。
1.2.4 丙二醛含量、电解质渗出率和抗氧化酶活性的测定采用硫代巴比妥酸(Thiobarbituric acid,TBA)法[19]测定丙二醛(Malondialdehyde,MDA)含量; 参考刘新的方法[20]测定电解质渗出率。超氧化物歧化酶(Superoxide dismutase,SOD)活性测定采用氮蓝四唑(Nitro-blue tetrazolium,NBT)还原法[19]; 过氧化物酶(Peroxidase,POD)活性测定采用愈创木酚比色法[19]; 过氧化氢酶(Catalase,CAT)活性采用紫外吸收法[19]测定,抗氧化酶活性测定时采用同一提取液体系,提取液为pH 7.8(50 mmol/L)磷酸缓冲液。各项指标的测定均重复3次。
1.2.5 数据分析与作图用Microsoft Excel 2003处理数据,用SPSS 19.0软件对数据进行单因素(One-way analysis,ANOVA)方差分析,采用Duncan’s新复极差法进行差异显著性检验(P < 0.05),结果以平均值±标准差(Mean±SD)表示,用Origin 8.5作图。
2 结果 2.1 盐胁迫下根施SA对幼苗生长发育的影响番茄幼苗在NaCl胁迫处理(SS0)下,生长发育受阻,株高、茎粗、茎叶和根系生物量及壮苗指数分别比CK显著降低了27.30%、25.18%、40.85%、32.76%和32.50%(表 1)。与SS0处理相比,施加不同浓度SA处理(SS1-SS5)的幼苗上述生长指标均不同程度升高,且随处理浓度增加,均呈现出先上升后下降的变化趋势。在SS3处理时,增幅均达到最大,各指标依次分别比SS0处理显著提高了24.77%、24.14%、49.64%、30.77%和31.48%,但与CK相比仍显著偏低。由此可见,根施SA处理可有效缓解NaCl胁迫对番茄幼苗生长的抑制作用,且具有剂量效应,其中以200 μmol/L SA处理效果最好,但仍未能恢复至CK的水平。
由图 1可见,与CK相比,NaCl胁迫处理(SS0)的番茄幼苗叶片叶绿素a(Chl a)、叶绿素b(Chl b)和总叶绿素(Chl a+b)含量分别显著降低了36.27%、27.11%和34.14%。与SS0处理相比,施加不同浓度SA处理(SS1-SS5)均能不同程度提高NaCl胁迫下幼苗叶片各叶绿素的含量,且随处理浓度增加,均呈现先升高后降低的变化趋势。在SS3处理时,各指标增幅均达到最大,Chl a、Chl b和Chl a+b含量依次分别比SS0处理显著提高了33.49%、20.93%和30.23%。以上结果说明,根施SA处理可以通过维持叶片较高的叶绿素含量来促进番茄幼苗的光能转化与利用,从而增强其盐胁迫抗性,并以200 μmol/L SA处理时效果最好。

|
| 不同字母表示处理间差异显著(P < 0.05)。下同 图 1 盐胁迫下根施水杨酸对番茄幼苗叶片2种叶绿素含量的影响 |
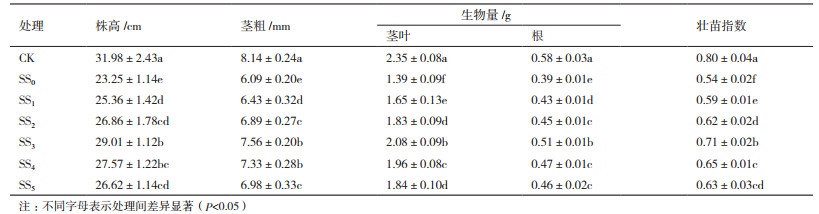
番茄幼苗在NaCl胁迫处理(SS0)后,叶片净光合速率(Pn)、气孔导度(Gs)和蒸腾速率(Tr)分别比CK显著降低了60.00%、39.69%和37.56%,而细胞间隙CO2浓度(Ci)却比CK显著升高了17.23%(图 2)。与SS0处理相比,施加不同浓度SA处理(SS1-SS5)的幼苗叶片Pn、Gs和Tr均不同程度升高,Ci则显著降低,且呈现出随处理浓度增加,Pn、Gs和Tr先升高后降低,而Ci则与上述两个参数完全相反的趋势变化。在SS3处理时,变幅达到最大,其Pn、Gs和Tr分别较SS0处理显著提高了88.91%、34.69%和29.43%,Ci则比SS0处理显著降低了10.39%。以上结果说明,NaCl胁迫显著抑制了幼苗叶片的光合同化效率,而根施SA处理不但可以保持叶肉较强的CO2羧化功能,而且还能通过维持较高的光合底物浓度来同化更多光合产物,进而有效缓解了盐胁迫对番茄幼苗光合作用的抑制,并以200 μmol/L SA处理效果最好。
|
| 图 2 盐胁迫下根施水杨酸对番茄幼苗叶片气体交换参数的影响 |
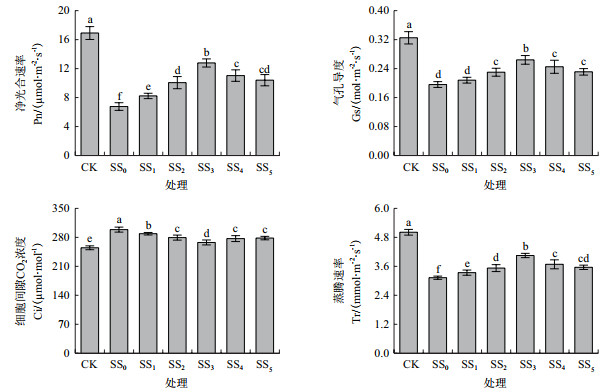
由图 3可知,与CK相比,NaCl胁迫处理(SS0)的番茄幼苗叶片最小荧光(Fo)与非光化学淬灭系数(NPQ)分别显著升高了40.52%和43.99%,而最大荧光(Fm)、PSⅡ最大光化学效率(Fv/Fm)、实际光化学效率(ΦPSⅡ)和光化学淬灭系数(qP)则分别显著降低了23.24%、18.58%、73.40%和55.56%。胁迫条件下,经SA处理后,叶片Fo与NPQ均表现出先降低后升高的变化趋势,而Fm、Fv/Fm、ΦPSⅡ和qP却表现为先升高后降低的变化趋势。与SS0处理相比,除Fm外的其余各参数在不同浓度SA处理下(SS1-SS5)的变化均达显著水平。在SS3处理时,上述所有参数的变幅均达到最大,叶片Fo和NPQ分别比SS0处理降低了17.67%和22.93%,Fm、Fv/Fm、ΦPSⅡ和qP则分别比SS0处理提高了12.77%、13.51%、143.20%和67.23%。以上结果说明,盐胁迫下根施SA处理提高了番茄幼苗叶片的PSⅡ光化学活性,减轻了光抑制对类囊体膜的破坏,同时有效抑制了天线色素捕获光能的非光化学热耗散。
|
| 图 3 盐胁迫下根施水杨酸对番茄幼苗叶片叶绿素荧光参数的影响 |
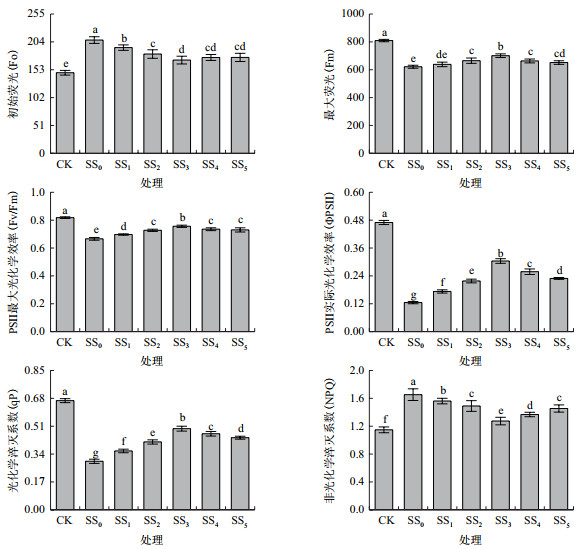
番茄幼苗在NaCl胁迫处理(SS0)后,叶片超氧化物歧化酶(SOD)和过氧化物酶(POD)活性分别比CK显著提高了40.10%和31.73%(图 4)。胁迫条件下同时经不同浓度SA处理(SS1-SS5)的幼苗叶片上述2种酶活性进一步升高,且随处理浓度的增加,均呈现出先升高后降低的变化趋势。在SS3处理时,增幅均达到最大,二指标依次分别比SS0处理显著高出了56.72%和51.82%。另外,叶片过氧化氢酶(CAT)活性变化较为复杂,在SS0处理下,其值变化与CK相比并不显著。与SS0相比,SS1-SS5处理虽然均能不同程度促进胁迫下叶片CAT活性的进一步升高,但随处理浓度的增加,这一变化并无明显规律。SS3处理时,叶片CAT活性增幅亦达到最大,比SS0处理显著高出了53.76%。以上结果说明,盐胁迫激活了幼苗体内的抗盐机制,使叶片抗氧化酶活性明显升高,根施一定浓度外源SA处理后,进一步提高了叶片的抗氧化酶活性,从而增强了番茄幼苗抵御盐胁迫的能力。试验条件下以200 μmol/L SA处理效果最佳。
|
| 图 4 盐胁迫下根施水杨酸对番茄幼苗叶片抗氧化酶活性的影响 |
由图 5可知,番茄幼苗叶片MDA含量和电解质渗出率在各处理条件下均表现出相似的变化趋势。其中,NaCl胁迫处理(SS0)的幼苗叶片MDA含量和电解质渗出率分别较CK显著高出了142.31%和115.14%。与SS0相比,施加不同浓度SA处理(SS1-SS5)均能显著降低NaCl胁迫下幼苗叶片的MDA含量和电解质渗出率,且随处理浓度增加,两参数均呈现出先降低后升高的变化特征。在SS3处理时,降幅达到最大,MDA含量和电解质渗出率分别比SS0显著降低了35.00%和32.28%。以上结果说明,NaCl胁迫引发了膜脂过氧化,导致膜结构受损,根施SA处理能显著缓解这种伤害程度,并以200 μmol/L SA处理效果最佳,浓度过高反而会削弱缓解效果。

|
| 图 5 盐胁迫下根施水杨酸对番茄幼苗叶片丙二醛含量和电解质渗出率的影响 |
生长发育状况是植物响应盐胁迫的综合反映,也是评价植物耐盐性的直接指标[21]。试验结果显示,NaCl胁迫下,50 µmol/L-800 µmol/L SA处理的幼苗株高、茎粗、单株生物量和壮苗指数均获得不同程度的提高,这表明根施SA处理可以起到缓解盐胁迫抑制番茄幼苗生长的作用。众所周知,光合作用是植物生长发育、形成生物产量的前提,而叶绿素又是光合作用的物质基础,盐胁迫可以通过抑制叶绿素合成,以及加速其分解(通过增加叶绿素降解酶活性来降低植物总叶绿素含量)阻碍叶片光合作用的进行[22],继而造成植株生长发育受阻、生物积累量降低。本试验中,NaCl胁迫下,番茄幼苗叶片Chl a、Chl b以及Chl a+b含量均显著降低,而根施不同浓度SA处理均可使胁迫下的幼苗叶片各叶绿素含量获得不同程度的提高,说明根施一定浓度外源SA可以通过提高盐胁迫下的叶绿素含量而影响番茄幼苗的生长发育,进而增强了植株的耐盐性。相似的研究结果也出现于付乃鑫等[17]对冬小麦的报道中。
盐逆境会引发渗透胁迫,致使植物吸水困难[23-24]。为了控制水分消耗,植物主动调节气孔关闭,以减少叶片水分蒸腾的耗散[24]。此时,通过气孔扩散至叶肉细胞间隙中的CO2的浓度(Ci)减小,造成了叶片光合作用的气孔限制。与气孔限制不同,盐胁迫导致的非气孔限制主要表现为叶肉导度和光合色素含量的下降、电子传递和光合磷酸化活性的减弱,以及与暗反应相关的酶活性的丧失等多种原因阻碍了植物叶片对CO2的利用[25],造成Ci的升高,进而导致光合速率(Pn)的降低。气体交换模型理论认为,只有当Ci和Pn变化方向相同,且二者同时减小时,才可以得出Pn下降主要是由Gs降低所引起的可靠结论; 相反,如果叶片Pn下降的同时伴随有Ci的升高,那么可以肯定Pn下降的主导因素是叶肉细胞光合活性的削弱,而不是Gs的因素[10]。本试验中,NaCl胁迫处理第6天,番茄叶片Pn和Gs显著降低、Ci显著增加,这表明Pn降低的主导因素是非气孔限制,即产生了叶肉光合功能障碍。与单独盐胁迫处理相比,50 μmol/L-800 μmol/L SA处理不同程度缓解了NaCl胁迫下叶片Pn、Gs和Tr的降低和Ci的升高,说明根施一定浓度外源SA处理可以有效缓解盐胁迫对光合作用产生的气孔和非气孔限制,从而增强了叶肉细胞对CO2的同化利用,使植株叶片在盐逆境条件下依然可以维持较高的光合能力,进而提高了番茄幼苗的盐渍耐受性。
叶绿素荧光是光合研究的无损探针,逆境胁迫对光合作用各过程产生的任何影响都可通过植物体内叶绿素荧光诱导动力学参数的变化反映出来。在诸多荧光参数中,Fv/Fm是最常使用的、用来反映PSⅡ最大光化学效率,判断植物光抑制发生与否的重要指标。该值降低暗示植株已经发生了光抑制[26]。有研究指出,在Fv/Fm降低时,若相伴有最小荧光(Fo)的升高,则可明确PSⅡ反应中心已经遭到了破坏[27]。本研究中,番茄幼苗在NaCl胁迫处理的第6天,叶片Fv/Fm显著降低、Fo显著升高,说明PSⅡ反应中心严重受损,因而使通过PSⅡ的光化学电子传输活性(Fm)显著降低。光化学淬灭系数(qP)代表天线色素捕获光能用于光化学电子传递的份额,非光化学猝灭系数(NPQ)则反映了天线色素吸收的、通过热能形式耗散的过剩光能的份额,PSⅡ实际光化学效率(ΦPSⅡ)表示反应中心在部分关闭情况下的实际原初光能捕获效率,与碳同化反应的强度密切相关[28],ΦPSⅡ的降低将影响同化力(ATP和NADPH)的生成,进而降低卡尔文循环工作效率,导致Ci的升高和Pn的降低。本研究结果显示,50 μmol/L-800 μmol/L SA处理不同程度缓解了NaCl胁迫下叶片Fv/Fm、Fm、qP和ΦPSⅡ的降低,同时抑制了Fo和NPQ的升高,表明根施一定浓度SA处理能够起到保护光合机构、增强番茄幼苗叶片光化学利用光能的作用,进而减轻了盐胁迫引发的光抑制。这与Poór等[11]研究结果相似,与Mimouni等[12]研究结果并不完全相符。在后者报道中,外源SA处理在显著提高受盐胁迫番茄叶片Fv/Fm的同时,使ΦPSⅡ和qN(非光化学猝灭系数另一种表达形式)不同程度降低,而这一结果出现的原因文中并未给予明确的阐释,对此尚需进一步探讨。
正常生长条件下,植物体内活性氧(ROS)的产生与清除始终处于动态平衡状态。盐逆境下,叶片光合电子传递受阻,致使更多电子传递至O2而引发ROS的大量产生[29]。ROS能直接攻击质膜和细胞膜中的不饱和脂肪酸,导致膜脂过氧化,使细胞膜流动性减弱、膜透性增加[30]。为避免自身受到伤害,植物主动或被动调动抗氧化保护酶类来清除过量的ROS,以减缓或抵御其对整个膜系统造成的氧化伤害。细胞膜相对透性、MDA含量是判断植物膜系统稳定与否的重要指标,而膜系统稳定性的大小又与植物抗盐能力密切相关[12]。SOD、POD和CAT是抗氧化酶系统中最重要的3种抗氧化酶,它们能协同实现对ROS的清除。本研究表明,NaCl胁迫第6天,经50-800 μmol/L SA根施处理的番茄幼苗叶片SOD、POD、CAT活性不同程度增加,MDA含量和电解质渗出率降低,表明一定浓度外源SA处理可通过提高抗氧化酶活性,增强叶片ROS的清除能力,使细胞膜脂过氧化程度降低、膜结构稳定性增强,进而维持了番茄幼苗较高的盐渍耐受性,这与宿越等[14]和Stevens等[15]分别在喷施和根部处理方式下获得的研究结果一致。
4 结论根施外源SA对番茄幼苗盐害损伤的缓解作用具有剂量效应,试验条件下以200 μmol/L SA处理效果最好。
| [1] |
Abiala MA, Abdelrahman M, Burritt DJ, et al. Salt stress tolerance mechanisms and potential applications of legumes for sustainable reclamation of salt-degraded soils[J]. Land Degradation & Development, 2018, 29(10): 3812-3822. |
| [2] |
Munns R, Tester M. Mechanisms of salinity tolerance[J]. Annual Review of Plant Biology, 2008, 59: 651-681. DOI:10.1146/annurev.arplant.59.032607.092911 |
| [3] |
Delian EB, dulescu L, Dobrescu A, et al. A brief overview of seed priming benefits in tomato[J]. Romanian Biotechnological Letters, 2017, 22(3): 12505-12513. |
| [4] |
Li J, Liu L, Bai Y, et al. Seedling salt tolerance in tomato[J]. Euphytica, 2011, 178(3): 403-414. DOI:10.1007/s10681-010-0321-x |
| [5] |
Janda M, Ruelland E. Magical mystery tour:salicylic acid signalling[J]. Environmental and Experimental Botany, 2015, 114: 117-128. DOI:10.1016/j.envexpbot.2014.07.003 |
| [6] |
Rivas-San VM, Plasencia J. Salicylic acid beyond defence:its role in plant growth and development[J]. Journal of Experimental Botany, 2011, 62(10): 3321-3338. DOI:10.1093/jxb/err031 |
| [7] |
Makandar R, Nalam VJ, Lee H, et al. Salicylic acid regulates basal resistance to Fusarium head blight in wheat[J]. Molecular Plant-Microbe Interactions, 2012, 25(3): 431-439. DOI:10.1094/MPMI-09-11-0232 |
| [8] |
Meher HC, Gajbhiye VT, Singh G. Salicylic acid-induced glutathione status in tomato crop and resistance to root-knot nematode, Meloidogyne incognita(Kofoid & White)Chitwood[J]. Journal of Xenobiotics, 2011, 1(5): 22-28. |
| [9] |
Singh SK, Singh AK, Dwivedi P. Modulating effect of salicylic acid in tomato plants in response to waterlogging stress[J]. International Journal of Agriculture, Environment and Biotechnology, 2017, 10(1): 1-7. |
| [10] |
孙德智, 杨恒山, 彭靖, 等. 外源SA和NO对NaCl胁迫下番茄幼苗生长、光合及离子分布的影响[J]. 生态学报, 2014, 34(13): 3519-3528. |
| [11] |
Poór P, Gémes K, Horváth F, et al. Salicylic acid treatment via the rooting medium interferes with stomatal response, CO2 fixation rate and carbohydrate metabolism in tomato, and decreases harmful effects of subsequent salt stress[J]. Plant Biology, 2011, 13(1): 105-114. DOI:10.1111/j.1438-8677.2010.00344.x |
| [12] |
Mimouni H, Wasti S, Manaa A, et al. Does salicylic acid(SA)improve tolerance to salt stress in plants? A study of SA effects on tomato plant growth, water dynamics, photosynthesis, and biochemical parameters[J]. OMICS:A Journal of Integrative Biology, 2016, 20(3): 180-190. DOI:10.1089/omi.2015.0161 |
| [13] |
宋士清, 郭世荣, 尚庆茂, 等. 外源SA对盐胁迫下黄瓜幼苗的生理效应[J]. 园艺学报, 2006, 33(1): 68-72. DOI:10.3321/j.issn:0513-353X.2006.01.013 |
| [14] |
宿越, 李天来, 杨凤军, 等. 外源水杨酸对NaCl胁迫下番茄幼苗保护酶活性和渗透调节物质含量的影响[J]. 沈阳农业大学学报, 2009, 40(3): 273-276. |
| [15] |
Stevens J, Senaratna T, Sivasithamparam K. Salicylic acid induces salinity tolerance in tomato(Lycopersicon esculentum cv. Roma):associated changes in gas exchange, water relations and membrane stabilisation[J]. Plant Growth Regulation, 2006, 49(1): 77-83. |
| [16] |
Li XM, Ma LJ, Bu N, et al. Effects of salicylic acid pre-treatment on cadmium and/or UV-B stress in soybean seedlings[J]. Biologia Plantarum, 2014, 58(1): 195-199. DOI:10.1007/s10535-013-0375-4 |
| [17] |
付乃鑫, 贺明荣, 诸葛玉平, 等. 外源SA对盐胁迫下冬小麦幼苗生长的缓解效应及其机理[J]. 中国农业大学学报, 2019, 24(3): 10-17. |
| [18] |
沙汉景, 刘化龙, 王敬国, 等. 水杨酸调控作物耐盐性生理机制[J]. 东北农业大学学报, 2017, 48(3): 80-88. |
| [19] |
王学奎, 黄见良. 植物生理生化实验原理与技术[M]. 北京: 高等教育出版社, 2015.
|
| [20] |
刘新. 植物生理学实验指导[M]. 北京: 中国农业出版社, 2015.
|
| [21] |
白文波, 李品芳. 盐胁迫对马蔺生长及K+, Na+吸收与运输的影响[J]. 土壤, 2005, 37(4): 415-420. DOI:10.3321/j.issn:0253-9829.2005.04.012 |
| [22] |
Verma SS, Verma RS, Verma SK, et al. Impact of salt stress on plant establishment, chlorophyll and total free amino acid content of ber(Zizyphus mauritiana Lamk.)cultivars[J]. Journal of Pharmacognosy and Phytochemistry, 2018, 7(2): 556-559. |
| [23] |
Khan MSA, Chowdhury JA, Razzaque MA, et al. Dry matter production and seed yield of soybean as affected by post-flowering salinity and water stress[J]. Bangladesh Agronomy Journal, 2016, 19(2): 21-27. |
| [24] |
Farooq M, Hussain M, Wakeel A, et al. Salt stress in maize:effects, resistance mechanisms, and management. A review[J]. Agronomy for Sustainable Development, 2015, 35(2): 461-481. DOI:10.1007/s13593-015-0287-0 |
| [25] |
Wang XX, Wang WC, Huang JL, et al. Diffusional conductance to CO2 is the key limitation to photosynthesis in salt-stressed leaves of rice(Oryza sativa)[J]. Physiologia Plantarum, 2018, 163(1): 45-58. DOI:10.1111/ppl.12653 |
| [26] |
Kahlaoui B, Hachicha M, Rejeb S, et al. Response of two tomato cultivars to field-applied proline under irrigation with saline water:Growth, chlorophyll fluorescence and nutritional aspects[J]. Photosynthetica, 2014, 52(3): 421-429. DOI:10.1007/s11099-014-0053-6 |
| [27] |
Baker NR. Chlorophyll fluorescence:a probe of photosynthesis in vivo[J]. Annual Review of Plant Biology, 2008, 59: 89-113. DOI:10.1146/annurev.arplant.59.032607.092759 |
| [28] |
Zhang Y, Liu G. Effects of cesium accumulation on chlorophyll content and fluorescence of Brassica juncea L.[J]. Journal of Environmental Radioactivity, 2018, 195: 26-32. DOI:10.1016/j.jenvrad.2018.09.017 |
| [29] |
Gill SS, Tuteja N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J]. Plant Physiology and Biochemistry, 2010, 48(12): 909-930. DOI:10.1016/j.plaphy.2010.08.016 |
| [30] |
Zhang J, Li X, Zhou L, et al. Analysis of effects of a new environmental pollutant, bisphenol A, on antioxidant systems in soybean roots at different growth stages[J]. Scientific Reports, 2016, 6: 23782. DOI:10.1038/srep23782 |