2. 中国热带农业科学院海口实验站,海口 571101;
3. 海南省热带观赏植物种质创新利用工程技术研究中心,儋州 571737
2. Haikou Experimental Station, Chinese Academy of Tropical Agricultural Sciences, Haikou 571101;
3. The Engineering Technology Research Center of Tropical Ornamental Plant Germplasm Innovation and Utilization, Hainan Province, Danzhou 571737
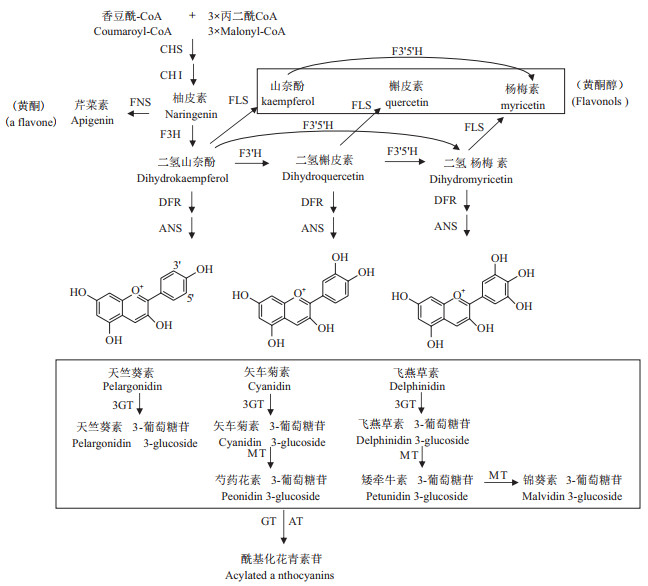
花色是观赏植物最受关注的性状,新奇的花色是育种者始终追求的目标。长期以来杂交育种和突变选种是创造新花色的主要方法。花青素是花瓣中普遍存在的花色素,能使花呈现从红到紫红到蓝的变化,花青素在胞质中合成,在液泡中积累[1]。在高等植物中花青素的生物合成从查尔酮开始到生成花青素3-葡萄糖苷的途径非常保守(图 1),且研究得比较透彻[1]。根据对不同观赏植物花青素生物合成途径的认知,每个物种表达特定的酶基因,只能积累有限种类的花青素苷,因此一个物种拥有全部种类的花色几乎是不可能的。例如,大宗贸易花卉月季、康乃馨和菊花均因不积累飞燕草素为核心的花青素苷而缺少紫色和蓝色的品种。培育蓝色名贵花卉是几辈育种者多年的梦想,基因工程技术为花色育种者打开了一扇大门,使突破物种遗传背景限制,培育新奇的花色成为可能。蓝色花的育种一直是花色研究的热点,近年来获得了大量的研究成果。这期间最突出的成就是月季、菊花、蝴蝶兰等重要花卉蓝色品种的诞生[2-4]。本文根据已有研究基础[5-6]总结了蓝色花形成的原因以及近15年蓝色花基因工程育种的基本策略及研究进展。
蓝色花最主要的成因在于花青素的化学结构,蓝色花瓣中含有的花青素通常被甲基化、糖苷化和酰基化修饰,被芳香酸如对-香豆酸、咖啡酸、阿魏酸、对-羟基苯甲酸等多重酰基化是蓝色花中最主要的花青素苷酰基化修饰,芳香酸酰基与花青素形成“三明治”型的分子内堆叠,这使得花青素苷蓝化且更加稳定[7-8]。酰基化修饰的位置也非常重要,通常在花青素3'-和/或7-位上发生芳香酸酰基化比3-和/或5-位上的芳香酸酰基化对于蓝色的形成更为重要[9]。大多数蓝色花主要含有飞燕草素糖苷及其酰基化衍生物,极少数的蓝色花以酰基化的矢车菊素糖苷或矮牵牛素糖苷为主。以飞燕草素为主的蓝色花典型代表有鸭跖草(Commelina communis)、飞燕草(Delphinium spp.)、龙胆(Gentiana spp.)、鼠尾草(Salvia spp.)、蝶豆花(Clitoria ternatea)、风信子(Hyacinthus orientalis)等[7, 10-11]。以酰基化矢车菊素糖苷为主的蓝色花有矢车菊(Centaurea cyanus)、圆叶牵牛(Ipomoea purpurea)、绿绒蒿(Meconopsis spp.)等[7, 12-14]。以酰基化矮牵牛素糖苷为主的蓝色花以琉璃唐草(Nemophila menziesii)为代表[7, 15]。
鸭跖草、矢车菊、鼠尾草、琉璃唐草的蓝色色素为金属络合花青素苷(Metalloanthocyanins),即花青素苷、黄酮和金属离子以6:6:2的化学计量比自络合形成的超分子金属络合色素[7]。在以飞燕草素为发色团的超分子金属络合色素中,Mg2+对稳定蓝色的作用是足够的;在以矢车菊素或矮牵牛素为发色团的金属络合色素中,除了Mg2+以外,还需要1/6当量的Fe3+辅助[7]。然而,自然界中含有金属络合花青素苷的蓝色花却非常少。通常的蓝色花中以非化学计量比存在的金属离子对花青素苷起到辅助着色的作用,这些蓝色色素稳定性较差,在分离色素或结晶的过程中蓝色便消失了[7]。例如,大花绿绒蒿(Meconopsis grandis)的色素组成为1当量的矢车菊素糖苷,2或更多当量的山奈酚衍生物(黄酮醇),1/6当量的Fe离子和过量的Mg2+[16]。
1.2 蓝色呈现所需要的液泡环境许多体外试验表明,有了蓝色花青素如飞燕草素及其衍生物通常不一定呈现蓝色,可见液泡内的环境包括pH值、有机物和无机物的组成和含量等对蓝色花的形成尤为重要。以绣球花为例,红色、紫红色、蓝色等花中均只含有飞燕草素3-葡萄糖苷。进一步研究发现,蓝色品种花瓣的pH值、5-O-乙酰奎宁酸与花青素苷的摩尔比率,以及Al3+的摩尔当量都显著高于红色细胞[17-18]。郁金香品种Murasakizuisho内层花瓣基部因大量积累铁离子,与飞燕草素3-芸香糖苷作用而呈蓝色[19]。牵牛花(Ipomoea tricolor cv. Heavenly Blue)在花蕾期为紫红色,完全开放为蓝色,其所含色素为紫红色的咖啡酸酰化芍药花素糖苷,没有金属离子络合。在花蕾期液泡pH值为6.6,完全开放期液泡pH值上升为7.7[20]。
目前蓝色花形成的化学和生理机制尚未完全解析,根据已有研究结果,蓝色花形成的因素主要有:(1)蓝色花青素的生成;(2)花青素苷的多重芳香酸酰化;(3)黄酮、黄酮醇等辅助色素参与;(4)金属离子络合;(5)较高的液泡pH值等。
2 与蓝色花形成相关的基因 2.1 与蓝色色素合成相关的酶基因在高等植物中,从查尔酮到花青素-3-葡萄糖苷的生物合成途径非常保守,从花青素-3-葡萄糖苷之后的进一步糖苷化、酰基化修饰方式在不同植物中变化多样,因此蓝色花的花青素苷合成途径尚未完全阐明。已知的几种参与蓝色花青素合成的关键酶中,细胞色素P450氧化酶家族CYP75A或CYP75B亚家族的类黄酮3',5'-羟化酶(F3'5'H)催化二氢山奈酚B环上的3'-和5'-位的羟基化生成二氢杨梅素,是合成飞燕草素的前体。由于单一积累飞燕草素糖苷及其多酰基化的衍生物被育种者认为是培育蓝色花最有效的手段,因此F3'5'H基因最受关注,并已从多种植物中克隆并鉴定[21]。而抑制蓝色花自身的F3'5'H基因表达,可导致花色变成紫红色,如龙胆[22]。
二氢黄酮醇4-还原酶(DFR)催化二氢黄酮醇生成无色花青素苷元(Leucoanthocyanidins)。不同植物中DFR的底物专一性影响了花瓣中最终积累的花青素苷元B环上的羟基化程度。例如,矮牵牛、大花蕙兰等的DFR只能催化二氢槲皮素和二氢杨梅素,不能催化二氢山奈酚[9]。因此这些植物的DFR对于专一性地合成飞燕草素是有利的。
花青素的糖苷化和酰基化修饰对于维持其颜色的稳定非常重要,也是蓝色花色素最常见的结构修饰方式。迄今鉴定出的花青素糖苷化酶有两类,一类是依赖UDP-糖的糖苷化酶家族1,另一类是依赖酰基-葡萄糖的花青素糖苷化酶[9]。已鉴定的花青素苷酰基转移酶也分为两类,一类是利用酰基-CoA为供体,将酰基转移至花青素苷糖基部分的特定位置;另一类是类丝氨酸羧肽酶(SCPL)-酰基转移酶,利用酰基葡萄糖作为供体分子,催化花青素苷糖基部分的酰基化[9]。飞燕草的糖基转移酶基因AA7GT或酰基转移酶基因AA7GT-AT发生突变,均可产生由于积累中间产物而导致粉色或者红色的花色表型[23]。
2.2 细胞pH值调控基因矮牵牛花瓣中鉴定出7个调控pH值的基因位点PH1-PH7[24]。其中PH5编码一种定位于液泡膜的H+P3A-ATPase质子泵。当PH5基因发生突变时,液泡中的pH值升高,花瓣从紫红色变成蓝紫色[25]。PH1基因突变体的花色与PH5基因突变体颜色相似,PH1编码的P3B-ATPase可与PH5编码的H+P3A-ATPase物理性结合,促进H+转运活性,增加液泡的酸化程度[26]。裂叶牵牛(Ipomoea nil)开花过程中InNHX1和InNHX2基因编码的转运蛋白将K+/Na+转运至液泡,提高液泡pH值,使花色变蓝[27-28]。
2.3 金属离子转运蛋白基因从郁金香中分离鉴定了一种编码液泡铁离子转运蛋白的基因TgVit1,其编码蛋白具有促进液泡中铁离子的积累,与飞燕草素3-芸香糖苷作用呈现蓝色的功能[29]。随后在矢车菊中鉴定了与TgVit1同源的基因CCViT[30]。绣球花中分离鉴定了编码液泡膜和质膜定位的Al离子转运蛋白的基因VALT和编码质膜Al离子转运蛋白1的基因PALT1,这些基因编码的Al离子转运蛋白与Al离子参与蓝色绣球花花色的形成有关[31]。
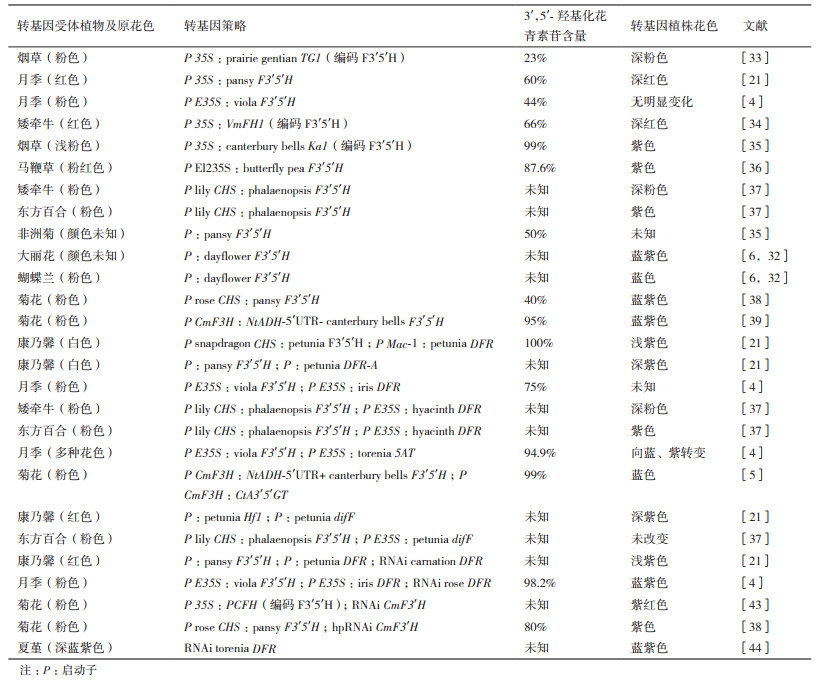
3 蓝色花卉基因工程育种实践与策略目前,育种者利用基因工程技术培育蓝色花主要有以下几方面的实践(表 1)。
尽管矢车菊、绿绒蒿等蓝色花是由矢车菊素糖苷与金属离子形成络合物而呈蓝色,含有芍药花素糖苷的牵牛花由于细胞内pH值升高而产生蓝色,但是,大多数蓝色花的成因是积累大量的飞燕草素。而许多缺少蓝色花色的植物如康乃馨、月季、菊花、百合、蝴蝶兰等[21, 32]就是因为本身缺乏飞燕草素合成途径上的关键基因F3'5'H。因此通过转基因技术,向不含飞燕草素的花卉植物中,转入外源F3'5'H基因促进飞燕草素的生成,是全世界公认的最有可能获得蓝色花的手段。
3.1.1 转基因受体的筛选原则转基因受体要有合适的遗传背景和类黄酮组成[4]。转入外源F3'5'H后,能否将F3'5'H酶的产物二氢杨梅素转化成飞燕草素非常关键,即首先要检测转基因受体DFR酶是否具有催化二氢杨梅素能力,如没有则要转入外源的DFR基因。还要考虑受体植物內源的DFR、F3'H和FLS酶对F3'5'H酶底物的竞争。要避免底物竞争,最好有这些竞争基因功能缺失的天然突变体,或者通过基因工程手段如RNAi等下调这些基因的表达。此外,尽量选择花瓣pH值较高、黄酮/黄酮醇含量较高的材料[21]。这样才有可能获得较理想的蓝色花表型。
3.1.2 单一转入外源F3'5'H基因国内外学者对转入外源F3'5'H基因做了大量的尝试。将洋桔梗(Eustoma grandiflorum)F3'5'H基因转入烟草,转基因烟草最多仅积累了23%的3',5'-羟基化的花青素苷,花色有所加深[33]。Tanaka[21]将三色堇(Viola sp. cultivar black pansy)F3'5'H基因转入后使月季最多产生了60%的飞燕草素糖苷,花色变成深红色。堇菜(Viola spp.)F3'5'H基因在月季品种Lavande中过表达,最多可产生44.2%的飞燕草素,然而有三分之二的转基因株系的飞燕草素含量少于20%,花色变化不明显[4]。蔓长春花(Vinca major)F3'5'H基因VmFH1在红色矮牵牛中过表达,产生了深红色带深紫色扇形区域的花色表型[34]。风铃草(Campanula medium)F3'5'H基因在烟草中异源表达可以特异性积累飞燕草素(最多达99%),花色也变成新奇的紫色[35]。蝶豆花F3'5'H基因转入马鞭草植株后,比过表达马鞭草F3'5'H基因的植株产生的表型变化更明显,花色由粉红色变成紫红色[36]。将蝴蝶兰(Phalaenopsis)F3'5'H基因在矮牵牛花中过表达,使花色由粉色变成深粉色;蝴蝶兰F3'5'H基因在东方百合Sorbonne花被片中瞬时过表达,产生了紫色的细胞[37]。日本Florigene公司将三色堇(Viola sp. cultivar black pansy)F3'5'H基因在非洲菊中过表达,能够积累50%的飞燕草素糖苷,花色也发生了一定的变化[8]。日本千叶大学Mii教授等[6]将鸭跖草(Commelina communis)F3'5'H基因转入大丽花,转基因植株产生了飞燕草素衍生物,花色呈现蓝紫色[6, 32]。Mii教授等还将鸭跖草F3'5'H基因转入了蝴蝶兰,由于粉色蝴蝶兰花瓣中主要花青素为7-位和3'-位多重糖苷化和芳香酸酰化的矢车菊素,因此单独过表达矢车菊F3'5'H基因的蝴蝶兰很容易生成多重酰基化的飞燕草素,呈现出非常接近蓝色的花色[6, 32]。
Brugliera等[38]将三色堇(Viola sp. cultivar black pansy)F3'5'H基因在菊花中过表达,产生40%的飞燕草素糖苷,使花瓣颜色转蓝,然而所产生的花色并不新奇,已有育种者用传统手段育成类似的花色。Noda等[39]筛选出菊花中高效驱动外源F3'5'H表达的启动子为菊花F3H(CmF3H)启动子,在此启动子驱动下,带有烟草NtADH基因5'UTR序列的风铃草F3'5'H基因过表达能产生更多的飞燕草素(达到95%),花色也呈现出了蓝紫色。
以上结果表明,F3'5'H基因的来源以及其转化的受体对改变花色的结果都非常重要,因此需要筛选适合受体植物的外源基因和启动子。然而通常仅转入外源F3'5'H基因虽然能在目标植物花瓣中产生飞燕草素,却往往并不能达到令人满意的蓝色效果。
3.1.3 外源F3'5'H基因与其它关键酶基因同时转入 3.1.3.1 与DFR基因同时转入将外源F3'5'H基因和DFR基因同时转入创造蓝色花最经典的实例就是蓝紫色的“Moon”系列康乃馨的诞生。以散枝型DFR和F3'H突变体白花品种White Unesco为转基因受体,转入矮牵牛F3'5'H基因和DFR基因,获得了完全积累飞燕草素的浅紫色品种FLORIGENE Moondust,这是世界上首个商业化的转基因观赏植物[21]。随后发现三色堇(Viola sp. cultivar black pansy)的F3'5'H基因在康乃馨中表现更好,将其与矮牵牛DFR-A基因同时转化DFR突变体品种Unesco,产生了比Moondust积累更多飞燕草素的深紫色品种FLORIGENE Moonshadow,其花瓣中含有一种芹菜素C-苷作为辅助色素,且花瓣的pH值更高,使花色看起来更蓝[40]。采用同样的策略育出了FLORIGENE Moonvista、FLORIGENE Moonshade、FLORIGENE Moonlite、FLORIGENE Moonaqua等众多商业品种[21]。
月季品种Lavande中,同时过表达堇菜(Viola spp.)F3'5'H基因和鸢尾(Iris×hollandica)DFR基因比单独过表达堇菜F3'5'H基因积累了更多的飞燕草素,最高可达75%[4]。蝴蝶兰F3'5'H基因与风信子(Hyacinthus orientalis 'Sky Jacket')DFR基因同时在矮牵牛中过表达比蝴蝶兰F3'5'H基因单独过表达能积累更多的飞燕草素糖苷,在东方百合花被片中瞬时过表达这两个基因比单独过表达F3'5'H基因产生颜色更紫的细胞[37]。
3.1.3.2 与花青素苷修饰酶基因同时转入除了改变受体植物的花青素苷元结构生成飞燕草素外,学者们也对飞燕草素糖苷的芳香酰基化修饰进行了尝试。将堇菜(Viola spp.)F3'5'H基因和夏堇(Torenia hybrid cultivar Summer Wave Blue)5AT(花青素苷5-羟基肉桂酸酰基转移酶)基因共同转化不同花色的月季品种,结果显示各品种转基因株系都不同程度地积累了飞燕草素糖苷,花色也发生了不同程度的蓝化。只有一些(不超过44%)花青素苷被夏堇的5AT酶酰基化,且5-位酰基化只能使花青素苷的最大吸收波长红移4 nm,因此很难观察到由酰基化产生的花色变化[4]。
由于单独转化风铃草F3'5'H基因得到的菊花花色并不是纯正的蓝色[39],为了让菊花能像蝶豆花一样积累3'-位和5'-位被糖苷化的飞燕草素糖苷,研究者进一步将蝶豆花的UDP-葡萄糖:花青素苷3',5'-O-葡萄糖基转移酶基因(CtA3'5'GT)与风铃草F3'5'H基因同时转入菊花,成功生成了飞燕草素3',5'-双糖苷化的衍生物,在木犀草素7-丙二酰葡萄糖苷辅助着色作用下,使花瓣呈现了纯正的蓝色[5]。应用这种方法实现了各种花型蓝色菊花的培育[32]。
3.1.3.3 与辅助基因同时转入矮牵牛的一种在花中特异表达的基因difF,因其编码一种细胞色素b5蛋白能够增强F3'5'H酶活性[41],在蓝色花育种中可作为F3'5'H基因的辅助基因,同时转化目标植物。FLORIGENE公司向缺少F3'H酶活性积累天竺葵素的红色康乃馨品种Cerise Westpearl中,同时转入矮牵牛F3'5'H基因(Hf1)和difF,获得了深紫色的品种FLORIGENE Moonvelvet在美国上市[21]。在东方百合中同时瞬时表达蝴蝶兰F3'5'H基因和矮牵牛difF基因,然而被转化细胞颜色没有发生变化[37]。
3.1.4 转入外源基因同时抑制内源关键酶基因FLORIGENE公司利用RNAi技术抑制康乃馨红色品种Cerise Westpearl内源DFR基因表达,并转入三色堇(Viola sp. cultivar black pansy)F3'5'H基因和矮牵牛DFR基因,产生了紫色品种FLORIGENE Moonberry和浅紫色品种FLORIGENE Moonpearl,均已上市[21]。
抑制月季品种Lavande的DFR基因,同时转入堇菜(Viola spp.)F3'5'H基因和鸢尾(Iris×hollandica)DFR基因,2/3的转基因株系中积累超过80%的飞燕草素,最高可达98%,成功地使月季中花青素代谢流从矢车菊素合成途径转向了飞燕草素合成途径,花色由浅紫红色变成了蓝紫色[4]。至此蓝色月季Applause诞生了,并于2009年上市[21]。然而Applause花色还是偏向紫色,接下来将从增加辅助色素和调节液泡pH值等方向进一步改良[21]。不久前完成的月季基因组测序获得了当前植物基因组中质量最高的基因组信息,通过重建次生代谢及其调控通路,提出了月季花色和花香关联的调控模型,为进一步阐明月季花色分子机制提供了基础,能够加速月季、蔷薇科物种及其他观赏植物的花色改良育种[42]。
菊花中F3'H基因是矢车菊素合成途径的关键因,为了使花青素向飞燕草素合成途径转变,Huang等[43]采用RNAi技术抑制菊花CmF3'H的表达,且过表达瓜叶菊(Senecio cruentus)F3'5'H基因(PCFH),然而瓜叶菊F3'5'H酶在菊花中仅表现出3'-羟基化的功能,使转基因菊花中的矢车菊素含量显著增加。Brugliera等[38]尝试了利用hairpin RNAi(hp RNAi)干扰菊花CmF3'H的表达,同时转入三色堇(Viola sp. cultivar black pansy)F3'5'H,使转基因菊花中积累达80%的飞燕草素糖苷,花色由粉色变为紫色。
3.2 增加辅助色素含量Aida等[44]研究一系列夏堇的转基因植株发现,转入反义DFR基因的花色比转入反义CHS基因的花色更蓝。原因是DFR基因功能受抑制导致辅助色素黄酮的含量显著增加,因而使花色更蓝。这一方法可应用于其它植物蓝色花的育种。
3.3 提高液泡pH值尽管已育成的蓝色月季中积累了足够多的飞燕草素,但是由于花瓣细胞液泡酸度过高,花色仍然呈现出一定程度的红色色调[4]。因此要使花瓣呈现蓝色,转入基因创造一个pH值5.6-6.2微酸性的液泡环境,或者选择天然具有较高pH值的受体材料尤为重要[32]。例如,由细胞培养得到的突变体培育而成的紫色仙客来主要含有锦葵素3,5-二葡萄糖苷,在此基础上,通过隐性突变提高花瓣细胞pH值有望获得蓝色仙客来[32]。
3.4 增加金属离子含量在紫色郁金香花被片细胞中瞬时过表达液泡铁离子转运蛋白基因TgVit1,使铁蛋白合成基因TgFER受抑制,阻止铁蛋白积累并结合铁离子,使细胞变蓝[29, 45]。进而Shoji等[46]又利用花瓣特异表达的TgMYB1启动子驱动TgVit1基因的表达,期望获得蓝色郁金香。此外,Kurihara等[47]将TgVit1在积累飞燕草素3,5-二葡萄糖苷的突变体仙客来中瞬时表达,获得了蓝色细胞,有望通过稳定表达得到蓝色仙客来。
3.5 蓝色花卉基因工程育种策略综合上述蓝色花育种实践,如要成功地利用基因工程创造有商业价值的花卉需要具备以下条件:(1)分离到有效的基因;(2)建立高效的目标植物遗传转化体系;(3)通过启动子序列、目标基因的来源和终止子序列等方面来优化目标基因的表达;(4)选择遗传背景合适的受体品种[21]。根据蓝色花形成的因素,创造蓝色花应从以下方面入手:积累飞燕草素糖苷,其糖基被芳香有机酸酰化,或者加强花青素苷与辅助色素、和/或金属离子之间的相互作用。
4 小结尽管众多育种实践证实了通过基因工程的手段创造蓝色花的可行性,然而让目标植物特异地大量积累某一类色素并呈现蓝色非常困难。首先需要考虑蓝色花青素苷通常有复杂的糖苷化和酰基化修饰,这些修饰酶在异源植物中的活性是否能够正常发挥,还需要考虑调节液泡pH值以及有辅助色素和金属离子共存,这就需要对目标植物的花色形成机制有全面的认识。近年来日趋普及的全基因组测序工作将为全面解析植物花色形成的机制奠定坚实基础。此外,对于非模式植物来说,很多观赏植物普遍存在遗传转化效率低、童期长、转入基因表达变异大等问题,攻克这些难题才有希望获得更多新奇的商品化的蓝色花卉。
| [1] |
Tanaka Y, Sasaki N, Ohmiya A. Biosynthesis of plant pigments:anthocyanins, betalains and carotenoids[J]. Plant Journal, 2008, 54: 733-749. DOI:10.1111/j.1365-313X.2008.03447.x |
| [2] |
徐清燏, 戴思兰. 蓝色花卉分子育种[J]. 分子植物育种, 2004, 2(1): 93-99. DOI:10.3969/j.issn.1672-416X.2004.01.014 |
| [3] |
欧阳汝欣. 蓝色花的基因工程育种研究进展[J]. 黑龙江农业科学, 2010(1): 8-10. DOI:10.3969/j.issn.1002-2767.2010.01.004 |
| [4] |
Katsumoto Y, Fukuchi-Mizutani M, Fukui Y, et al. Engineering of the rose flavonoid biosynthetic pathway successfully generated blue-hued flowers accumulating delphinidin[J]. Plant and Cell Physiology, 2007, 48(11): 1589-1600. DOI:10.1093/pcp/pcm131 |
| [5] |
Noda N, Yoshioka S, Kishimoto S, et al. Generation of blue chrysanthemums by anthocyanin B-ring hydroxylation and glucosylation and its coloration mechanism[J]. Science Advances, 2017, 3(7): e1602785. DOI:10.1126/sciadv.1602785 |
| [6] |
Mii M. Ornamental plant breeding through interspecific hybridization, somatic hybridization and genetic transformation[J]. Acta Horticulturae, 2012(953): 43-54. |
| [7] |
Yoshida K, Mori M, Kondo T. Blue flower color development by anthocyanins: from chemical structure to cell physiology[J]. Natural Product Reports, 2009, 26(7): 884-915. DOI:10.1039/b800165k |
| [8] |
Okitsu N, Noda N, Chandler S, et al. Flower Color and Its Engineering by Genetic Modification[M]// Van Huylenbroeck J. Ornamental Crops. Handbook of Plant Breeding, vol 11. Cham Heidelberg: Springer, 2018: 29-62.
|
| [9] |
Sasaki N, Nakayama T. Achievements and perspectives in biochemistry concerning anthocyanin modification for blue flower coloration[J]. Plant and Cell Physiology, 2015, 56(1): 28-40. |
| [10] |
Hosokawa K, Fukushi E, Kawabata J, et al. Seven acylated anthocyanins in blue flowers of Gentiana[J]. Phytochemistry, 1997, 45(1): 167-171. DOI:10.1016/S0031-9422(96)00775-3 |
| [11] |
Hosokawa K. Variations among anthocyanins in the floral organs of seven cultivars of Hyacinthus orientalis[J]. Journal of Plant Physiology, 1999, 155(2): 285-287. DOI:10.1016/S0176-1617(99)80021-2 |
| [12] |
Saito N, Tatsuzawa F, Yoda K, et al. Acylated cyanidin glycosides in the violet-blue flowers of Ipomoea purpurea[J]. Phytochemistry, 1995, 40(4): 1283-1289. DOI:10.1016/0031-9422(95)00369-I |
| [13] |
Takeda K, Yamaguchi S, Iwata K, et al. A malonylated anthocyanin and flavonols in the blue flowers of Meconopsis[J]. Phytochemistry, 1996, 42(3): 863-865. DOI:10.1016/0031-9422(95)00067-4 |
| [14] |
Tanaka M, Fujimori T, Uchida I, et al. A malonylated anthocyanin and flavonols in blue Meconopsis flowers[J]. Phytochemistry, 2001, 56(4): 373-376. DOI:10.1016/S0031-9422(00)00357-5 |
| [15] |
Yoshida K, Tojo K, Mori M, et al. Chemical mechanism of petal color development of Nemophila menziesii by a metalloanthocyanin, nemophilin[J]. Tetrahedron, 2015, 71(48): 9123-9130. DOI:10.1016/j.tet.2015.10.007 |
| [16] |
Yoshida K, Kitahara S, Ito D, et al. Ferric ions involved in the flower color development of the Himalayan blue poppy, Meconopsis grandis[J]. Phytochemistry, 2006, 67(10): 992-998. DOI:10.1016/j.phytochem.2006.03.013 |
| [17] |
Yoshida K. Sepal color variation of Hydrangea macrophylla and vacuolar pH measured with a proton-selective microelectrode[J]. Plant and Cell Physiology, 2003, 44(3): 262-268. DOI:10.1093/pcp/pcg033 |
| [18] |
Toyama-Kato Y, Yoshida K, Fujimori E, et al. Analysis of metal elements of hydrangea sepals at various growing stages by ICP-AES[J]. Biochemical Engineering Journal, 2003, 14(3): 237-241. DOI:10.1016/S1369-703X(02)00220-6 |
| [19] |
Shoji K, Miki N, Nakajama N, et al. Perianth bottom-specific blue color development in tulip cv. Murasakizuisho requires ferric ions[J]. Plant Cell Physiology, 2007, 48: 243-251. |
| [20] |
Yoshida K, Kondo T, Okazaki Y, et al. Cause of blue petal colour[J]. Nature, 1995, 373(6512): 291-291. DOI:10.1038/373291a0 |
| [21] |
Tanaka Y, Brugliera F. Flower colour and cytochromes P450[J]. Philosophical transactions of the royal society B, 2013, 368: 20120432. DOI:10.1098/rstb.2012.0432 |
| [22] |
Nakatsuka T, Mishiba KI, Abe Y, et al. Flower color modification of gentian plants by RNAi-mediated gene silencing[J]. Plant Biotechnology, 2008, 25(1): 61-68. DOI:10.5511/plantbiotechnology.25.61 |
| [23] |
Nishizaki Y, Yasunaga M, Okamoto E, et al. p-Hydroxybenzoyl-glucose is a zwitter donor for the biosynthesis of 7-polyacylated anthocyanin in Delphinium[J]. Plant Cell, 2013, 25(10): 4150-4165. DOI:10.1105/tpc.113.113167 |
| [24] |
van Houwelingen A. Analysis of flower pigmentation mutants generated by random transposon mutagenesis in Petunia hybrida[J]. Plant Journal, 1998, 13(1): 39-50. DOI:10.1046/j.1365-313X.1998.00005.x |
| [25] |
Verweij W, Spelt C, Di Sansebastiano G P, et al. An H+ P-ATPase on the tonoplast determines vacuolar pH and flower colour[J]. Nature Cell Biology, 2008, 10(12): 1456-1462. DOI:10.1038/ncb1805 |
| [26] |
Faraco M, Spelt C, Bliek M, et al. Hyperacidification of vacuoles by the combined action of two different P-ATPases in the tonoplast determines flower color[J]. Cell Reports, 6: 32-43. DOI:10.1016/j.celrep.2013.12.009 |
| [27] |
Yamaguchi T, Fukada-Tanaka S, Inagaki Y, et al. Genes encoding the vacuolar Na+/H+ exchanger and flower coloration[J]. Plant Cell Physiology, 2001, 42: 451-461. DOI:10.1093/pcp/pce080 |
| [28] |
Ohnishi M, Fukada-Tanaka S, Hoshino A, et al. Characterization of a novel Na+/H+ antiporter gene InNHX2 and comparison of InNHX2 with InNHX1, which is responsible for blue flower coloration by increasing the vacuolar pH in the Japanese morning glory[J]. Plant Cell Physiology, 2005, 46: 259-267. DOI:10.1093/pcp/pci028 |
| [29] |
Momonoi K, Yoshida K, Mano S, et al. A vacuolar iron transporter in tulip, TgVit1, is responsible for blue coloration in petal cells through iron accumulation[J]. Plant Journal, 2009, 59: 437-447. DOI:10.1111/j.1365-313X.2009.03879.x |
| [30] |
Yoshida K, Negishi T. The identification of a vacuolar iron transporter involved in the blue coloration of cornflower petals[J]. Phytochemistry, 2013, 94: 60-67. DOI:10.1016/j.phytochem.2013.04.017 |
| [31] |
Negishi T, Oshima K, Hattori M, et al. Tonoplast- and plasma membrane-localized aquaporin-family transporters in blue hydrangea sepals of aluminum hyperaccumulating plant[J]. PLoS One, 2012, 7(8): e43189. DOI:10.1371/journal.pone.0043189 |
| [32] |
Noda N. Recent advances in the research and development of blue flowers[J]. Breeding Science, 2018, 68(1): 79-87. |
| [33] |
Shimada Y, Nakano-Shimada R, Ohbayashi M, et al. Expression of chimeric P450 genes encoding flavonoid-3', 5'-hydroxylase in transgenic tobacco and petunia plants[J]. FEBS Letters, 1999, 461: 241-245. DOI:10.1016/S0014-5793(99)01425-8 |
| [34] |
Mori S, Kobayashi H, Hoshi Y, et al. Heterologous expression of the flavonoid 30, 50-hydroxylase gene of Vinca major alters flower color in transgenic Petunia hybrida[J]. Plant Cell Reports, 2004, 22: 415-421. DOI:10.1007/s00299-003-0709-3 |
| [35] |
Okinaka Y, Shimada Y, Nakano-Shimada R, et al. Selective accumulation of delphinidin derivatives in tobacco using a putative flavonoid 3', 5'-hydroxylase cDNA from Campanula medium[J]. Bioscience, Biotechnology, Biochemistry, 2003, 67(1): 161-165. DOI:10.1271/bbb.67.161 |
| [36] |
Togami J, Tamura M, Ishiguro K, et al. Molecular characterization of the flavonoid biosynthesis of Verbena hybrida and the functional analysis of verbena and Clitoria ternatea F3'5'H genes in transgenic verbena[J]. Plant Biotechnology, 2006, 23: 5-11. DOI:10.5511/plantbiotechnology.23.5 |
| [37] |
Qi Y, Lou Q, Quan Y, et al. Flower-specific expression of the Phalaenopsis flavonoid 3', 5'-hydoxylase modifies flower color pigmentation in Petunia and Lilium[J]. Plant Cell Tissue & Organ Culture, 2013, 115(2): 263-273. |
| [38] |
Brugliera F, Tao GQ, Tems U, et al. Violet/Blue chrysanthemums--metabolic engineering of the anthocyanin biosynthetic pathway results in novel petal colors[J]. Plant and Cell Physiology, 2013, 54(10): 1696-1710. DOI:10.1093/pcp/pct110 |
| [39] |
Noda N, Aida R, Kishimoto S, et al. Genetic engineering of novel bluer-colored chrysanthemums produced by accumulation of delphinidin-based anthocyanins[J]. Plant and Cell Physiology, 2013, 54(10): 1684-1695. DOI:10.1093/pcp/pct111 |
| [40] |
Fukui Y, Tanaka Y, Kusumi T, et al. A rationale for the shift in colour towards blue in transgenic carnation flowers expressing the flavonoid 3', 5'-hydroxylase gene[J]. Phytochemistry, 2003, 63(1): 15-23. DOI:10.1016/S0031-9422(02)00684-2 |
| [41] |
de Vetten N, Horst JT, Schaik HPV, et al. A Cytochrome b5 is required for full activity of flavonoid 3', 5'-hydroxylase, a cytochrome P450 involved in the formation of blue flower colors[J]. Proceedings of the National Academy of Sciences, 1999, 96(2): 778-783. DOI:10.1073/pnas.96.2.778 |
| [42] |
Raymond O, Gouzy J, Just J, et al. The Rosa genome provides new insights into the domestication of modern roses[J]. Nature Genetics, 2018, 50: 772-777. DOI:10.1038/s41588-018-0110-3 |
| [43] |
Huang H, Hu K, Han K, et al. Flower colour modification of chrysanthemum by suppression of F3'H and overexpression of the exogenous Senecio cruentus F3'5'H Gene[J]. PLoS One, 2013, 8(11): e74395. DOI:10.1371/journal.pone.0074395 |
| [44] |
Aida R, Yoshida K, Kondo T, et al. Copigmentation gives bluer flowers on transgenic torenia plants with the antisense dihydroflavonol-4-reductase gene[J]. Plant Science, 2000, 160(1): 49-56. DOI:10.1016/S0168-9452(00)00364-2 |
| [45] |
Shoji K, Momonoi K, Tsuji T. Alternative expression of vacuolar iron transporter and ferritin genes leads to blue/purple coloration of flowers in Tulip cv. "Murasakizuisho"[J]. Plant and Cell Physiology, 2010, 51(2): 215-224. DOI:10.1093/pcp/pcp181 |
| [46] |
Shoji K. Identification of cis-element for tulip petal-specific TgMYB1 promoter and its application for modifying a flower color[C]. Proceedings of the Annual Meeting of Japan Society for Bioscience, Biotechnology, and Agrochemistry, 2015.
|
| [47] |
Kurihara C, Hosoi S, Kondo E, et al. Genetic approach for breeding of the blue-flowered fragrant cyclamen[J]. J Fac Eng Saitama Inst Technol, 2015, 25: 17-21. |